La definición funcional de la enfermedad pulmonar obstructiva crónica (EPOC), basada en la limitación al flujo aéreo, ha predominado durante largo tiempo en el ámbito de la neumología. Sin embargo, ha surgido una nueva perspectiva que establece que en la EPOC tiene lugar una compleja variedad de manifestaciones celulares, orgánicas, funcionales y clínicas, y se ha incrementado el interés por desentrañar la heterogeneidad fenotípica de dicha enfermedad. La presente revisión se basa en la opinión de unos autores que tienen una amplia experiencia en la investigación de los diversos aspectos de la EPOC. La revisión parte de la base de que el conocimiento actual sobre la fisiopatología y el cuadro clínico de la EPOC permite clasificar la información fenotípica en función de las siguientes dimensiones: síntomas respiratorios y estado de salud, exacerbaciones agudas, función pulmonar, cambios estructurales, inflamación local y sistémica, y efectos sistémicos. Se han identificado 26 rasgos fenotípicos que se han asignado a alguna de las 6 dimensiones. Para cada dimensión se proporciona un resumen de la mejor evidencia sobre la relación existente entre los rasgos fenotípicos —en concreto, entre aquellos que corresponden a diferentes dimensiones— y sobre la relación entre dichos rasgos y las manifestaciones relevantes en la evolución natural de la EPOC. Toda la información se ha organizado gráficamente en una matriz fenotípica donde cada celda que representa un par de rasgos fenotípicos está vinculada a referencias bibliográficas relevantes. La información podría ayudar a comprender mejor la heterogeneidad de los fenotipos de la EPOC y a planificar estudios futuros sobre aspectos que todavía no se han investigado.
A functional definition of chronic obstructive pulmonary disease (COPD) based on airflow limitation has largely dominated the field. However, a view has emerged that COPD involves a complex array of cellular, organic, functional, and clinical events, with a growing interest in disentangling the phenotypic heterogeneity of COPD. The present review is based on the opinion of the authors, who have extensive research experience in several aspects of COPD. The starting assumption of the review is that current knowledge on the pathophysiology and clinical features of COPD allows us to classify phenotypic information in terms of the following dimensions: respiratory symptoms and health status, acute exacerbations, lung function, structural changes, local and systemic inflammation, and systemic effects. Twenty-six phenotypic traits were identified and assigned to one of the 6 dimensions. For each dimension, a summary is provided of the best evidence on the relationships among phenotypic traits, in particular among those corresponding to different dimensions, and on the relationship between these traits and relevant events in the natural history of COPD. The information has been organized graphically into a phenotypic matrix where each cell representing a pair of phenotypic traits is linked to relevant references. The information provided has the potential to increase our understanding of the heterogeneity of COPD phenotypes and help us plan future studies on aspects that are as yet unexplored.
La EPOC es una de las principales causas de discapacidad y mortalidad. La mayoría de los casos puede atribuirse al consumo de tabaco, cuya eliminación sería suficiente para reducir drásticamente la aparición de la enfermedad. Se ha pronosticado que la EPOC se convertirá en la quinta causa principal de discapacidad y mortalidad en todo el mundo en el año 20201, y sin embargo no se han realizado muchas investigaciones sobre esta enfermedad hasta fechas recientes. Entre las prioridades de investigación, la Global Initiative for Chronic Obstructive Lung Disease (GOLD) destaca la necesidad de conocer mejor las características fenotípicas que la definen2,3.
EPOC es un término relativamente reciente que deriva de la convergencia de 2 perspectivas históricas: una, predominante en el Reino Unido, consideraba la bronquitis crónica una enfermedad progresiva que daba lugar a una obstrucción crónica e irreversible; la otra, más extendida en EE.UU., contemplaba la bronquitis crónica como una enfermedad benigna, pero señalaba el enfisema como el trastorno fundamental que originaba una obstrucción persistente e irreversible de las vías respiratorias. Una tercera línea de pensamiento, la hipótesis holandesa, propuso en los años sesenta que el asma y la EPOC podrían constituir los 2 extremos de una misma afección en desarrollo. Más recientemente se ha definido la EPOC como una disminución al flujo aéreo, por lo general progresiva, aunque no del todo irreversible, que genera alteraciones en las vías respiratorias centrales, los bronquios y bronquiolos periféricos, y el parénquima pulmonar4,5.
Durante las últimas décadas, tanto en la práctica clínica como en el ámbito de la investigación, el diagnóstico de la EPOC se ha basado en la disminución del flujo espiratorio, medido a través del volumen espiratorio forzado en el primer segundo (FEV1) y su razón con la capacidad vital forzada (FEV1/FVC). Sin embargo, a pesar del amplio acuerdo que ha concitado esta definición funcional de la EPOC, que ha sido la predominante, tradicionalmente también se han contemplado determinados fenotipos como manifestaciones diferentes de la EPOC por diversos motivos. Dornhorst6 describió 2 fenotipos clínicos extremos de insuficiencia respiratoria: a) el enfisema del tipo disneico acianótico (pink puffer, literalmente, “soplador rosado”), con pérdida muscular, y b) la bronquitis crónica del tipo congestivo cianótico (blue bloater), con insuficiencia ventricular derecha congestiva6. Las alteraciones de las vías respiratorias y la pérdida de las paredes alveolares pueden darse en ambos fenotipos7. Hoy día no es frecuente encontrar dichos fenotipos extremos7, probablemente debido a los avances en el tratamiento2. Por su parte, Burrows et al8 propusieron distinguir entre los diferentes fenotipos de obstrucción crónica al flujo aéreo basándose en el pronóstico y definieron 2 fenotipos: el enfisematoso (fumadores sin alergia ni asma diagnosticada), con una mayor mortalidad y peor función pulmonar, y la bronquitis asmática (personas alérgicas o no fumadoras con asma diagnosticada). Aunque el solapamiento entre el asma y la EPOC sigue sin resolverse, en la actualidad ha cobrado mayor interés porque diversos estudios muestran que el asma crónica persistente puede acompañarse de una obstrucción crónica al flujo aéreo que revierte sólo parcialmente a pesar del tratamiento con dosis elevadas de corticoides9. Además, las personas con asma pierden función pulmonar de forma más rápida que la población sana10, y los asmáticos que fuman y no son alérgicos tienen un mayor riesgo de pérdida de la función pulmonar11. Aunque por lo general puede distinguirse entre el asma y la EPOC y ambas enfermedades presentan diferencias por lo que se refiere a la inflamación de las vías respiratorias12, a menudo se manifiestan conjuntamente.
Flenley13 empleó el término “síndrome de solapamiento” para aludir a la asociación del síndrome de apneas del sueño y la EPOC14, aunque en un amplio estudio epidemiológico se encontró que en pacientes con y sin EPOC la frecuencia de un índice de apnea-hipopnea superior a 10 acontecimientos por hora era similar15. Otros posibles subtipos de EPOC que han suscitado atención clínica son la enfermedad ampollosa, la deficiencia de alfa-1- antitripsina, la EPOC de inicio precoz y otras enfermedades de las vías respiratorias de menor gravedad.
El número de investigaciones sobre la EPOC ha aumentado durante la última década, lo que ha dado lugar a un crecimiento exponencial de la información sobre sus características clínicas y fisiopatológicas. Por consiguiente, los componentes de la heterogeneidad fenotípica de la EPOC pueden comprenderse con más facilidad y es más probable que esta información aporte nuevos enfoques diagnósticos o posibilidades de tratamiento. Gracias a este incremento del conocimiento, se ha puesto de manifiesto que en la EPOC intervienen diferentes órganos diana, así como un complejo conjunto de acontecimientos celulares, orgánicos, funcionales y clínicos16, que se han reflejado en las nuevas definiciones de la EPOC17. Por lo tanto, no debe sorprender el creciente interés por desentrañar la heterogeneidad fenotípica de la EPOC, con la esperanza de establecer nuevas entidades, como ya ha ocurrido en el caso del asma y otras enfermedades crónicas18–20. En este trabajo se revisan los diversos rasgos fenotípicos de la EPOC, prestando especial atención a las relaciones existentes entre ellos y en cómo podría comprenderse mejor esta compleja red de relaciones.
MétodosEsta revisión se basa en la opinión de expertos que participan en un proyecto de investigación sobre la heterogeneidad fenotípica de la EPOC. Parte de la base de que el conocimiento actual sobre la fisiopatología y el cuadro clínico de la EPOC permite clasificar sus características fenotípicas en diversas dimensiones: síntomas respiratorios y estado de salud, exacerbaciones, anomalías en la función respiratoria (p. ej., disminución del flujo aéreo, hiperreactividad bronquial, hiperinsuflación, intercambio de gases), alteraciones estructurales (como enfisema o insuficiencia respiratoria), inflamación local y sistémica, y otros efectos sistémicos. El uso de dimensiones para clasificar un número elevado de variables clínicas relacionadas está bien desarrollado tanto conceptual como métricamente mediante instrumentos que miden la calidad de vida relacionada con la salud21.
Los miembros del Grupo de Trabajo sobre la Caracterización Fenotípica y Evolución de la EPOC (PAC-COPD) que cuentan con experiencia en estas dimensiones han seleccionado la mejor evidencia sobre los rasgos fenotípicos más importantes, las relaciones existentes entre ellos y la relación entre los rasgos fenotípicos y las principales manifestaciones en la evolución natural de la EPOC. Se han realizado búsquedas bibliográficas sobre los principales rasgos fenotípicos. En total se han incluido 26 rasgos fenotípicos que se han asignado a alguna de las 6 dimensiones (tabla 1), prestándose especial atención a aquéllos asociados con la gravedad de la enfermedad y la mortalidad. En la tabla 1 se muestran los rasgos y las dimensiones.
Dimensiones y rasgos fenotípicos de la EPOC
| Síntomas respiratorios y estado de salud |
| Hipersecreción mucosa crónica |
| Disnea |
| Calidad de vida relacionada con la salud |
| Exacerbaciones |
| Exacerbaciones |
| Colonización |
| Infección |
| Anomalías de la función respiratoria |
| FEV1, FEV1/FVC |
| Gravedad (FEV1) |
| Hiperreactividad bronquial |
| Reversibilidad |
| Hiperinsuflación dinámica |
| Capacidad inspiratoria |
| Intercambio de gases: PaO2, PaCO2, DCLO |
| Alteraciones estructurales |
| Enfisema |
| Bronquitis crónica |
| Bronquiolitis |
| Bronquiectasia |
| Inflamación local y sistémica |
| Inflamación local: marcadores inflamatorios o células en el esputo o tejido pulmonar |
| Inflamación sistémica: marcadores inflamatorios o células en la sangre o suero |
| Proteólisis |
| Estrés oxidativo |
| Remodelación vascular |
| Efectos sistémicos |
| Estado nutricional |
| Músculos estriados (respiratorios y periféricos) |
| Capacidad de ejercicio |
| Trastornos cardiovasculares |
FEV1: volumen espiratorio forzado en el primer segundo; FVC: capacidad vital forzada; DLCO: difusión alveolar de monóxido de carbono corregida para el volumen alveolar; PaCO2: presión arterial de anhídrido carbónico; PaO2: presión arterial de oxígeno.
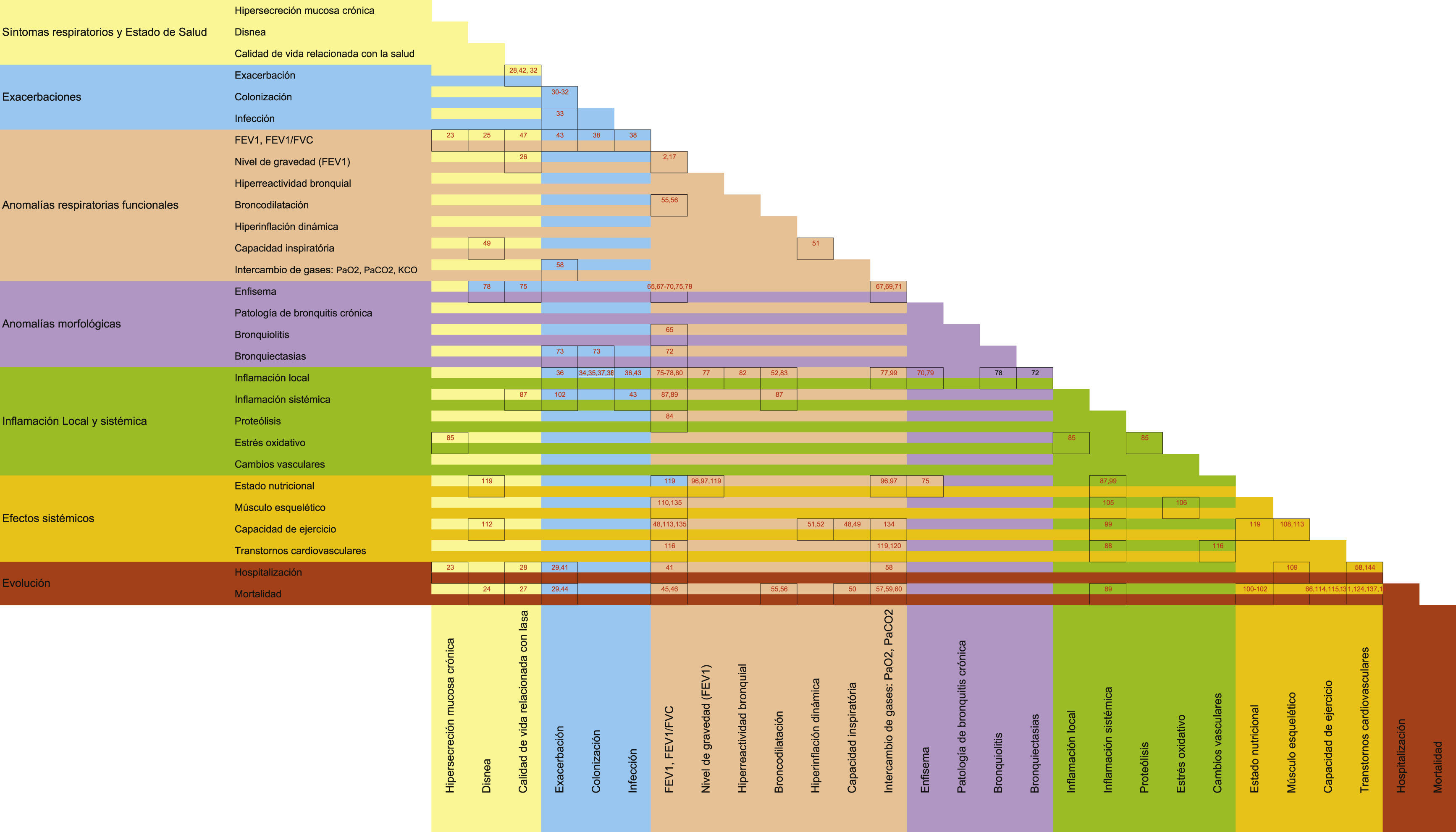
Como las relaciones entre los rasgos fenotípicos parecen complejas y difíciles de organizar, se ha desarrollado una matriz fenotípica multidimensional de la EPOC (fig. 1). Esta matriz es una tabla 2×2 que recoge la información sobre las relaciones entre rasgos de la misma dimensión o de diferentes dimensiones, así como entre dichos rasgos y la evolución de la enfermedad. La matriz también incluye las referencias bibliográficas que demuestran dichas relaciones. Además de destacar los vínculos entre las dimensiones, la matriz también muestra las áreas vacías que pueden ser el resultado de la carencia de investigaciones y, por lo tanto, puede ayudar a planificar futuros estudios.
Matriz fenotípica multidimensional de EPOC. Cada celda incluye las referencias bibliográficas más relevantes sobre la interrelación de los rasgos fenotípicos interseccionados. FEV1: volumen espiratorio forzado en el primer segundo; FVC: capacidad vital forzada; DLCO: difusión alveolar de monóxido de carbono corregida para el volumen alveolar; PaCO2: presión arterial de anhídrido carbónico; PaO2: presión arterial de oxígeno.
La tos crónica y la expectoración constituyen manifestaciones habituales de la EPOC, por lo que debería considerarse este diagnóstico cuando se presentan dichos síntomas17. Sin embargo, al principio se pensaba que su presencia en fumadores era algo benigno, independiente de la EPOC101. Esto se puso en duda cuando se observó que había una asociación entre la hipersecreción bronquial, la pérdida de FEV1 y los ingresos hospitalarios por EPOC28. Se observó que los pacientes con EPOC y bronquitis crónica presentaban una disminución del recuento de eosinófilos en las biopsias bronquiales y un mayor porcentaje de eosinófilos en el esputo que aquéllos sin síntomas84. En los casos de EPOC moderada-grave, la disnea constituye uno de los síntomas principales, además de ser un factor pronóstico independiente de mortalidad29. Sin embargo, el grado de disnea varía de manera considerable en los pacientes con EPOC y sólo se corresponde parcialmente con la pérdida de la función pulmonar33, lo que aumenta su potencial utilidad como característica fenotípica definitoria de la enfermedad. Además, en la EPOC la mala calidad de vida relacionada con la salud se correlaciona con la gravedad86 y se asocia tanto con la mortalidad total y por causas respiratorias, independientemente del FEV122, como con los ingresos hospitalarios por reagudizaciones de la enfermedad102. En una amplia muestra de pacientes con EPOC grave, la puntuación total del Saint George's Respiratory Questionnaire se ha relacionado tanto con la prueba de la marcha de 6min, como con el resultado obtenido en pruebas de ejercicio cardiopulmonar25. La discapacidad funcional, determinada con el índice de Barthel, se ha asociado a un mayor riesgo de muerte en pacientes con EPOC tras ajustar por la comorbilidad26.
Exacerbaciones agudasLas exacerbaciones agudas contribuyen al deterioro de los pacientes con EPOC, puesto que su frecuencia se asocia a un peor estado de salud24,27, una disminución drástica de la función pulmonar50 y una mayor frecuencia de ingreso hospitalario y muerte51. La frecuencia y la intensidad de las reagudizaciones aumentan con la gravedad de la EPOC, aunque algunos pacientes son más propensos que otros a las reagudizaciones recurrentes. Esta mayor tendencia a presentar reagudizaciones, se ha considerado una característica fenotípica de la EPOC. La colonización bacteriana de los bronquios49, la aparición de nuevos microorganismos potencialmente patógenos en las vías respiratorias inferiores52,32 y las infecciones víricas103 se han relacionado con las reagudizaciones. Los marcadores inflamatorios de las secreciones bronquiales como la mieloperoxidasa, la elastasa neutrófila, el leucotrieno B4, la interleucina (IL) 8 y el factor de necrosis tumoral alfa (TNF-α) están relacionados con la carga de microorganismos potencialmente patógenos en la colonización y en la infección bronquial, con un patrón de dosis-respuesta23,31,104. Asimismo, la adquisición de un nuevo microorganismo potencialmente patógeno en las vías respiratorias inferiores se asocia a un incremento de los marcadores inflamatorios en el esputo (TNF-α y elastasa neutrófila) y en el suero (proteína C reactiva), y la resolución de la exacerbación se acompaña de una reducción de las concentraciones de los marcadores inflamatorios86. La carga bacteriana de las vías respiratorias se ha asociado a una disminución del FEV1 en pacientes con EPOC. La respuesta inflamatoria y la gravedad de la reagudización dependen de la naturaleza del organismo causante de la infección, y las coinfecciones víricas y bacterianas se asocian a una mayor gravedad32,87. Se ha observado que en las reagudizaciones de la EPOC, además de las infecciones, intervienen otros factores, como la presencia de tromboembolismo pulmonar, que también se ha identificado en un porcentaje de las reagudizaciones de EPOC grave de origen desconocido88, los ingresos hospitalarios previos debidos a reagudizaciones de la EPOC y la oxigenoterapia a largo plazo30.
Función pulmonarEl FEV1 y el cociente FEV1/FVC han constituido las características funcionales que definen la EPOC, así como la base para su estadificación17. El FEV1 está estrechamente relacionado con el riesgo de ingreso hospitalario por EPOC88 y la mortalidad74, incluso en la población general36. En cambio, guarda una escasa correlación con los síntomas y la calidad de vida relacionada con la salud89. Los volúmenes pulmonares estáticos y la capacidad inspiratoria (un índice de hiperinsuflación pulmonar) también pueden contribuir a una mejor caracterización de la enfermedad. La reducción de la capacidad inspiratoria constituye un mejor predictor de la tolerancia al ejercicio que la reducción del FEV1 o de la FVC37. La capacidad inspiratoria también está muy vinculada con una mejora de la tolerancia al ejercicio y de la disnea tras la administración de broncodilatadores inhalados57, y su razón con la capacidad pulmonar total constituye un factor de riesgo independiente de mortalidad en los pacientes con EPOC105. La hiperinsuflación dinámica durante el ejercicio físico se relaciona mejor con la capacidad inspiratoria en reposo y puede ayudarnos a comprender la dificultad que experimentan los pacientes con EPOC ante un aumento de las demandas mecánicas y metabólicas durante el ejercicio físico34,106.
La hiperreactividad bronquial constituye otro rasgo fenotípico que puede estar presente en más de la mitad de los pacientes con EPOC35. Algunos estudios iniciales señalaron que la bronquitis asmática8 podría ser un fenotipo particular de la obstrucción crónica al flujo aéreo, cuyo pronóstico más favorable podría relacionarse con una mayor concentración de eosinófilos en las secreciones y la mucosa bronquiales90. Estudios más recientes han mostrado que la reversibilidad de la obstrucción al flujo aéreo constituye un predictor independiente de mejor supervivencia y de un descenso más lento del FEV1 en la EPOC38,91.
Algunos pacientes con EPOC avanzada presentan una alteración del intercambio gaseoso, causada principalmente por una mala relación ventilación-perfusión, lo que se ha relacionado con la mortalidad92 y los ingresos hospitalarios por reagudizaciones107. Los pacientes con hipoxemia diurna leve pueden experimentar una grave hipoxemia nocturna transitoria y desaturaciones de oxígeno durante el ejercicio físico, trastornos ambos que se relacionan con una supervivencia menor108. En cambio, en un estudio, los pacientes con desaturación de oxígeno nocturna, seleccionados de entre una amplia población de pacientes con EPOC, presentaron un estado de salud, una calidad del sueño y una función diaria similares a los de aquéllos sin desaturación nocturna109. Las medias de los valores de la presión arterial pulmonar y de la presión arterial de anhídrido carbónico se han identificado como indicadores de la gravedad de la desaturación nocturna110. Debido a su posible valor pronóstico, tanto la hipoxemia en reposo como la inducida durante el ejercicio físico y la hipercapnia constituyen el centro de los estudios que se realizan en la actualidad41,95.
Alteraciones estructuralesEl enfisema, la bronquitis crónica y la bronquiolitis son las principales alteraciones estructurales de la EPOC42,43. Sin embargo, no se ha conseguido distinguir fenotipos de EPOC a partir del predominio de los componentes bronquiales o enfisematosos16, probablemente por la insuficiente resolución de la radiología de tórax. Los nuevos avances que ha experimentado la tomografía computarizada de alta resolución (TACAR)44, incluida la tomografía computarizada helicoidal, permiten una valoración cuantitativa del enfisema. A pesar de que la valoración del enfisema mediante tomografía computarizada se relaciona bien con la histología45, los estudios sobre su correlación con la limitación al flujo aéreo, la gasometría y otros parámetros de volumen pulmonar han proporcionado resultados contradictorios40,44,46–48,111. Un estudio reciente de 458 pacientes con EPOC, que ha establecido la validez la medición del enfisema mediante radiografía de tórax, ha observado que aquéllos con enfisema presentaban un menor índice de masa corporal, FEV1 y capacidad de difusión del monóxido de carbono (DLCO), una peor calidad de vida y una mayor limitación de la actividad física53.
Algunos estudios han investigado la relación existente entre el enfisema medido con TACAR y la función pulmonar. En general, los estudios más recientes han observado una peor función respiratoria, incluida la DLCO, en pacientes con mayor grado de enfisema39,54,55,60, a pesar de que en un estudio dicha relación sólo se halló en pacientes con EPOC que habían presentado bronquitis crónica112. Otros rasgos que se han relacionado con la presencia de enfisema en los pacientes con EPOC son la elastasa en esputo, el índice BODE (que incorpora el índice de masa corporal, el grado de obstrucción, la disnea y la capacidad de ejercicio) y la disnea. La TACAR puede también resultar útil para evaluar el componente bronquiolar de la EPOC y la presencia de bronquiectasias, que se observan en el 30–50% de los casos56,58. Las bronquiectasias se han relacionado con reagudizaciones más graves, con colonización bacteriana de las vías respiratorias inferiores y con un incremento de los marcadores inflamatorios en el esputo56, así como con el FEV1112.
Inflamación local y sistémicaHasta la fecha se han identificado 3 mecanismos celulares que intervienen en el desarrollo y la evolución de la EPOC: la inflamación, la proteólisis y el estrés oxidativo. La EPOC se considera una enfermedad inflamatoria de las vías respiratorias y el parénquima pulmonar, caracterizada por un incremento de la cantidad de neutrófilos, macrófagos y linfocitos CD864. Se ha observado una relación entre la inflamación local y la gravedad de la limitación al flujo aéreo o la evolución de la enfermedad65. Coincidiendo con estos resultados, los mediadores de la inflamación pulmonar, como la IL-6 y la IL-861,113, y las células inflamatorias, como los linfocitos T CD8+ y los neutrófilos, se han relacionado con la limitación al flujo aéreo63,80,81. Asimismo, se ha observado una aceleración en la disminución del FEV1 en pacientes con concentraciones más elevadas de IL-6 y de leucocitos en el esputo114. También se han detectado diversos marcadores de inflamación y de estrés oxidativo en el aire exhalado de pacientes con EPOC, tales como isoprostanos, leucotrienos, citocinas, productos de la peroxidación lipídica y otros marcadores de estrés oxidativo y nitrosativo115. La presencia de esosinófilos en el esputo de pacientes con EPOC se ha relacionado con la hiperreactividad bronquial116, la respuesta a períodos cortos de tratamiento con esteroides inhalados117,118 y la presencia de enfisema medido por TACAR115. Otros marcadores de inflamación relacionados con el enfisema son las metaloproteinasas de la matriz-9 y la razón entre éstas y el inhibidor tisular de las metaloproteinasas-1119. Asimismo, el desequilibrio entre proteasas y antiproteasas se ha relacionado con la limitación al flujo aéreo y podría ser potencialmente importante67. En pacientes con EPOC, el estrés oxidativo pulmonar se ha relacionado con la hipersecreción mucosa, la proteólisis y la inflamación pulmonar68.
Actualmente se considera que la inflamación pulmonar que se observa en la EPOC se extiende a otros territorios titulares más allá de los pulmones hasta convertirse en sistémica. En comparación con los grupos de control, los pacientes con EPOC presentan concentraciones séricas más elevadas de leucocitos y un incremento de los valores de biomarcadores como citocinas proinflamatorias (IL-1β, IL-6, IL-8, TNF-α), fibrinógeno y proteína C reactiva (PCR)120. Asimismo, en dichos pacientes la PCR —un marcador de la inflamación sistémica aguda— se ha relacionado con la función pulmonar y el estado de salud59, la respuesta a la prueba de la marcha y la presión arterial de oxígeno93, los trastornos cardiovasculares94 y la mortalidad62, de manera que, en combinación con la presencia de síntomas, podría resultar útil en el diagnóstico de las reagudizaciónes121. La PCR resultó ser un predictor potente e independiente de ingresos hospitalarios por EPOC y de mortalidad en una cohorte de base poblacional122. Asimismo, se ha observado que sus concentraciones disminuyen tras la administración de corticoides inhalados71 o pravastatina72. Por el contrario, en un estudio prospectivo de pacientes con EPOC se ha demostrado que el fibrinógeno, pero no otros biomarcadores de inflamación sistémica, entre los que se incluye la PCR, está asociado de forma independiente con las reagudizaciones123. Con las nuevas tecnologías de micromatrices se han incrementado considerablemente las posibilidades de examinar un amplio número de biomarcadores en un mismo estudio. Siguiendo este enfoque, en un estudio reciente se han analizado 143 biomarcadores de diferente naturaleza (quimioatrayentes, de inflamación, de destrucción y reparación de tejidos) en muestras de suero de pacientes con EPOC y de controles, y en 24 de ellos se observaron relaciones con el FEV1, la respuesta a la prueba de la marcha de 6min, la DLCO, el índice BODE y las reagudizaciones77.
Efectos sistémicos de la EPOC: estado nutricional, músculos esqueléticos, capacidad de ejercicio físico y trastornos cardiovascularesRecientemente los efectos sistémicos de la EPOC han sido objeto de un creciente interés por parte de los investigadores69,82. Algunos autores postulan que un manejo adecuado de la EPOC implicaría contemplarla como una enfermedad de múltiples componentes124, y se ha planteado la hipótesis de que son las citocinas proinflamatorias las que llevan la EPOC más allá de los pulmones73. A continuación se describen algunos de los que podrían considerarse componentes extrapulmonares de la EPOC.
Estado nutricionalDiversos estudios han observado anomalías nutricionales en los pacientes con EPOC82,75. La manifestación clínica más evidente de estas anomalías nutricionales es la pérdida de peso no atribuible a otras causas, que es particularmente prevalente (aproximadamente un 50%) en pacientes con EPOC grave e insuficiencia respiratoria crónica96, aunque también se ha observado en un 25% de los pacientes con enfermedad leve-moderada97. Sin embargo, su frecuencia puede variar entre áreas geográficas78. Es interesante la asociación existente entre concentraciones más elevadas de TNF-α en sangre y la pérdida de peso125. El adelgazamiento se ha relacionado con una menor supervivencia66,126, asociación que puede revertirse con suplementos nutricionales125. La estratificación de la masa corporal en masa grasa y masa libre de grasa es importante para el pronóstico, como se ha resaltado recientemente, debido a su asociación con la gravedad79 y la mortalidad127.
Músculos esqueléticosUn importante componente sistémico de la EPOC es la disfunción de los músculos esqueléticos. Los músculos respiratorios sufren una pérdida de fuerza y resistencia a pesar de las diversas respuestas adaptativas128. En los músculos periféricos, especialmente en las extremidades inferiores, la pérdida de masa muscular y las anomalías en el metabolismo muscular resultan incluso más patentes129. En los pacientes con EPOC, los músculos alterados pueden presentar un incremento de los valores de células y moléculas proinflamatorias99, así como de marcadores del estrés oxidativo130. Las anomalías musculares se han asociado a una disminución de la actividad física131 y de la capacidad de ejercicio132, así como a un incremento del uso de los servicios sanitarios133, pero no al grado de limitación al flujo aéreo134.
Capacidad de ejercicioLa disminución de la capacidad de ejercicio es una consecuencia grave de la EPOC debida a factores como la dificultad de ventilación (hiperinsuflación dinámica), las anomalías en el intercambio de gases, la disminución del gasto cardíaco, las alteraciones de la musculatura respiratoria y sistémica, y los trastornos nutricionales135. Aunque cuando se compara a los pacientes con EPOC con controles sanos la disnea y la fatiga en las extremidades inferiores parecen ser las principales causas de la limitación de la capacidad de ejercicio98, en los pacientes con EPOC grave son la fuerza muscular y la función pulmonar las variables que más se correlacionan con la capacidad de ejercicio136. La importancia de la capacidad de ejercicio como rasgo fenotípico de la EPOC radica en su asociación independiente con la mortalidad76,137, y dicha asociación es más estrecha que la correspondiente al consumo máximo de oxígeno medido durante el esfuerzo máximo70. En un estudio prospectivo de pacientes con EPOC, la disminución del FEV1 se asoció a un peor resultado en las pruebas de rendimiento físico y una menor distancia recorrida en la prueba de la marcha de 6 min138.
Trastornos cardiovascularesSe ha postulado que la EPOC por sí sola constituye un factor de riesgo independiente de morbilidad y mortalidad cardiovasculares. Por cada disminución de un 10% del FEV1, la mortalidad cardiovascular aumenta un 28% y los acontecimientos coronarios no mortales casi un 20%100, y se ha planteado la hipótesis de que este incremento del riesgo cardiovascular puede deberse a la inflamación sistémica de la EPOC93. Por el contrario, en un amplio ensayo aleatorizado de pacientes con insuficiencia cardíaca, los parámetros ecocardiográficos fueron similares en los pacientes con y sin EPOC139. La hipertensión pulmonar moderada no es infrecuente en la EPOC140, y hallazgos recientes respaldan la hipótesis de que puede ser la consecuencia de la remodelación pulmonar vascular o de los daños inducidos por el tabaco141, más que de la hipoxemia inducida por el ejercicio o durante el sueño142,143. La importancia de evaluar la hipertensión pulmonar en los pacientes con EPOC sigue siendo poco clara, a pesar de que aquélla se relaciona de forma independiente con la mortalidad83,144 y con los ingresos hospitalarios por EPOC92. Otras anomalías cardiovasculares poco estudiadas en el contexto de la EPOC, como la disfunción ventricular izquierda145 y la hipertensión arterial, no se comprenden del todo en el contexto de la EPOC, pero podrían tener una influencia relevante en la evolución de la enfermedad. No obstante, la EPOC no resultó ser un predictor de mortalidad en un estudio de pacientes con insuficiencia cardíaca146.
Otras enfermedadesEl cáncer147,148, la enfermedad de Crohn, la colitis ulcerosa149 y la anemia150,151 también se han relacionado con la EPOC. Por ejemplo, la anemia se ha asociado a una mayor utilización de servicios sanitarios152, a un grado mayor de disnea y a una menor distancia recorrida en la prueba de la marcha de 6 min153. Igualmente se ha observado que la depresión es más prevalente en pacientes con EPOC154 que en controles, y que su presencia se asocia a un peor estado de salud155. Asimismo, se ha puesto de manifiesto que la comorbilidad disminuye la respuesta a la rehabilitación respiratoria156. En la mayoría de estas enfermedades no se dispone de evidencia suficiente para determinar si la asociación con la EPOC se corresponde a la distribución conjunta que cabe esperar en una población de edad avanzada, a fenotipos interrelacionados debido a mecanismos fisiopatológicos comunes y/o al resultado de los determinantes medioambientales compartidos.
Conocer la heterogeneidad fenotípica en la EPOC: un enfoque clínico-epidemiológicoDiversos estudios han analizado la heterogeneidad fenotípica de la EPOC utilizando técnicas estadísticas descriptivas como el análisis de clusters y el análisis factorial. Estos enfoques agrupan diferentes variables correlacionadas entre sí en unos pocos factores estadísticamente independientes y conceptualmente relevantes. De hecho, este enfoque se ha utilizado a menudo para explorar las dimensiones subyacentes a la fisiopatología de la EPOC157–162. Varios de estos estudios han identificado como mínimo 3 factores independientes y relevantes: a) la capacidad de ejercicio y el grado de disnea; b) la limitación al flujo aéreo, y c) el volumen pulmonar (hiperinsuflación y retención de aire), que en conjunto explican más de un 60% de la variancia total156–159. Sin embargo, en un estudio que incluyó en el análisis factores como la inflamación y la reversibilidad de la obstrucción bronquial se obtuvo un patrón diferente, con estos 3 factores: a) limitación al flujo aéreo y alteración de los volúmenes pulmonares; b) reversibilidad de la obstrucción bronquial, aumento de la inmunoglobulina E y disminución de la DLCO, y c) aumento del óxido nítrico exhalado y de los neutrófilos y eosinófilos en el esputo161. Una de las limitaciones más importantes de estos estudios es que la mayoría se llevó a cabo en un número reducido y no representativo de pacientes, e incluyeron un número limitado de variables y dimensiones de la EPOC. Además, parte de la variabilidad descrita podría no estar relacionada con la heterogeneidad de la enfermedad en sí misma, sino más bien con el hecho de que los pacientes se encontraban en diferentes etapas de la evolución natural de la enfermedad163.
Una vez que la heterogeneidad fenotípica se ha sintetizado en una serie de grupos de variables que proporcionan información diferente e independiente sobre el fenotipo de la EPOC, el paso siguiente consiste en evaluar la relación entre los grupos fenotípicos independientes y las manifestaciones de la enfermedad, de manera que pueda valorarse su relevancia clínica y sanitaria. A pesar de que la bibliografía disponible muestra que muchos rasgos fenotípicos están relacionados con la manifestación de la enfermedad, es decir, que las medidas de estado de salud en pacientes con EPOC están relacionadas con la mortalidad relativa a la función pulmonar85, estos estudios se han basado en un número limitado de rasgos fenotípicos, generalmente marcadores diferentes de la misma dimensión fenotípica. Una de las pocas excepciones es la evaluación del valor pronóstico de un índice multidimensional de la gravedad de la EPOC164, el índice BODE, que ha demostrado ser mejor predictor de la mortalidad total y por causas respiratorias, que la estratificación basada en el FEV1.
Aunque los estudios sobre la heterogeneidad fenotípica de la EPOC incluidos en esta revisión suponen una importante contribución, la mayoría de ellos incluyó sólo un número limitado de rasgos fenotípicos. En nuestra revisión hemos identificado 26 rasgos fenotípicos, que se han agrupado en 6 dimensiones y que han proporcionado información sobre las interrelaciones entre dichos rasgos y sobre su relación con diversos resultados clínicos importantes (fig. 1). Esta información puede resultar útil tanto para integrar los estudios disponibles como para diseñar futuras investigaciones. Esta revisión se ha realizado como parte del estudio PAC-COPD, que ha incluido a una cohorte inicial de 342 pacientes procedentes de 9 hospitales y seleccionados tras su primer ingreso hospitalario por una exacerbación aguda de la EPOC, y ha procedido a su seguimiento. La extensa evaluación fenotípica que se llevará a cabo en dichos pacientes, junto con la información de los ingresos hospitalarios previos y la mortalidad, deberá permitir que se avance en el conocimiento sobre la heterogeneidad fenotípica de la EPOC.
La presente revisión tiene diversas limitaciones que deben tenerse en cuenta. No se basa en una revisión sistemática de la literatura médica, puesto que hemos dado por sentado que la gama de intereses de investigación de los autores era lo suficientemente amplia para abarcar las diferentes dimensiones fenotípicas de la EPOC. Aunque es posible que no se hayan incluido algunos estudios, es poco probable que esto afecte seriamente al conjunto de rasgos y dimensiones fenotípicas que hemos planteado. Un aspecto más problemático hace referencia a la validez interna de los estudios incluidos. Cuando ha sido posible, hemos seleccionado estudios de diseño longitudinal (o transversal de ser apropiado) con muestras de tamaño suficiente. No obstante, a menudo la única información disponible procede de estudios clínicos con muestras pequeñas que presentan sesgos de selección potencialmente importantes. Por lo tanto, es posible que en algunos aspectos las conclusiones a las que hemos llegado sobre las relaciones entre rasgos fenotípicos se hayan basado en resultados sesgados. Por último, esta revisión se ha centrado exclusivamente en el fenotipo de la EPOC, ya que consideramos que éste es el primer paso necesario para la investigación de la heterogeneidad fenotípica. No obstante, deben tenerse en cuenta otros enfoques, en concreto, la investigación sistemática de los mecanismos genéticos que intervienen en la expresión de los rasgos fenotípicos de la EPOC165. Si bien hay pocas dudas de que el conocimiento de los mecanismos genéticos permitirá identificar algunas variantes de la EPOC166,167, el empleo de los enfoques genéticos para entender la complejidad del fenotipo de la EPOC requiere un esfuerzo multidisciplinario168. Nuevos enfoques, entre los que figuran la exploración extensa del genoma y modelos animales con EPOC169, así como estudios de proteómica170, que cada vez son más viables, posiblemente contribuirán a desentrañar la heterogeneidad genética de esta enfermedad.
Miembros del Grupo de Trabajo sobre la Caracterización Fenotípica y Evolución de la EPOC (PAC-COPD)Centro de Investigación en Epidemiología Ambiental (CREAL), Institut Municipal d’Investigació Mèdica (IMIM), Barcelona: Josep M. Antó (investigador principal), Judith Garcia-Aymerich (coordinadora de proyecto), Marta Benet, Jordi de Batlle; Hospital del Mar-IMIM, Barcelona: Joaquim Gea (coordinador del centro), Eva Balcells, Àngel Gayete, Mauricio Orozco-Levi; Hospital Clínic-Institut d’Investigacions Biomèdiques August Pi i Sunyer (IDIBAPS), Barcelona: Joan Albert Barberà (coordinador del centro), Federico P. Gómez, Carles Paré, Josep Roca, Robert Rodríguez-Roisin; Hospital General Universitari Vall d’Hebron, Barcelona: Jaume Ferrer (coordinador del centro), Esther Pallissa, Esther Rodríguez; Hospital de la Santa Creu i Sant Pau, Barcelona: Pere Casan (coordinador del centro), Rosa Güell, Ana Giménez; Hospital Universitari Germans Trias i Pujol, Badalona: Eduard Monsó (coordinador del centro), Alicia Marín, Josep Morera; Hospital Universitario de Bellvitge, L’Hospitalet de Llobregat: Eva Farrero (coordinador del centro), Joan Escarrabill; Hospital de Sabadell, Corporació Parc Taulí, Institut Universitari Parc Taulí (Universitat Autònoma de Barcelona), Sabadell: Antoni Ferrer (coordinador del centro); Hospital Universitari Son Dureta, Palma de Mallorca: Jaume Sauleda (coordinador del centro), Àlvar G.N. Agustí; Hospital de Cruces, Barakaldo: Juan Bautista Gáldiz (coordinador del centro), Lorena López; Hospital General Universitari, Valencia: José Belda.
FinanciaciónEl trabajo realizado para esta publicación estuvo parcialmente subvencionado por el Fondo de Investigación Sanitaria (FISPI020541), del Ministerio de Salud de España; la Agencia de Evaluación de Tecnología e Investigaciones Médicas (AATRM035/20/02), de la Generalitat de Catalunya; la Sociedad Española de Neumología y Cirugía Torácica (SEPAR2002/137); la Fundació Catalana de Pneumologia (FUCAP2003, Beca Marià Ravà); la Red Respira (RTICC03/11); la Red RCESP(RTICC03/09); el Fondo de Investigación Sanitaria (PI052486 y PI052302); la Fundació La Marató de TV3 (n.% o041110); el DURSI (2005SGR00392), así como por una subvención educativa ilimitada de Novartis Farmacéutica, España. J. Garcia-Aymerich cuenta con un contrato de investigación del Instituto de Salud Carlos III (CP05/00118), Ministerio de Salud, España. Los patrocinadores no han contribuido en el contenido del presente informe ni han participado en la decisión de cómo presentarlo para su publicación. El CIBER de Epidemiología y Salud Pública es una iniciativa y está financiado por el Instituto de Salud Carlos III.