La disfunción de las pequeñas vías aéreas (DPV) inducida por el tabaco contribuye precozmente a la patogenia de la limitación al flujo aéreo (LFA), aunque resulta poco conocida su repercusión en la percepción de salud. Se pretende evaluar la frecuencia de DPV en fumadores activos sin LFA y comparar la calidad de vida relacionada con la salud (CVRS) de no fumadores, fumadores sin DPV, fumadores con DPV y fumadores con LFA.
MétodosEn 53 fumadores activos sin LFA, 20 fumadores con LFA y 20 no fumadores, se utilizaron los cuestionarios SF-36 y EuroQoL y se realizó oscilometría de impulsos, espirometría y determinación de las densidades de atenuación del parénquima pulmonar en inspiración y espiración máximas. Se consideró que existía DPV cuando la resistencia a 5Hz (R5), la diferencia R5-R20 y el área de reactancia (AX) excedían su límite superior de la normalidad.
ResultadosEl 35,8% de los fumadores sin LFA tenía DPV. No se detectaron diferencias en los parámetros espirométricos ni la atenuación pulmonar entre los fumadores con o sin DPV y los no fumadores. Sin embargo, los fumadores con DPV presentaban una peor puntuación en los cuestionarios de CVRS que los fumadores sin DPV o los no fumadores, e intermedia a los fumadores con LFA. R5 y X5 fueron identificados como determinantes independientes de la CVRS en los fumadores sin LFA.
ConclusionesLa DPV es frecuente en fumadores sin LFA, afectando a un tercio de los mismos, y condicionando de forma independiente su percepción de salud.
Small airway dysfunction (SAD) caused by smoking contributes to the early onset of airflow limitation (AFL), although its impact on patients’ perception of health is largely unknown. We aimed to evaluate the frequency of SAD in active smokers without AFL, and to compare health-related quality of life (HRQoL) of non-smokers, smokers without SAD, smokers with SAD, and smokers with AFL.
MethodsA total of 53 active smokers without AFL, 20 smokers with AFL, and 20 non-smokers completed the SF-36 and EuroQoL questionnaires and performed impulse oscillometry and spirometry. Pulmonary parenchymal attenuation was determined in inspiration and expiration. SAD was determined to exist when resistance at 5Hz (R5), the difference between R5 and R20, and reactance area (AX) exceeded the upper limit of normal.
ResultsIn total, 35.8% of smokers without AFL had SAD. No differences were detected in spirometric parameters or pulmonary attenuation between smokers with or without AFL and non-smokers. However, smokers with SAD had worse scores on HRQoL questionnaires than smokers without SAD or non-smokers, and scores compared to smokers with AFL were intermediate. R5 and X5 were identified as independent determinants of HRQoL in smokers without AFL.
ConclusionsSAD is common in smokers without AFL, affecting one third of this population, and independently affecting their perception of health.
El tabaquismo es, con diferencia, la causa más frecuente de enfermedad pulmonar obstructiva crónica (EPOC) en el mundo, siendo responsable de más del 80-90% de los nuevos casos1. Clásicamente, su desarrollo ha sido atribuido a una inflamación crónica desencadenada por el humo de tabaco, que libera sustancias proteolíticas y radicales libres favoreciendo el daño de las vías aéreas y la degradación del parénquima pulmonar hasta originar una limitación al flujo aéreo (LFA) con repercusión sintomática2. Sin embargo, desde hace ya varias décadas, se reconoce que la afectación precoz de las pequeñas vías aéreas desempeña un importante papel patogénico3,4.
Diversos estudios han explorado a fumadores que todavía no han desarrollado LFA mediante tomografía computarizada (TC)5,6. Sin embargo, este procedimiento no permite evaluar directamente las pequeñas vías aéreas, sino que analiza la pared de bronquiolos de mayor tamaño o la probable repercusión de la disfunción de las pequeñas vías (DPV) sobre la atenuación del parénquima pulmonar7. Frente a ello, la oscilación forzada u oscilometría de impulsos (IOS) proporciona una evaluación funcional específica de las pequeñas vías aéreas, adecuadamente sistematizada y con un patrón de afectación característico de la DPV8,9.
En los últimos años, se ha reconocido que los fumadores sin LFA constituyen un grupo heterogéneo con diferentes manifestaciones sintomáticas y repercusión sobre la calidad de vida relacionada con la salud (CVRS)10,11. Sin embargo, se dispone de poca información sobre parámetros funcionales o morfológicos que puedan discriminar a dichos fumadores y, en cierto modo, contribuir a su afectación sintomática. Dada su potencial relevancia patogénica, resulta atractivo considerar que la presencia de DPV podría constituir un paso previo al desarrollo de LFA12 y mostrar incipientes repercusiones sobre la calidad de vida.
Por tanto, establecemos como hipótesis que los fumadores sin LFA tienen una peor calidad de vida cuando han desarrollado DPV. Nuestro objetivo principal ha sido comparar la calidad de vida de fumadores sin LFA pero con evidencia de DPV mediante IOS con la de no fumadores, fumadores sin DPV y fumadores con LFA compatible con EPOC. Como objetivos secundarios hemos pretendido determinar la frecuencia de DPV en fumadores sin LFA y comparar las densidades de atenuación del parénquima pulmonar entre los 4 grupos de sujetos.
MétodosSujetos del estudioEn las consultas de deshabituación tabáquica de nuestro centro, se seleccionaron de forma consecutiva 53 fumadores activos sin evidencia de LFA y 20 fumadores activos con LFA compatible con EPOC. En ambos casos, los sujetos debían tener de 40 a 70 años y un consumo de tabaco acumulado medio de al menos 20 paquetes×año. Como grupo control, se seleccionaron 20 sujetos de 40 a 70 años del grupo de referencia de nuestro laboratorio. El estudio fue aprobado por el Comité de Ética de Investigación del Hospital Universitario La Paz (PI-1261) y todos los participantes firmaron su consentimiento informado.
En el material suplementario se proporciona información más detallada de los criterios de selección y de los procedimientos realizados.
DeterminacionesLa CVRS fue evaluada mediante la autoadministración de la versión española de los cuestionarios genéricos Short Form 36 Health Survey (SF-36) y European Quality of Life-5 Dimensions (EQ-5D), y en los fumadores se utilizaron los test de Fagerström y Glover-Nilsson.
Se realizó una TC de tórax de alta resolución volumétrica, en inspiración y espiración máximas, mediante un equipo de 16 detectores (Somatom Emotion 16, Siemens Medical Solutions, Erlangen, Alemania). Mediante un programa de análisis semiautomático (Software syngo InSpace4D, Siemens), se determinó, tanto en inspiración como en espiración máximas, la densidad pulmonar media (MLD), el porcentaje de vóxeles con valores de atenuación por debajo de −950 unidades Hounsfield (UH) (LAV) o entre −1.000 y −951 UH (subrango 1) y los umbrales de atenuación correspondientes al percentil 15 (P15)13.
Todas las pruebas de función respiratoria fueron llevadas a cabo por una única investigadora (CGQ) con un equipo MasterScreen (Viasys Healthcare, Würzburg, Alemania). La IOS se realizó según las recomendaciones vigentes8. Se solicitó a los participantes que, con una pinza nasal y sentados con la cabeza en una posición neutral, respiraran a volumen corriente con los labios sellados alrededor de una boquilla mientras apretaban firmemente sus mejillas con las manos. Al menos, se realizaron 3 registros aceptables (valores de coherencia a 5 y 20Hz≥0,7 y 0,9, respectivamente) con una duración de 30 segundos, utilizando para el análisis el promedio de 3 pruebas aceptables y repetibles (variabilidad <10%). Como índices de resistencia total y proximal de las vías aéreas, se utilizaron las resistencias respiratorias a 5 y 20Hz (R5 y R20), mientras que la caída en la resistencia de 5 a 20Hz (R5-R20) fue considerada un indicador de la resistencia de las vías aéreas periféricas. Además, se determinó la reactancia a 5Hz (X5) y el índice de área de reactancia de baja frecuencia (AX) como indicadores de la función de las vías respiratorias periféricas. Los datos obtenidos fueron interpretados en función de los valores de referencia europeos de Oostveen14. Inmediatamente después, se realizó una espirometría pre- y posbroncodilatador, según la normativa vigente15, utilizando los valores de referencia GLI16.
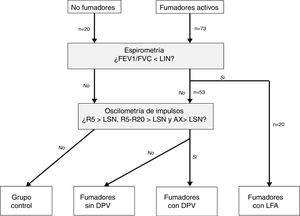
Clasificación de los pacientesSe definió LFA compatible con EPOC un FEV1/FVC posbroncodilatador menor del límite inferior de la normalidad17. La DPV fue definida por la presencia de una R5, R5-R20 y AX mayores de su límite superior de la normalidad18. En ausencia de LFA y DPV, los sujetos fueron considerados control. Según estos criterios, los sujetos del estudio fueron clasificados en 4 grupos mutuamente excluyentes: no fumadores control, fumadores sin DPV, fumadores con DPV y fumadores con LFA (fig. 1). Por último, los pacientes con LFA fueron clasificados por gravedad, grupo de riesgo y fenotipo de EPOC, según las recomendaciones vigentes19,20.
Distribución de los sujetos del estudio.AX: índice de área de reactancia de baja frecuencia; DPV: disfunción pequeñas vías aéreas; FEV1: volumen espiratorios forzado en el primer segundo; FVC: capacidad vital forzada; LFA: limitación al flujo aéreo; LIN: límite inferior de la normalidad; LSN: límite superior de la normalidad; R5: resistencia respiratoria a 5Hz; R20: resistencia respiratoria a 20Hz.
La estimación del tamaño muestral se realizó en función de una puntuación del componente físico del cuestionario SF-36 de 49,0±4,7 obtenida en un estudio piloto en fumadores sin LFA (datos no publicados). Para detectar una diferencia de al menos 5 unidades, mediante contraste bilateral, con un riesgo alfa de 0,05 y un riesgo beta de 0,10, se necesitarían 20 sujetos por cada grupo. Según un estudio previo que refirió una prevalencia de DPV del 26,3% entre fumadores o exfumadores con cardiopatía isquémica, alcanzando el 38% en fumadores activos21, para obtener 2 subgrupos de fumadores sin LFA comparables según la existencia o no de DPV, se necesitarían 53 sujetos.
Los datos se presentan como número (porcentaje) o media±desviación estándar, según sus características y una vez comprobado su ajuste a la distribución normal, mediante la prueba de Shapiro-Wilk. Para las comparaciones entre grupos se utilizó la prueba de chi-cuadrado y el análisis de varianza con comparaciones múltiples post-hoc mediante la prueba de Bonferroni. La relación entre variables fue evaluada utilizando el análisis de correlación de Pearson. Aquellas variables que alcanzaron una relación significativa fueron introducidas en un análisis de regresión lineal múltiple, que utilizó el método de pasos escalonados hacia delante. Un valor de p menor de 0,05 fue considerado significativo y todos los análisis fueron realizados con el programa SPSS 15.0 (SPSS Inc., Chicago, IL, EE.UU.).
ResultadosSegún los criterios establecidos, fueron reclutados 20 sujetos no fumadores, 53 fumadores activos sin LFA y 20 fumadores activos con LFA compatible con EPOC (tabla S1 del material suplementario). Los tres grupos resultaron homogéneos en sexo, edad, talla, peso e índice de masa corporal (tabla S2 del material suplementario).
En el grupo de fumadores sin LFA, se evidenció DPV en 19 sujetos, lo que supone una frecuencia del 35,8% (IC95%: 22,9-48,81%). En ningún sujeto del grupo de no fumadores se evidenció DPV, por lo que todos fueron considerados como sujetos control. En la tabla 1, se muestran las características antropométricas y de consumo de tabaco de los 4 grupos finalmente constituidos. Los parámetros antropométricos resultaron similares y no se apreciaron diferencias en las características del consumo de tabaco, dependencia de la nicotina ni dependencia psicológica, social o gestual entre los fumadores.
Características antropométricas y del hábito tabáquico en los grupos del estudio
| No fumadores (n=20) | Fumadores sin DPV (n=34) | Fumadores con DPV (n=19) | Fumadores con LFA (n=20) | p | |
|---|---|---|---|---|---|
| Sexo | 0,793 | ||||
| Mujer | 15 (75%) | 26 (76%) | 13 (68%) | 13 (65%) | |
| Hombre | 5 (25%) | 8 (24%) | 6 (32%) | 7 (35%) | |
| Edad, años | 55±6 | 53±7 | 51±6 | 53±6 | 0,229 |
| Talla, cm | 163±6 | 165±10 | 163±8 | 164±8 | 0,932 |
| Peso, kg | 69±10 | 71±16 | 68±11 | 70±13 | 0,717 |
| IMC, kg/m2 | 25,6±3,1 | 26,3±4,8 | 25,4±3,9 | 26,3±4,2 | 0,815 |
| Edad inicio tabaco, años | — | 18±3 | 18±5 | 20±3 | 0,267* |
| Cigarrillos/día | — | 22±10 | 18±6 | 23±12 | 0,091* |
| Paquetes×año | — | 42±24 | 31±12 | 37±16 | 0,063* |
| Test de Fagerström | — | 5,5±2,6 | 4,6±2,6 | 5,0±0 | 0,433* |
| Dependencia (test de Glover-Nilsson) | |||||
| Psicológica | — | 9,7±3,2 | 8,7±4,0 | 8,8±3,9 | 0,595* |
| Social | — | 3,6±1,8 | 3,9±2,2 | 3,4±2,1 | 0,695* |
| Gestual | — | 15,2±7,5 | 14,1±8,9 | 13,6±8,1 | 0,815* |
DPV: disfunción pequeñas vías aéreas; IMC: índice de masa corporal; LFA: limitación al flujo aéreo.
Al margen de las lógicas diferencias en las variables de la oscilación forzada utilizadas para definir los grupos, los únicos parámetros espirométricos que resultaron menores en los fumadores con DPV que en los fumadores sin DPV fueron el FEF25% y el FEF25-75% (tabla 2).
Características funcionales de los grupos del estudio
| No fumadores (n=20) | Fumadores sin DPV (n=34) | Fumadores con DPV (n=19) | Fumadores con LFA (n=20) | p | |
|---|---|---|---|---|---|
| FVC, % pred. | 112±10 | 96±27 | 85±29b | 82±4b,f | 0,002 |
| z-score FVC | 0,82±0,70 | −0,33±2,02 | −1,12±2,1b | −1,28±0,37b,f | 0,002 |
| FEV1, % pred. | 109±11 | 94±26 | 81±26a | 43±9a,e,g | <0,001 |
| z-score FEV1 | 0,70±0,82 | −0,45±1,99 | −1,34±1,99a | −3,83±0,56a,e,i | <0,001 |
| FEV1/FVC | 0,78±0,04 | 0,78±0,05 | 0,76±0,03 | 0,42±0,10a,d,g | <0,001 |
| z-score FEV1/FVC | −0,32±0,66 | −0,34±0,86 | −0,56±0,53 | −4,13±0,72a,d,g | <0,001 |
| FEF25-75%, % pred. | 81±15 | 83±33 | 58±34c,f | 42±23a,e,h | 0,005 |
| R5, % pred. | 87±15 | 103±24 | 157±37a,d | 162±38a,e | <0,001 |
| z-score R5 | −0,36±0,40 | 0,04±0,65 | 2,35±0,89a,d | 2,41±0,87a,e | <0,001 |
| R5-R20, % pred. | 86±6 | 94±4 | 186±12a,d | 179±13a,d | 0,003 |
| X5, % pred. | 106±6 | 110±7 | 164±11a,d | 182±23a,d | <0,001 |
| z-score X5 | 1,13±0,12 | 1,27±0,32 | 2,16±0,43a,d | 2,45±0,42a,d | <0,001 |
| AX, % pred. | 70±9 | 69±8 | 523±81a,d | 548±145a,d | <0,001 |
| z-score AX | −0,68±0,43 | −0,94±0,37 | 4,46±1,52a,d | 4,53±1,67a,d | <0,001 |
AX: índice de área de reactancia de baja frecuencia; DPV: disfunción pequeñas vías aéreas; FEF25-75%: flujo mesoespiratorio forzado; FEV1: volumen espiratorio forzado en el primer segundo; FVC: capacidad vital forzada; LFA: limitación al flujo aéreo; R5: resistencia respiratoria a 5Hz; R20: resistencia respiratoria a 20Hz; X5: reactancia capacitativa distal a 5Hz.
Claves de las comparaciones estadísticas:
La afectación morfológica del parénquima pulmonar evidenció una menor densidad de atenuación en los fumadores con LFA con respecto a los otros 3 grupos (tabla 3). Tanto en inspiración como en espiración, los pacientes con EPOC mostraban una menor densidad pulmonar media, mayores porcentajes de volumen de baja atenuación y volúmenes de atenuación de entre −1.000 a −951UH y de entre −950 a −901UH, así como un menor P15. Sin embargo, no se detectaron diferencias en las densidades de atenuación entre fumadores con o sin DPV. A su vez, tampoco se evidenció relación alguna entre las medidas de atenuación del parénquima pulmonar y las variables de oscilación forzada en los 2 grupos de fumadores sin LFA.
Comparación de los parámetros de atenuación del parénquima pulmonar entre los grupos del estudio
| No fumadores (n=20) | Fumadores sin DPV (n=34) | Fumadores con DPV (n=19) | Fumadores con LFA (n=20) | p | |
|---|---|---|---|---|---|
| MLD insp, UH | −831±25 | −826±27 | −839±20 | −856±30b,e,g | 0,001 |
| LAV insp, % | 2,2±2,5 | 1,8±2,0 | 3,0±2,9 | 13,8±11,3a,d,f | <0,001 |
| Subrango 1 (−1.000 a −951 UH) insp, % | 2,1±2,3 | 1,7±1,9 | 2,8±2,8 | 12,4±9,6a,d,f | <0,001 |
| P15 insp, UH | −907±21 | −902±21 | −914±17 | −939±28b,e,h | <0,001 |
| MLD esp, UH | −692±68 | −685±66 | −703±72 | −805±50a,d,f | <0,001 |
| LAV esp, % | 0,2±0,4 | 0,2±0,2 | 0,3±0,6 | 8,3±8,1a,d,f | <0,001 |
| Subrango 1 (−1.000 a −951 UH) esp, % | 0,2±0,3 | 0,2±0,2 | 0,3±0,5 | 7,1±6,7a,d,f | <0,001 |
| P15 esp, UH | −817±50 | −821±51 | −827±48 | −910±48b,d,f | <0,001 |
| MLD insp-esp, UH | −132±43 | −141±55 | −136±68 | −51±40a,d,f | <0,001 |
| LAV insp-esp, % | 3,7±4,3 | 1,6±2,0 | 2,7±2,8 | 5,5±4,5e | 0,002 |
| Subrango 1 (−1.000 a −951 UH) insp-esp, % | 3,8±4,0 | 1,5±1,9 | 2,6±2,7 | 5,3±4,2e,g | 0,001 |
| P15 insp-esp, UH | −70±59 | −92±41 | −87±45 | −29±28c,d,g | <0,001 |
DPV: disfunción pequeñas vías aéreas; esp: espiración; insp: inspiración; LAV: volumen de baja atenuación; LFA: limitación al flujo aéreo; MLD: densidad pulmonar media; UH: unidades Hounsfield; P: percentil.
Claves de las comparaciones estadísticas:
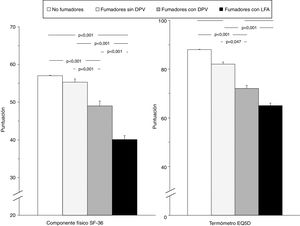
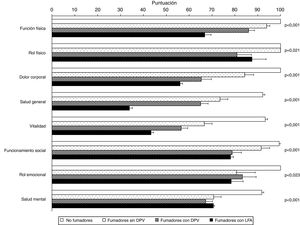
La tabla 4 muestra la comparación de la CVRS entre los 4 grupos del estudio. Además de las previsibles diferencias entre fumadores con LFA y los otros grupos, resulta interesante destacar que los fumadores con DPV tienen una peor puntuación en las escalas componente físico y componente mental del cuestionario SF-36 y en el termómetro del cuestionario EQ-5D, tanto con respecto a los controles no fumadores como a los fumadores sin DPV, lo que evidencia una situación intermedia de deterioro de la calidad de vida entre estos sujetos y los fumadores con EPOC (fig. 2). El análisis de los distintos dominios del cuestionario SF-36 muestra un comportamiento similar, que afecta principalmente a los dominios relacionados con el componente físico (tabla 4 y fig. 3).
Comparación de la calidad de vida relacionada con la salud entre los grupos del estudio
| Cuestionarios y dominios | No fumadores (n=20) | Fumadores sin DPV (n=34) | Fumadores con DPV (n=19) | Fumadores con LFA (n=20) | p |
|---|---|---|---|---|---|
| SF-36 | |||||
| Escala componente físico | 57,0±0,5 | 55,3±3,9 | 49,0±7,4a,e | 40,1±4,7a,d,g | <0,001 |
| Escala componente mental | 57,4±1,2 | 56,7±9,5 | 45,6±10,5a,f | 49,5±2,3c,f | <0,001 |
| Función física | 100±0 | 93,9±6,1 | 86,0±15,0a | 66,8±12,5a,d,g | <0,001 |
| Rol físico | 100±0 | 100±0 | 80,9±36,9 | 87,5±27,5 | 0,021 |
| Dolor corporal | 100±0 | 84,3±17,2 | 65,3±26,1a,e | 56,0±5,0a,d | <0,001 |
| Salud general | 92,2±4,0 | 73,5±15,0c | 65,0±19,1a,d | 33,9±6,0a,d,g | <0,001 |
| Vitalidad | 93,3±4,7 | 66,6±14,8a | 56,5±16,7a,f | 43,3±4,9a,d,h | <0,001 |
| Funcionamiento social | 99,4±2,8 | 91,5±16,1 | 78,8±23,7a,f | 78,1±5,6b | <0,001 |
| Rol emocional | 100±0 | 80,7±35,7 | 83,3±35,1 | 78,4±32,0 | 0,023 |
| Salud mental | 91,8±3,8 | 70,7±14,2a | 67,2±17,7a | 70,6±2,3a | <0,001 |
| EQ-5D | |||||
| Tarifa EVA | 1,000±0 | 0,905±0,145 | 0,817±0,158a | 0,864±0,143b | <0,001 |
| Tarifa ET | 1,000±0 | 0,937±0,129 | 0,871±0,160 | 0,829±0,100b | 0,004 |
| Termómetro | 88±4 | 82±10 | 72±16a,f | 65±8a,d | <0,001 |
DPV: disfunción pequeñas vías aéreas; EQ-5D: European Quality of Life-5 Dimensions; ET: equivalencia temporal; EVA: escala visual analógica; LFA: limitación al flujo aéreo; SF-36: Short Form 36 Health Survey.
Claves de las comparaciones estadísticas:
Comparación de las puntuaciones globales del componente físico del cuestionario SF-36 y del termómetro del cuestionario EQ-5D en los 4 grupos del estudio. Las barras de error corresponden al error estándar de la media.DPV: disfunción pequeñas vías aéreas; EQ-5D: European Quality of Life-5 Dimensions; LFA: limitación al flujo aéreo; SF-36: Short Form 36 Health Survey.
En los fumadores sin LFA, tanto con DPV como sin ella, no se halló relación alguna entre la CVRS y las características antropométricas, edad de inicio, intensidad del consumo de tabaco, años de tabaquismo ni con las puntuaciones de los test de Fagerström o Glover-Nilsson.
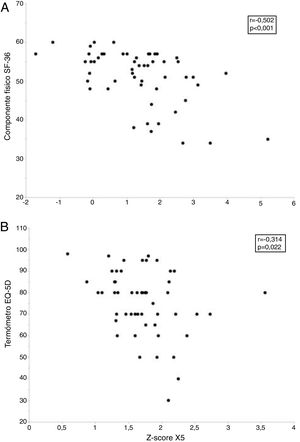
Sin embargo, la calidad de vida de estos sujetos se relacionó con diversos parámetros funcionales y morfológicos (tabla 5). Así la puntuación de la escala componente físico del cuestionario SF-36 alcanzó una moderada relación inversamente proporcional con R5, R20, X5 y AX y una débil relación directamente proporcional con la FVC, FEV1 y FEF25-75%, así como con diversas medidas de atenuación del parénquima (MLD y P15) en inspiración. A su vez, la puntuación obtenida en el termómetro del EQ-5D se relacionó de forma inversamente proporcional con R5 y X5 (tabla 5). Finalmente, los modelos de regresión lineal múltiple solo retuvieron a la R5 y X5 como predictores independientes del componente físico del cuestionario SF-36 y del termómetro EQ-5D, respectivamente (fig. 4 y tabla 6).
Parámetros funcionales y morfológicos relacionados con la valoración global de la calidad de vida relacionada con la salud en fumadores sin limitación al flujo aéreo
| Parámetro | Escala componente físico | Termómetro EQ-5D | ||
|---|---|---|---|---|
| Coeficiente de correlación (IC95%) | p | Coeficiente de correlación (IC95%) | p | |
| FVC, % pred. | 0,300 (0,032 a 0,528) | 0,029 | — | — |
| z-score FVC | 0,298 (0,030 a 0,526) | 0,030 | — | — |
| FEV1, % pred. | 0,320 (0,054 a 0,543) | 0,020 | — | — |
| z-score FEV1 | 0,305 (0,038 a 0,531) | 0,026 | — | — |
| FEF25-75%, % pred. | 0,328 (0,063 a 0,550) | 0,017 | — | — |
| R5, % pred. | −0,448 (−0,641 a −0,202) | 0,001 | −0,276 (−0,508 a −0,006) | 0,046 |
| z-score R5 | −0,502 (−0,680 a −0,268) | <0,001 | −0,297 (−0,525 a −0,029) | 0,031 |
| R20, % pred. | −0,521 (−0,694 a −0,292) | <0,001 | — | — |
| z-score R20 | −0,468 (−0,655 a −0,226) | <0,001 | — | — |
| X5, % pred. | −0,509 (−0,685 a −0,277) | <0,001 | −0,311 (−0,536 a −0,044) | 0,024 |
| z-score X5 | −0,515 (−0,689 a −0,284) | <0,001 | −0,314 (−0,539 a −0,048) | 0,022 |
| AX, % pred. | −0,339 (−0,558 a −0,076) | 0,015 | — | — |
| z-score AX | −0,338 (−0,557 a −0,075) | 0,015 | — | — |
| MLD insp, UH | 0,298 (0,030 a 0,526) | 0,030 | — | — |
| P15 insp, UH | 0,298 (0,030 a 0,526) | 0,031 | — | — |
AX: índice de área de reactancia de baja frecuencia; FEF25-75%: flujo mesoespiratorio forzado; FEV1: volumen espiratorio forzado en el primer segundo; FVC: capacidad vital forzada; insp: inspiración; IC95%: intervalo de confianza al 95%; MLD: densidad pulmonar media; P: percentil; R5: resistencia respiratoria a 5Hz; R20: resistencia respiratoria a 20Hz; UH: unidades Hounsfield; X5: reactancia capacitativa distal a 5Hz.
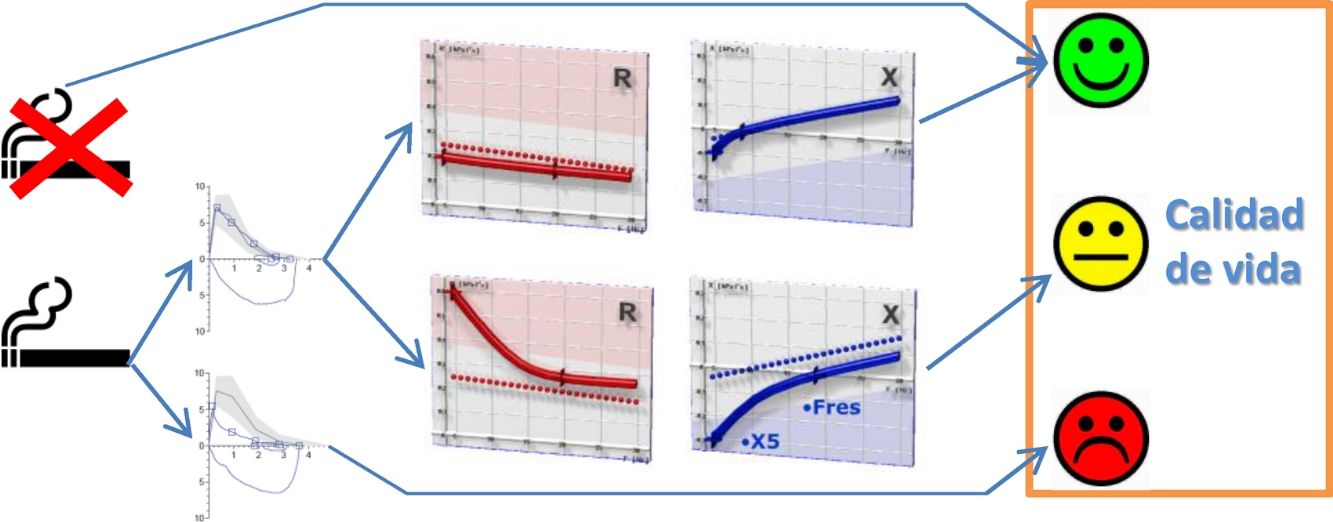
Relación entre los parámetros oscilométricos y la calidad de vida relacionada con la salud en fumadores sin limitación al flujo aéreo. El panel superior (A) muestra la relación entre la resistencia respiratoria a 5Hz (R5) y el componente físico del cuestionario Short Form 36 Health Survey (SF-36), mientras que el panel inferior (B) presenta la relación entre la reactancia capacitativa a 5Hz (X5) y el termómetro del cuestionario European Quality of Life-5 Dimensions (EQ-5D).
Factores determinantes independientes de la calidad de vida relacionada con la salud en fumadores sin limitación al flujo aéreo
| Coeficientes no estandarizados | Coeficientes estandarizados | Cambio r2 | p | |||
|---|---|---|---|---|---|---|
| Beta | Error típico | IC95% | Beta | |||
| Componente físico cuestionario SF-36 | ||||||
| z-score R5 | −2,616 | 0,594 | −3,810 a −1,422 | −0,520 | 0,290 | <0,001 |
| Constante | −21,345 | 36,957 | −95,693 a 53,002 | — | — | 0,566 |
| Termómetro cuestionario EQ-5D | ||||||
| z-score X5 | −9,559 | 4,049 | −17,687 a −1,430 | −0,314 | 0,099 | 0,022 |
| Constante | 73,058 | 2,262 | 68,517 a 77,599 | — | — | <0,001 |
EQ-5D: European Quality of Life-5 Dimensions; IC95%: intervalo de confianza al 95%; r2: coeficiente de determinación; R5: resistencia respiratoria a 5Hz; SF-36: Short Form 36 Health Survey; X5: reactancia capacitativa a 5Hz.
Los principales resultados de nuestro estudio consisten en la demostración que la DPV resulta frecuente en fumadores sin LFA, afectando a más de un tercio de los mismos. Aunque la presencia de esta alteración no tiene repercusión sobre la espirometría ni sobre los cambios en la atenuación del parénquima pulmonar, se asocia a un deterioro incipiente de la CVRS, hasta el punto de identificar una relación independiente entre la misma y algunos parámetros de oscilación forzada.
La frecuencia de DPV detectada en nuestros fumadores es superior a la identificada en estudios previos, que referían que un 5-13% de fumadores con espirometría normal podían tener una IOS alterada22,23. Sin embargo, en dichos estudios no se establecía un punto de corte concreto para la detección de DPV y se mezclaban fumadores activos con exfumadores de distinto tiempo de evolución. En contraste, empleando puntos de corte predeterminados para R5-R20, se ha referido la presencia de DPV en un 33-42% de sujetos con asma y una espirometría normal24,25. Aunque la información disponible en fumadores sin LFA resulta escasa, Jetmalani et al.26 encontraron que hasta un 51% de dichos sujetos tenían al menos una anomalía en, predominantemente en la resistencia respiratoria, mientras que Berger et al.27 describen que un 56% de fumadores asintomáticos con espirometría normal tienen una R5 elevada. En cualquier caso, el porcentaje de DPV identificada en fumadores sin LFA resulta concordante con la hallada mediante lavado múltiple de nitrógeno, que permite identificar afectación de las vías aéreas de conducción en un 24% de los sujetos y de las vías accinares en un 38%28.
Un análisis previo de una submuestra del estudio ECLIPSE puso de manifiesto la potencial utilidad de la IOS en las fases preliminares del daño pulmonar inducido por el tabaco22. Aunque en dicho estudio no se detectaron diferencias en los valores absolutos de los parámetros oscilométricos entre pacientes con EPOC, fumadores sin LFA y no fumadores, probablemente por las notables diferencias en las características antropométricas y de tabaquismo entre los grupos, el estudio demostró que la variabilidad intraindividual a corto y medio plazo de la impedancia del sistema respiratorio es muy discreta y aceptable clínicamente22. Pero lo más interesante, fue la identificación de un grupo de fumadores «aparentemente sanos» que tenían una AX elevada, lo que llevó a los autores a plantear la existencia de una alteración de las pequeñas vías aéreas, que constituiría una evidencia precoz de LFA no detectada con los parámetros espirométricos convencionales22. En la misma línea, Frantz et al.29 compararon a pacientes con una espirometría normal y un diagnóstico autorreferido de bronquitis crónica o enfisema con sujetos sin dicho diagnóstico, comprobando que los primeros tenían valores más elevados de R5, R5-R20, X5 y AX, además de una mayor utilización de medicación respiratoria.
Es interesante destacar que en nuestros fumadores sin evidencia de LFA no se halló relación alguna entre los parámetros oscilométricos y las medidas de atenuación del parénquima pulmonar en inspiración o espiración, al igual que se ha descrito en el estudio ECLIPSE con respecto a las medidas de TC realizadas en inspiración22. Para justificar esta discrepancia, se ha propuesto la existencia de 3 tipos de afectación pulmonar evidenciada por TC: engrosamiento de la pared de las vías aéreas, aumento de la atenuación pulmonar (enfisema) y mixto30. Las alteraciones de R5, R5-R20, fres y X5 se corresponderían sobre todo a la afectación de las vías aéreas y a la mixta, por lo que no es previsible su relación con los cambios de atenuación30. Otra explicación complementaria podría radicar en que la IOS y la TC son sensibles a cambios de la mecánica pulmonar producidos en distintas etapas de progresión del daño de las vías aéreas. La resistencia se ve afectada por múltiples factores, entre los que destaca el calibre de las vías aéreas, particularmente cuando su estrechamiento es heterogéneo, generalizado e involucra a vías aéreas centrales y periféricas14. La reactancia también es sensible al estrechamiento heterogéneo y generalizado de la luz bronquial y bronquiolar, pero además depende del cierre de las vías aéreas9, por lo que también podría verse comprometida en caso de atrapamiento aéreo. Sin embargo, se ha descrito que el atrapamiento aéreo de los fumadores sin LFA es mucho menor al de los asmáticos31, por lo que probablemente esta alteración es muy discreta para inducir cambios relevantes en la atenuación pulmonar y generar un incremento adicional de la X5. En definitiva, se podría plantear que la TC permite evaluar la afectación distal de parénquima, mientras que la impedancia respiratoria, y particularmente las resistencias respiratorias, reflejan el calibre de las pequeñas vías aéreas, incluso mejor que el grosor de la pared bronquial, puesto que esta última medida se realiza sobre generaciones bronquiales anteriores31.
En nuestra opinión, el resultado más novedoso del presente estudio es el deterioro de la CVRS en fumadores activos con DPV que todavía no han desarrollado LFA. Previamente, se había descrito que los sujetos con una R5 elevada refieren sibilancias con mayor frecuencia28. La disminución de la CVRS en los fumadores con DPV, situándose en una posición intermedia entre los no fumadores o fumadores sin DPV y los fumadores con LFA, podría justificar las diferencias en la percepción subjetiva de salud de los fumadores. Resulta conocido que los fumadores tienen peor CVRS que los no fumadores32 y que la persistencia del tabaquismo se asocia a un deterioro progresivo de la misma11, mientras que su abandono origina una mejoría de la calidad de vida33. Al igual que en nuestro estudio, la afectación de la CVRS se puede detectar mediante cambios en las tarifas del cuestionario EQ-5D y en todos los dominios de los cuestionarios SF-12 y SF-3633-35, aunque con un grado de afectación ligeramente superior al de nuestros pacientes, probablemente por tratarse de sujetos de mayor edad, con un mayor predominio de hombres, sin una tasa acumulada de tabaquismo conocida y procedentes de otras áreas geográficas.
Sin embargo, lo más destacado de la afectación de la CVRS en fumadores con espirometría normal es la heterogeneidad de su intensidad, que hasta el momento no ha podido ser adecuadamente justificada solo por una mayor intensidad del hábito34 o una mayor dependencia de la nicotina35. La identificación que los fumadores con DPV son los que realmente experimentan un deterioro de su calidad de vida permite identificar un potencial riesgo de esta alteración funcional y es concordante con información procedente de pacientes con EPOC, en los que la DPV evaluada mediante IOS se relaciona con su estado de salud y con su nivel de disnea36.
Resulta razonable asumir que la presencia de DPV en fumadores sin LFA es debida al estrés oxidativo y al daño directo originado por la inflamación local en las vías aéreas periféricas37. De hecho, en fumadores con espirometría normal, se ha comprobado que aquellos que tienen DPV presentan un mayor recuento de linfocitos y neutrófilos en su lavado broncoalveolar y mayores niveles de las citocinas IL-8 y eotaxina, así como de la quimioquina CD3CL127, que resulta particularmente importante por estar implicada en la diferenciación de células Th1738 y, por lo tanto, en la progresión de las enfermedades respiratorias crónicas. A su vez, la existencia de una relación directamente proporcional entre la R5 y los niveles en lavado broncoalveolar de IL-8, eotaxina, CD3CL1, IL-12p70 y TGFalfa soporta su asociación con el grado de inflamación de las vías aéreas distales27.
La información disponible sobre el significado pronóstico de la DPV en fumadores sin LFA todavía es incipiente, aunque en fumadores y exfumadores sin EPOC del estudio COPDGene se ha comprobado que la alteración de las pequeñas vías aéreas se relaciona con la tasa de deterioro anual del FEV1, que llega a equipararse con la de los pacientes con EPOC moderada, aunque podría resultar reversible si se controla la inflamación de las vías aéreas más distales39. Estos resultados parecen concordantes con los obtenidos en un pequeño grupo de pacientes con EPOC moderada seguidos durante 5 años, en los que la X5, AX y fres también se relacionaron con la tasa de deterioro anual del FEV140.
Nuestro estudio presenta diversas limitaciones. Se trata de un estudio unicéntrico y con un limitado tamaño muestral, aunque suficiente para detectar diferencias en la CVRS entre los distintos grupos de sujetos. Ello hace difícil la extrapolación de los resultados a la población de fumadores en general. A diferencia de otros análisis, hemos incluido un elevado número de mujeres y de sujetos en la edad media de la vida para disponer de una muestra más representativa de la población fumadora actual, aunque esto hace que la comparación con otros estudios deba ser cautelosa. La evaluación de la atenuación del parénquima pulmonar se realizó mediante un software de uso clínico, que no proporciona medidas del grosor del calibre de las vías aéreas. A su vez, tampoco se dispone de mediciones de la capacidad de difusión pulmonar, aunque la posibilidad de hallar alteraciones en este parámetro entre los fumadores con o sin DPV parece poco probable por no mostrar diferencias en sus densidades de atenuación. Por último, se trata de un estudio transversal, por lo que del mismo no se pueden establecer inferencias pronósticas ni demostrar asociación o causalidad. En esta misma línea, nuestros resultados no permiten establecer una recomendación sobre el manejo o tratamiento de los fumadores activos con DPV.
En conclusión, la DPV en fumadores activos que todavía no han desarrollado LFA ni alteraciones en la densidad de atenuación pulmonar tiene impacto en la percepción sintomática de la salud, puesto que los fumadores con DPV presentan un deterioro de su CVRS, situándose en una posición intermedia entre los no fumadores o fumadores sin DPV y los fumadores que han desarrollado una EPOC. La utilización de la oscilación forzada constituye un procedimiento simple, rápido, inocuo y de escaso coste que permite identificar DPV en más de un tercio de fumadores activos.
FinanciaciónProyecto de investigación parcialmente financiado por Chiesi. Dicho patrocinador no ha participado en el diseño del estudio, la recolección, el análisis y la interpretación de los datos, la redacción del manuscrito o la decisión de enviar el artículo para su publicación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.