Introducción
La fibrosis quística (FQ) es una enfermedad multisistémica que afecta, entre otros órganos, al pulmón y al páncreas, tanto exocrino como endocrino. Es la enfermedad genética autosómica recesiva grave más frecuente de la raza blanca, con una incidencia aproximada de uno por cada 2.500 nacidos vivos1. El páncreas exocrino se ve afectado en el 85-90% de los enfermos y el comienzo de la lesión es intrauterino. Sin embargo, la alteración del páncreas endocrino es tardía e incrementa su frecuencia con la edad de los pacientes2.
Es importante el diagnóstico y tratamiento precoz de la diabetes mellitus (DM) relacionada con la FQ (DMRFQ), ya que la falta de control glucémico adecuado condicionará una peor evolución de la función respiratoria de estos pacientes y una mayor morbilidad3 y mortalidad2.
La alteración hidrocarbonada se presenta en los pacientes con insuficiencia pancreática exocrina asociada y preferentemente en los portadores de la mutación ΔF508. La prevalencia de diabetes es 100 veces mayor entre los pacientes con FQ que en la población general. Hay un factor que podría modificar la incidencia de las alteraciones del metabolismo hidrocarbonado en estos pacientes: el trasplante pulmonar, tratamiento final y única alternativa en muchos casos. En los pacientes que reciben trasplante de órganos sólidos la aparición de DM en relación con éste es una complicación frecuente e importante. Numerosos estudios analizan los factores que influyen en su aparición4,5, entre ellos el tipo de inmunodepresión inicial empleada. Se ha estudiado fundamentalmente en los receptores de trasplante renal, pero factores similares deberían de incidir en pacientes sometidos a otro tipo de trasplante, como el pulmonar.
Teniendo en cuenta que los pacientes con FQ constituyen una población de riesgo, con una mayor predisposición para el desarrollo de alteraciones del metabolismo hidrocarbonado, es lógico pensar que, ante este factor diabetógeno añadido que suponen el trasplante y su tratamiento asociado, la incidencia de diabetes en estos pacientes se incrementaría notablemente. Un estudio publicado recientemente apoya esta hipótesis6.
El objetivo de este estudio ha sido analizar si el trasplante pulmonar es un factor de riesgo importante para el desarrollo de alteraciones hidrocarbonadas en la FQ, si influye en la gravedad y tratamiento de dichas alteraciones, y si existe relación con el tipo de inmunodepresión inicial utilizada.
Pacientes y métodos
Se ha realizado un estudio transversal retrospectivo de 54 pacientes afectados de FQ y controlados en las Consultas de Endocrinología del Hospital Universitario La Fe de Valencia. Se recogieron los siguientes datos: sexo, edad en el momento del estudio, peso, talla e índice de masa corporal (peso [kg]/talla [m]2), valores de glucemia e insulinemia basales y a los 120 min de sobrecarga oral con 75 g de glucosa. La glucemia se determinó mediante método enzimático (método de la hexocinasa). Se utilizó el sistema AU5400, en Analizador OLYMPUS (Olympus Europe, Hamburg, Alemania). La insulinemia se determinó mediante ensayo inmunométrico por método de quimioluminiscencia. Se utilizó el analizador IMMULITE 2000 (DPC DIPESA, Diagnostic Products Corporation, Los Angeles, California, EE.UU.). Se calculó el índice de resistencia a la insulina HOMAIR (de Homeostasis Model Assessment) mediante la fórmula siguiente7: [insulinemia (μU/ml) × glucemia (mmol/l)]/22,5.
El tipo de mutación se analizó en 31 casos; en los restantes no pudo obtenerse el dato. En los casos en que se determinó en la Unidad de Genética del Hospital Universitario La Fe, se realizó mediante amplificación de las secuencias exónicas y secuencias intrónicas colindantes con técnica de reacción en cadena de la polimerasa, seguido de búsqueda de las mutaciones más frecuentes en la población española mediante diversos métodos: polimorfismos de conformación de cadena sencilla/heterodúplex o digestión con enzimas de restricción.
Los datos de insuficiencia pancreática exocrina se obtuvieron en 45 pacientes. Se evaluó mediante el test de Van de Kamer. Se determinó grasa en heces de 24 h durante 3 días consecutivos, con dieta rica en grasas desde 3 días antes; se analizó mediante espectrofotometría de infrarrojo, con el analizador FENIR 8820 (Alerbio, Madrid, España). Se consideró patológica una cantidad de grasa en heces superior a 6 g/día.
Se recogió la presencia o no de trasplante pulmonar. En caso de haberse realizado, se anotaron la edad en el momento de la intervención, el tiempo de evolución del trasplante, la existencia o no de alteración previa del metabolismo hidrocarbonado y de qué tipo, la aparición o no de DM postrasplante (DMPT) no transitoria, el momento en que se produjo y su tratamiento, y el tipo de inmunodepresión inicial empleada.
En el estadio de alteración de la tolerancia a la glucosa no hay manifestaciones clínicas indicativas que nos lleven al diagnóstico y, si no se estudia de manera sistemática, no se diagnostica el trastorno8. Por ello, está hoy aceptado que el estudio del metabolismo hidrocarbonado debe realizarse en los pacientes que presentan insuficiencia pancreática exocrina asociada y son mayores de 10 años, con un protocolo establecido, que consiste en la realización anual del test de tolerancia oral a la glucosa2,9, según el cual se clasificará a los pacientes en 5 categorías (criterios de la American Diabetes Association de 2004):
1. Tolerancia normal a la glucosa: glucemia menor de 100 mg/dl en ayunas y de 140 mg/dl a las 2 h.
2. Glucemia basal alterada: glucemia en ayunas de 100-125 mg/dl y a las 2 h menor de 140 mg/dl.
3. Intolerancia hidrocarbonada: glucemia en ayunas inferior a 126 mg/dl y a las 2 h de 140-199 mg/dl.
4. DMRFQ sin hiperglucemia basal: glucemia en ayunas menor de 126 mg/dl y a las 2 h de 200 mg/dl o más.
5. DMRFQ con hiperglucemia basal: glucemia en ayunas de 126 mg/dl o más y a las 2 h de 200 mg/dl o superior.
A todos los pacientes sin DM que presentan insuficiencia pancreática exocrina seguidos en nuestras consultas se les realiza sobrecarga oral de glucosa de forma anual. Después del trasplante se efectuó seguimiento con glucemias basales. En los pacientes remitidos desde otros centros para trasplante, y no valorados previamente a éste en nuestra consulta, no se pudo obtener el dato de la sobrecarga oral de glucosa previa, de modo que se clasificó el metabolismo hidrocarbonado según datos de anamnesis y analítica basal.
Se definió como DMPT no transitoria la presencia de hiperglucemia, según lo descrito en los criterios de la American Diabetes Association de 2004, más allá de 30 días después del trasplante, con necesidad de tratamiento farmacológico o no10,11.
Los datos se analizaron con el programa estadístico SPSS versión 12.0. Las variables cuantitativas se expresan como media ± desviación estándar (valor mínimo y máximo). Las variables cualitativas se expresan en porcentajes y la relación entre variables cualitativas se analizó mediante la prueba de la χ².
Al analizar y comparar el tratamiento que seguían los pacientes, los trasplantados que ya eran diabéticos previamente (n = 4) se incluyeron en el grupo de tratamiento de los no trasplantados, porque ya estaban en tratamiento insulínico antes del trasplante, por lo que no se puede considerar que el trasplante pulmonar fuera un factor que influyera en el tipo de tratamiento en estos casos. Por tanto, en el grupo de tratamiento de los pacientes trasplantados sólo se consideró a los 14 con DMPT. En el grupo de los no trasplantados se consideró a los 10 pacientes con intolerancia hidrocarbonada, a los 8 con DMRFQ no trasplantados y a los 4 con DMRFQ trasplantados. En ambos casos se excluyó a los pacientes sin alteraciones hidrocarbonadas, que no precisaban ningún tratamiento.
La influencia de la inmunodepresión inicial sólo se analizó en los 16 pacientes que no presentaban DM antes del trasplante. En uno de ellos no se pudo obtener el dato; por tanto, se analizó finalmente en 15 pacientes. En todos ellos se utilizó tratamiento triple con un inhibidor de la calcineurina (ciclosporina en 10 pacientes y tacrolimus en 5), un agente inmunodepresor no inhibidor de la calcineurina (azatioprina en 13 casos y micofenolatomofetil en 2) y prednisona a dosis comparables en todos ellos.
Resultados
Del total de los 54 pacientes estudiados, 34 eran varones (63%) y 20 eran mujeres (37%). La media (± desviación estándar) de edad en el momento del estudio fue de 25,4 ± 4,7 años (rango: 16-39). Presentaron un índice de masa corporal de 20,4 ± 3,3 kg/m² (rango: 14,3-28,2).
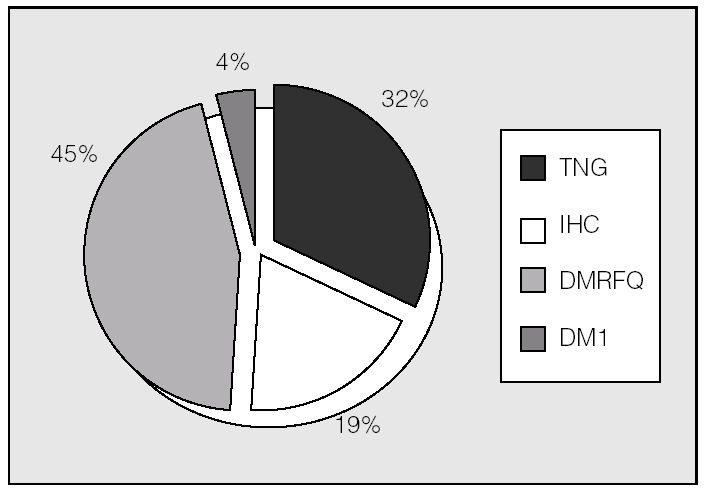
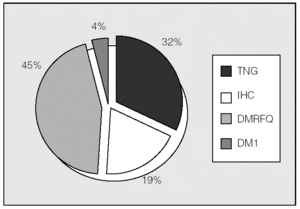
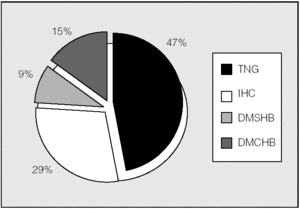
Las alteraciones del metabolismo hidrocarbonado en el total de los pacientes mostraban en el momento del estudio la distribución representada en la figura 1. Se observó un 45% de prevalencia de DM. El HOMAIR fue de 1,14 ± 0,65.
Fig. 1. Clasificación de alteraciones hidrocarbonadas en el conjunto de la población estudiada (n = 54). DM1: diabetes mellitus tipo 1; DMRFQ: diabetes mellitus relacionada con la fibrosis quística (incluye las diabetes pre y postrasplante); IHC: intolerancia hidrocarbonada; TNG: tolerancia normal a la glucosa.
De los 54 pacientes, 20 recibieron trasplante pulmonar (37%). La edad media en el momento del trasplante fue de 19,6 ± 4,9 años (rango: 10-31) y el tiempo de evolución del trasplante fue de 5,3 ± 3,2 años (rango: 2 meses a 11 años).
El 58,1% (n = 18) era portador de la mutación ΔF508 heterocigota, el 16,1% (n = 5) de ΔF508 homocigota, y el 25,8% (8 pacientes) de otros tipos distintos. Todos aquéllos con la mutación ΔF508 homocigota presentaron algún tipo de alteración hidrocarbonada: un 60% (n = 3) intolerancia hidrocarbonada y un 40% (n = 2) DM. Los pacientes con mutación ΔF508 heterocigota u otro tipo distinto presentaban tolerancia normal a la glucosa en el 50%, y en el otro 50%, intolerancia hidrocarbonada o DM.
El 86,7% de los pacientes (n = 39) presentaba insuficiencia pancreática exocrina. Entre quienes no la presentaban (13,3%; n = 6) ninguno desarrolló alteración hidrocarbonada, ninguno recibió trasplante pulmonar, ninguno era portador de la mutación ΔF508 homocigota y todos son mayores de 23 años en la actualidad.
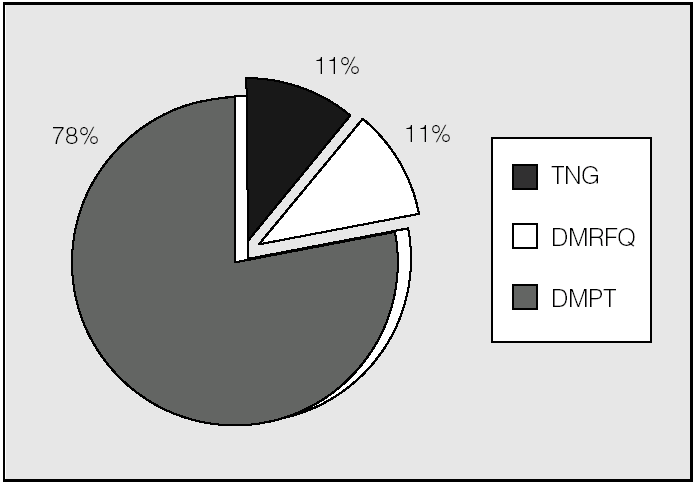
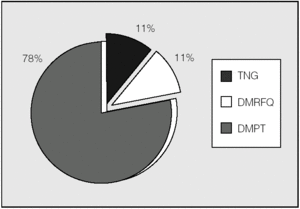
Analizando sólo a los pacientes trasplantados (fig. 2), 2 presentaban DMRFQ y otros 2 DM tipo 1 antes del trasplante. De los 16 restantes, 14 (87,5%) presentaron DMPT no transitoria y 2 permanecen con glucemias normales. Se excluyen en la figura 2 los 2 pacientes con DM tipo 1, por no tener relación su alteración hidrocarbonada con la FQ ni con el trasplante pulmonar.
Fig. 2. Clasificación de alteraciones hidrocarbonadas en pacientes trasplantados (n = 18). DMPT: diabetes mellitus postrasplante (todas con hiperglucemia basal); DMRFQ: diabetes mellitus relacionada con la fibrosis quística (todas con hiperglucemia basal); TNG: tolerancia normal a la glucosa.
De los 20 pacientes trasplantados, 4 eran diabéticos previamente y 16 no lo eran. De esos 16 no diabéticos, 14 presentaron DMPT. Analizando su situación previa, 2 presentaban intolerancia hidrocarbonada antes del trasplante; 9 no tenían alteración del metabolismo hidrocarbonado antes de someterse a la intervención, lo que se demostró con la realización de la sobrecarga oral de glucosa; en los 3 restantes no había alteración previa referida por el paciente, pero se desconocen los datos de sobrecarga oral de glucosa por haber sido seguidos en otro centro antes del trasplante.
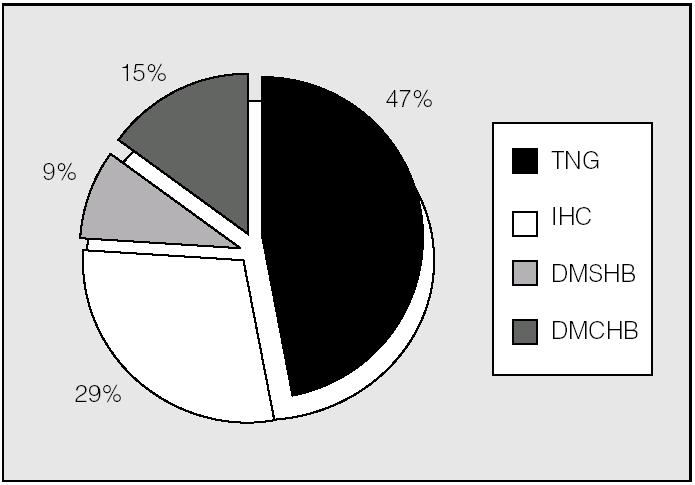
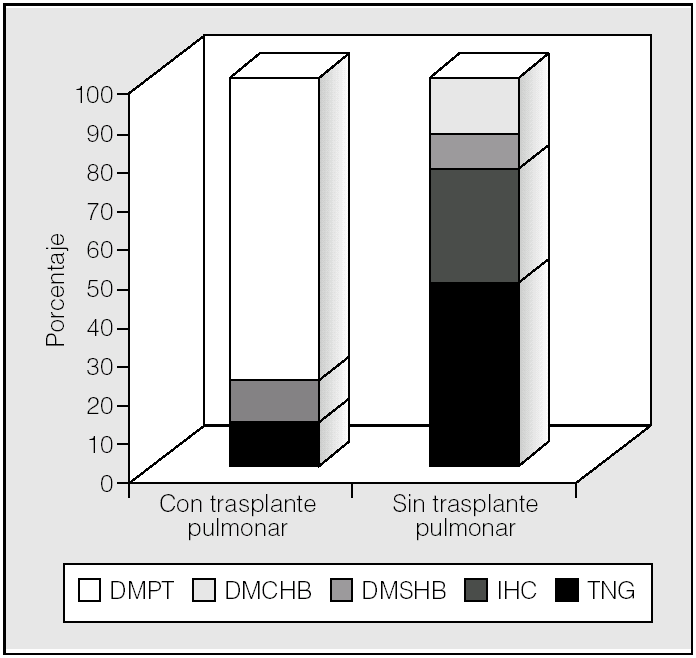
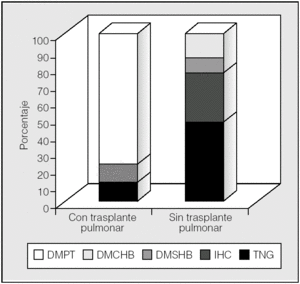
En los pacientes no trasplantados predominó la intolerancia hidrocarbonada frente a la DM (fig. 3). Se observó una diferencia significativa en la prevalencia de alteraciones del metabolismo de hidratos de carbono en función del trasplante pulmonar (p < 0,01; prueba de χ²). En los pacientes trasplantados la prevalencia de diabetes fue del 89% (un 78% con DMPT y un 11% con DMRFQ previa). Los no trasplantados presentaron en un 24% DMRFQ y en un 29% intolerancia hidrocarbonada; el resto de pacientes presentaba tolerancia normal a la glucosa (fig. 4).
Fig. 3. Clasificación de alteraciones hidrocarbonadas en pacientes no trasplantados (n = 34). DMCHB: diabetes mellitus con hiperglucemia basal; DMSHB: diabetes mellitus sin hiperglucemia basal; IHC: intolerancia hidrocarbonada; TNG: tolerancia normal a la glucosa.
Fig. 4. Alteraciones hidrocarbonadas en función del trasplante pulmonar. DMCHB: diabetes mellitus con hiperglucemia basal; DMPT: diabetes mellitus postrasplante (todas con hiperglucemia basal); DMSHB: diabetes mellitus sin hiperglucemia basal; IHC: intolerancia hidrocarbonada; TNG: tolerancia normal a la glucosa.
El tiempo que tardó en aparecer la DMPT fue de 1,8 ± 2,5 años (rango: postrasplante inmediato a 7 años después). El tiempo de seguimiento de la DMPT fue de 4,5 ± 3,4 años (rango; 6 meses a 11 años).
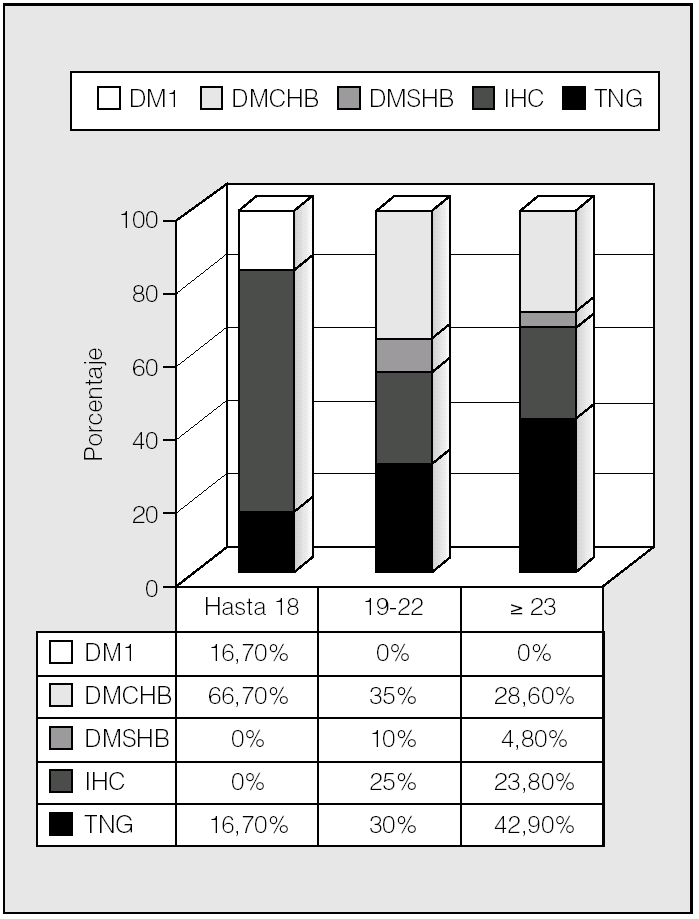
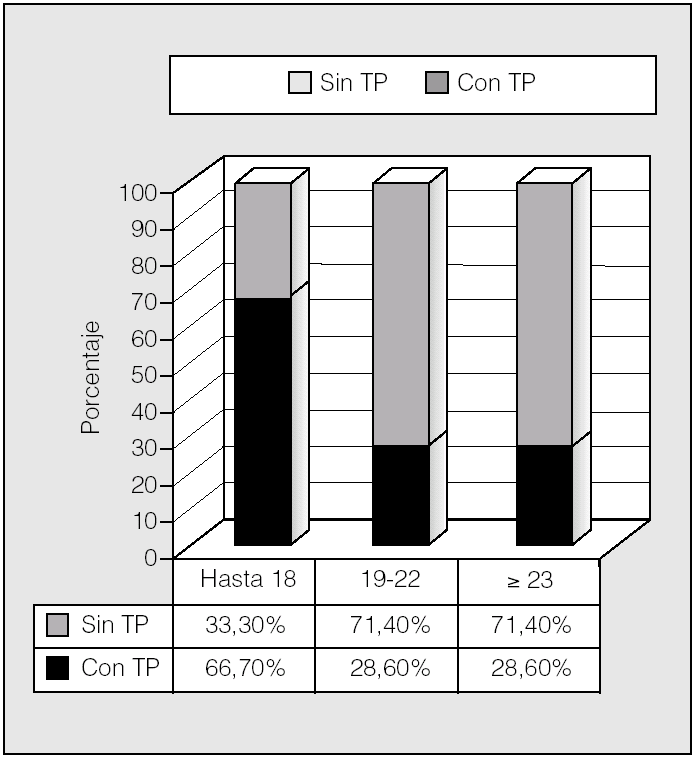
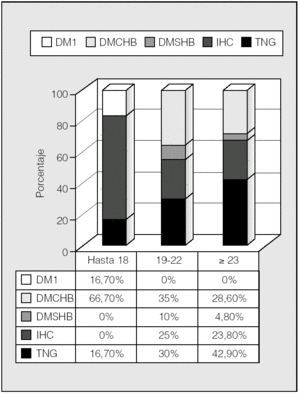
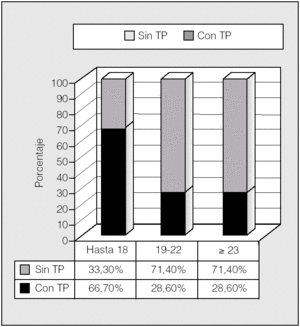
La distribución de las alteraciones hidrocarbonadas por grupos de edad se representa en la figura 5. En el rango de edad hasta los 18 años, un 66,7% eran diabéticos, mientras que lo era el 45% de los de 19-22 años y el 33,4% de los mayores de 23 años. Por tanto, la tolerancia normal a la glucosa incrementó su frecuencia con la edad (p < 0,05; prueba de χ²). Para ver si esto podía tener relación con el trasplante pulmonar, se analizó éste en relación con los grupos de edad (fig. 6). Se observa que en el rango de edad hasta los 18 años es donde había más pacientes diabéticos y también mayor porcentaje de pacientes trasplantados (66,7%), mientras que en los grupos de 19-22 años y mayores de 23 años había una mayoría (71,4%) de no trasplantados y una mayor proporción de pacientes no diabéticos (p < 0,05; prueba de χ²).
Fig. 5. Clasificación de las alteraciones hidrocarbonadas por grupos de edad ("Hasta 18 años" incluye a pacientes de 15-18). DM1: diabetes mellitus tipo 1; DMCHB: diabetes mellitus con hiperglucemia basal; DMSHB: diabetes mellitus sin hiperglucemia basal; IHC: intolerancia hidrocarbonada; TNG: tolerancia normal a la glucosa.
Fig. 6. Distribución de pacientes con y sin trasplante pulmonar (TP) por grupos de edad.
Analizando el tratamiento, el 50% de los pacientes no trasplantados (n = 11) se mantenía con dieta, el 13,6% (n = 3) con antidiabéticos orales y el 36,3% (n = 8) precisó insulina. Entre los trasplantados, el 14,3% (n = 2) seguía sólo dieta, el 7,1% (n = 1) recibía tratamiento con antidiabéticos orales y el 78,6% (n = 11) precisó insulina.
Analizando la influencia del tipo de inmunodepresión, de los 10 pacientes tratados con ciclosporina, 9 desarrollaron DMPT (90%), y de los 5 tratados con tacrolimus la desarrollaron 4 (80%). No se encontraron diferencias estadísticamente significativas.
Discusión
En la población de pacientes de este estudio, cuya edad media en el momento de realizarlo era de 25 años, se observa una prevalencia de DM del 45%, algo mayor que la descrita en la literatura médica, que es del 15-35% en esta década de la vida2,12-14. Ninguno de estos estudios de prevalencia relaciona las alteraciones hidrocarbonadas con el trasplante pulmonar, que podría ser uno de los factores determinantes en la mayor o menor frecuencia de diabetes e intolerancia hidrocarbonada descrita.
En nuestro trabajo la mayor prevalencia de alteraciones del metabolismo hidrocarbonado, y principalmente DM con hiperglucemia basal, se observa en el grupo de pacientes menores de 18 años (15-18 años), lo cual se opone a lo que cabría esperar: el aumento de prevalencia de alteraciones hidrocarbonadas con la edad2. Esto se debe probablemente a que en nuestro estudio son los menores de 18 años los que en mayor porcentaje recibieron trasplante pulmonar (el 66,7 frente al 28,6% en los otros dos grupos de edad establecidos); por tanto, es en este grupo de edad en el que las alteraciones hidrocarbonadas son más prevalentes (p < 0,05; prueba de χ²). El trasplante pulmonar parece tener una influencia importante en la aparición de DM en los enfermos con FQ. En un estudio recientemente publicado se compara la prevalencia de DM pre y postrasplante en una misma población de pacientes con FQ6. La prevalencia pretrasplante es del 28,6% y posteriormente a la intervención se incrementa al 49,4% (p = 0,008). En este estudio se observa, por tanto, una notable influencia del trasplante pulmonar en la aparición de DM en los pacientes con FQ. En otro trabajo reciente se describe una prevalencia de DMPT en pacientes con FQ del 56,3%15. En nuestra serie, la prevalencia de DMPT es mayor (89%). Estas diferencias pueden deberse a los criterios utilizados para definir DMPT. En nuestro estudio se utilizó como criterio la persistencia de hiperglucemia más allá de 30 días después del trasplante, con independencia de la necesidad de tratamiento farmacológico o no10,11. En otros trabajos se ha utilizado la persistencia de hiperglucemia más allá de 60 días después del trasplante6. Estas diferencias en las definiciones hacen que los estudios publicados sobre la prevalencia de DMPT sean difícilmente comparables y que existan amplias diferencias.
La etiopatogenia de la DMRFQ es multifactorial. La causa primaria es el déficit de insulina, por pérdida de las células betapancreáticas, debido a fibrosis e infiltración grasa de los islotes16. La resistencia a la insulina puede influir en determinadas situaciones, como el tratamiento con glucocorticoides o durante la pubertad, pero fuera de este contexto su papel es más discutido y existen estudios con resultados contradictorios17,18. En nuestros pacientes el HOMAIR fue normal, lo que apoya la ausencia de resistencia a la insulina. Estas consideraciones serían importantes en el tratamiento, ya que en este caso no sería adecuado administrar sensibilizadores a la insulina, sino que las pautas deberían centrarse en los secretagogos.
Se observa que la prevalencia de diabetes en pacientes trasplantados es del 89% (un 78% DMPT y un 11% DMRFQ previa), mientras que en pacientes no trasplantados predomina la intolerancia hidrocarbonada (29%) frente a la DM (24%), y un 47% de pacientes permanece normoglucémicos. Estas diferencias fueron estadísticamente significativas (p < 0,01; prueba de χ2). Por tanto, esto apoya de nuevo la hipótesis de que el trasplante es un factor que influye de manera importante en el desarrollo de DM en estos pacientes. De los 16 pacientes que recibieron trasplante y no eran diabéticos previamente, 14 desarrollaron DMPT y sólo 2 permanecen euglucémicos.
Numerosos estudios han analizado la relación entre el trasplante de órganos sólidos y la aparición de alteraciones hidrocarbonadas4,5,19-21. La DMPT se reconoce hoy día como una de las complicaciones más graves tras el trasplante, pues se asocia a una disminución de la supervivencia del injerto y del paciente, y aumenta el riesgo de complicaciones. Su incidencia se desconoce realmente, debido a la carencia de criterios unificados para su diagnóstico que se aprecia en los diversos estudios realizados, lo que hace que no sean comparables. Es necesario, por tanto, seguir unas guías de consenso de diagnóstico y tratamiento de esta entidad10,11. En una revisión reciente de 56 trabajos publicados entre 1992 y 2002 se comunica un 13,4% de incidencia de DMPT en receptores de órganos sólidos22. En esta revisión se observa la multitud de artículos publicados sobre trasplantes renales y hepáticos, mientras que son muchos menos los datos acerca del trasplante cardíaco y prácticamente nulos los artículos que relacionan la DM y el trasplante pulmonar. En nuestros resultados se observa una incidencia de DMPT en pacientes con FQ del 87,5%, mucho más elevada que la descrita en la literatura médica, lo cual probablemente se deba a que los pacientes con FQ presentan una prevalencia de diabetes en la historia natural de su enfermedad 100 veces mayor que la población general.
Son numerosos los estudios que han evaluado la influencia de la pauta inmunodepresora en la aparición de DMPT23-26. Es conocido desde hace años que los inhibidores de la calcineurina se asocian a mayores tasas de DMPT, y especialmente el tacrolimus, que ha demostrado en un metaanálisis reciente un mayor poder diabetógeno que la ciclosporina en trasplante renal, hepático, cardíaco y pulmonar22. Además, el uso simultáneo de corticoides para minimizar el riesgo de rechazo hace que se una el componente de resistencia insulínica que comporta el uso de éstos.
En nuestro estudio no se ha observado diferencia estadísticamente significativa entre el tacrolimus y la ciclosporina en cuanto a su influencia sobre la aparición de DMPT. Esto se debe probablemente al escaso número de pacientes en quienes pudo estudiarse esta variable (n = 15). También es posible que, al constituir los pacientes con FQ un grupo especial, por su mayor predisposición natural a presentar DM, la influencia del tipo de inmunodepresión sea menos determinante que en otros grupos de pacientes trasplantados.
En cuanto al tratamiento de la DMPT en general, las pautas son similares a las prescritas a los pacientes con DM tipo 210,11. Se comienza con modificaciones en el estilo de vida y se añaden antidiabéticos orales e insulina según el grado de control metabólico. Los pacientes trasplantados con FQ constituyen un grupo especial debido al defecto de secreción de insulina que presentan por su enfermedad pancreática; por consiguiente, las pautas de tratamiento de la DMPT en la FQ pueden diferir respecto a las de los receptores de otros órganos. En nuestro estudio se observa cómo, de los pacientes no trasplantados, más del 60% consigue un adecuado control sólo con dieta, con o sin antidiabéticos orales; sin embargo, entre los trasplantados, más del 75% precisa insulinización. Esto se debe posiblemente a que entre los no trasplantados predominan la intolerancia hidrocarbonada y la DM sin hiperglucemia basal (diagnosticada mediante sobrecarga oral de glucosa) frente a la DM con hiperglucemia basal (el 38 frente al 15%), mientras que en los trasplantados predomina la DM con hiperglucemia basal (89%). Estas diferencias en la gravedad de la alteración hidrocarbonada marcarían la diferencia en el tratamiento empleado. En los pacientes a los que se prescribieron antidiabéticos orales, los de elección fueron las glinidas, a dosis variables.
En la revisión realizada hemos encontrado 2 estudios que evalúan la incidencia de DMPT en pacientes con FQ sometidos a trasplante pulmonar6,15. Los pacientes afectados de esta enfermedad hereditaria presentan una elevada prevalencia de alteraciones del metabolismo hidrocarbonado per se, ya sea DM o intolerancia hidrocarbonada. Por tanto, es un grupo de pacientes en los que es lógico pensar que la DMPT será más frecuente que en los receptores de otros órganos sólidos, dado que se añade la toxicidad sobre la célula beta pancreática de los inmunodepresores, junto con la resistencia a la insulina producida por los corticoides, a un páncreas ya patológico.
En nuestro estudio se observa que el trasplante pulmonar es el factor de riesgo más importante para el desarrollo de DM en pacientes con FQ. No obstante, el número de pacientes estudiados es reducido y habría que confirmar dicho dato con una población mayor. Los resultados del presente trabajo deberían servir para resaltar la importancia de realizar un seguimiento estrecho de la glucemia en los pacientes con FQ tras someterse a un trasplante pulmonar, incluso cuando antes de éste la tolerancia a la glucosa sea normal. Este seguimiento debe ser a largo plazo, ya que el tiempo medio de aparición de la diabetes observado en este estudio fue de 1,8 años después del trasplante, e incluso hubo algunos casos en que apareció hasta 7 años más tarde. La detección y el tratamiento precoz de la alteración hidrocarbonada podrían conducir a una menor morbilidad y mortalidad de estos pacientes.
Correspondencia: Dr. J.F. Merino Torres.
Servicio de Endocrinología y Nutrición. Hospital Universitario La Fe.
Avda. Campanar, 21. 46009 Valencia. España.
Correo electrónico: merino_jfr@gva.es
Recibido: 20-12-2005; aceptado para su publicación: 16-5-2006.