Introducción
A lo largo de las últimas décadas se ha profundizado en el conocimiento de las alteraciones fisiopatológicas que se producen en la enfermedad pulmonar obstructiva crónica (EPOC)1. Además de la limitación al flujo aéreo, se ha destacado la trascendencia que para estos pacientes tiene el desequilibrio de la relación ventilación/perfusión2,3, la limitación de la tolerancia al ejercicio4,5, la afectación de los músculos respiratorios6,7 y las repercusiones sistémicas de la enfermedad8,9, sobre todo en relación con el desarrollo de desnutrición10 y de afectación de la musculatura periférica11-13. Sin lugar a dudas, todos estos aspectos han mejorado el conocimiento de la enfermedad y permiten una visión más integrada y multicomponente de los pacientes1,14-16.
Por dicho motivo, y aunque en la definición de la enfermedad se incluye la existencia de una alteración de la mecánica ventilatoria, resulta paradójico que esta esfera de la fisiopatología respiratoria perdiera protagonismo en la evaluación de la EPOC. Sin embargo, en la última década los trastornos de la mecánica ventilatoria han recobrado vigencia por el redescubrimiento de un viejo conocido: el atrapamiento aéreo.
Limitación al flujo aéreo, atrapamiento aéreo e hiperinsuflación
Los cambios patológicos que caracterizan a la EPOC son la obstrucción de las vías aéreas, con el consiguiente incremento de la resistencia al flujo aéreo, y la pérdida de la retracción elástica del pulmón con descenso de la presión de conducción para el flujo espiratorio. En la obstrucción de las vías aéreas participan alteraciones tanto extra como intraluminales17. Normalmente el parénquima pulmonar tracciona de las vías aéreas para mantenerlas abiertas. Sin embargo, en el enfisema se pierde su integridad estructural, debido a las alteraciones de la matriz de colágeno y elastina, y, por tanto, su efecto de tracción. El componente intraluminal de la obstrucción corresponde al engrosamiento de las paredes bronquiales, a la contracción del músculo liso bronquial y a la acumulación de restos celulares y mucoides.
La consecuencia funcional inmediata de estos cambios patológicos es la limitación al flujo aéreo. Puesto que el flujo a través de las pequeñas vías aéreas es inversamente proporcional a su resistencia y directamente proporcional al gradiente de presiones, tanto la pérdida de retracción elástica como el incremento de la resistencia de las vías aéreas contribuyen a disminuir el flujo espiratorio.
La mayor colapsabilidad de los alveolos y de los bronquiolos respiratorios y el incremento de las resistencias de las vías aéreas determinan que, durante un ciclo respiratorio normal, los alveolos tengan dificultades para vaciarse a lo largo de la fase espiratoria, con lo que resultan incapaces de retornar a la situación previa a la inspiración18. Este trastorno, conocido como atrapamiento aéreo, sucede en prácticamente todas las formas de EPOC, con independencia de su gravedad, así como en otras enfermedades como el asma19.
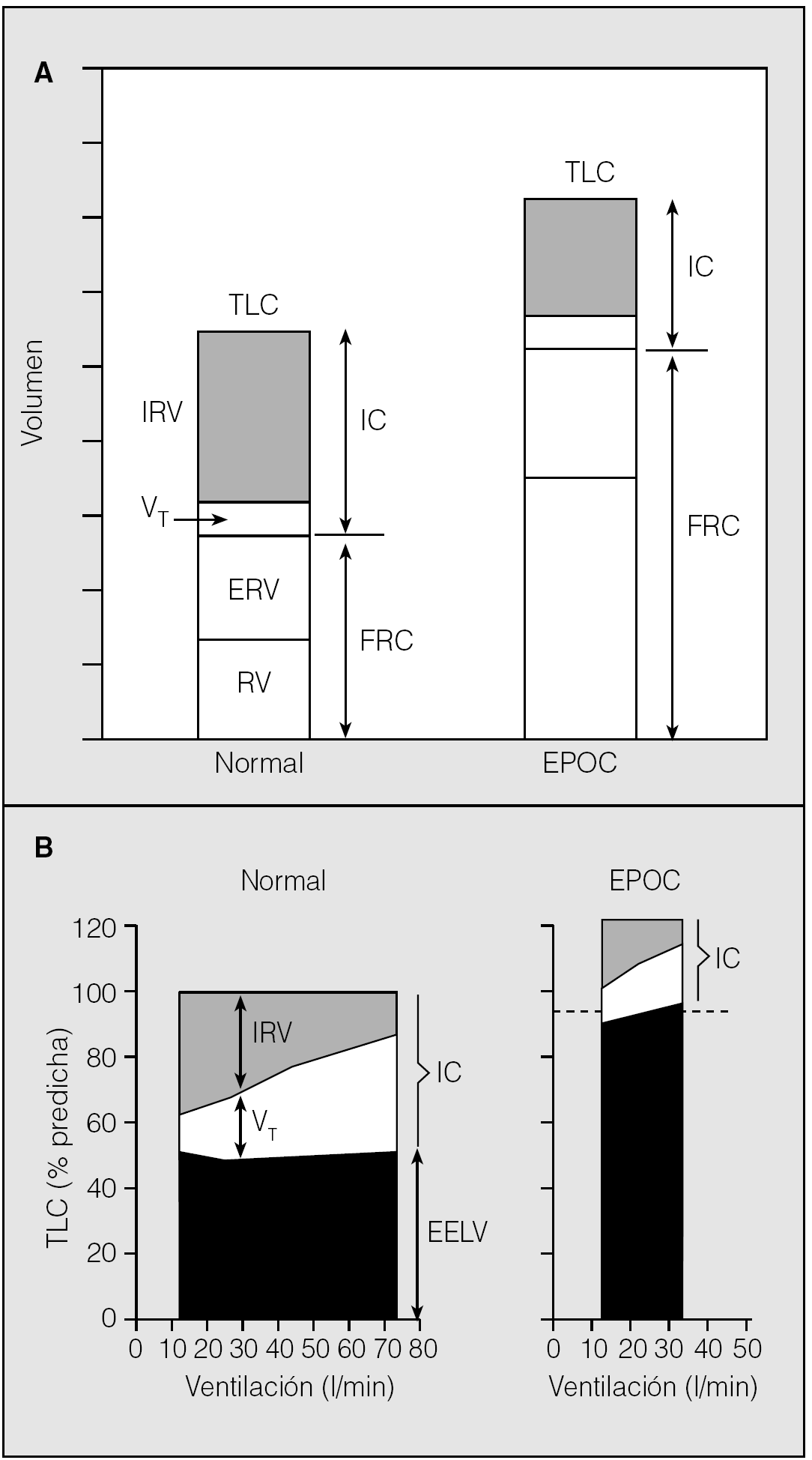
La consecuencia más inmediata del atrapamiento aéreo en la EPOC es el desarrollo de hiperinsuflación. Puesto que los alveolos tienen dificultad para lograr una deflación completa en la espiración, el volumen pulmonar al final de ésta, o capacidad residual funcional, aumentará de forma progresiva hasta originar una hiperinsuflación pulmonar (fig. 1A)20. De forma paralela, los restantes volúmenes pulmonares estáticos también experimentan algunos cambios. La pérdida de retracción elástica del pulmón origina un incremento de la distensibilidad del sistema respiratorio que lleva a un aumento de la capacidad pulmonar total (TLC). Sin embargo, la TLC de estos pacientes no se incrementa tanto como cabría esperar por la pérdida de retracción elástica, debido a la reducción de la capacidad de los músculos inspiratorios, en especial del diafragma, para generar presión a volúmenes pulmonares elevados.
Fig. 1. Volúmenes pulmonares en reposo (A) y durante el ejercicio (B) en una persona sana y en un paciente con EPOC e hiperinsuflación. TLC: capacidad pulmonar total; IRV: volumen de reserva inspiratoria; VT: volumen corriente; IC: capacidad inspiratoria; ERV: volumen de reserva espiratoria; RV: volumen residual; FRC: capacidad residual funcional; EELV: volumen pulmonar teleespiratorio.
El volumen residual también resulta alto en los pacientes con EPOC, por el propio atrapamiento aéreo y por la disnea relacionada con flujos muy bajos a volúmenes pulmonares muy reducidos, lo que impide al enfermo realizar una exhalación profunda hasta alcanzar su verdadero volumen residual. Generalmente, el incremento del volumen residual supera al de la TLC, por lo que el cociente volumen residual/TLC se eleva y, en consecuencia, disminuye la capacidad vital de forma paralela a la gravedad de la obstrucción al flujo aéreo.
La hiperinsuflación pulmonar detectada en condiciones pasivas se magnifica cuando aumentan las demandas ventilatorias de los pacientes, como sucede con la práctica de ejercicio físico. En dichas situaciones, la espiración deja de ser un proceso pasivo para requerir la contracción de los músculos espiratorios, lo que en sujetos sanos produce una disminución del volumen pulmonar teleespiratorio (EELV)21. Sin embargo, en esta misma circunstancia, muchos pacientes con limitación al flujo espiratorio desarrollan un acusado incremento del EELV y alcanzan un nuevo punto de equilibrio a un nivel superior a la capacidad residual funcional (fig. 1B). A este fenómeno se le denomina hiperinsuflación dinámica.
La hiperinsuflación dinámica, que sucede durante actividades habituales en la vida cotidiana de los pacientes tales como la deambulación22, coloca a los músculos inspiratorios en una situación de desventaja debido a sus efectos sobre la relación longitud-tensión. Además, supone una carga tipo umbral para la inspiración. Cuando el EELV permanece sobre la capacidad residual funcional al final de una espiración normal, se mantiene una presión de retracción elástica residual que origina una presión alveolar positiva. Antes de que en la siguiente inspiración pueda entrar aire en los pulmones, la presión alveolar ha de hacerse negativa con respecto a la atmosférica. Por tanto, una cierta fracción de la presión generada por los músculos inspiratorios se gastará simplemente en revertir la presión de retracción elástica residual del sistema respiratorio. Como la respiración tiene lugar a mayores volúmenes pulmonares, se produce en una porción menos distensible de la curva presión-volumen del sistema respiratorio y, en consecuencia, se incrementa el trabajo respiratorio. Por todo ello, la hiperinsuflación dinámica contribuye significativamente a la sensación de disnea de los pacientes con EPOC.
Consecuencias clínicas del atrapamiento aéreo y de la hiperinsuflación
El desarrollo de atrapamiento aéreo y de su consecuencia inmediata, la hiperinsuflación, tiene importantes repercusiones clínicas sobre el paciente con EPOC. Hasta el momento se ha establecido una relación de la hiperinsuflación con la tolerancia al ejercicio, la disnea y la hipoventilación alveolar. Además, muy recientemente se ha comprobado que la hiperinsuflación podría constituir un factor pronóstico en la enfermedad.
Limitación al ejercicio
Es un hecho sobradamente conocido que muchos pacientes con EPOC experimentan una reducción de su capacidad de ejercicio19,23,24. La limitación al esfuerzo de estos enfermos tiene un origen multifactorial. A ella contribuyen de forma primordial la limitación de la mecánica ventilatoria, por el deterioro funcional del sistema respiratorio y la disfunción de los músculos respiratorios, las anormalidades metabólicas y en el intercambio de gases y la disfunción de los músculos periféricos, además de alteraciones cardíacas, sedentarismo, falta de motivación o factores psicológicos19.
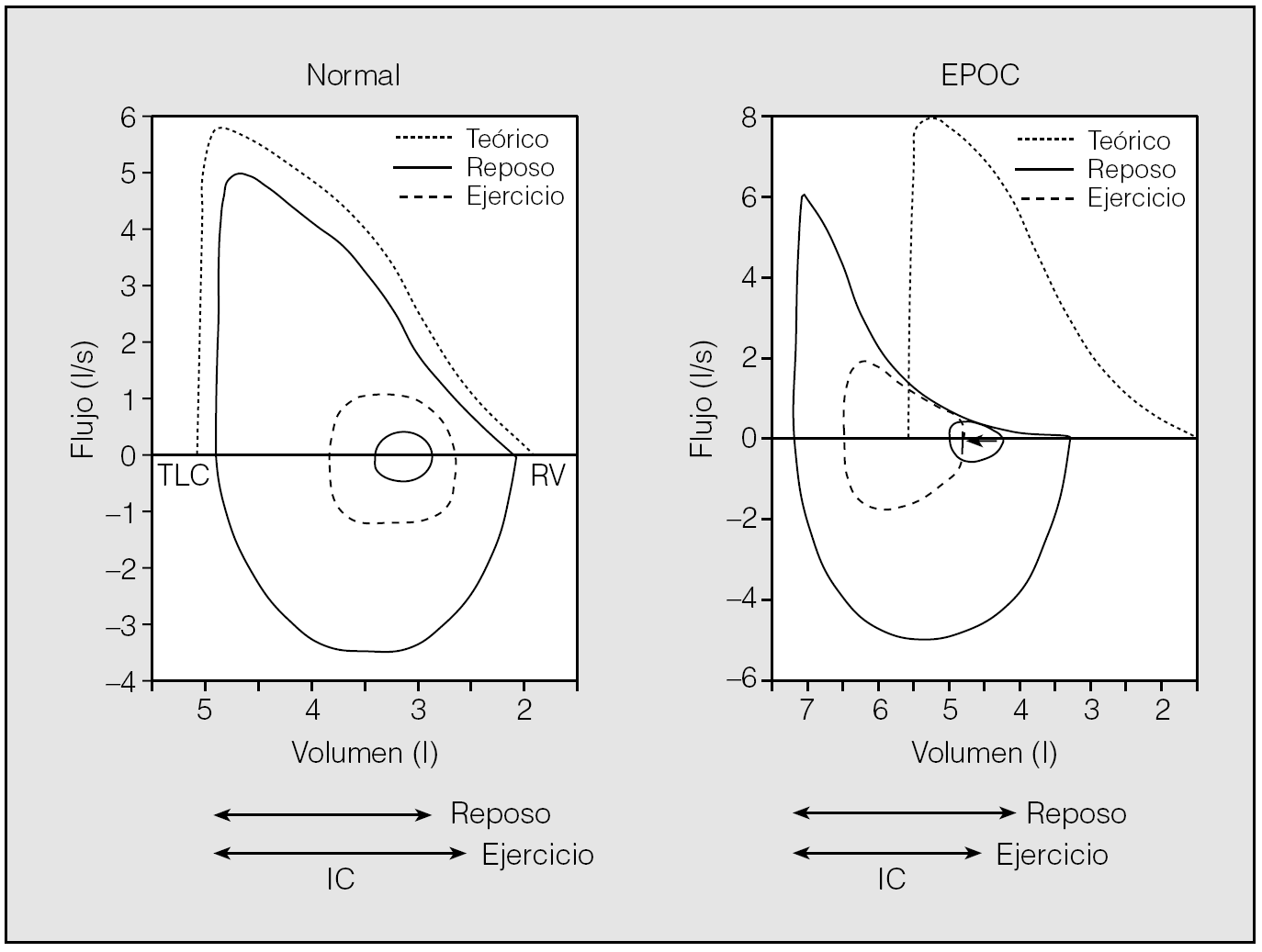
Desde hace años se reconocen las limitaciones que plantea el enfoque convencional de la valoración de la limitación ventilatoria durante el ejercicio. La predicción de la ventilación pico alcanzada durante el esfuerzo a partir de la ventilación voluntaria máxima en reposo es problemática, puesto que el patrón de reclutamiento de los músculos respiratorios, los cambios en las presiones intratorácicas y en los volúmenes y flujos respiratorios, así como la extensión de la hiperinsuflación dinámica, difieren ampliamente entre estas 2 situaciones25. De hecho, aunque una relación entre la ventilación pico y la máxima ventilación voluntaria (VE pico/MVV) mayor de 0,9 indica con intensidad una limitación ventilatoria, un cociente VE pico/MVV menor de 0,75 no la descarta totalmente19. Por el contrario, se ha comprobado que el análisis durante el ejercicio de la curva flujo-volumen respirando a volumen corriente (fig. 2) puede permitir identificar una importante limitación para la generación de volumen y flujo, en presencia de una reserva ventilatoria aparentemente adecuada, cuando se estima a partir de la relación VE pico/MVV23,24.
Fig. 2. Comparación de las curvas flujo-volumen máximas y a volumen corriente en una persona sana y en un paciente con EPOC, en reposo y durante el ejercicio. IC: capacidad inspiratoria; TLC: capacidad pulmonar total; RV: volumen residual. (Modificada de O'Donnell20.)
Mediante este procedimiento se ha comprobado que la principal alteración de la mecánica ventilatoria durante el ejercicio viene determinada por el desarrollo de una limitación para la insuflación pulmonar, que define un defecto ventilatorio restrictivo, atribuible a la hiperinsuflación dinámica19,20. Durante el ejercicio el incremento medio del EELV de los pacientes con EPOC oscila en diferentes series publicadas19 entre 0,3 y 0,6 l. Sin embargo, algunos enfermos no incrementan el EELV y otros experimentan aumentos muy acusados (> 1,00 l). Los principales determinantes de la hiperinsuflación dinámica son el grado de hiperinsuflación pulmonar basal, la extensión de la limitación al flujo espiratorio, la demanda ventilatoria y el patrón respiratorio a cualquier nivel de ventilación.
Se podría considerar que, en una situación inicial, la hiperinsuflación dinámica sería una respuesta adaptativa a la limitación al flujo aéreo, mediante la que se pretenden incrementar las velocidades de los flujos espiratorios, al situar al paciente en un punto más elevado de la curva presión-volumen del sistema respiratorio. Esto permitiría aumentar la presión de retracción elástica y, en consecuencia, el flujo espiratorio. Sin embargo, el desarrollo de hiperinsuflación plantea otros inconvenientes más importantes (tabla I).
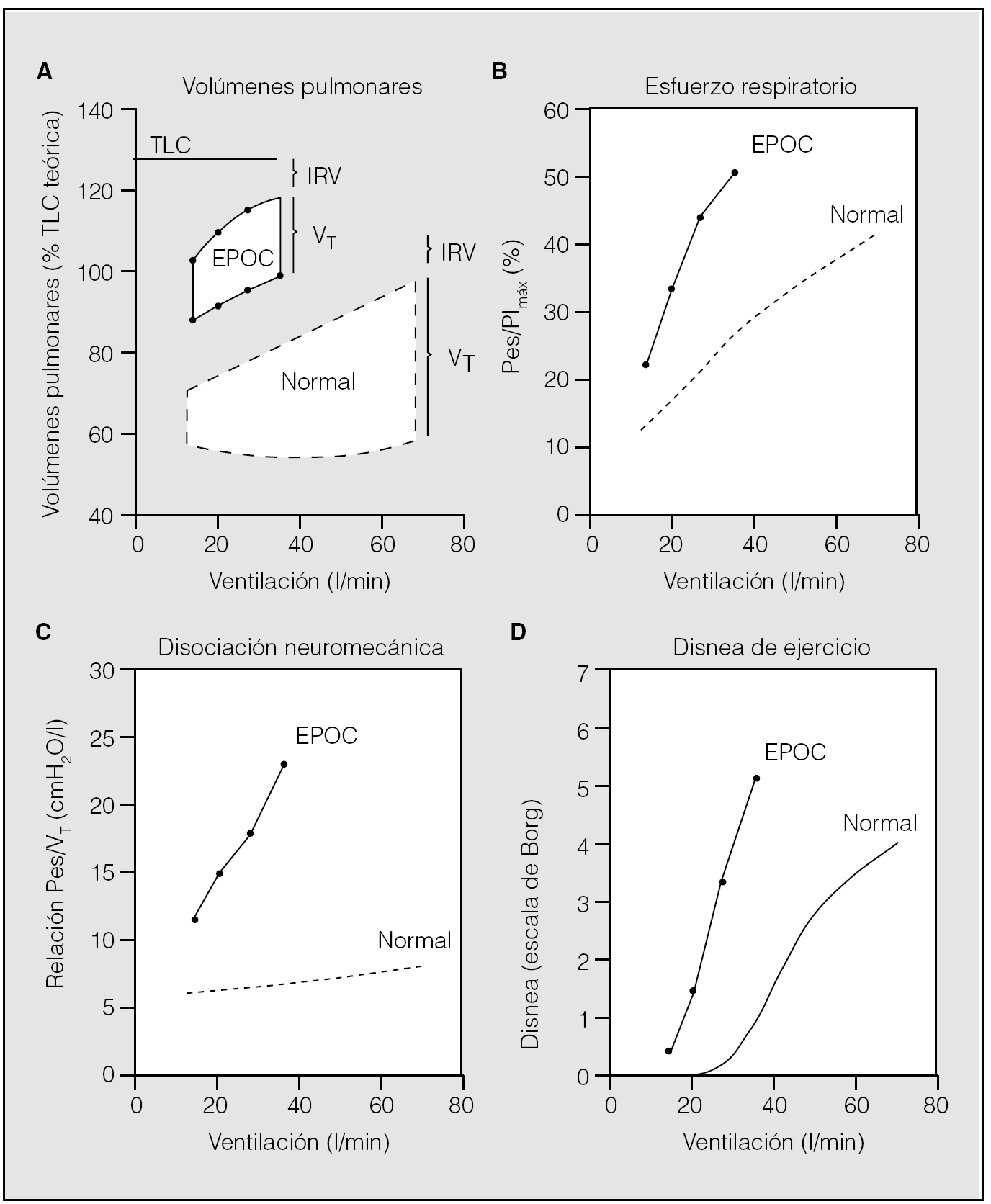
Debido al incremento de los volúmenes pulmonares al final de la espiración, el EELV se encuentra más próximo a la TLC, con lo que el volumen de reserva inspiratorio es menor y, por tanto, la posibilidad de expansión del volumen corriente también está disminuida (fig. 3). La única posibilidad para incrementar la ventilación minuto durante el ejercicio será elevar la frecuencia respiratoria, pero la taquipnea acorta el tiempo espiratorio y no hace sino potenciar el círculo vicioso de la hiperinsuflación dinámica. El desplazamiento en la curva presión-volumen del sistema respiratorio condiciona un aumento de la carga elástica de los músculos, que incrementa el trabajo mecánico y el coste de oxígeno de la respiración.
Fig. 3. Repercusión funcional de la hiperinsuflación. Los pacientes con EPOC respiran a volúmenes pulmonares más elevados (A), lo que origina un mayor esfuerzo inspiratorio (B) y una disociación neuromecánica más acusada (C), que determina una mayor percepción de disnea (D) hasta limitar su capacidad de ejercicio. TLC: capacidad pulmonar total; IRV: volumen de reserva inspiratoria; VT: volumen corriente; PImáx: presión inspiratoria máxima; Pes: presión esofágica. (Tomada de O'Donnell19.)
Como ya se ha mencionado, la hiperinsuflación dinámica supone una carga inspiratoria de tipo umbral. Dado que en estos pacientes la inspiración comienza cuando aún no se ha producido un vaciamiento pulmonar completo, los músculos inspiratorios deben superar primero la presión de retracción elástica del pulmón que todavía favorece la espiración23,26. Este comportamiento supone una autopresión positiva al final de inspiración o una presión positiva al final de inspiración intrínseca.
También se altera la relación longitud-tensión de los músculos respiratorios, particularmente del diafragma, lo que empeora su capacidad para generar presión27. Además, la taquipnea y el incremento de la velocidad de acortamiento muscular durante el ejercicio potencian la debilidad funcional de los músculos. El incremento del trabajo respiratorio que origina la hiperinsuflación dinámica y la debilidad muscular hacen que en estos enfermos las presiones inspiratorias a volumen corriente representen una fracción muy elevada de la máxima capacidad para generar fuerza muscular, lo que supone un riesgo mayor de fatiga.
En pacientes con EPOC, la hiperinsuflación dinámica progresiva conduce al desarrollo de una limitación ventilatoria crítica, que determina una finalización prematura del ejercicio. En este grupo de pacientes se ha comprobado que la capacidad de ejercicio se relaciona con la magnitud de la hiperinsuflación en reposo, reflejada por una disminución de la capacidad inspiratoria28,29.
Disnea
Se ha demostrado que hay una estrecha relación entre la intensidad de la disnea durante el ejercicio y las medidas de hiperinsuflación dinámica30. En pacientes con EPOC grave, los cambios en el EELV y en el volumen corriente resultan los principales determinantes del cambio de la puntuación de disnea en la escala de Borg durante el ejercicio y justifican, junto con la frecuencia respiratoria, el 61% de la variación en la disnea30. La mayor intensidad de la disnea se relaciona con una mayor relación entre la magnitud del esfuerzo inspiratorio y el volumen corriente alcanzado (relación esfuerzo/desplazamiento), lo que traduce un mayor grado de disociación neuromecánica (fig. 3)31. En definitiva, se considera que la hiperinsuflación dinámica y sus efectos negativos sobre la mecánica pulmonar contribuyen de forma importante a la disnea desarrollada durante el ejercicio en los pacientes con EPOC.
Hipoventilación alveolar
Las causas más importantes de hipercapnia por fallo de bomba en la EPOC son la reducción del impulso inspiratorio central, las alteraciones de las vías de transmisión nerviosa, de los músculos respiratorios o de la caja torácica y el desarrollo de fatiga muscular32.
Aunque la intensidad del impulso inspiratorio central sea normal y la pared torácica se mantenga intacta, los músculos respiratorios pueden ser incapaces de generar una presión pleural adecuada para mantener el patrón respiratorio requerido. Durante la respiración espontánea, los músculos inspiratorios deben desarrollar una fuerza suficiente que permita superar la limitación elástica y de resistencia para la expansión del sistema respiratorio. Además, deben ser capaces de mantener estos cambios en el tiempo, para ajustar su patrón de ventilación a un óptimo intercambio de gases. A la incapacidad de los músculos respiratorios para generar de forma continua una presión adecuada para mantener la ventilación alveolar se le denomina fatiga32,33. Es importante diferenciarla de debilidad, que se refiere a una disminución constante de la fuerza muscular generada, que no resulta reversible con el reposo34.
Como ya se ha mencionado, la hiperinsuflación plantea varios inconvenientes para la función muscular. Afecta a la relación longitud-tensión de los músculos respiratorios. Las fibras musculares se acortan, por lo que para un estímulo de la misma intensidad se generará menos presión. Ello supone que para mantener un grado determinado de ventilación alveolar será necesario desarrollar un mayor porcentaje de su presión máxima y, en definitiva, se originará un mayor consumo energético34.
La hiperinsuflación también induce una distorsión geométrica en las fibras de los músculos inspiratorios. Al aplanarse el diafragma, su radio se aproxima al infinito y disminuye su capacidad de convertir tensión en presión34. Además, se reduce la zona de aposición diafragmática, con lo que empeora la transmisión de la presión abdominal originada por la contracción diafragmática a la porción lateroinferior de la caja torácica. Por otra parte, la hiperinsuflación altera la orientación espacial de las fibras costales y crurales del diafragma, de modo que le obligan a trabajar en serie y perpendicularmente a la caja torácica35. Durante la inspiración, la contracción de estas fibras orientadas perpendicularmente origina un movimiento paradójico de la porción inferior del tórax. Al igual que el diafragma, la hiperinsuflación coloca a los músculos inspiratorios en una situación de desventaja mecánica35.
Además de todas estas alteraciones mecánicas, la hiperinsuflación también aumenta per se el trabajo respiratorio36. En consecuencia, se incrementan las demandas energéticas, mientras que el suplemento de energía está limitado por la contracción sostenida de los músculos respiratorios. La combinación de incremento del trabajo, disminución de la fuerza, reducción de la eficiencia y disminución del suministro energético durante la hiperinsuflación coloca a los músculos respiratorios en una situación de riesgo y los hace particularmente sensibles al desarrollo de fatiga37.
Se desarrolla fatiga muscular cuando el suministro de energía a los músculos respiratorios no es suficiente para compensar sus demandas. Los factores que predisponen al desarrollo de fatiga de los músculos respiratorios de los pacientes con EPOC son aquellos que incrementan las demandas energéticas musculares o disminuyen el aporte de energía32,33.
La demanda energética depende del trabajo de la respiración y de la fuerza y eficiencia de los músculos respiratorios. El trabajo respiratorio incrementa proporcionalmente con la presión media desarrollada por los músculos respiratorios, expresada como una fracción de la máxima presión inspiratoria, con la ventilación minuto, y con la duración de su contracción inspiratoria en relación con la duración total del ciclo respiratorio32.
En la EPOC, la presión inspiratoria media está elevada por el aumento de la carga de los músculos inpiratorios, tanto de tipo elástico (edema pulmonar) como de resistencia (obstrucción de las vías aéreas). Existe un valor crítico, inferior al 60% de la máxima fuerza inspiratoria, que puede ser generado indefinidamente a capacidad residual funcional38. Por el contrario, los enfermos con EPOC no son capaces de mantener por un tiempo prolongado una presión mayor del 60% de la máxima fuerza inspiratoria, por lo que se le considera el límite para el desarrollo de fatiga39.
Aunque fatiga y debilidad musculares son conceptos diferenciados, la debilidad muscular que experimentan algunos pacientes con EPOC también favorece el desarrollo de fatiga. En esta situación, para realizar un determinado trabajo, los músculos necesitarán mayor cantidad de energía. Como el umbral de trabajo muscular que induce fatiga es una proporción de su fuerza máxima, cualquier situación que debilite el músculo y reduzca su fuerza máxima predispone a la fatiga. Entre tales situaciones figuran la atrofia, las enfermedades neuromusculares y el trabajo en una circunstancia que lleve a una relación longitud-tensión ineficiente, como sucede durante la hiperinsuflación, en la que tanto el diafragma como los músculos intercostales trabajan a menor longitud.
La relación entre la intensidad del trabajo realizado y el consumo de energía (o eficiencia energética) es otro factor importante que contribuye a la demanda energética de los pacientes con EPOC. Se sabe que la eficiencia de los músculos inspiratorios disminuye en situación de hiperinsuflación. Se ha demostrado que, para la misma carga de trabajo, el consumo de oxígeno es mucho más elevado en pacientes con enfisema que en sujetos normales40. Es probable que esto sea debido a la contracción isométrica de sus músculos (consumen energía pero no realizan trabajo) o a que sus músculos inspiratorios están trabajando en una porción ineficiente de su relación longitud-tensión.
En definitiva, los pacientes con EPOC desarrollan fatiga cuando se produce un desequilibrio entre el aporte de energía a los músculos respiratorios y sus demandas. En dicho caso, se origina una pérdida de la fuerza muscular que impide a los músculos respiratorios desarrollar una presión inspiratoria adecuada durante la respiración a volumen corriente y, en consecuencia, disminuyen el volumen corriente y la ventilación minuto, con lo que se origina hipercapnia34.
Recientemente se ha demostrado que la hiperinsuflación dinámica también es uno de los mecanismos que contribuyen de forma más importante al desarrollo de hipercapnia durante el ejercicio en pacientes con EPOC41. En un número limitado de pacientes se ha establecido una relación entre la hiperinsuflación dinámica y la hipercapnia durante el ejercicio, por un empeoramiento de la relación ventilación-perfusión. El incremento de la presión arterial de anhídrido carbónico inducido por el ejercicio dependía de la desaturación arterial de oxígeno y de la relación EELV/TLC, que llegaba a justificar un 56% de la variación de la presión arterial de anhídrido carbónico durante el ejercicio41.
Pronóstico
Muy recientemente Casanova et al42 han analizado en una cohorte de 689 pacientes con EPOC, con un seguimiento medio de 34 meses, la relación entre la hiperinsuflación pulmonar y la mortalidad respiratoria o de cualquier origen. En su estudio han valorado la hiperinsuflación mediante la relación capacidad inspiratoria/TLC, también denominada fracción inspiratoria, que representa el porcentaje de volumen que el paciente puede inspirar y, por tanto, sería una imagen en espejo de la hiperinsuflación. Comprobaron que un índice capacidad inspiratoria/TLC del 25% o menor estaba asociado con un menor tiempo de supervivencia, tanto de cualquier causa como de origen respiratorio. Mediante el ajuste de modelos de regresión de Cox para el punto de corte de capacidad inspiratoria/TLC del 25% o menor, se obtuvo una hazard ratio para todas las causas de muerte de 1,970 (intervalo de confianza del 95%, 1,364-2,847) y de 2,042 (intervalo de confianza del 95%, 1,257-3,317) para insuficiencia respiratoria, una vez ajustado para todos los demás factores predictores42. En definitiva, se demuestra por primera vez que la hiperinsuflación, valorada mediante el cociente capacidad inspiratoria/TLC, es un factor pronóstico independiente de mortalidad, tanto respiratoria como de cualquier origen.
Cambios de actitud originados por el atrapamiento aéreo
Recuperación de la espirometría lenta
Como se comenta en otros artículos de este suplemento, el volumen espiratorio forzado en el primer segundo (FEV1) resulta un parámetro central en el diagnóstico y en la clasificación de la gravedad de la EPOC. Sin embargo, también debe reconocerse que guarda una pobre relación con la disnea y con la capacidad de ejercicio43,44. Además, el cambio obtenido en el FEV1 después del tratamiento broncodilatador tiene poco valor predictivo individual para la mejoría de la disnea o el incremento de la tolerancia al ejercicio en pacientes con EPOC grave45-47. Por otra parte, el FEV1 no proporciona información sobre la extensión de la limitación al flujo espiratorio o de la hiperinsuflación dinámica20.
La capacidad inspiratoria y otros parámetros inspiratorios proporcionan medidas indirectas de la hiperinsuflación pulmonar en reposo y de la extensión de la consiguiente restricción mecánica (fig. 2). De hecho, la capacidad inspiratoria en reposo, no la capacidad vital, representa los verdaderos límites operativos para el incremento del volumen corriente durante el ejercicio.
Por todas estas consideraciones, la espirometría lenta ha recobrado protagonismo en la evaluación de los pacientes con EPOC y parece razonable promover su uso en el futuro. Además de las implicaciones pronósticas y clínicas ya referidas, la capacidad inspiratoria parece ser un parámetro más útil que el FEV1 en la monitorización de cualquier intervención realizada sobre este grupo de pacientes.
Modificación de la diana terapéutica
El reconocimiento de la trascendencia de la hiperinsuflación pulmonar la ha convertido en el objetivo de algunas intervenciones terapéuticas empleadas en los pacientes con EPOC.
La atenuación de la hiperinsuflación mediante cirugía de reducción de volumen constituye una modalidad terapéutica aplicable a un reducido número de pacientes y con resultados discretos. De hecho, los beneficios demostrados tras un seguimiento de 2 años en el estudio NETT resultaron escasos, incluso en pacientes con muy poca actividad física habitual y predominio de la afectación en lóbulos superiores48.
Datos preliminares refieren que la administración de oxígeno a concentraciones elevadas durante el ejercicio a pacientes con EPOC sin insuficiencia respiratoria podría aumentar el tiempo de resistencia, la distancia caminada y la potencia máxima alcanzada. Más concretamente, se ha comprobado que la administración de una fracción inspiratoria de oxígeno del 60% aumenta un 35% el tiempo de resistencia en una prueba de carga constante en cicloergómetro y reduce los índices disnea-tiempo e impulso inspiratorio central-tiempo, así como la producción de lactato19.
Somfay et al49 demostraron en un reducido grupo de pacientes con EPOC grave e hipoxemia leve que el tiempo de resistencia en un ejercicio progresivo limitado por síntomas aumentó mientras respiraban un 30% de oxígeno en relación con aire, y todavía aumentó más respirando oxígeno al 50%. En comparación con el ejercicio realizado respirando aire ambiente, al respirar oxígeno se produjo una significativa reducción de los índices de disnea, del EELV, del volumen pulmonar teleinspiratorio, de la ventilación minuto y de la frecuencia respiratoria. En definitiva, parece que la hiperoxia durante el ejercicio induce una mejoría, dependiente del esfuerzo, de la resistencia y de la disnea, que parece parcialmente relacionada con un descenso de la hiperinsuflación dinámica y de la frecuencia respiratoria. Dicho efecto parece máximo con fracciones inspiratorias de oxígeno próximas al 50%.
Además de la depresión ventilatoria originada por este tipo de estimulación hiperóxica, con la consiguiente reducción de la hiperinsuflación dinámica y aumento del tiempo espiratorio, la administración de altos flujos de oxígeno durante el ejercicio también favorecería una menor producción de lactato y un aumento del aporte de oxígeno a los músculos esqueléticos, con lo que mejoraría su capacidad metabólica50.
El entrenamiento respiratorio, que ha demostrado disminuir la ventilación submáxima en pacientes con EPOC grave, por una mejoría en la eficiencia ventilatoria o por una disminución de la acidosis metabólica, podría mejorar la limitación ventilatoria de un modo similar a la hiperoxia. De hecho, en 2 metaanálisis ya clásicos se comprobó que la rehabilitación respiratoria incrementa la tolerancia al ejercicio, tanto al aumentar la distancia recorrida en la prueba de la marcha de 6 min51,52 como al incrementar la potencia máxima alcanzada en pruebas de ejercicio cardiorrespiratorio progresivo51.
No obstante, y sin lugar a dudas, el aspecto posiblemente más atractivo para la mayoría de los pacientes viene dado por la posibilidad de incidir sobre la hiperinsuflación mediante el tratamiento broncodilatador convencional. Se sabe que al ser tratados con broncodilatadores muchos pacientes con EPOC experimentan una mejoría sintomática y un incremento de su calidad de vida, que no se acompañan de un incremento paralelo del FEV1. Es posible que el principal efecto de estos fármacos se produzca a través de la disminución de la hiperinsuflación pulmonar y, por tanto, resulte más aconsejable monitorizar la capacidad inspiratoria que el FEV1.
Belman et al53 demostraron en 13 pacientes con EPOC que la mejoría en la disnea de ejercicio obtenida después de la administración de un broncodilatador de acción rápida se relacionaba con la reducción de los volúmenes pulmonares operativos durante el ejercicio. Comprobaron que el fármaco originaba un descenso de la relación EELV/TLC en ejercicio pico, así como una disminución significativa en la puntuación de disnea durante el esfuerzo en una escala de Borg. En definitiva, demostraron que con los broncodilatadores se lograba mejorar el acoplamiento neuroventilatorio y, por tanto, disminuir la disnea.
Poco después, O'Donnell et al54 demostraron en 29 pacientes con EPOC grave que la mejoría en la disnea de ejercicio lograda tras la administración de dosis elevadas de anticolinérgicos guardaba una estrecha relación con el incremento de la capacidad inspiratoria. A su vez, la disminución de la disnea y de los volúmenes pulmonares operativos justificaba el incremento del tiempo de resistencia al ejercicio. Como se comentará más adelante, con broncodilatadores de acción prolongada se ha demostrado un efecto similar55-57, que resulta especialmente manifiesto con tiotropio55,57.
Conclusión
El atrapamiento aéreo y la hiperinsuflación son manifestaciones de la limitación al flujo aéreo presentes en muchos pacientes con EPOC. Parecen los responsables de buena parte de la limitación al ejercicio y de la disnea que experimentan estos pacientes y son un factor pronóstico independiente. Todo ello ha contribuido a reconsiderar la importancia de este trastorno fisiopatológico conocido desde hace décadas y a potenciar intervenciones terapéuticas que tengan como objetivo disminuir la hiperinsuflación pulmonar.
Correspondencia: Dr. F. García Río.
Alfredo Marqueríe, 11, izqda., 1.o A. 28034 Madrid. España.
Correo electrónico: fgr01m@jazzfree.com