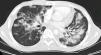
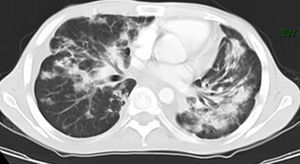
Se trata de un varón de 23 años con infección por virus de inmunodeficiencia humana (VIH) y antecedente de sarcoma de Kaposi en paladar, tratado con radioterapia y antirretrovirales hace 2 años. Consulta por la aparición de lesiones violáceas en piel de cara, disnea y dolor pleurítico con recuento de linfocitos T CD4 de 149 células/mm3 y carga viral 52.092 copias/ml. La tomografía de tórax de alta resolución (fig. 1) reveló nódulos bilaterales con bordes irregulares y áreas de vidrio esmerilado, engrosamiento peribroncovascular y derrame pleural izquierdo. La broncoscopia mostró una lesión elevada de la mucosa en segmento apical de lóbulo superior derecho y el lavado broncoalveolar (LBA), abundantes hemosiderófagos que confirman la presencia de hemorragia alveolar. La inmunohistoquímica fue positiva para herpes virus tipo 8 (VHH-8). Se inició tratamiento con doxorrubicina liposomal, y cambio de terapia antirretroviral con sobrevida de 8 meses hasta la fecha.
El sarcoma de Kaposi con compromiso pulmonar ocurre en el 6-32% de los pacientes con síndrome de inmunodeficiencia adquirida (sida), que cursan con lesiones cutáneas1,2, y en el 47-75% de los pacientes postmortem3. Las lesiones comprometen el parénquima pulmonar, el árbol bronquial, la pleura, la pared torácica y los ganglios linfáticos mediastinales1,3, y se asocian a un conteo de linfocitos T CD4<100 células/mm3. Las coinfecciones son causa de muerte en el 80% de los casos e incluyen citomegalovirus, complejo Mycobacterium avium, Pneumocistis jirovecii, neumonía bacteriana e infección por herpes simplex1.
La tomografía de tórax revela nódulos mal definidos bilaterales y simétricos en una distribución peribroncovascular (lesiones en llama). Otros hallazgos incluyen engrosamiento septal peribroncovascular e interlobular, consolidación progresiva del espacio aéreo y opacidades en vidrio esmerilado3.
Las lesiones en paladar son un fuerte predictor de compromiso broncopulmonar1. En la broncoscopia las lesiones típicas son placas de color rojo o violáceo «en cereza» en el árbol bronquial1, que se asocian a la detección del VHH-8 en LBA, el cual es altamente específico (95-98,9%) con sensibilidad variable del 58-100%.
La hemorragia alveolar oculta se describió en pacientes positivos para VIH con síntomas respiratorios y hallazgos radiológicos anormales en ausencia de hemoptisis. En el 35,6% de los casos se encontró sarcoma de Kaposi broncopulmonar y de estos, el 60,5% presentaron hemorragia alveolar oculta4.
Posteriormente, Vincent et al.5, encontraron como factores de riesgo, la presencia de sarcoma de Kaposi (OR: 5,3; IC 95%: 1,8-16,7; p=0,003), neumonía por citomegalovirus (OR: 9,8; IC 95%: 1-100; p=0,05), edema pulmonar hidrostático (OR: 16,4; IC 95%: 1,8-142; p=0,01) y recuento plaquetario <60.000 (OR: 5,6; IC 95%: 1,5-20; p=0,009).
En conclusión, la broncoscopia es una herramienta útil para el diagnóstico de hemorragia alveolar oculta en pacientes con infección por VIH y síntomas respiratorios.
FinanciaciónNingún tipo de fuente de financiación.
A los doctores Edgar Sánchez y Alfredo Saavedra, Médicos Internistas, Neumólogos, Unidad de Neumología, Instituto Nacional de Cancerología, Universidad Nacional de Colombia.
A la doctora Sonia Cuervo, Infectóloga, Instituto Nacional de Cancerología, Bogotá, Colombia.