La guía de práctica clínica de enfermedad pulmonar obstructiva crónica (EPOC) ALAT 2014 fue elaborada contestando preguntas clínicas en formato PICO a través del análisis de evidencias sobre factores de riesgo, búsqueda de casos, evaluación pronóstica, tratamiento y exacerbaciones. La evidencia indica que existen factores de riesgo diferentes al tabaco, diferencias según el género, soporta la búsqueda activa de casos en población de riesgo y el valor predictivo de los índices multidimensionales. En la EPOC estable se encuentran similares beneficios de la monoterapia broncodilatadora (LAMA o LABA) sobre la disnea, función pulmonar o calidad de vida, y mayor efectividad del LAMA para prevenir exacerbaciones. La doble terapia broncodilatadora tiene mayores beneficios comparada con la monoterapia. La eficacia de la terapia con LAMA y la combinación LABA/CI es similar, con mayor riesgo de neumonía con la combinación LABA/CI. Existe limitada información sobre la eficacia y la seguridad de la triple terapia. La evidencia soporta el uso de vacunación contra la influenza en todos los pacientes y contra neumococo en <65años y/o con obstrucción grave. Los antibióticos profilácticos pueden disminuir la frecuencia de exacerbaciones en pacientes de riesgo. Está justificado el uso de corticosteroides sistémicos y antibióticos en exacerbaciones que requieren tratamiento intrahospitalario y en algunas de tratamiento ambulatorio.
ALAT-2014 COPD Clinical Practice Guidelines used clinical questions in PICO format to compile evidence related to risk factors, COPD screening, disease prognosis, treatment and exacerbations. Evidence reveals the existence of risk factors for COPD other than tobacco, as well as gender differences in disease presentation. It shows the benefit of screening in an at-risk population, and the predictive value use of multidimensional prognostic indexes. In stable COPD, similar benefits in dyspnea, pulmonary function and quality of life are achieved with LAMA or LABA long-acting bronchodilators, whereas LAMA is more effective in preventing exacerbations. Dual bronchodilator therapy has more benefits than monotherapy. LAMA and combination LABA/IC are similarly effective, but there is an increased risk of pneumonia with LABA/IC. Data on the efficacy and safety of triple therapy are scarce. Evidence supports influenza vaccination in all patients and anti-pneumococcal vaccination in patients <65years of age and/or with severe airflow limitation. Antibiotic prophylaxis may decrease exacerbation frequency in patients at risk. The use of systemic corticosteroids and antibiotics are justified in exacerbations requiring hospitalization and in some patients managed in an outpatient setting.
El documento ALAT-2014 sobre enfermedad pulmonar obstructiva crónica (EPOC) representa un esfuerzo asociativo que contiene información regional e incorpora herramientas de elaboración de Guías de Práctica Clínica (GPC) para mejorar la efectividad, la eficiencia y la seguridad de las decisiones que se tomen en la práctica diaria en estos pacientes.
Este documento presenta la metodología de la GPC y el desarrollo de las preguntas PICO formuladas por capítulo. La versión completa de la GPC está disponible online.
MetodologíaGrupo elaborador y formulación de preguntas clínicasEl grupo de trabajo se integró con aquellos asociados que participaron en el consenso de expertos 2011 y se invitó a nuevos integrantes con experiencia en elaboración y/o evaluación de GPC. Se formaron 5 subgrupos de trabajo:
- •
Metodología.
- •
Epidemiología y definición.
- •
Diagnóstico.
- •
Tratamiento de la EPOC estable.
- •
Exacerbación.
Estos subgrupos definieron las preguntas clínicas a contestar en la guía.
Para las preguntas se siguió el formato PICO o su variante PECO: Paciente (Problema o Población), Intervención o Exposición, Comparación y Outcome (desenlace)1.
La estrategia de búsqueda bibliográfica se realizó en 2 metabuscadores: Tripdatabase y PubMed. El primero se utilizó para jerarquizar la información introductoria de cada capítulo, y contestar las preguntas PICO; PubMed, con el uso de MeSh, se empleó para contrastar y complementar la búsqueda de las preguntas PICO. La tabla 1 muestra las palabras clave usadas para la búsqueda en Tripdatabase y los términos MeSh. Para cada pregunta, el número y los tipos de trabajos capturados fueron evaluados por al menos 3 expertos y se seleccionaron solo los estudios que obtuvieran una puntuación en CASPe ≥70%, que se resume en la tabla 2. Para la actualización del cuerpo de cada capítulo se dio prioridad a: guías publicadas previamente, evidencias secundarias, ensayos clínicos e investigaciones primarias extendidas capturadas en Tripdatabase con una estrategia de búsqueda basada en palabras clave.
Estrategia de búsqueda (palabras claves del Tripdatabase y términos MeSh)
| Pregunta clínica | Pregunta PICO | Estrategia de búsqueda con términos Mesh |
|---|---|---|
| ¿Existen otros factores de riesgo inhalados diferentes al humo de tabaco relacionados con el desarrollo de EPOC? | a) P=COPD or Chronic Obstructive Pulmonary DiseaseI=outdoor air pollution OR occupational exposureC=ØO=Risk factorb) P= COPD or Chronic Obstructive Pulmonary DiseaseI=secondhand smokeC= ØO=Risk factorc) P=COPD or Chronic Obstructive Pulmonary DiseaseI=biomassC=ØO=Risk factor | a) Términos para COPD AND OCCUPATIONAL EXPOSURE AND AIR POLLUTION(«pulmonary disease, chronic obstructive»[MeSH Terms] OR COPD OR Chronic Obstructive Pulmonary Disease OR COAD OR Chronic Obstructive Airway Disease OR Chronic Obstructive Lung Disease OR Airflow Obstruction, Chronic OR Airflow Obstructions, Chronic OR Chronic Airflow Obstructions OR Chronic Airflow Obstruction AND «Occupational Exposure»[Mesh] AND «Air Pollutants, Occupational»[Mesh] AND («risk factors»[MeSH Terms] OR risk factors[Text Word] OR factors, risk OR factors, risk OR risk factor))b)Términos para COPD AND SECOND HAND SMOKING(«pulmonary disease, chronic obstructive»[MeSH Terms] OR COPD OR Chronic Obstructive Pulmonary Disease OR COAD OR Chronic Obstructive Airway Disease OR Chronic Obstructive Lung Disease OR Airflow Obstruction, Chronic OR Airflow Obstructions, Chronic OR Chronic Airflow Obstructions OR Chronic Airflow Obstruction) AND (Passive OR Passive Smoking OR Smoking, Passive OR Secondhand Smoking OR Secondhand Smoking OR Smoking, Secondhand OR Smoking, Secondhand OR Second Hand Smoke OR Hand Smoke, Second OR Hand Smoke, Second OR Second Hand Smoke OR Smoke, Second Hand OR Smokes, Second Hand OR Secondhand Smoke OR Secondhand Smoke OR Smoke, Secondhand OR Smokes, Secondhand OR Involuntary Smoking OR Involuntary Smoking OR Smoking, Involuntary OR Smoking, Involuntary OR Passive Smoking) AND («risk factors»[MeSH Terms] OR risk factors[Text Word] OR factors, risk OR factors, risk OR risk factor)c)Términos para COPD AND BIOMASS EXPOSURE(«pulmonary disease, chronic obstructive»[MeSH Terms] OR COPD OR Chronic Obstructive Pulmonary Disease OR COAD OR Chronic Obstructive Airway Disease OR Chronic Obstructive Lung Disease OR Airflow Obstruction, Chronic OR Airflow Obstructions, Chronic OR Chronic Airflow Obstructions OR Chronic Airflow Obstruction)) AND «Biomass»[Mesh]) AND («risk factors»[MeSH Terms] OR risk factors[Text Word] OR factors, risk OR factors, risk OR risk factor) |
| La EPOC en mujeres ¿tiene características epidemiológicas y clínicas diferentes? | P=COPD or Chronic Obstructive Pulmonary DiseaseI=GenderC=ØO=Ø | («pulmonary disease, chronic obstructive»[MeSH Terms] OR COPD OR Chronic Obstructive Pulmonary Disease OR COAD OR Chronic Obstructive Airway Disease OR Chronic Obstructive Lung Disease OR Airflow Obstruction, Chronic OR Airflow Obstructions, Chronic OR Chronic Airflow Obstructions OR Chronic Airflow Obstruction AND «Gender Identity»[Mesh] AND («gender identity»[MeSH Terms] OR («gender»[All Fields] AND «identity»[All Fields]) OR «gender identity»[All Fields] OR («gender»[All Fields] AND «identities»[All Fields]) OR «gender identities»[All Fields]) |
| ¿Es la búsqueda activa de casos por medio de espirometría en población expuesta a factores de riesgo el mejor método para detectar pacientes con EPOC? | P=COPD or Chronic Obstructive Pulmonary DiseaseI=spirometryC=ØO=diagnosis | («pulmonary disease, chronic obstructive»[MeSH Terms] OR COPD OR Chronic Obstructive Pulmonary Disease OR COAD OR Chronic Obstructive Airway Disease OR Chronic Obstructive Lung Disease OR Airflow Obstruction, Chronic OR Airflow Obstructions, Chronic OR Chronic Airflow Obstructions OR Chronic Airflow Obstruction) AND («Mass screening»[MeSH Terms] AND «spirometry»[Mesh terms]) AND Diagnosis»[Mesh terms]) |
| ¿Qué índices multidimensionales han sido validados para predecir mortalidad en EPOC? | P=COPD or Chronic Obstructive Pulmonary DiseaseI=multidimentional index or Severity of IllnessIndexC=ØO=Mortality | («pulmonary disease, chronic obstructive»[MeSH Terms] OR COPD OR Chronic Obstructive Pulmonary Disease OR COAD OR Chronic Obstructive Airway Disease OR Chronic Obstructive Lung Disease OR Airflow Obstruction, Chronic OR Airflow Obstructions, Chronic OR Chronic Airflow Obstructions OR Chronic Airflow Obstruction) AND («Severity of Illness Index»[Mesh] and «mortality»[Mesh]) |
| Los antimuscarínicos de acción prolongada (LAMA) ¿proporcionan mayores beneficios que los β2-agonistas de acción prolongada (LABA) en pacientes con EPOC? | P=COPD or Chronic Obstructive Pulmonary DiseaseI=TiotropiumC=Long-acting beta2-agonistO=Ø | («pulmonary disease, chronic obstructive»[MeSH Terms] OR COPD OR Chronic Obstructive Pulmonary Disease OR COAD OR Chronic Obstructive Airway Disease OR Chronic Obstructive Lung Disease OR Airflow Obstruction, Chronic OR Airflow Obstructions, Chronic OR Chronic Airflow Obstructions OR Chronic Airflow Obstruction) AND ((«Adrenergic beta-2 Receptor Agonists»[Mesh]) OR («indacaterol»[Supplementary Concept] OR 5- AND (2- AND (5,6-diethylindan-2-ylamino) AND -1-hydroxyethyl) AND -8-hydroxy-1H-quinolin-2-one OR QAB-149 OR arcapta neohaler OR Onbrez)) AND ((«Cholinergic Antagonists»[Mesh]) OR («tiotropium»[Supplementary Concept] OR Spiriva OR tiotropium bromide OR 7- AND ((hydroxybis AND (2-thienyl) AND acetyl) AND oxy) AND -9,9-dimethyl-3-oxa-9-azoniatricyclo AND (3.3.1.0 AND (2,4)) AND nonane bromide OR BA 679 BR OR BA-679 BR)) |
| La asociación LABA+LAMA ¿proporciona mayores beneficios que la monoterapia con LAMA o LABA en pacientes con EPOC? | P=COPD or Chronic Obstructive Pulmonary DiseaseI=long-acting beta2-agonist and tiotropiumC=tiotropium OR long-acting beta2-agonistO=Ø | («pulmonary disease, chronic obstructive»[MeSH Terms] OR COPD OR Chronic Obstructive Pulmonary Disease OR COAD OR Chronic Obstructive Airway Disease OR Chronic Obstructive Lung Disease OR Airflow Obstruction, Chronic OR Airflow Obstructions, Chronic OR Chronic Airflow Obstructions OR Chronic Airflow Obstruction) AND ((«tiotropium»[Supplementary Concept] OR Spiriva OR tiotropium bromide OR 7- AND ((hydroxybis AND (2-thienyl) AND acetyl) AND oxy) AND -9,9-dimethyl-3-oxa-9-azoniatricyclo AND (3.3.1.0 AND (2,4)) AND nonane bromide OR BA 679 BR OR BA-679 BR) AND ((«Adrenergic beta-2 Receptor Agonists»[Mesh]) OR («indacaterol»[Supplementary Concept] OR 5- AND (2- AND (5,6-diethylindan-2-ylamino) AND -1-hydroxyethyl) AND -8-hydroxy-1H-quinolin-2-one OR QAB-149 OR arcapta neohaler OR Onbrez))) |
| La terapia combinada LABA/corticoides inhalados (LABA/CI) ¿proporciona mayores beneficios que la monoterapia con LAMA en pacientes con EPOC | P=COPD or Chronic Obstructive Pulmonary DiseaseI=Combination inhaled steroid and long-acting beta2-agonistC=TiotropiumO=Ø | («pulmonary disease, chronic obstructive»[MeSH Terms] OR COPD OR Chronic Obstructive Pulmonary Disease OR COAD OR Chronic Obstructive Airway Disease OR Chronic Obstructive Lung Disease OR Airflow Obstruction, Chronic OR Airflow Obstructions, Chronic OR Chronic Airflow Obstructions OR Chronic Airflow Obstruction) AND (((«Adrenergic beta-2 Receptor Agonists»[Mesh]) OR («indacaterol»[Supplementary Concept] OR 5- AND (2- AND (5,6-diethylindan-2-ylamino) AND -1-hydroxyethyl) AND -8-hydroxy-1H-quinolin-2-one OR QAB-149 OR arcapta neohaler OR Onbrez)) AND («Glucocorticoids»[Mesh] OR glucocorticoid effect OR effects, glucocorticoid OR glucorticoid effects OR effects, glucorticoid)) AND ((«Cholinergic Antagonists»[Mesh]) OR («tiotropium»[Supplementary Concept] OR Spiriva OR tiotropium bromide OR 7- AND ((hydroxybis AND (2-thienyl) AND acetyl) AND oxy) AND -9,9-dimethyl-3-oxa-9-azoniatricyclo AND (3.3.1.0 AND (2,4)) AND nonane bromide OR BA 679 BR OR BA-679 BR)) |
| La combinación LABA/CI sumada a tiotropio (terapia triple) ¿proporciona mayores beneficios comparada con la monoterapia con tiotropio, la combinación LABA/CI o la doble terapia broncodilatadora (LABA+LAMA) en pacientes con EPOC? | P=COPD or Chronic Obstructive Pulmonary DiseaseI=inhaled steroid plus long-acting beta2-agonist plus tiotropiumC=tiotropium OR inhaled steroid and long-acting beta2-agonistO=Ø | («pulmonary disease, chronic obstructive»[MeSH Terms] OR COPD OR Chronic Obstructive Pulmonary Disease OR COAD OR Chronic Obstructive Airway Disease OR Chronic Obstructive Lung Disease OR Airflow Obstruction, Chronic OR Airflow Obstructions, Chronic OR Chronic Airflow Obstructions OR Chronic Airflow Obstruction) AND ((«tiotropium»[Supplementary Concept] OR Spiriva OR tiotropium bromide OR 7- AND ((hydroxybis AND (2-thienyl) AND acetyl) AND oxy) AND -9,9-dimethyl-3-oxa-9-azoniatricyclo AND (3.3.1.0 AND (2,4)) AND nonane bromide OR BA 679 BR OR BA-679 BR) AND ((«indacaterol»[Supplementary Concept] OR 5- AND (2- AND (5,6-diethylindan-2-ylamino) AND -1-hydroxyethyl) AND -8-hydroxy-1H-quinolin-2-one OR QAB-149 OR arcapta neohaler OR Onbrez) OR («Adrenergic beta-2 Receptor Agonists»[Mesh])) AND («Glucocorticoids»[Mesh] OR glucocorticoid effect OR effects, glucocorticoid OR glucorticoid effects OR effects, glucorticoid)) |
| ¿Se justifica la aplicación de inmunizaciones y lisados bacterianos en pacientes con EPOC? | P=COPD or Chronic Obstructive Pulmonary DiseaseI=vaccine or vaccinationC=ØO=exacerbation or hospitalization or mortality | (((«pulmonary disease, chronic obstructive»[MeSH Terms] OR COPD OR Chronic Obstructive Pulmonary Disease OR COAD OR Chronic Obstructive Airway Disease OR Chronic Obstructive Lung Disease OR Airflow Obstruction, Chronic OR Airflow Obstructions, Chronic OR Chronic Airflow Obstructions OR Chronic Airflow Obstruction)) AND («Vaccines»[Mesh])) AND ((«Mortality»[Mesh]) OR («Hospitalization»[Mesh]) OR («Disease Progression»[Mesh]) OR exacerbation*) |
| El uso profiláctico de antibióticos en pacientes con EPOC estable ¿previene las exacerbaciones? | P=COPD exacerbationsI=Prophylactic antibioticsC=ØO=Prevention and Control | ((((«pulmonary disease, chronic obstructive»[MeSH Terms] OR COPD OR Chronic Obstructive Pulmonary Disease OR COAD OR Chronic Obstructive Airway Disease OR Chronic Obstructive Lung Disease OR Airflow Obstruction, Chronic OR Airflow Obstructions, Chronic OR Chronic Airflow Obstructions OR Chronic Airflow Obstruction) AND (acute* OR Exacerbation*))) AND («prevention and control»[Subheading])) AND («Anti-Bacterial Agents»[Mesh]) |
| ¿Son los antibióticos efectivos en todas las exacerbaciones de la EPOC? | P=COPD exacerbationsI=AntibioticsC=ØO=hospitalization or mortality | (((«pulmonary disease, chronic obstructive»[MeSH Terms] OR COPD OR Chronic Obstructive Pulmonary Disease OR COAD OR Chronic Obstructive Airway Disease OR Chronic Obstructive Lung Disease OR Airflow Obstruction, Chronic OR Airflow Obstructions, Chronic OR Chronic Airflow Obstructions OR Chronic Airflow Obstruction) AND (acute* OR Exacerbation*))) AND («Anti-Bacterial Agents»[Mesh]) AND («Mortality»[Mesh] OR «Hospitalization»[Mesh]) |
| ¿Son los corticoesteroides sistémicos (vía oral o parenteral) efectivos en el tratamiento de las E-EPOC? | P=COPD exacerbationsI=Systemic corticosteroidsC=ØO=Ø | ((((«pulmonary disease, chronic obstructive»[MeSH Terms] OR COPD OR Chronic Obstructive Pulmonary Disease OR COAD OR Chronic Obstructive Airway Disease OR Chronic Obstructive Lung Disease OR Airflow Obstruction, Chronic OR Airflow Obstructions, Chronic OR Chronic Airflow Obstructions OR Chronic Airflow Obstruction) AND (acute* OR Exacerbation*))) AND («Glucocorticoids[Mesh] OR glucocorticoid effect OR effects, glucocorticoid OR glucorticoid effects OR effects, glucorticoid)) AND ((systemic[All Fields] OR systemic/10[All Fields] OR systemic/aerosol[All Fields] OR systemic/airway[All Fields] OR systemic/anaphylactic[All Fields] OR systemic/anaphylaxis[All Fields] OR systemic/arterial[All Fields] OR systemic/bladder[All Fields] OR systemic/central[All Fields] OR systemic/cerebral[All Fields] OR systemic/compartmental[All Fields] OR systemic/constitutional[All Fields] OR systemic/core[All Fields] OR systemic/cutaneous[All Fields] OR systemic/disseminated[All Fields] OR systemic/distal[All Fields] OR systemic/environmental[All Fields] OR systemic/extracutaneous[All Fields] OR systemic/familial[All Fields] OR systemic/family[All Fields] OR systemic/general[All Fields] OR systemic/generalised[All Fields] OR systemic/genetic[All Fields] OR systemic/glomerular[All Fields] OR systemic/hepatic[All Fields] OR systemic/historic[All Fields] OR systemic/i[All Fields] OR systemic/immunomodulating[All Fields] OR systemic/inhaled/nebulized[All Fields] OR systemic/intracerebellar[All Fields] OR systemic/intraperitoneal[All Fields] OR systemic/intrasac[All Fields] OR systemic/intrathecal[All Fields] OR systemic/intravenous[All Fields] OR systemic/intravitreal[All Fields] OR systemic/it[All Fields] OR systemic/liver[All Fields] OR systemic/local[All Fields] OR systemic/localized[All Fields] OR systemic/malignant[All Fields] OR systemic/management[All Fields] OR systemic/metabolic[All Fields] OR systemic/metabolic/toxic[All Fields] OR systemic/metastatic[All Fields] OR systemic/microvascular[All Fields] OR systemic/mucosal[All Fields] OR systemic/multiorgan[All Fields] OR systemic/muscular[All Fields] OR systemic/neurologic[All Fields] OR systemic/neurophysiological[All Fields] OR systemic/nonsystemic[All Fields] OR systemic/ocular[All Fields] OR systemic/oral[All Fields] OR systemic/organ[All Fields] OR systemic/organism[All Fields] OR systemic/organizational[All Fields] OR systemic/organs[All Fields] OR systemic/other[All Fields] OR systemic/periocular[All Fields] OR systemic/peripheral[All Fields] OR systemic/portal[All Fields] OR systemic/process[All Fields] OR systemic/productive[All Fields] OR systemic/pulmonary[All Fields] OR systemic/reflective[All Fields] OR systemic/regional[All Fields] OR systemic/remote[All Fields] OR systemic/renal[All Fields] OR systemic/respiratory[All Fields] OR systemic/rheumatic[All Fields] OR systemic/serum[All Fields] OR systemic/strategic[All Fields] OR systemic/structural[All Fields] OR systemic/suprasystemic[All Fields] OR systemic/systems[All Fields] OR systemic/targeted[All Fields] OR systemic/technical[All Fields] OR systemic/tissue[All Fields] OR systemic/topical[All Fields] OR systemic/urticarial[All Fields] OR systemic/vascular[All Fields] OR systemic/vital[All Fields] OR systemic’[All Fields] OR systemica[All Fields] OR systemical[All Fields] OR systemically[All Fields] OR systemically/orally[All Fields] OR systemically’[All Fields] OR systemicautoimmune[All Fields] OR systemicc[All Fields] OR systemicchemotherapy[All Fields] OR systemich[All Fields] OR systemiche[All Fields] OR systemichem[All Fields] OR systemicity[All Fields] OR systemickych[All Fields] OR systemiclupus[All Fields] OR systemicly[All Fields] OR systemicmastocytosis[All Fields] OR systemico[All Fields] OR systemicoportal[All Fields] OR systemicopulmonary[All Fields] OR systemicpulmonary[All Fields] OR systemicresistance[All Fields] OR systemics[All Fields] OR systemicto[All Fields] OR systemicus[All Fields] OR systemicuse[All Fields]) OR Endovenous[All Fields]) |
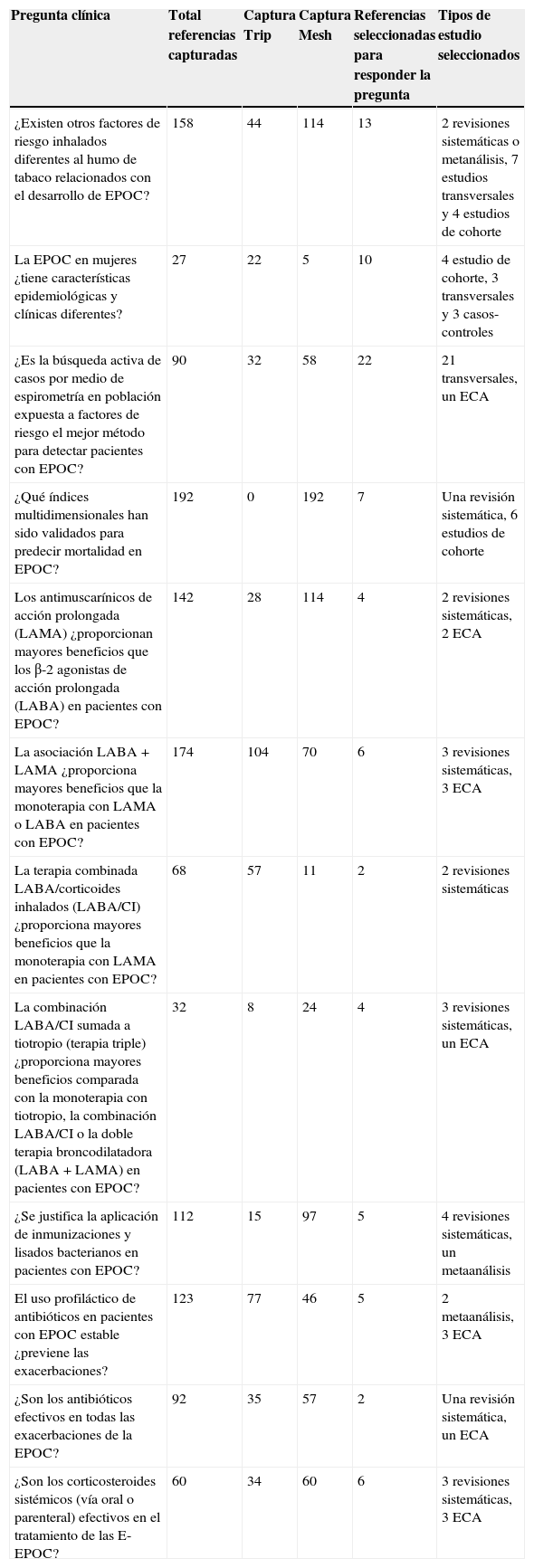
Número y tipo de trabajos seleccionados para responder las preguntas clínicas
| Pregunta clínica | Total referencias capturadas | Captura Trip | Captura Mesh | Referencias seleccionadas para responder la pregunta | Tipos de estudio seleccionados |
|---|---|---|---|---|---|
| ¿Existen otros factores de riesgo inhalados diferentes al humo de tabaco relacionados con el desarrollo de EPOC? | 158 | 44 | 114 | 13 | 2 revisiones sistemáticas o metanálisis, 7 estudios transversales y 4 estudios de cohorte |
| La EPOC en mujeres ¿tiene características epidemiológicas y clínicas diferentes? | 27 | 22 | 5 | 10 | 4 estudio de cohorte, 3 transversales y 3 casos-controles |
| ¿Es la búsqueda activa de casos por medio de espirometría en población expuesta a factores de riesgo el mejor método para detectar pacientes con EPOC? | 90 | 32 | 58 | 22 | 21 transversales, un ECA |
| ¿Qué índices multidimensionales han sido validados para predecir mortalidad en EPOC? | 192 | 0 | 192 | 7 | Una revisión sistemática, 6 estudios de cohorte |
| Los antimuscarínicos de acción prolongada (LAMA) ¿proporcionan mayores beneficios que los β-2 agonistas de acción prolongada (LABA) en pacientes con EPOC? | 142 | 28 | 114 | 4 | 2 revisiones sistemáticas, 2 ECA |
| La asociación LABA+LAMA ¿proporciona mayores beneficios que la monoterapia con LAMA o LABA en pacientes con EPOC? | 174 | 104 | 70 | 6 | 3 revisiones sistemáticas, 3 ECA |
| La terapia combinada LABA/corticoides inhalados (LABA/CI) ¿proporciona mayores beneficios que la monoterapia con LAMA en pacientes con EPOC? | 68 | 57 | 11 | 2 | 2 revisiones sistemáticas |
| La combinación LABA/CI sumada a tiotropio (terapia triple) ¿proporciona mayores beneficios comparada con la monoterapia con tiotropio, la combinación LABA/CI o la doble terapia broncodilatadora (LABA+LAMA) en pacientes con EPOC? | 32 | 8 | 24 | 4 | 3 revisiones sistemáticas, un ECA |
| ¿Se justifica la aplicación de inmunizaciones y lisados bacterianos en pacientes con EPOC? | 112 | 15 | 97 | 5 | 4 revisiones sistemáticas, un metaanálisis |
| El uso profiláctico de antibióticos en pacientes con EPOC estable ¿previene las exacerbaciones? | 123 | 77 | 46 | 5 | 2 metaanálisis, 3 ECA |
| ¿Son los antibióticos efectivos en todas las exacerbaciones de la EPOC? | 92 | 35 | 57 | 2 | Una revisión sistemática, un ECA |
| ¿Son los corticosteroides sistémicos (vía oral o parenteral) efectivos en el tratamiento de las E-EPOC? | 60 | 34 | 60 | 6 | 3 revisiones sistemáticas, 3 ECA |
ECA: ensayo controlado aleatorizado.
Para los resultados obtenidos de las preguntas PICO se priorizó la selección al nivel más alto de evidencia (ensayos controlados aleatorizados [ECA], metaanálisis y revisiones sistemáticas) que mejor respondiera a la pregunta clínica. Si esto no era posible, se seleccionaron estudios de nivel moderado (observacionales) o bajo (abiertos, serie de casos o consensos) en la jerarquización de evidencias. Se siguió la recomendación de selección algorítmica principalmente para las preguntas terapéuticas2. No se describen por separado los resultados de aquellos ECA incluidos en una revisión sistemática, a menos que en ellos se haya considerado un aspecto muy relevante que amerite comentario adicional (por ejemplo, desenlaces secundarios). Se consideraron publicaciones en español, portugués e inglés. La fecha de cierre de la última búsqueda fue octubre de 2013.
Análisis crítico y formulación de recomendacionesPara el análisis crítico de las referencias seleccionadas se usaron las recomendaciones y plantillas de la red CASPE (www.redcaspe.org). Se utilizó el «ACCP grading system», el cual clasifica las recomendaciones en fuerte o débil de acuerdo con el balance entre riesgo, beneficio, carga y, en ocasiones, costo. La calidad de la evidencia fue clasificada en alta, moderada o baja según el diseño del estudio, la consistencia de los resultados y la claridad de la evidencia para responder a la pregunta PICO. Ese sistema fue seleccionado por ser simple, transparente, explícito y consistente con la aproximación metodológica actual para el proceso de desarrollo de GPC basada en evidencia3.
Se propuso un grupo de revisores externos con experiencia en EPOC, que aparece en la sección de ***«autores y colaboradores». La versión final de la guía ha sido revisada y aprobada por el grupo de autores.
Preguntas PICOMediante la introducción de preguntas PICO, la GPC aborda evidencias y controversias en: factores de riesgo, búsqueda de casos, evaluación pronóstica, tratamiento de la EPOC estable, prevención y tratamiento de exacerbaciones.
Factores de riesgoPersiste el debate sobre la importancia de otros factores de riesgo diferentes al tabaco en la EPOC y la influencia del género.
1. Pregunta: ¿Existen otros factores de riesgo inhalados diferentes al humo de tabaco relacionados con el desarrollo de la EPOC?
JustificaciónAunque el consumo de tabaco es el principal factor de riesgo para la EPOC, existe una proporción importante de casos no atribuibles a esta exposición. Otros factores de riesgo (exposición al humo de biomasa, ocupacionales a polvos, gases y contaminación del aire exterior) han sido vinculados con su patogenia4.
Selección de búsquedaSe capturaron 158 referencias (MeSh: 114; Tripdatabase: 44), seleccionando 13 para responder la pregunta (2 revisiones sistemáticas, 7 estudios de corte transversal y 4 estudios de cohorte).
Resumen de la evidenciaCerca del 50% de los hogares a nivel mundial y el 90% de los rurales utilizan la biomasa como fuente de energía doméstica. Los resultados de un metaanálisis indican que los expuestos al humo de biomasa tienen 2,44 veces más posibilidad (IC95%: 1,9-3,33) de desarrollar EPOC5. Esta exposición fue identificada como factor de riesgo para hombres y mujeres5. Otro metaanálisis en mujeres del área rural indica asociación de esta exposición con EPOC (OR: 2,40; IC95%: 1,47-3,93)6. Estudios latinoamericanos confirman esta relación, e indican que los síntomas respiratorios se presentan a partir de una exposición de 100h/año y la limitación al flujo de aire a partir de 200h/año o >10años7.
Existe información limitada sobre contaminación del aire exterior y desarrollo de EPOC. Los resultados de un estudio transversal8 y el seguimiento de esta corte sugieren asociación de esta exposición con la pérdida de función pulmonar9 y reducción de los síntomas con la disminución de la exposición a partículas ambientales10. Otros estudios han reportado la asociación entre admisión hospitalaria y el aumento en los niveles de contaminación11-13.
Existe evidencia para inferir una relación causal entre exposición ocupacional y desarrollo de EPOC. Un estudio de incidencia acumulada de EPOC en 10años mostró una tendencia como factor de riesgo para la ocupación de obrero manual de la industria (OR: 1,78; IC95%: 0,80-3,97)14. Pacientes con EPOC moderada-grave no fumadores reportaron exposición a polvos orgánicos en el lugar de trabajo con mayor frecuencia que los sujetos sin obstrucción (30,4% vs. 23%)15. Según datos de NHANES-III, el 31% de los casos de EPOC en no fumadores sería atribuible a exposición laboral16.
Un estudio transversal indica que la exposición pasiva al humo del tabaco ≥20h semanales aumenta 1,18 veces el riesgo de EPOC (IC95%: 1,0-1,4)17.
Conclusiones y recomendacionesExisten otros factores de riesgo inhalados diferentes al tabaco para desarrollar EPOC.
Evidencia alta para sugerir la asociación con exposición ocupacional y al humo de biomasa. Recomendación fuerte para explorar clínica y epidemiológicamente otros factores de riesgo inhalados diferente al tabaco.
2. Pregunta: La EPOC en mujeres ¿tiene características epidemiológicas y clínicas diferentes?
JustificaciónExisten controversias sobre posibles diferencias en la expresión clínica de la EPOC en mujeres (impacto, características clínicas, progresión y mortalidad).
Selección de búsquedaSe capturaron 27 referencias (MeSh: 5; Tripdatabase: 22), seleccionando 10 para responder la pregunta (4 estudios de cohorte, 3 estudios de corte transversal y 3 estudios casos y controles).
Resumen de la evidenciaFrente a la misma exposición al humo del tabaco, las mujeres son más propensas a desarrollar EPOC a edad más temprana y con mayor deterioro de la función pulmonar18,19. El subdiagnóstico en mujeres es 1,27 veces más frecuente (86,0% vs. 67,6%; p<0,05)20.
Estudios en población general y seleccionada muestran que las mujeres con similar gravedad de obstrucción presentan: mayor disnea, ansiedad y depresión, menos enfisema en la radiología, peor calidad de vida y mejor sobrevida21-27.
Conclusiones y recomendacionesExisten diferencias en la epidemiología y en la expresión clínica de la EPOC en mujeres. Es importante considerar e identificar estas manifestaciones y desarrollar estrategias para su adecuado control, especialmente en los casos de ansiedad y depresión.
Evidencia alta que confirma las diferencias epidemiológicas y clínicas en la EPOC según el género. Recomendación fuerte para considerar al género como un factor importante en el riesgo de desarrollar EPOC y su impacto en la expresión clínica.
Búsqueda de casosPersiste la controversia sobre las posibles estrategias para enfrentar el subdiagnóstico en EPOC.
3. Pregunta: ¿Es la búsqueda activa de casos por medio de espirometría en población expuesta a factores de riesgo el mejor método para detectar pacientes con EPOC?
JustificaciónEl subdiagnóstico de la EPOC es un problema importante28-32. Los principales factores asociados con el subdiagnóstico son: menor edad, menor gravedad de obstrucción y pocos síntomas respiratorios29. Un tercio de los pacientes detectados en estudios poblacionales o por búsqueda activa en atención primaria son asintomáticos, y más del 50% tienen manifestaciones leves30,33-35. La ausencia y la pobre percepción de síntomas en esta fase preclínica contribuye al subdiagnóstico29,31,32.
Las alteraciones espirométricas son frecuentemente la única evidencia de la enfermedad en etapas tempranas31,36. Sigue siendo controversial la selección de la población y el mejor momento de realizar la espirometría para reducir el subdiagnóstico. La búsqueda activa de casos con espirometría en la población general (tamizaje o cribado masivo) no es costo-efectiva porque la detección de casos es baja si no se discrimina una población de alto riesgo y no hay certeza sobre los beneficios del tratamiento farmacológico en pacientes asintomáticos37-39.
También hay controversias sobre el costo-efectividad de la búsqueda activa de casos con espirometría en población de riesgo, ya que en esta también existe una proporción significativa de sujetos asintomáticos o con enfermedad leve que no se beneficiarían de intervenciones terapéuticas37. Sin embargo, otros autores argumentan que el diagnóstico en esta etapa permitiría intervenir sobre los factores de riesgo, modificando el curso de la enfermedad, realizar cambios del estilo de vida, capacitar al pacientes a entender la enfermedad y el uso de recursos disponibles38,40. La selección de la población en riesgo se puede realizar por interrogatorio simple o cuestionarios estructurados que identifiquen síntomas respiratorios crónicos y exposiciones a factores de riesgo41.
Selección de búsquedaSe capturaron 90 referencias (MeSh: 58; Tripdatabase: 32), seleccionando 22 para responder la pregunta (un ECA y 21 estudios de corte transversal).
Resumen de la evidenciaLos estudios analizados evalúan fundamentalmente el rendimiento de las estrategias de búsqueda de casos en términos de prevalencia, proporción de nuevos casos y sus costos33,35,42-60. Ninguno analiza el rendimiento en términos de su impacto sobre el curso de la enfermedad o morbimortalidad.
Para discriminar la población ≥40años en riesgo y justificar el uso de espirometría algunos estudios parten de la historia de exposición a tabaco, otros de los síntomas respiratorios o la combinación de ambos.
La aplicación de cuestionarios, tanto a la población general (búsqueda activa) como a la que consulta por cualquier causa (búsqueda oportunista), permitió seleccionar una población con mayor riesgo y mejoró el rendimiento diagnóstico de la espirometría49,57. La discriminación inicial del riesgo por la presencia de síntomas respiratorios crónicos tuvo menor rendimiento que la historia de exposición a tabaco (10,8% vs. 36,3%)59. Cuando la discriminación del riesgo parte de la historia de exposición a contaminantes (tabaco), la proporción de casos fue superior a la prevalencia de EPOC en población general61. La presencia concomitante de síntomas en individuos expuestos aumenta la probabilidad de diagnóstico. Un estudio mostró que la búsqueda de casos de EPOC entre fumadores de una clínica de cesación de tabaco, con o sin síntomas respiratorios, puede tener mayor rendimiento que entre fumadores sintomáticos de la población general (13,3% vs. 10,1%)54. Dado que la población en estos programas tiene por lo general mayor exposición al tabaco, este rendimiento no puede ser extrapolado a la búsqueda de casos en otras poblaciones consultantes u oportunistas (por ejemplo, atención primaria).
Conclusiones y recomendacionesSe recomienda el uso de la espirometría para la detección de casos de EPOC en población ≥40años expuesta a factores de riesgo como tabaco (≥10paquetes/año), humo de biomasa (≥200h/año o ≥10años) u ocupación, con o sin síntomas respiratorios, tanto en población que no consulta (búsqueda activa de casos) como en población que consulta por cualquier causa (búsqueda oportunista de casos).
Evidencia baja del rendimiento diagnóstico de la búsqueda activa de casos de EPOC por medio de espirometría en población de riesgo. Recomendación fuerte para realizar espirometría en población expuesta a factores de riesgo con síntomas respiratorios. Recomendación débil para realizar espirometría en población expuesta a factores de riesgo asintomática.
Evaluación pronósticaLa estratificación de la gravedad utilizando variables sencillas de fácil aplicación constituye una primera aproximación pronóstica en la EPOC. A partir del desarrollo del índice BODE62 se han introducido otros índices utilizando diferentes variables para evaluar el pronóstico.
4. Pregunta: ¿Qué índices multidimensionales han sido validados para predecir mortalidad en EPOC?
JustificaciónAunque el deterioro de la función pulmonar está relacionado con la morbimortalidad en la EPOC, su naturaleza heterogénea obliga a buscar y validar marcadores pronósticos de carácter multidimensional63-68. La gravedad de la disnea, la edad, la capacidad de ejercicio, el índice de masa corporal, las exacerbaciones y la calidad de vida han sido utilizadas individualmente como predictores de mortalidad por todas las causas. Una visión más integral de la EPOC debe involucrar escalas multidimensionales que apoyen en la toma de decisiones y a establecer pronóstico. Se han propuesto varios índices pronóstico en la EPOC, pero persiste la controversia sobre cuáles predicen con más certeza mortalidad.
Selección de búsquedaSe capturaron 192 referencias (MeSh: 192), seleccionando 7 para contestar la pregunta (una revisión sistemática y 6 estudios de cohorte).
Resumen de la evidenciaUna revisión sistemática69 describe el valor predictivo de mortalidad de 8 índices: ADO (por su acrónimo en inglés Age, Dyspnea, Obstruction)64,70, BODE (Body mass index, Obstruction Dyspnea, Exercise)62, HADO (Health, Activity, Dyspnea, Obstruction)71, DOREMI BOX (Dyspnea, Obstruction, Rate of Exacerbation, Movement exercise Intolerance, Body Mass Index, Ox-blood oxygen disturbances)72, PILE (Predicted FEV1, IL-6 and knee Extensor strength)73, e-BODE (BODE plus Exacerbations) y BODEx (Body mass index, Obstruction Dyspnea, and Exacerbations)74. Otros índices evaluados en ensayos clínicos son el DOSE (Dyspnea, Obstruction, Smoking, Exacerbation)75, mBODE (VO2% esperado en lugar de la caminata)76, mDOSE (DOSE modificado; sustituye exacerbaciones por calidad de vida)76, i-BODE (sustituye la caminata por el shuttle test)77, y CART (Classification And Regression Tree)78.
En pacientes con EPOC se han validado todos estos índices para predecir mortalidad, con valores predictivos similares y superiores al VEF1. En el estudio COCOMICS, al ajustar por edad, el índice BODE y sus variantes (e-BODE y BODEx) muestran una discreta superioridad79.
Conclusiones y recomendacionesLa evidencia valida la superioridad de los índices multidimensionales sobre el VEF1 para predecir mortalidad en la EPOC, mostrando el BODE o sus variantes (e-BODE y BODEx) una discreta superioridad.
Evidencia alta del valor predictivo de mortalidad de los índices multidimensionales de la EPOC. Recomendación fuerte para el uso de los índices multidimensionales validados en la evaluación del pronóstico de estos pacientes.
Tratamiento de la EPOC estableEl tratamiento farmacológico está dirigido fundamentalmente a reducir los síntomas, la frecuencia y la gravedad de las exacerbaciones, y a mejorar la calidad de vida, la función pulmonar y la tolerancia al ejercicio. El análisis de los datos sobre eficacia y seguridad de los fármacos permitirá orientar la terapéutica.
5. Pregunta: Los antimuscarínicos de acción prolongada (LAMA) ¿proporcionan mayores beneficios que los β2-agonistas de acción prolongada (LABA) en pacientes con EPOC?
JustificaciónTanto los LAMA como los LABA han demostrado beneficios sobre algunos desenlaces en la EPOC, con un perfil de seguridad adecuado. Al disponer de ambas opciones terapéuticas, surge la pregunta si existen diferencias en términos de eficacia y seguridad entre estos tratamientos.
Selección de búsquedaSe capturaron 142 referencias (MeSh: 114; Tripdatabase: 28), seleccionando 4 para responder la pregunta (2 revisiones sistemáticas y 2 ECA).
Resumen de la evidenciaEn términos de eficacia, 2 revisiones sistemáticas muestran que la mejoría en la calidad de vida, disnea, actividades de la vida diaria y función pulmonar fueron similares con las 2 opciones terapéuticas80,81. Sin embargo, el tiotropio fue superior a los LABA como un solo grupo (indacaterol, salmeterol o formoterol) respecto a la disminución del número de exacerbaciones y hospitalizaciones relacionadas con la enfermedad, sin diferencias en la tasa de hospitalizaciones generales (por cualquier causa) y mortalidad80,81. En cuanto a la seguridad, se indica un menor número de eventos adversos serios y abandonos con el uso de tiotropio80.
Un ensayo clínico controlado que comparó indacaterol con tiotropio en pacientes graves indica que ambas opciones terapéuticas mejoran la función pulmonar con similar perfil de seguridad82. El grupo tratado con tiotropio tuvo mayores beneficios en la prevención de exacerbaciones.
El aumento de mortalidad cardiovascular con el dispositivo Respimat® del tiotropio ha sido tema de controversia. Una revisión sistemática en la que fueron incluidos 2 estudios con tiotropio Respimat® reportó aumento del riesgo de mortalidad general y cardiovascular en la rama que usó Respimat® y disminución de ambos desenlaces con la terapia combinada (salmeterol/fluticasona)83. Sin embargo, el estudio de seguridad TioSpir indica que ambas dosis de tiotropio Respimat® (5 o 2,5μg/día) fueron similares al tiotropio HandiHaler® (18μg) en términos de mortalidad general84. En este estudio fueron excluidos aquellos pacientes con historia de infarto de miocardio en los 6meses anteriores, hospitalización por insuficiencia cardíaca claseiii-iv, o con arritmia inestable o potencialmente fatal que requirieron nuevo tratamiento dentro de los 12meses anteriores al estudio.
No se encontraron estudios comparativos entre indacaterol versus nuevos LAMA como glicopirronio, umeclidinio y aclidinio.
Conclusiones y recomendacionesEn términos de eficacia, el tiotropio y los LABA tienen beneficios similares sobre la disnea, la función pulmonar y la calidad de vida. El tiotropio es más efectivo que los LABA para reducir la frecuencia de exacerbaciones. El perfil de seguridad es similar entre ambas opciones terapéuticas.De acuerdo con el desenlace evaluado:
Evidencia alta y recomendación fuerte para el uso de LABA o LAMA (sin preferencia de algún broncodilatador en particular) en términos de mejoría de la disnea, calidad de vida y función pulmonar.
Evidencia alta y recomendación fuerte para el uso preferencial de LAMA (tiotropio) sobre LABA en términos de reducir la frecuencia de exacerbaciones.
6. Pregunta: La asociación LABA+LAMA ¿proporciona mayores beneficios que la monoterapia con LAMA o LABA en pacientes con EPOC?
JustificaciónVarios estudios han evaluado la eficacia y la seguridad de la doble terapia broncodilatadora (LABA+LAMA) comparada con la monoterapia LAMA o LABA. Se asume que la adición de un segundo broncodilatador con diferente mecanismo de acción incrementa los beneficios. Surge entonces la pregunta de si se justifica adicionar un segundo broncodilatador en aquellos pacientes que persisten sintomáticos con la monoterapia broncodilatadora.
Selección de búsquedaSe capturaron 174 referencias (MeSh: 70; Tripdatabase: 104), seleccionando 6 para responder la pregunta (3 revisiones sistemáticas y 3 ECA).
Resumen de la evidenciaEn términos de eficacia, una revisión sistemática muestra discreta mejoría en la calidad de vida con la combinación de tiotropio y LABA comparada con la monoterapia (tiotropio) en pacientes moderados-graves85. Aunque esta diferencia fue estadísticamente significativa (−1,61; IC95%: −2,93 a −0,29), el intervalo de confianza excluye la diferencia clínicamente importante (SGRQ −4 unidades). No se observaron diferencias en otros desenlaces (hospitalizaciones, mortalidad, función pulmonar, exacerbaciones y síntomas). En esta revisión no se incluyeron estudios que analizaran la eficacia de la doble terapia broncodilatadora comparada con LABA como monoterapia. El tiempo de seguimiento de los estudios incluidos fue <1año.
Otra revisión sistemática en pacientes moderados-muy graves que incluye estudios con seguimiento <6meses indica mayor beneficio de la doble terapia broncodilatadora sobre la monoterapia (tiotropio+LABA vs. tiotropio) en la calidad de vida (SGRQ −1,81 unidades), disnea (TDI disminución >1punto), función pulmonar (VEF1 pre y posbroncodilatador >100ml), uso de medicación de rescate, pero no del riesgo de exacerbaciones86. La mejoría en la calidad de vida no alcanzó la relevancia clínica.
En pacientes moderados-graves, una revisión sistemática muestra mejoría de la función pulmonar (VEF1105ml; IC95%: 69-142) y la disnea (TDI1,50; IC95%: 1,01-1,99) con tiotropio+formoterol comparado con tiotropio87. En 7 de los 8 estudios analizados se incluyeron pacientes con corticosteroides inhalados (CI), por lo que persiste la duda de si estos resultados pueden ser extrapolados de manera generalizada a los pacientes sin CI87.
Un ECA que compara tiotropio+indacaterol vs. tiotropio en pacientes moderados-graves reporta mayores beneficios en la función pulmonar (VEF1>100ml) con la doble terapia broncodilatadora, en 12semanas de seguimiento88. Otro ECA compara indacaterol+glicopirronio vs. glicopirronio o tiotropio en pacientes graves-muy graves seguidos durante 64semanas89. La doble terapia broncodilatadora mostró mayores beneficios en la función pulmonar (VEF170-80ml vs. glicopirronio y 60-80ml vs. tiotropio), calidad de vida (SGRQ −1,9 a −2,8 vs. glicopirronio y −1,7 a −3,1 vs. tiotropio) y reducción en la tasa total de exacerbaciones. El análisis separado de los tipos de exacerbaciones no reportó diferencias en la tasa de exacerbaciones moderadas-graves. Por otra parte, la comparación de la doble terapia broncodilatadora (glicopirronio+indacaterol) mostró mayores beneficios comparada con placebo, tiotropio, glicopirronio e indacaterol en la función pulmonar, la disnea y la calidad de vida en pacientes moderados-graves, sin alcanzar la relevancia clínica90.
En términos de seguridad, la frecuencia de efectos adversos fue similar para la doble terapia broncodilatadora comparada con la monoterapia de LABA o LAMA88-90.
Conclusiones y recomendacionesEn términos de eficacia, la doble terapia broncodilatadora tiene mayores beneficios comparada con la monoterapia en pacientes con EPOC moderada-muy grave sobre la disnea, la función pulmonar y la calidad de vida, pero no sobre el número de exacerbaciones. El perfil de seguridad es similar en ambas opciones terapéuticas.
Evidencia alta y recomendación fuerte para el uso de la doble terapia broncodilatadora (LABA+LAMA) vs. LAMA o LABA en pacientes moderados-muy graves que persisten sintomáticos o con calidad de vida afectada con la monoterapia broncodilatadora.
7. Pregunta: La terapia combinada LABA/corticoides inhalados (LABA/CI) ¿proporciona mayores beneficios que la monoterapia con LAMA en pacientes con EPOC?
JustificaciónLa combinación LABA/CI y la monoterapia con LAMA son tratamientos de uso frecuentes en la EPOC91. El tiotropio y la terapia combinada (LABA/CI) han mostrado beneficios sobre la disnea, la calidad de vida, la frecuencia de exacerbaciones y las hospitalizaciones92,93. Al disponer de ambas opciones terapéuticas surge la pregunta sobre diferencias en términos de eficacia y seguridad entre estos tratamientos.2
Selección de búsquedaSe capturaron 68 referencias (MeSh: 11; Tripdatabase: 57), seleccionando 2 para responder la pregunta (2 revisiones sistemáticas).
Resumen de la evidenciaEn términos de eficacia, una revisión sistemática muestra resultados similares en la frecuencia de exacerbaciones, ingresos hospitalarios por exacerbaciones y calidad de vida entre las 2 opciones terapéuticas94. Sin embargo, el número de abandonos en uno de los estudios incluidos fue alto, con desequilibrio entre ambos grupos sin seguimiento de los pacientes luego del abandono, lo que limita parcialmente la aplicabilidad de sus resultados95.
Otra revisión sistemática mostró mejoría modesta sobre el VEF1 pre-broncodilatador (cambio 60ml), uso de medicación de rescate y calidad de vida (SGRQ −2,07 unidades) con la terapia combinada comparada con la monoterapia con tiotropio, sin alcanzar estos cambios la relevancia clínica86.
En términos de seguridad, se evidencia aumento del riesgo de neumonía y efectos adversos serios con la combinación salmeterol/fluticasona comparada con tiotropio86,94. No se encontraron estudios comparativos entre otras combinaciones diferentes a salmeterol/fluticasona versus tiotropio u otros LAMA.
Conclusiones y recomendacionesEn términos de eficacia, la monoterapia con LAMA y la terapia LABA/CI son similares. En relación con la seguridad, existe evidencia que asocia mayor riesgo de neumonía con la combinación LABA/CI.
Evidencia alta para el uso de tiotropio o LABA/CI en términos de mejorar la disnea, la función pulmonar, la calidad de vida, la frecuencia de exacerbaciones y las hospitalizaciones por exacerbación. Recomendación débil para preferir el uso de LAMA sobre LABA/CI debido al riesgo aumentado de neumonía con el uso de LABA/CI.
8. Pregunta: La combinación LABA/CI sumada a tiotropio (terapia triple) ¿proporciona mayores beneficios comparada con la monoterapia con tiotropio, la combinación LABA/CI o la doble terapia broncodilatadora (LABA+LAMA) en pacientes con EPOC?
JustificaciónSe ha sugerido que adicionar tiotropio a la combinación LABA/CI podría disminuir las exacerbaciones, las hospitalizaciones y el costo sanitario en pacientes con EPOC moderada-grave. Sin embargo, persiste la controversia sobre el perfil de eficacia y seguridad de la triple terapia (LABA/CI+tiotropio) comparada con la monoterapia o la doble terapia broncodilatadora (LABA+LAMA).
Selección de búsquedaSe capturaron 32 referencias (MeSh: 24; Tripdatabase: 8), seleccionando 4 para responder la pregunta (3 revisiones sistemáticas y un ECA).
Resumen de la evidenciaUna revisión sistemática en la que se identificó un solo estudio que compara la triple terapia (LABA/CI+tiotropio) vs. doble terapia broncodilatadora (LABA+LAMA) no mostró diferencias en términos de eficacia (calidad de vida, función pulmonar, mortalidad por todas las causas, exacerbaciones y hospitalizaciones), frecuencia de neumonías y otros eventos adversos96. Aunque metodológicamente el estudio fue adecuado, la alta y desigual frecuencia de abandono (26% en la triple terapia y 46% en la doble terapia broncodilatadora) hace que los resultados no sean concluyentes.
Una segunda revisión sistemática que compara la triple terapia (LABA/IC+tiotropio), la terapia combinada (LABA/CI) y la monoterapia (tiotropio) indica una mejoría en la calidad de vida y en la función pulmonar con el uso de la triple terapia97. Sin embargo, los beneficios sobre la mortalidad, la frecuencia de hospitalizaciones y exacerbaciones, así como los riesgos sobre neumonía a largo plazo de la triple terapia, son inciertos. En esta revisión se identificó un solo estudio que compara la triple terapia con la combinación LABA/ICS98, mostrando mejoría significativa del VEF1 con la triple terapia (0,05; IC95%: 0,00-0,09), sin diferencia en efectos adversos y abandonos.
Otra revisión sistemática que compara la triple terapia con monoterapia (tiotropio) muestra mayores beneficios de la triple terapia sobre la función pulmonar y la calidad de vida, sin diferencias en la tasa de exacerbaciones, disnea, neumonías, eventos adversos serios y abandonos86. Los resultados de un estudio abierto aleatorizado que compara triple terapia vs. monoterapia (tiotropio) mostró mayor eficacia de la triple terapia sobre la función pulmonar y calidad de vida en pacientes con VEF1≤ 65%, sin diferencias en frecuencia de neumonías y eventos adversos99.
Conclusiones y recomendacionesEn términos de eficacia, la triple terapia muestra discretos beneficios sobre la función pulmonar y la calidad de vida en pacientes moderados-graves, con un perfil de seguridad similar comparada con otras opciones terapéuticas (monoterapia con tiotropio o LABA/CI). No hay evidencia de superioridad de la triple terapia sobre la doble terapia broncodilatadora.
Evidencia alta, recomendación débil, para el uso de triple terapia en pacientes con EPOC moderada-grave comparado con LAMA como monoterapia (tiotropio) en términos de mejoría de la función pulmonar y de la calidad de vida.
Evidencia alta, recomendación débil para el uso de triple terapia en pacientes con EPOC moderada-grave comparado con terapia combinada (LABA/CI) en términos de mejoría de la función pulmonar.
Prevención y tratamiento de exacerbacionesEl tratamiento de las exacerbaciones en la EPOC (E-EPOC) tendrá por objetivo minimizar su impacto y prevenir nuevas agudizaciones.
9. Pregunta: ¿Se justifica la aplicación de inmunizaciones y lisados bacterianos en pacientes con EPOC?
JustificaciónAlgunas pautas terapéuticas recomiendan la aplicación regular de inmunizaciones contra influenza y neumococo para prevenir las E-EPOC. Esto podría implicar mayor costo y posibles efectos adversos. Es controversial el uso de lisados bacterianos en la prevención de E-EPOC.
Selección de búsquedaSe capturaron 112 referencias (MeSh: 97; Tripdatabase: 15), seleccionando 5 para responder la pregunta (4 revisiones sistemáticas y un metaanálisis).
Resumen de la evidenciaEn términos de eficacia, una evaluación de evidencia indica que, en general, la probabilidad de no adquirir episodios de infecciones respiratorias agudas relacionadas con influenza en los sujetos vacunados contra la influenza (trivalente, virus fragmentado e inactivado) es del 76%100. La efectividad de la vacuna fue del 84, del 45 y del 85% para la EPOC leve, moderada o grave, respectivamente100. No se observaron diferencias en el número de hospitalizaciones por infecciones respiratorias agudas relacionadas con influenza y la necesidad de ventilación mecánica entre los pacientes vacunados y el grupo placebo100. Similares hallazgos han sido reportados en otra revisión sistemática101. En términos de seguridad, los eventos adversos locales (prurito o inflamación) fueron mayores en los vacunados, pero no la frecuencia de reacciones sistémicas (cefalea, mialgia, fiebre y erupción cutánea)100,101.
Una revisión sistemática que incluye estudios con las vacunas contra el neumococo (polisacáridos purificados de 14 y 23 serotipos) en pacientes con EPOC no mostró reducción del riesgo de desarrollar neumonía neumocócica y mortalidad cardiovascular o por cualquier causa102. Tampoco se observó reducción en la frecuencia de exacerbaciones, ingresos hospitalarios o visitas a urgencias. El análisis de un ensayo clínico en subgrupos de pacientes indica que la eficacia en la prevención de neumonías (neumocócica y de etiología desconocida) en pacientes <65años fue del 76 y del 48% en aquellos con obstrucción grave (VEF1<40%)103. En términos de seguridad, los efectos locales y sistémicos son comparables al placebo102.
Los resultados de un metaanálisis y una revisión sistemática no muestran efectos sobre la prevención de E-EPOC con el uso de lisados bacterianos obtenidos a partir de lisis por proteólisis104,105. Los efectos adversos urológicos y cutáneos fueron comunes en los pacientes que recibían este tratamiento.
Conclusiones y recomendacionesEvidencia alta y recomendación fuerte para el uso anual de la vacuna contra la influenza en todo paciente con EPOC.
Evidencia alta y recomendación fuerte para el uso de la vacuna contra neumococo en pacientes con EPOC <65años y/o con obstrucción grave (VEF1<40%) y débil para el uso de esta inmunización de manera generalizada en el resto de los pacientes con EPOC.
Evidencia alta y recomendación fuerte en contra del uso de lisados bacterianos orales para prevenir E-EPOC.
10. Pregunta: El uso profiláctico de antibióticos en pacientes con EPOC estable ¿previene las exacerbaciones?
JustificaciónVarios estudios han evaluado la posibilidad de reducir la frecuencia de E-EPOC con el uso profiláctico de antibióticos. Los primeros estudios demostraron reducción de los días con discapacidad sin modificar la frecuencia de exacerbaciones, con el agravante de eventos adversos y el desarrollo de resistencia bacteriana106. Estudios recientes han investigado la utilidad de diferentes esquemas con antibióticos intermitentes a largo plazo que ameritan su análisis para generar una recomendación sobre su uso en la prevención de E-EPOC.
Selección de búsquedaSe capturaron 123 referencias (MeSh: 46; Tripdatabase: 77), seleccionando 5 para responder la pregunta (2 metaanálisis y 3 ECA).
Resumen de la evidenciaLos resultados de 2 metaanálisis que evalúan el uso de macrólidos muestran reducción de la frecuencia de exacerbaciones en los pacientes que recibieron estos fármacos por al menos 6meses107,108. Es importante destacar la heterogeneidad en los esquemas antibióticos de los estudios incluidos en los metaanálisis y del tratamiento inhalado de base (<50% de los pacientes recibían terapia doble o triple).
El uso de 250mg de eritromicina cada 12h durante un año redujo las exacerbaciones moderadas y graves en pacientes moderados-graves109. En forma similar, el uso de 250mg de azitromicina al día durante un año disminuyó la frecuencia de exacerbaciones y mejoró la calidad de vida110.
En términos de seguridad, el uso de azitromicina se asocia con mayor resistencia a macrólidos y deterioro auditivo. En este estudio se excluyeron pacientes con taquicardia en reposo, o riesgo de intervalo QT corregido prolongado, por lo que persiste la controversia sobre el riesgo cardiovascular110.
El moxifloxacino (400mg/día durante 5días) en pulsos cada 8semanas por 48semanas no modificó la frecuencia de exacerbaciones ni otros desenlaces (hospitalizaciones, mortalidad o calidad de vida)111. Sin embargo, en pacientes con expectoración purulenta redujo el número de exacerbaciones.
Los principales eventos adversos asociados al uso de moxifloxacino fueron gastrointestinales (náuseas, vómitos y diarrea).
Conclusiones y recomendacionesEl uso de antibióticos profilácticos podría disminuir la frecuencia de E-EPOC en pacientes con riesgo elevado de exacerbaciones, a pesar de recibir tratamiento con broncodilatadores y CI. Sin embargo, la presencia de eventos adversos, la posibilidad de favorecer la resistencia bacteriana y la ausencia de información para prolongar estos esquemas más allá de un año impiden hacer una recomendación general para su uso.
Evidencia alta de disminución de frecuencia de exacerbaciones con el uso de antibióticos profilácticos. Recomendación fuerte para evitar el uso rutinario o generalizado de antibióticos profilácticos en la EPOC debido a los efectos adversos.
11. Pregunta: ¿Son los antibióticos efectivos en todas las exacerbaciones de la EPOC?
JustificaciónLa causa más común de las E-EPOC son las infecciones respiratorias, que representan aproximadamente el 80% de los casos (50-70% de origen bacteriano). Por otra parte, se recomienda clasificar la gravedad de las E-EPOC según al nivel de atención requerida: ambulatorio, hospitalizado en sala general o en la UCI. Existe controversia sobre la indicación rutinaria de antibióticos en todas las E-EPOC.
Selección de búsquedaSe capturaron 92 referencias (MeSh: 57; Tripdatabase: 35), seleccionando 2 para responder la pregunta (una revisión sistemática y un ECA).
Resumen de la evidenciaUna revisión sistemática muestra en términos de eficacia beneficios del uso de antibióticos sobre el riesgo de fracaso de tratamiento, estancia hospitalaria y mortalidad en los pacientes con E-EPOC ingresados en la UCI112. En pacientes hospitalizados fuera de la UCI con exacerbación grave, el uso de antibióticos redujo los fracasos de tratamiento pero no la estancia hospitalaria ni la mortalidad. Persiste la incertidumbre sobre los beneficios en E-EPOC de tratamiento ambulatorio. No se observaron diferencias en fracaso de tratamiento, reingresos y tiempo hasta la próxima exacerbación entre esquemas de corta (5-7días) y larga duración (10-14días)112.
Un subanálisis de un ECA que evaluó predictores de desenlace en E-EPOC leves-moderadas encontró que fue mayor el fracaso clínico sin antibióticos (19,9%) comparado con el grupo que recibió amoxicilina/clavulánico (9,5%)113. Los principales factores asociados con el riesgo de fracaso sin antibióticos fueron la purulencia del esputo (OR=6,1; IC95%: 1,5-25; p=0,005) y un nivel de PCR≥40mg/l (OR=13,4; IC95%: 4,6-38,8; p<0,001). Cuando ambos estaban presentes, la probabilidad de fracaso sin antibióticos fue del 63,7%113.
Conclusiones y recomendacionesEstá justificado el uso de antibióticos en las E-EPOC que requieran ingreso hospitalario, en particular en pacientes que ingresan a la UCI. En E-EPOC leves-moderadas se recomienda considerar el uso de antibiótico en pacientes con expectoración purulenta y/o nivel de PCR elevado.
Evidencia alta y recomendación fuerte para el uso de antibióticos en exacerbaciones graves-muy graves.
Evidencia alta y recomendación débil en exacerbaciones leves-moderadas con expectoración purulenta y/o nivel de PCR elevado.
12. Pregunta: ¿Son los corticosteroides sistémicos (vía oral o parenteral) efectivos en el tratamiento de las E-EPOC?
JustificaciónLos corticosteroides sistémicos han sido utilizados en el tratamiento ambulatorio e intrahospitalario de la E-EPOC. Existen evidencias que respaldan su uso, aunque persisten las controversias sobre el riesgo de efectos adversos, dosis, vía de administración y duración del tratamiento.
Selección de búsquedaSe capturaron 60 referencias (MeSh: 24; Tripdatabase: 36), seleccionando 6 para responder la pregunta (3 revisiones sistemáticas y 3 ECA).
Resumen de la evidenciaDos revisiones sistemáticas muestran beneficio del uso de corticosteroides sistémicos (orales o parenterales) para disminuir el riesgo de fracaso terapéutico, duración de la estancia hospitalaria, recurrencias y readmisiones a los 30días, mejoría del VEF1, gases arteriales y disnea en pacientes con E-EPOC tratados en forma ambulatoria o intrahospitalaria114,115.
Los resultados de 3 revisiones sistemáticas y 3 ECA apoyan el uso de prednisona por vía oral como primera elección (30-60mg/día) durante 5-14días, o metilprednisolona a dosis equivalentes115-119. Las evidencias indican igual efectividad al comparar esquemas de tratamiento de 5 vs. 14días con 40mg/día de prednisona. Los esquemas de corta duración (5-7días) son igualmente efectivos que los de larga duración (10-14días). Sin embargo, con los esquemas de corta duración se ha descrito menor frecuencia de efectos adversos (hiperglucemia e infecciones respiratorias).
En relación con la vía de administración, en términos de eficacia no hay diferencias entre la vía intravenosa y la oral; sin embargo, la vía parenteral se asoció con mayor costo y complicaciones locales116,118. En términos de seguridad, el evento adverso más frecuente es la hiperglucemia transitoria. En los pacientes con frecuentes exacerbaciones que requieren múltiples cursos de corticosteroides, la dosis acumulativa aumenta el riesgo de diabetes, osteoporosis, fracturas, ganancia de peso, insomnio y complicaciones oculares119.
Conclusiones y recomendacionesEl uso de corticosteroides sistémicos, preferentemente por vía oral y a dosis equivalente de 40mg/día de prednisona durante 5-10días, es eficaz y seguro en el tratamiento de las E-EPOC. Se recomienda usar de rutina la vía oral y limitar el uso de la vía parenteral.
Evidencia alta y recomendación fuerte a favor del uso de corticosteroides sistémicos orales en E-EPOC que requieran tratamiento ambulatorio o intrahospitalario.
FinanciaciónAstraZeneca, Bayer, Boehringer Ingelheim, GlaxoSmithKline, Novartis y Takeda. Los patrocinadores no han influido ni han tenido participación en ninguna etapa de la elaboración de la guía. Ninguno de los autores ha recibido remuneración por su participación en la elaboración de esta actualización.
Conflicto de interesesMaría Montes de Oca ha recibido honorarios por impartir conferencias y/o asesoría científica de AstraZeneca, Boehringer Ingelheim y Novartis.
María Victorina López Varela ha recibido honorarios por impartir conferencias y/o asesoría científica de AstraZeneca, Boehringer Ingelheim, Bayer, Novartis, GlaxoSmithKline y Takeda.
Agustín Acuña ha recibido honorarios por impartir conferencias y/o asesoría científica de AstraZeneca y Novartis.
Eduardo Schiavi ha recibido honorarios por impartir conferencias y/o asesoría científica de AstraZeneca, Boehringer Ingelheim y Takeda.
María Alejandra Rey ha recibido honorarios por impartir conferencias y/o asesoría científica de AstraZeneca, Boehringer Ingelheim, Novartis y Roche.
José Jardim ha recibido honorarios por impartir conferencias y/o asesoría científica de AstraZeneca, Boehringer Ingelheim, Bayer, Novartis, GlaxoSmithKline, MSD, Chiesi, Grifols, CSL, Ache y Teva.
Alejandro Casas ha recibido honorarios por impartir conferencias y/o asesoría científica de AstraZeneca, Boehringer Ingelheim, Novartis, Takeda, Biotoscana y MSD.
Antonio Tokumoto ha recibido honorarios por impartir conferencias y/o asesoría científica de AstraZeneca y Boehringer Ingelheim.
Carlos A. Torres Duque ha recibido honorarios por impartir conferencias y/o asesoría científica de Novartis, GlaxoSmithKline, MSD y Biotoscana.
Alejandra Ramírez-Venegas ha recibido honorarios por impartir conferencias y/o asesoría científica de AstraZeneca, Boehringer Ingelheim, Novartis, GlaxoSmithKline y MSD.
Gabriel García ha recibido honorarios por impartir conferencias y/o asesoría científica de Novartis, GlaxoSmithKline, Pfizer, MSD y Sanofi.
Roberto Stirbulov ha recibido honorarios por impartir conferencias y/o asesoría científica de AstraZeneca, Boehringer Ingelheim, Bayer, Novartis y GlaxoSmithKline.
Aquiles Camelier ha recibido honorarios por impartir conferencias y/o asesoría científica de AstraZeneca, Boehringer Ingelheim, Novartis, GlaxoSmithKline y Chiesi.
Miguel Bergna ha recibido honorarios por impartir conferencias y/o asesoría científica de AstraZeneca, Boehringer Ingelheim, Novartis, GlaxoSmithKline y Sanofi.
Mark Cohen ha recibido honorarios por impartir conferencias y/o asesoría científica de AstraZeneca, Boehringer Ingelheim, Novartis, GlaxoSmithKline, MSD y Oxirent.
Santiago Guzmán ha recibido honorarios por impartir conferencias y/o asesoría científica de AstraZeneca, Boehringer Ingelheim, Novartis, Bayer, GlaxoSmithKline, Biotoscana, Ferrer Leti, Pfizer y Takeda Nycomed.
Efraín Sánchez no tiene conflicto de intereses.
Agradecemos a Ciro Casanova (Hospital Universitario La Candelaria, Tenerife, España), Juan Pablo de Torres (Departamento Pulmonar, Clínica Universitaria de Navarra, España) y Rogelio Pérez-Padilla (Instituto Nacional de Enfermedades Respiratorias [INER], Ciudad de México, México), quienes fueron los revisores externos de este documento.