Streptococcus pneumoniae es causante de diversos cuadros clínicos: neumonía adquirida en la comunidad, sinusitis, otitis media, etc. Sin duda, la forma clínica más grave ocasionada por este germen es la enfermedad neumocócica invasiva. Se sabe que determinados factores, entre los que destaca el consumo de tabaco, y el padecimiento de enfermedades subyacentes concomitantes aumentan el riesgo de padecer estos procesos. Este artículo muestra un documento de consenso sobre vacunación antineumocócica en fumadores que ha sido realizado por un grupo de expertos en tabaquismo de la Sociedad Española de Neumología y Cirugía Torácica y de la Asociación Latinoamericana del Tórax.
Streptococcus pneumoniae is responsible for several clinical syndromes, such as community-acquired pneumonia, sinusitis, otitis media, and others. The most severe clinical entity caused by this bacteria is undoubtedly invasive pneumococcal disease. Certain factors are known to increase the risk of presenting invasive pneumococcal disease, the most important being smoking habit and underlying concomitant diseases. This article comprises a consensus document on antipneumococcal vaccination in smokers, drawn up by a Smoking Expert Group from the Spanish Society of Pulmonology and Thoracic Surgery and the Latin American Chest Association.
Streptococcus pneumoniae (S. pneumoniae) es un coco grampositivo, cuya cápsula dispone de un antígeno que es quien le dota de patogenicidad y virulencia. Dicho antígeno capsular define el serotipo y es la base para el desarrollo de vacunas. Se han identificado más de 92 serotipos de este germen, aunque no todos tienen capacidad patogénica. Es de destacar que 23 de ellos son causantes del 76% de las enfermedades neumocócicas que se producen en el mundo1. Según estimaciones de la OMS, la enfermedad neumocócica es responsable de 1,6 millones de muertes anuales y es la primera causa evitable de muerte por vacunación2,3.
En España, S. pneumoniae fue, durante el período 2003-2007, el agente patógeno más frecuentemente identificado en la neumonía adquirida en la comunidad (NAC), responsable de hasta el 63,7% de las mismas. Además, en ese mismo período, se registraron un total de 75.932 muertes por NAC en adultos de 50 o más años de edad (16,9%)4,5. En un estudio realizado en Latinoamérica, entre 1970 y 2008, período más amplio que el analizado en el estudio español, se encontró que S. pneumoniae fue el patógeno más comúnmente identificado como causante de NAC, siendo el responsable del 35% de los casos diagnosticados. Es más, la mortalidad por NAC en esta región es más elevada que la que origina este mismo proceso en otros países desarrollados, 6% frente a un 4%6.
S. pneumoniae es causante de diversos cuadros clínicos: NAC, sinusitis, otitis media, etc. Sin duda, la forma clínica más grave ocasionada por este germen es la enfermedad neumocócica invasiva (ENI) que se define como la presencia de S. pneumoniae en sangre, líquido cefalorraquídeo u otro fluido normalmente estéril7. Se sabe que determinados factores y el padecimiento de enfermedades subyacentes concomitantes aumentan el riesgo de enfermedad neumocócica invasiva. Entre las enfermedades subyacentes, destacan aquellas que conllevan un estado de déficit inmunitario, o alteración de las defensas locales del órgano diana, tales como la enfermedad respiratoria, renal, hepática y cardiovascular crónica; los pacientes infectados por el VIH; en espera de trasplante de órgano sólido y trasplantados de órgano sólido y/o progenitores hematopoyéticos; los que reciben quimioterapia por tumor sólido o neoplasia hematológica; con enfermedad autoinmune y tratados con corticoides, inmunosupresores o productos biológicos; pacientes diabéticos; con fístulas de líquido cefalorraquídeo, implantes cocleares así como con asplenia anatómica o funcional8. El tabaquismo se ha mostrado, igualmente, como un factor de riesgo importante para el desarrollo de enfermedad neumocócica9–14.
En el humo del tabaco se han descrito hasta 4.500 sustancias tóxicas, la mayor parte de ellas con capacidad patogénica para el ser humano9. Muchas de estas sustancias alteran los mecanismos de defensa pulmonares y facilitan que las infecciones bacterianas respiratorias, y sobre todo las neumocócicas, se produzcan más frecuentemente en fumadores que en no fumadores10,11. Se ha encontrado que la NAC se desarrolla con mayor frecuencia entre fumadores y que el germen más frecuentemente implicado en su etiología es el S. pneumoniae12,13. Por otro lado, se sabe que la ENI es más frecuente en fumadores activos, en fumadores pasivos y en ex fumadores de menos de cinco años de evolución que en aquellos que nunca han fumado14. Todos estos datos señalan al tabaquismo como uno de los principales factores de riesgo independientes para el desarrollo de NAC y de ENI.
En 2012, un grupo de expertos del área de tabaquismo de la Sociedad Española de Neumología y Cirugía Torácica (SEPAR) dictó unas recomendaciones para la vacunación neumocócica en fumadores15. Ese mismo año, la Sociedad Española de Medicina Preventiva, Salud Pública e Higiene, publicó unas recomendaciones de vacunación antineumocócica en los adultos en las que corroboraba las recomendaciones del grupo de la SEPAR16, recomendaciones que también se especifican en la guía multidisciplinar para el manejo de la NAC publicada en 201317. Por último, en el Consenso sobre vacunación antineumocócica en el adulto con patología de base, refrendado por 16 sociedades científicas españolas y publicado en 2013, también se avalan las recomendaciones del grupo de la SEPAR18.
Recientemente, expertos en tabaquismo de la SEPAR y de la Asociación Latinoamericana del Tórax (ALAT), han debatido sobre la necesidad de publicar un documento de consenso sobre vacunación antineumocócica en fumadores en el que, partiendo del documento original de la SEPAR, se consideren las necesidades de este tipo de vacunación en fumadores de esa amplia área geográfica. Diversas razones han llevado a la creación de este grupo de trabajo: la alta prevalencia de tabaquismo existente en estos países, la alta tasa de enfermedades neumocócicas que se diagnostican en los mismos (en Latinoamérica el 35% frente a España con un 63,7%), la alta tasa de mortalidad por NAC que padecen y la necesidad de establecer criterios científicos sobre vacunación antineumocócica en fumadores en estos países que comparten características sociales y culturales similares6,13,19–21.
A lo largo de este documento, se mostrarán los diferentes estudios de investigación básica que sostienen al tabaquismo como un factor de riesgo relevante para el desarrollo de la enfermedad neumocócica y se revisarán los estudios clínico-epidemiológicos realizados, tanto en el ámbito español como en el latinoamericano, que señalan al tabaquismo como importante factor de riesgo de esos procesos. Finalmente, se definirán los grupos de riesgo y se describirá la propuesta de vacunación consensuada.
Relación entre tabaquismo y enfermedad neumocócica. Revisión de los estudios de investigación básicaSe ha descrito un mayor riesgo de infecciones por neumococo entre los fumadores, debido fundamentalmente a la alteración del epitelio de la mucosa bronquial, el aumento de la adherencia bacteriana y los cambios en las respuestas inmunes, innata y adaptativa, que se operan en este grupo de sujetos22–31.
Las sustancias tóxicas del humo del tabaco producen lesiones en el epitelio respiratorio que causan disminución del aclaramiento mucociliar. Entre ellas se han descrito: hipertrofia de las glándulas mucosas, aumento de células caliciformes, desaparición de los cilios, trastorno en la producción de moco y alteración de sus características reológicas, así como trastornos de las uniones entre las células del epitelio bronquial22,23. Además, en un estudio se ha encontrado que los niveles de β defensina-2 humana, producida por las células del epitelio bronquial, son menores en los fumadores y ex fumadores que en los no fumadores24.
Pero, además de estas lesiones del epitelio bronquial causadas por el tabaquismo, también se encontró que dichas sustancias tóxicas, alteran el número y la función de las células alveolares. Diferentes estudios, llevados a cabo tanto in vivo como in vitro, demostraron que en el líquido alveolar de fumadores existe un mayor número de macrófagos alveolares y de polimorfonucleares y que la capacidad fagocítica de estas células está claramente disminuida en comparación con la de los no fumadores25–27.
Otro mecanismo que explica la facilidad para la infección por neumococo en fumadores, es que el humo del tabaco modifica la adherencia bacteriana, hecho que sería clave en el desarrollo de enfermedad de mucosas o invasiva28. En un estudio se vio que la exposición a un condensado de humo de tabaco aumenta la producción de biofilm por el neumococo y disminuye la actividad de la neumolisina pudiendo explicar la mayor colonización y persistencia del neumococo en fumadores29.
Por otro lado, se sabe que el humo del tabaco puede causar una alteración de la respuesta inmunológica. En estudios in vitro se observó que los fumadores tenían menor respuesta de inmunidad celular contra células de melanoma y que la producción de Ig G e Ig A estaba disminuida30. Estudios in vivo han demostrado que la condición de fumador afecta las subpoblaciones de linfocitos T, en particular las poblaciones CD4 y la relación CD4/CD831. En otros análisis se comprobó que el humo del tabaco atenuaba la respuesta inflamatoria de las células respiratorias. Efectivamente, se ha comprobado que el tabaco inhibe la respuesta de los receptores tipo Toll II (TLR2), del factor nuclear KB (NF-KB), la proliferación de células CD4 (LTCD4), la maduración de células dendríticas y la capacidad de opsonización32–36. Luego, teniendo en cuenta estos datos obtenidos tanto en estudios in vivo como in vitro, parece claro que el humo del tabaco causa alteración de la respuesta inmunológica de las células respiratorias.
La tabla 1 resume las principales conclusiones de los estudios de investigación básica que han analizado las alteraciones causadas por el humo del tabaco en el aparato respiratorio y que llevan a que la infección, particularmente por neumococo, sea más frecuente y con mayor mortalidad entre los fumadores.
Alteraciones causadas por el consumo del tabaco en el aparato respiratorio
| 1.- Alteraciones del epitelio muco-ciliar |
| Desaparición de los cilios |
| Hipertrofia de las glándulas mucosas |
| Aumento de células caliciformes |
| Trastorno en la producción del moco |
| Alteración de las características reológicas del moco |
| Trastorno de las uniones entre las células del epitelio bronquial |
| Reducción en la producción de β defensina-2 humana |
| 2.- Aumento de la adherencia bacteriana |
| - Disminución de la producción de neumolisina |
| - Aumento en la producción de biofilm |
| 3.- Cambios en la respuesta inmunológica |
| -Reducción de la fagocitosis por parte de los macrófagos alveolares y polimorfonucleares |
| -Reducción en la producción de citoquinas |
| -Reducción en la producción de inmunoglobulinas |
| -Alteraciones en las subpoblaciones linfocitarias |
Diferentes estudios de tipo clínico-epidemiológico han encontrado que el consumo de tabaco es un factor de riesgo independiente para el desarrollo de NAC y de ENI.
En un estudio de base poblacional, de casos y controles, realizado en España por Almirall et al. en el que fueron identificados 1.336 casos de NAC sobre una población de 859.033 sujetos, en el análisis multivariado se encontró que el consumo de tabaco era un factor de riesgo para el desarrollo de este proceso: OR: 1,48 (1,14-1,86)37. Además, en otro estudio del mismo autor se encontró que había una relación dosis/respuesta entre el consumo de tabaco y la posibilidad de desarrollar NAC. De tal manera que, a una mayor duración del consumo de tabaco, a un mayor número de cigarrillos consumidos y a un más alto índice paquetes/año, la posibilidad de desarrollar NAC era más alta. Incluso, se observó que las posibilidades de desarrollar este proceso disminuían al dejar de fumar, de tal manera que caían por debajo del 50% tras cinco años del abandono del tabaco38. Esta relación entre NAC y consumo de tabaco ha sido encontrada en múltiples estudios. Así Torres et al., en una revisión de la literatura en la que analizaron hasta un total de 60 publicaciones encontraron que el tabaquismo es un factor de riesgo muy relevante para el padecimiento de NAC, OR: 1,81 (1,53-2,15)39.
Es de destacar que otros estudios han encontrado que el tabaquismo es un factor de riesgo independiente para el padecimiento de NAC severa de etiología neumocócica con una OR 2,11 (1,02-4,34, p=0,04) para sufrir shock séptico40,41. Además, en la población con infección por el VIH y en la era del tratamiento antirretroviral combinado, el tabaquismo se ha descrito en varios estudios como el principal factor de riesgo para el desarrollo de NAC(42,43). Un estudio epidemiológico demostró que el tabaquismo es un factor de riesgo independiente de mortalidad en NAC bacteriémicas por S. pneumoniae44. Un reciente estudio español ha investigado la influencia del tabaquismo en la mortalidad por NAC de etiología neumocócica45. Se analizaron un total de 4.288 pacientes hospitalizados por NAC. De ellos 892 padecían NAC de etiología neumocócica. Se encontró que el consumo activo de tabaco fue un factor de riesgo independiente para increementar la mortalidad a los 30 días en los sujetos con NAC de etiología neumocócica, OR, 5,0 (1,8-13,5; p 0,001), después de ajustar por diferentes factores de confusión (edad, hepatopatía, sepsis, etc.)45.
Pero no solo el tabaquismo activo se ha vinculado en el desarrollo de NAC, también el tabaquismo pasivo ha demostrado ser factor de riesgo. Un estudio de base poblacional de casos y controles encontró que el tabaquismo pasivo era un factor de riesgo importante en sujetos inmunocompetentes para el desarrollo de bacteriemia neumocócica14.
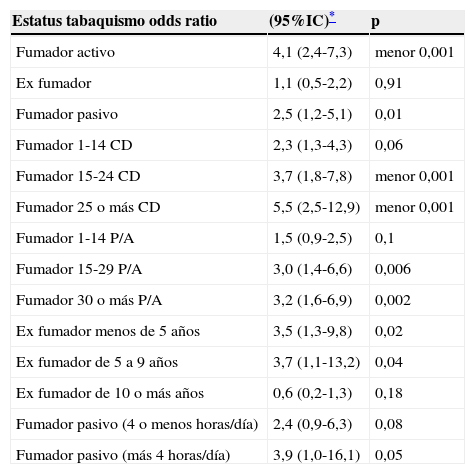
La ENI es otro proceso en el que el tabaquismo se muestra como un factor de riesgo importante. En España, según un estudio prospectivo, multicéntrico, de vigilancia hospitalaria (Estudio ODIN), durante el período 2010-2012, en el que se analizaron un total de 436 pacientes, inmunodeprimidos o no, se encontró que el tabaquismo era el principal factor de riesgo46. Además, se ha mostrado cómo el principal factor de riesgo independiente para el desarrollo de ENI en adultos inmunocompetentes en un estudio de base poblacional14. Los autores de este estudio analizaron a todos los sujetos inmunocompetentes que habían padecido ENI en diferentes ciudades de EE. UU. y Canadá. Fueron identificados un total de 228 sujetos y un total de 301 fueron utilizados como controles. Los autores encontraron que ENI se asoció significativamente con el consumo de tabaco; OR, 4,1 (2,4-7,3). Además, había una relación dosis/respuesta positiva no solo con el índice paquetes/año sino, también, con el tiempo de abandono de consumo (tabla 2)14. Se encontró, también, un riesgo de desarrollar ENI atribuible al tabaquismo pasivo que alcanzó el 17%14. Con respecto a los resultados de este estudio cabe destacar que ya en fumadores de un paquete/año se observa un incremento del riesgo para el desarrollo de ENI que llega a ser de casi el doble y que el riesgo de un ex fumador no se iguala al de un no fumador hasta cumplir diez años de abandono del consumo del tabaco14.
Relación entre tabaquismo activo y pasivo y riesgo de desarrollar ENI
| Estatus tabaquismo odds ratio | (95%IC)* | p |
|---|---|---|
| Fumador activo | 4,1 (2,4-7,3) | menor 0,001 |
| Ex fumador | 1,1 (0,5-2,2) | 0,91 |
| Fumador pasivo | 2,5 (1,2-5,1) | 0,01 |
| Fumador 1-14 CD | 2,3 (1,3-4,3) | 0,06 |
| Fumador 15-24 CD | 3,7 (1,8-7,8) | menor 0,001 |
| Fumador 25 o más CD | 5,5 (2,5-12,9) | menor 0,001 |
| Fumador 1-14 P/A | 1,5 (0,9-2,5) | 0,1 |
| Fumador 15-29 P/A | 3,0 (1,4-6,6) | 0,006 |
| Fumador 30 o más P/A | 3,2 (1,6-6,9) | 0,002 |
| Ex fumador menos de 5 años | 3,5 (1,3-9,8) | 0,02 |
| Ex fumador de 5 a 9 años | 3,7 (1,1-13,2) | 0,04 |
| Ex fumador de 10 o más años | 0,6 (0,2-1,3) | 0,18 |
| Fumador pasivo (4 o menos horas/día) | 2,4 (0,9-6,3) | 0,08 |
| Fumador pasivo (más 4 horas/día) | 3,9 (1,0-16,1) | 0,05 |
CD: cigarrillos al día; P/A: índice paquetes/año.
Otro estudio de base poblacional de características similares a este, también encontró que el consumo de tabaco era un factor de riesgo significativo para el desarrollo de ENI47. Dicho estudio observó esta asociación, con una OR de 2,6 en fumadores entre 24 y 64 años y una OR de 2,2 en fumadores mayores de 65 años. El riesgo atribuido era de 31% en el primer grupo y de 13% en el segundo47.
Definición de grupos de riesgo y propuesta de vacunaciónA la vista de los resultados de todos estos estudios se desprende que el consumo de tabaco es un factor de riesgo muy significativo para el desarrollo de enfermedad neumocócica en sus formas clínicas de NAC y ENI. Sin duda, que la mejor recomendación que le debemos hacer a un fumador para que disminuya su riesgo de padecer enfermedad neumocócica es que abandone el tabaco. Con ello podemos disminuir el riesgo de NAC un 50% al cabo de 5 años y reducir la incidencia de ENI un 14% cada año que pase sin fumar, lo que, al cabo de 10 años, lo situará al mismo nivel que en un no fumador14,38.
Pero además, este grupo de trabajo, constituido por expertos en tabaquismo de SEPAR y ALAT, ha consensuado que cabe recomendar vacunación antineumocócica en los siguientes grupos de fumadores:
- •
Grupo 1.- Fumadores sin comorbilidad y que tienen una carga de consumo de uno o más paquetes/año.
- •
Grupo 2.- Todos los fumadores, independientemente de su intensidad y/o carga de consumo, que padecen los siguientes procesos:
- •
Grupo 2. A.- Fumadores con déficits inmunitarios primarios.
- •
Grupo 2. B.- Fumadores con déficits inmunitarios secundarios a:
- •
En espera de trasplante de órgano sólido o que ya hayan sido trasplantados (6 meses después del trasplante).
- •
Tratamiento quimioterápico o radioterápico: 15 días antes de iniciar el tratamiento o 3 meses después de suspendido.
- •
Tratamiento con corticoides de forma crónica.
- •
Enfermedad renal crónica.
- •
Pacientes infectados por el HIV.
- •
Pacientes trasplantados de progenitores hematopoyéticos.
- •
Pacientes con neoplasia hematológica.
- •
Pacientes con enfermedad autoinmune o tratados con inmunosupresores o productos biológicos.
- •
Asplenia anatómica o funcional.
- •
- •
Grupo 2. C.- Fumadores con:
- •
Enfermedad hepática crónica.
- •
Enfermedad respiratoria crónica.
- •
Enfermedades crónicas del corazón.
- •
Diabetes.
- •
Fístulas del líquido cefalorraquídeo.
- •
Implantes cocleares.
- •
Alcoholismo crónico.
- •
- •
Grupo 3.- Ex fumadores de al menos un paquete/año que llevan menos de 10 años sin fumar.
El grupo de expertos quiere hacer constar que en algunos países pueden existir dificultades para implementar la vacunación en algunos de estos adultos que no pertenecen a los grupos cuya financiación está autorizada por la administración, lo que supone una dificultad añadida para extender la vacunación a estos grupos de riesgo y, seguramente, una barrera para su implementación48. No obstante, una revisión de la literatura que analizaba un grupo de estudios de evaluación económica de la vacuna polisacárida 23 valente (VNP-23) en adultos encontró que la inmunización con esta vacuna era coste/efectiva y que en algunos casos era una estrategia de ahorro de costes para la prevención de la ENI49.
En agosto del año 2014, el Advisory Committee on Immunization Practices, después de analizar los resultados preliminares del estudio CAPiTA evaluó la evidencia científica que sustentaba la utilización de vacuna conjugada 13 valente (VNC-13) en adultos utilizando el sistema GRADE (Grading of Recommendations, Assessment, Development, and Evaluation) y determinó que era de tipo 2 (nivel de evidencia moderado), por lo que la recomendación se especificó de categoría A50.
Pautas para la administración de la vacunaTeniendo en cuenta estas recomendaciones y las especificadas por otros grupos y en otros consensos, el grupo de expertos de SEPAR/ALAT ha consensuado que se debe recomendar el uso prioritario de VNC-13 con dos tipos de pautas de vacunación: una para aquellos sujetos que no estuvieran previamente vacunados con VNP-23 y otra para aquellos que ya hubieran sido vacunados con dicha formulación15–18,50–52.
- 1.
En fumadores que no hayan sido previamente vacunados
En este caso se recomienda que los sujetos de todos los grupos reciban al menos una dosis de VNC-13 y que los sujetos de los grupos 2.A y 2.B reciban una dosis de VNP-23, al menos, dos meses después de haber recibido la dosis de la VNC-13.
- 2.
En fumadores que están previamente vacunados con VNP-23
En este caso se recomienda que los sujetos de todos los grupos reciban al menos una dosis de VNC-13, transcurrido un año de haber recibido la dosis de la VNP-23. Además, los sujetos de los grupos 2.A y 2.B deberán recibir una nueva dosis de VNP-23 al menos dos meses después de haber recibido la dosis de la VNC-13, si la primera dosis de VNP-23 fue hace cinco o más años.
La financiación para este estudio se ha recibido de un beca irrestricta procedente de Pfizer para la Sociedad Española de Neumología y Cirugía Torácica, SEPAR y la Asociación Latinoaméricana del Tórax, ALAT.
Conflicto de interesesLos autores Carlos Andrés Jiménez Ruiz, Daniel Buljubasich, Raúl Sánsores, Juan Antonio Riesco Miranda, Alfredo Gueerreros Benavides, Susana Luhning, José Miguel Chatkin, Gustavo Zabert, José Ignacio de Granda Orive y Sgismundo Solano Reina no declaran conflictos de interés. El Dr. Alejandro Casas declara Advisory board Boehringer y Novartis, conferencista Boehringer, Novartis, MSD y GSK. La Dra. Pilar de Lucas Ramos declara: beca de investigación Almirall, advisory board de Almirall y Takeda, participación en reuniones de Boehringer, Pfizer y Novartis.