La real-time EndobroBronchial UltraSound-guided TransBronchial Needle Aspiration (EBUS-TBNA) ha supuesto uno de los principales hitos en la historia de la broncoscopia. En los primeros 10años de utilización se han publicado una ingente cantidad de artículos de todo tipo sobre el procedimiento y los resultados de esta técnica que han avalado su utilización en el estudio de diversas lesiones mediastínicas y pulmonares.
En el presente artículo se realiza una exhaustiva y ordenada revisión de toda la evidencia científica disponible sobre sus indicaciones más generalizadas, mediante la descripción de las características y los resultados de los estudios específicos sobre su eficacia, seguridad y coste-efectividad disponibles hasta el momento.
Este análisis demuestra que la EBUS-TBNA es una técnica segura, coste-efectiva y con una elevada validez diagnóstica para el diagnóstico y la estadificación mediastínica de pacientes con sospecha o confirmación de cáncer de pulmón, con un grado de evidencia alto. Sin embargo, se precisa de un mayor número de estudios que nos ayuden en la toma de decisiones ante un resultado negativo. La evidencia disponible sobre el papel de la EBUS-TBNA en el diagnóstico de sarcoidosis y neoplasias extratorácicas también es elevada, pero mucho menor cuando la técnica se emplea para el estudio de tuberculosis y de linfoma y para la reestadificación del cáncer de pulmón tras quimioterapia neoadyuvante. No obstante, por su alta seguridad y menor invasividad que las técnicas quirúrgicas, el grado de recomendación para emplear la EBUS-TBNA como la prueba diagnóstica inicial en estas patologías parece muy alto en la mayoría de los casos.
Real-time endobronchial ultrasound-guided transbronchial needle aspiration (EBUS-TBNA) is one of the major landmarks in the history of bronchoscopy. In the 10years since it was introduced, a vast body of literature on the procedure and its results support the use of this technique in the study of various mediastinal and pulmonary lesions.
This article is a comprehensive, systematic review of all the available scientific evidence on the more general indications for this technique. Results of specific studies on efficacy, safety and cost-effectiveness available to date are examined.
The analysis shows that EBUS-TBNA is a safe, cost-effective technique with a high grade of evidence that is a valuable tool in the diagnosis and mediastinal staging of patients with suspected or confirmed lung cancer. However, more studies are needed to guide decision-making in the case of a negative result. Evidence on the role of EBUS-TBNA in the diagnosis of sarcoidosis and extrathoracic malignancies is also high, but much lower when used in the study of tuberculosis, lymphoma and for the re-staging of lung cancer after neoadjuvant chemotherapy. Nevertheless, due to its good safety record and lack of invasiveness compared to surgical techniques, the grade of evidence for recommending EBUS-TBNA as the initial diagnostic test in patients with these diseases is very high in most cases.
Desde su comercialización, hace ya 10años, la expansión de la ecobroncoscopia lineal o sectorial con punción en tiempo real (real-time EndobroBronchial UltraSound-guided TransBronchial Needle Aspiration [EBUS-TBNA]) para el diagnóstico de enfermedades que cursan con afectación de ganglios hiliares y/o mediastínicos y/o lesiones peritraqueobronquiales ha sido probablemente el mayor hito en la historia de la broncoscopia tras la introducción de la fibrobroncoscopia1. Inicialmente dirigida al diagnóstico y a la estadificación del cáncer de pulmón2-4, pronto se demostró también su utilidad en otras patologías neoplásicas y granulomatosas que producen afectación mediastínica1,2,5. Además de evitar la realización de pruebas más invasivas, ha supuesto una influencia positiva sobre los tiempos diagnósticos y una mejor relación coste-efectividad en el diagnóstico y la estadificación del cáncer de pulmón5-8. Hay también evidencias sobre su posible papel en el drenaje de lesiones quísticas mediastínicas o pleuropericárdicas9,10, o para la valoración de patología vascular pulmonar11.
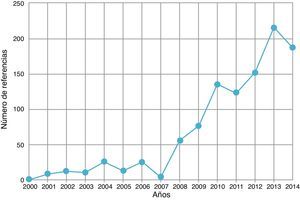
El número de publicaciones que avalan la efectividad y la seguridad de esta técnica se ha incrementado de forma exponencial (fig. 1). Existen en el momento actual numerosos metaanálisis y revisiones sistemáticas, estudios aleatorizados, de cohortes, de casos y controles, series de casos y una ingente cantidad de revisiones narrativas que abordan diversos aspectos sobre la efectividad, la eficiencia y la seguridad de esta técnica. En los últimos 5años, muchos de los estudios asocian la efectividad de la EBUS-TBNA a la de la transoEsophageal UltraSonography-guided Fine Needle Aspiration (EUS-FNA) a través de la utilización de 2 dispositivos diferentes, o bien utilizando un solo dispositivo, el ecobroncoscopio lineal, para realizar el estudio de las lesiones accediendo tanto desde la vía aérea como desde el esófago (EUS-B)12-15.
En este contexto, parece pues oportuno ordenar y resumir la evidencia científica sobre la efectividad y la eficiencia de los primeros 10años de práctica clínica de la EBUS lineal, especialmente en las indicaciones más aceptadas5.
Para ello se ha realizado una exhaustiva y ordenada revisión de todas las publicaciones incluidas en las bases de datos MEDLINE y EMBASE en relación con la EBUS lineal hasta abril de 2015, presentándose fundamentalmente en forma de tablas. Estas resumen las características y los resultados de los metaanálisis y, en su ausencia, de todos los estudios controlados o de otro tipo que abordan específicamente una patología determinada. En ellas se han incluido las variables que permiten al lector una evaluación global pero sencilla de la evidencia científica disponible sobre esta prueba diagnóstica, incluyendo la sensibilidad (S), la especificidad (E) y las razones de probabilidad positiva (RPP) y negativa (RPN), calculadas por los autores de esta revisión en muchos casos, ya que al no ser dependientes de la prevalencia permiten una mejor comparación entre los diferentes estudios que los valores predictivos16,17. En los metaanálisis se ha incluido el índice I2, que refleja el porcentaje total de variación de los resultados que se debe a la heterogeneidad de los estudios y no al azar, de forma que cuanto más se aproxime su valor al 100%, mayor será la heterogeneidad de los trabajos incluidos18. Finalmente, se resume la evidencia actual en relación con la seguridad y el análisis de coste-efectividad de esta técnica.
De forma deliberada, en esta revisión no se han incluido estudios diseñados para analizar aspectos técnicos de la EBUS-TBNA o del procesado o valor de las muestras para estudios moleculares. Sobre esto hay excelentes revisiones narrativas o documentos de consenso recientes19,20.
EBUS-TBNA en el diagnóstico y estadificación del cáncer de pulmónLa estadificación es una parte capital de la evaluación de todo paciente con cáncer de pulmón, adquiriendo un papel crucial a la hora de identificar la invasión maligna del mediastino en el cáncer de pulmón no microcítico (CPNM). En las guías de práctica clínica sobre diagnóstico y estadificación mediastínica del cáncer de pulmón, la EBUS-TBNA se considera una herramienta clave21-23, avalada por multitud de trabajos. La mayoría de ellos han sido incluidos en los 6 metaanálisis publicados hasta el momento3,4,12,13,21,24, de los que 3 consideran únicamente estudios sobre la EBUS-TBNA asociada al uso de la EUS12,13,21. Las características y los resultados de los mismos se resumen en la tabla 1, en la que se evidencia una elevada validez diagnóstica del estudio endosonográfico mediastínico en pacientes con cáncer de pulmón con un indudable valor en la toma de decisiones, máxima en el caso de resultados positivos, pero muy importante también en los negativos.
Características y resultados de los metaanálisis sobre el valor de la EBUS-TBNA en el diagnóstico y estadificación del cáncer de pulmón
| Autor, año | Estudios (n) | Pacientes (n) | S (%) | E (%) | RPP | RPN | I2 |
|---|---|---|---|---|---|---|---|
| Adams, 20093 | 10 | 995 | 88 | 100 | ∞ | 0,12 | ND |
| Gu, 20094 | 11 | 1.299 | 93 | 100 | ∞ | 0,07 | 74,4 |
| Dong, 201324 | 9 | 1.066 | 90 | 99 | 0,91 | 0,10 | 87,2 |
| Silvestri, 201321 | 26 | 2.756 | 89 | 100 | ∞ | 0,11 | ND |
| Silvestri, 201321a | 7 | 811 | 91 | 100 | ∞ | 0,09 | ND |
| Zhang, 201312a | 8 | 822 | 86 | 100 | ∞ | 0,15 | 75,7 |
| Dhooria, 201513a | 10 | 1.080 | 91 | 100 | ∞ | 0,09 | 82,4 |
E: especificidad; I2: índice I al cuadrado; ND: no disponible; RPN: razón de probabilidad negativa; RPP: razón de probabilidad positiva; S: sensibilidad.
En los 4 trabajos en los que se analizó este aspecto, se detectó una marcada heterogeneidad de los estudios incluidos, debido a las diferencias en las pruebas de referencia utilizadas, métodos de selección, diseño de los estudios, prevalencia de la enfermedad, variabilidad en la técnica y procedimiento, experiencia o posibilidad de valoración in situ por patólogos de los centros participantes2.
Aunque individualmente en los metaanálisis que analizan de forma conjunta el uso de EBUS-TBNA y EUS-FNA se demuestra una mayor S para la estrategia combinada frente a la EBUS-TBNA, al comparar directamente la S que se obtiene en los distintos trabajos (tabla 1) esto no parece observarse, lo que deja abierto el debate sobre si es necesaria la combinación de ambas técnicas de forma sistemática. Algún estudio específico muy reciente inclina la balanza hacia el estudio combinado, empezando con la EBUS-TBNA como primer procedimiento25.
La comparación directa de forma ciega entre la EBUS-TBNA y la mediastinoscopia, realizadas ambas en todos los pacientes y en diferentes escenarios, ha demostrado una eficacia diagnóstica superior o al menos similar de la primera en los 3 estudios publicados26-28 (tabla 1S, Suplemento Online).
Más que la comparación entre las diferentes técnicas, las cuestiones clave en el momento actual parecen la elección de la adecuada secuencia de ellas y la necesidad de la confirmación de resultados negativos obtenidos por las técnicas endosonográficas. El estudio ASTER14 fue el primer ensayo aleatorizado y multicéntrico que comparó la estadificación mediastínica quirúrgica con la ecoendoscópica completa, seguida de la quirúrgica si la primera era negativa, en pacientes con CPNM con adenopatías mediastínicas de diámetro superior a 10mm en la TC o con PET positivo (mediastino anormal por imagen) y en casos de tumores centrales o sospecha de afectación N1 (mediastino normal por imagen, pero sospecha elevada de N2 oculto). La S para el diagnóstico de metástasis ganglionares fue del 79% para la estadificación quirúrgica y del 94% para la ecoendoscópica, seguida de la quirúrgica si la primera era negativa. Un análisis posterior del estudio ASTER29 aplicando metodología bayesiana demostró que la probabilidad posprueba de detección de adenopatías malignas no aumenta con el abordaje endosonográfico seguido del quirúrgico frente al primero exclusivamente cuando el mediastino es normal por imagen (9% en ambos casos), pero sí en los casos de mediastino anormal por imagen (5% vs. 20%), lo que sugiere que solo deberían confirmarse quirúrgicamente los resultados negativos en este caso. Sin embargo, estos datos no han sido reproducidos en el estudio ASTER2, que incluyó pacientes con CPNM con sospecha clínica de afectación ganglionar hiliar30, lo que parece mantener abierto el debate de la necesidad de confirmación quirúrgica de resultados negativos cuando la probabilidad preprueba es baja o moderada. Diferentes estudios han demostrado que incluso con alteraciones en la TC o la PET la fiabilidad de los resultados negativos de la EBUS-TBNA varían mucho en función de una amplia serie de variables que dependen de características de la neoplasia (tipo, localización, estadio, tamaño), de las adenopatías (localización, características ecográficas, tamaño, avidez en la PET), del procedimiento (número de pases, cantidad y localización de las estaciones muestreadas, tipo de sedación), de la experiencia de los endoscopistas y patólogos, y de la calidad de la muestra obtenida31,32.
Las guías de práctica clínica más recientes, como la de la American College of Chest Phisicians (ACCP)21, la de la Sociedad Española de Patología Respiratoria (SEPAR)22 y la de la European Society of Thoracic Surgeons (ESTS)23, coinciden en incluir la EBUS-TBNA (con/sin EUS) como primera técnica para la confirmación de la afectación mediastínica del CPNM. Sin embargo, entre ellas existen aspectos poco definidos o incluso diferentes en la recomendación de la confirmación de los resultados negativos o en las indicaciones de estudio mediante EBUS-TBNA en pacientes con mediastino normal por imagen (tabla 2S Suplemento Online).
El valor de la EBUS-TBNA queda reforzado en un reciente estudio multicéntrico aleatorizado que demuestra que esta influye de forma favorable en los tiempos de diagnóstico y estadificación y la supervivencia de los pacientes con CPNM7.
EBUS-TBNA en la reestadificación del cáncer de pulmón no microcítico tras tratamiento de inducciónHasta el momento se han publicado 5 estudios específicos con esta indicación y que incluyen en total a 363 pacientes con estadios histológicos IIIA por N2 (tabla 2)33-37. Tres de ellos son estudios retrospectivos y de limitada casuística, con una marcada variabilidad en la prevalencia de afectación ganglionar mediastínica (entre el 20 y el 88%) y el valor predictivo negativo de la EBUS-TBNA (entre el 22 y el 94%), más alto en los casos de menor incidencia de enfermedad N2 tras el tratamiento. De forma general, en comparación con su valor en la estadificación inicial del CPNM, la EBUS-TBNA presenta en estos casos una S global más baja, una E y una RPP similares, salvo en uno de los trabajos, y una RPN que hace que la probabilidad posprueba pueda seguir siendo alta tras un resultado negativo. Solo en el estudio de Szlubowski et al.37 se analizó la eficacia conjunta de la EBUS y el EUS.
Características y resultados de los estudios que analizan la validez diagnóstica de la EBUS-TBNA en la reestadificación del cáncer de pulmón tras tratamiento de inducción con quimioterapia
| Autor, año | Diseño | Pacientes (n) | S (%) | E (%) | RPP | RPN |
|---|---|---|---|---|---|---|
| Herth, 200833 | Retrospectivo | 124 | 76 | 100 | ∞ | 0,24 |
| Szlubowski, 201034 | Prospectivo | 61 | 67 | 86 | 4,79 | 0,38 |
| Zielinsky, 201335 | Retrospectivo | 88 | 64 | 100 | ∞ | 0,36 |
| Nasir, 201436 | Retrospectivo | 27 | 50 | 100 | ∞ | 0,50 |
| Szlubowski, 201437 | ECA | 106 | 67 | 96 | 16,75 | 0,34 |
E: especificidad; ECA: estudio controlado aleatorizado; RPN: razón de probabilidad negativa; RPP: razón de probabilidad positiva; S: sensibilidad.
La EBUS-TBNA se ha utilizado frecuentemente para el diagnóstico de pacientes con lesiones centrales, paratraqueales o paraesofágicas no adenopáticas y sin afectación endobronquial, muchas veces tras otros estudios broncoscópicos negativos38. Se han publicado 8 trabajos específicos, casi todos series de casos retrospectivas, que incluyen un total de 393 pacientes a los que se les realizó una EBUS-TBNA con esta indicación (tabla 3)39-46. De forma general, la técnica parece mostrar una alta S, en la mayoría de los casos superior al 90%. La E únicamente se describe en 3 de ellos, en los que es del 100%, resultando una RPN que reduce de forma considerable la probabilidad preprueba.
Características y resultados de los estudios que analizan la validez diagnóstica de la EBUS-TBNA en el estudio pacientes con masas intrapulmonares
| Autor, año | Diseño | Pacientes (n) | S (%) | E (%) | RPP | RPN |
|---|---|---|---|---|---|---|
| Nakajima, 200839 | Prospectivo | 35 | 94 | 100 | ∞ | 0,06 |
| Tournoy, 200940 | Retrospectivo | 60 | 82 | ND | ND | ND |
| Zhao, 201341 | Prospectivo | 66 | 94 | 100 | ∞ | 0,06 |
| Lourido, 201342 | Retrospectivo | 24 | 96 | ND | ND | ND |
| Bhatti, 201343 | Retrospectivo | 32 | 94 | ND | ND | ND |
| Verma, 201344 | Retrospectivo | 37 | 86 | ND | ND | ND |
| Bugalho, 201345 | Prospectivo | 123 | 90 | 100 | ∞ | 0,10 |
| Dincer, 201546 | Retrospectivo | 16 | 94 | NA | ND | ND |
E: especificidad; ND: no disponible; RPN: razón de probabilidad negativa; RPP: razón de probabilidad positiva; S: sensibilidad.
Hasta un 30% de tumores extrapulmonares pueden producir afectación de ganglios mediastínicos o hiliares. En un metaanálisis reciente47 del valor de la EBUS-TBNA con esta indicación, en el que se incluyen 6 estudios (533 pacientes), la S agrupada fue del 85%, la E del 99%, la RPP de 28,6 y la RPN de 0,16. Los tumores primarios más frecuentes incluidos fueron: cabeza y cuello, colorrectal, mama, renal, esofágico, gástrico, prostático y melanoma. Dos estudios posteriores a este análisis48,49 demostraron resultados similares.
EBUS-TBNA en el diagnóstico del linfomaEl valor de la EBUS para estudiar la afectación mediastínica en procesos linfoproliferativos es la indicación de mayor controversia de las descritas en la presente revisión, dada la heterogeneidad de los estudios publicados50. Se han publicado 7 trabajos específicos para el diagnóstico de linfomas, que incluyen 341 pacientes (tabla 4)51-57. El tamaño muestral y la prevalencia son variables (entre el 10 y el 66%) y los datos de validez y exactitud diagnóstica que aportan son pobres en la mayoría, con una S muy diferente entre los estudios, aunque claramente mejor en los casos de recurrencias que en los linfomas primarios, y una RPN que obligaría a confirmar los negativos. En alguno de los trabajos, el estudio mediante técnicas de citometría de flujo y la valoración inmediata por un patólogo o por comités multidisciplinares podrían ayudar a mejorar la validez de la técnica53,55,56.
Características y resultados de los estudios que analizan la validez diagnóstica de la EBUS-TBNA en el estudio pacientes con linfoma
| Autor, año | Diseño | Pacientes (n) | S (%) | E (%) | RPP | RPN |
|---|---|---|---|---|---|---|
| Kennedy, 200851 | Retrospectivo | 25 | 73 | 100 | ∞ | 0,27 |
| Steinfort, 201052 | Prospectivo | 55 | 57 | 100 | ∞ | 0,43 |
| Marshall, 201153 | Retrospectivo | 33 | 100 | ND | ND | ND |
| Iqbal, 201254 | Retrospectivo | ND | 22 en P55 en R | ND | ND | ND |
| Ko, 201355 | Prospectivo | 95 | 60 | ND | ND | ND |
| Moonim, 201356 | Prospectivo | 100 | 88 en P100 en R | 97 | 0,33 | 0,10 |
| Talebian-Yazdi, 201457 | Retrospectivo | 33 | 55 en P88 en R | ND | ND | ND |
E: especificidad; ND: no disponible; P: linfoma primario; R: recurrencia de linfoma; RPN: razón de probabilidad negativa; RPP: razón de probabilidad positiva; S: sensibilidad (incluye diagnóstico y tipificación).
Tras el cáncer de pulmón, es en el estudio de la sarcoidosis donde más evidencia existe sobre el papel de la EBUS-TBNA. Disponemos de 2 metaanálisis recientes. El primero, de Agarwal et al.58, incluye a una población seleccionada con alta sospecha previa de sarcoidosis (prevalencia≈80%), mientras que el segundo, realizado por Trisolini et al.59, minimiza el sesgo de selección al analizar estudios que incluían pacientes con sospecha por técnicas de imagen de adenopatías patológicas, independientemente de la sospecha etiológica subyacente (prevalencia≈15%). El primero reúne un total de 533 pacientes en 15 estudios, mientras que el segundo incluye 2.097 pacientes en 14 publicaciones, con 3 estudios que se hallan incluidos en ambos. La eficacia diagnóstica fue del 79% para ambos. En el segundo metaanálisis la S diagnóstica fue del 85%, con una RPN del 0,16.
Existen también un importante número de publicaciones en las que se compara la EBUS-TBNA (con/sin EUS-FNA) con otras técnicas convencionales para el estudio de sarcoidosis como la TBNA convencional (TBNAc) y la biopsia transbronquial (BTB)60. En la tabla 5 se resumen los datos de los 10 estudios disponibles hasta el momento, la mayoría prospectivos o controlados, que incluyen un total de 835 pacientes15,61-69. Aunque la EBUS-TBNA en la mayoría de ellos aporta una mayor rentabilidad diagnóstica que la TBNAc o la BTB, las diferencias son menores en los estadiosi para la TBNAc, sobre todo en adenopatías de tamaño superior a 15mm y en estaciones paratraqueales derechas o subcarinales, y en los estadiosii para la BTB15,61-69. La adición sistemática de la EUS-FNA y de las técnicas convencionales potencia de forma importante su valor diagnóstico15,61-69.
Características y resultados de los estudios que comparan la validez diagnóstica de la EBUS-TBNA con otras técnicas broncoscópicas convencionales en la sarcoidosis
| Autor, año | Diseño | Pacientes (n) | Sensibilidad | ||
|---|---|---|---|---|---|
| TBNAc | BTB | EBUS-TBNA | |||
| Oki, 200761 | Prospectivo | 15 | 93% | – | 93% |
| Nakajima, 200962 | Retrospectivo | 35 | – | 31% | 63% |
| Tremblay, 200963 | ECA | 50 | 54% | – | 83% |
| Navani, 201164 | Prospectivo | 40 | – | 31% | 82% |
| Plit, 201265 | Retrospectivo | 37 | – | 78% | 84% |
| Von Bartheld, 201315 | ECA | 304 | – | 53% | 66%a |
| Oki, 201266 | Prospectivo | 62 | – | 37% | 94% |
| Gupta, 201467 | ECA | 130 | 48% | 66-73% | 74,5% |
| Li, 201468 | ECA | 62 | 62% | – | 93% |
| Gnass, 201569 | ECA | 100 | 59% | – | 77%a |
BTB: biopsia transbronquial; ECA: estudio controlado aleatorizado; BNAc: punción transbronquial convencional.
Se han publicado 6 estudios que de forma específica analizan el papel de la EBUS-TBNA para el diagnóstico de tuberculosis que se presentan con adenopatías mediastínicas o hiliares (tabla 6)70-75. Estos trabajos, que incluyen algo más de 550 pacientes, son en su mayoría series de casos de centros individuales, salvo uno de ellos, que es un estudio multicéntrico71. La S y la RPN son muy variables (con una E y una RPP similares), y en varios de ellos mejoran de forma significativa al combinarse el estudio citológico con el adecuado procesado microbiológico convencional o por técnicas moleculares74,75.
Características y resultados de los estudios que analizan la validez diagnóstica de la EBUS-TBNA en el estudio de tuberculosis
| Autor, año | Diseño | Pacientes (n) | S (%) | E (%) | RPP | RPN |
|---|---|---|---|---|---|---|
| Lin, 200970 | Prospectivo | 75 | 58,3 | 97 | 0,33 | 0,43 |
| Navani, 201171 | Prospectivo | 156 | 94 | 100 | ∞ | 0,06 |
| Sun, 201372 | Prospectivo | 59 | 85 | 100 | ∞ | 0,15 |
| Ren, 201373 | Retrospectivo | 78 | 64,6 | 100 | ∞ | 0,35 |
| Senturk, 201474 | Prospectivo | 27 | 90,9 | 100 | ∞ | 0,09 |
| Geake, 201575 | Retrospectivo | 158 | 62 | 100 | ∞ | 0,38 |
E: especificidad; ND: no disponible; RPN: razón de probabilidad negativa; RPP: razón de probabilidad positiva; S: sensibilidad.
Casi exclusivamente centrados en el cáncer de pulmón, de forma general podríamos incluir 3 tipos de estudios.
Los primeros estarían basados en la aplicación de modelos probabilísticos teóricos en función de los resultados previamente publicados encaminados a reducir los costes y a determinar la estrategia más económica entre las alternativas disponibles (técnicas de imagen, endoscópicas o quirúrgicas), como el que se incluye en las guías NICE de 2011 para el diagnóstico y tratamiento del cáncer de pulmón76, o el estudio de un grupo danés77, con resultados favorables en general hacia la estrategia que combina PET y EBUS-TBNA.
El segundo tipo de estudios serían aquellos de coste-beneficio en los que, basándose en la propia experiencia o en la publicada, se realizan análisis económicos directos de minimización de los costes de la aplicación de la EBUS-TBNA a cohortes reales o hipotéticas de pacientes con cáncer de pulmón frente a otras estrategias convencionales o quirúrgicas de diagnóstico y estadificación. Existen al menos 7 estudios de 5 países distintos en esta línea8,78-83, resultando en 6 de ellos favorables a la EBUS-TBNA, con una variación importante en los costes evitados en función del diseño del estudio y del sistema sanitario de cada país (tabla 3S Suplemento Online). En el único en el que los costes de la mediastinoscopia fueron discretamente menores que los de la EBUS-TBNA, esta se realizaba en quirófano y con anestesia general83.
El último grupo serían estudios de coste-efectividad relacionados con la calidad de vida y la supervivencia, como el que se realizó en la cohorte de pacientes incluida en el ASTER84, realizado en el Reino Unido, Holanda y Bélgica. Los resultados fueron favorables a la EBUS-TBNA, que supone menores costes globales y mejor calidad de vida de los pacientes que las técnicas quirúrgicas.
Complicaciones de la EBUS-TBNADebido a la importante expansión de esta técnica en la última década, progresivamente se fueron comunicando de forma individual o agrupándolos en pequeñas series de casos distintas complicaciones secundarias a la realización de este procedimiento, en la mayor parte de los casos escasas y de baja gravedad. Hemos encontrado 3 trabajos que permiten extraer una información global sobre la seguridad de esta técnica.
La revisión sistemática de Von Bartheld et al.85, que incluyó a un total de 9.119 pacientes, describe un 0,14% de complicaciones graves, siendo las infecciosas y el neumotórax las más prevalentes (ambos del 0,02%), de forma predominante en pacientes con lesiones quísticas y sarcoidosis, sin describir ningún fallecimiento.
Asano et al.86, en una encuesta nacional llevada a cabo en Japón sobre la realización de la EBUS a 7.345 pacientes, refieren una prevalencia de complicaciones graves del 1,23%, siendo la más frecuente el sangrado (0,68%), seguido de las complicaciones infecciosas (mediastinitis, abscesos…) en un 0,17%, de insuficiencia respiratoria (0,07%), y por último de neumotórax (0,03%). Se registró un fallecimiento.
Por último, el registro prospectivo AQUIRE87 en 6 hospitales de Estados Unidos encuentra en 1.317 pacientes una incidencia de complicaciones graves del 1,44%, siendo en su mayoría neumotórax (0,53%), seguido de insuficiencia respiratoria (0,23%) y de sangrado (0,2%), con un fallecimiento. En este estudio se incluían también técnicas convencionales, como la BTB, que fue un factor de riesgo independiente para el desarrollo de complicaciones.
ConclusionesEn función de lo descrito en la presente revisión, parece que la EBUS-TBNA es una técnica segura, coste-efectiva y con una elevada validez diagnóstica para el diagnóstico y la estadificación mediastínica de pacientes con sospecha o confirmación de cáncer de pulmón, con un grado de evidencia alto. Sin embargo, se precisa un mayor número de estudios que nos ayuden en la toma de decisiones ante un resultado negativo.
La evidencia disponible sobre el papel de la EBUS-TBNA en el diagnóstico de sarcoidosis y neoplasias extratorácicas también es elevada, pero mucho menor cuando la técnica se emplea para el estudio de tuberculosis, de linfoma y para la reestadificación del cáncer de pulmón tras quimioterapia neoadyuvante. No obstante, por su alta seguridad y menor invasividad que las técnicas quirúrgicas, el grado de recomendación para emplear la EBUS-TBNA como la prueba diagnóstica inicial en estas patologías parece muy alto en la mayoría de los casos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses en relación con los contenidos del presente manuscrito.