El pronóstico del cáncer de pulmón (CP) está relacionado directamente con el estadio de la enfermedad al diagnóstico.
Material y métodosRealizamos TC de baja dosis (TCBD) a personas asintomáticas ≥50años, fumadores o exfumadores de ≥10 paquetes-año, sin antecedentes oncológicos. Seguimos un algoritmo de evaluación según el tamaño y la morfología de los nódulos. En los CP diagnosticados se estableció el tratamiento adecuado y el seguimiento fue de 5años.
ResultadosEstudiamos 4.951 personas (65,4% varones) con una media de edad de 56,89±5,26años; 550 presentaron nódulos. De 3.891 nódulos detectados, 692 (19,57%) fueron considerados positivos, hallando 38 tumores (36CP). En el estudio anual, 224 sujetos mostraban algún nódulo, siendo 288 (7,91%) positivos (13CP). En el 80% el control se realizó con TCBD y se indicó biopsia en el 5,8% (basal) y 7,6% (anual) de los nódulos positivos. La prevalencia fue del 0,89 y la incidencia del 0,1%. La sensibilidad, la especificidad, el VPP y el VPN en el estudio basal fueron del 92,31, del 89,54, del 6,55 y del 99,93%, respectivamente, y en el anual, del 76,92, del 95,7, del 4,52 y del 99,94%, respectivamente. Se detectaron 52 tumores (49CP), 25 (52,08%) en estadioI. La supervivencia global de los CP fue del 58,5% a los 5años, y la supervivencia cáncer específica, del 67,1% (75,8% en los pacientes quirúrgicos).
ConclusionesLa TCBD integrada en un programa elaborado de detección y evaluación de nódulos es una herramienta útil para diagnosticar CP en estadio precoz.
The prognosis of lung cancer (LC) correlates directly with the stage of the disease at the time of diagnosis.
Material and methodsWe performed low-dose CT (LDCT) in asymptomatic individuals ≥50years old, smokers or former smokers of ≥10 pack-years, with no history of cancer. We followed an evaluation algorithm, according to the size and morphology of the nodules. The appropriate treatment for the LC diagnosis was given and patients were followed up for 5years.
ResultsWe studied 4,951 individuals (65.4% males) with an average age of 56.89±5.26years; 550 presented nodules. Of the 3,891 nodules detected, 692 (19.57%) were considered positive, and 38 tumors (36LC) were identified. In the annual follow-up, nodules were found in 224 subjects, 288 (7.91%) of which were positive (13LC). In 80%, the study was performed with LDCT, and biopsy was indicated in 5.8% (baseline) and in 7.6% (annual) of the positive nodules. Prevalence was 0.89 and incidence was 0.1%. The sensitivity, specificity, PPV and NPV in the baseline study were 92.31, 89.54, 6.55 and 99.93%, respectively, and in the annual study, they were 76.92, 95.7, 4.52 and 99.94%, respectively. A total of 52 tumors were detected (49LC), 25 (52.08%) in stageI. The 5-year overall survival rate for LC was 58.5% and cancer-specific survival was 67.1% (75.8% in surgical patients).
ConclusionLDCT integrated into an elaborate nodule detection and evaluation program is a useful tool for diagnosing early-stage LC.
El cáncer de pulmón (CP) supone un importante problema de salud: es uno de los tipos de cáncer más frecuentes y el que presenta una mayor mortalidad. Su supervivencia global a los 5años no supera el 16%, pronóstico que está directamente relacionado con el estadio de la enfermedad en el momento del diagnóstico. La prevención primaria del tabaquismo es clave para reducir su incidencia, y el mayor número de casos se diagnostica entre exfumadores. Aun con esta prevención primaria y los recientes avances en el tratamiento, el diagnóstico precoz de la enfermedad es la clave para reducir su mortalidad.
El International Early Lung Cancer Action Program (I-ELCAP), estudio no aleatorizado, ya en 2006 publicaba que el 85% de los cánceres diagnosticados se encontraban en estadioI, con una supervivencia estimada a los 10años del 88%1 (del 92% si los CP en estadioI se resecaban antes del primer mes desde el diagnóstico). El National Lung Screening Trial (NLST) es el primer estudio de cribado aleatorizado en personas de alto riesgo que mostró una reducción de la mortalidad por CP: del 20,3% en el grupo cribado con TC de baja dosis (TCBD) frente la radiografía de tórax, y del 6,7% en la mortalidad global2. Estos resultados motivaron que la U.S. Preventive Services Task Force (USPSTF) recomendara en 2014 el cribado en sujetos de alto riesgo con un grado de evidencia 2B3. La European Society of Radiology (ESR) y la European Respiratory Society (ERS) mostraron en 2015 su apoyo al cribado4. Recientemente, la International Association for the Study of Lung Cancer (IASLC) ha recomendado la implementación del cribado basándose en los resultados del estudio NELSON (NEderlands-leuvens Longkanker Screenings ONderzoek) presentados en la IASLC 19th World Conference of Lung Cancer en Toronto. Confirma que el cribado con TCBD reduce la mortalidad por CP el 26% en varones y hasta el 61% en mujeres.
En España contamos con la amplia experiencia de la Clínica Universitaria de Navarra5, que también forma parte de I-ELCAP, aportando importantes contribuciones al cribado: uso de la tomografía por emisión de positrones (PET)6, valor del enfisema y la enfermedad pulmonar obstructiva crónica (EPOC)7 y creación de modelos predictivos de riesgo7,8.
Apoyando las reflexiones sobre la implementación del cribado que la Sociedad Española de Neumología y Cirugía Torácica, junto con otras sociedades, publicó en 20179, pretendemos mostrar con nuestros datos que la TCBD integrada en un protocolo estructurado permite detectar CP en estadios tempranos potencialmente curables.
Material y métodosPoblación de estudioSe incluyeron personas que entraron en el programa de cribado de CP de la Fundación IVO entre junio de 2008 y diciembre de 2012, formando parte de una cohorte internacional en el programa I-ELCAP. Cumplían los siguientes criterios: edad ≥50años, fumadores o exfumadores con un hábito acumulado de, al menos, 10paquetes-año, sin antecedentes personales de procesos oncológicos (excepto carcinomas basocelulares de piel) y sin síntomas sugestivos de CP. Todos ellos fueron voluntarios (algunos remitidos por su médico de atención primaria, la mayoría informados por otros participantes) y, tras ser informados del estudio y del riesgo de las técnicas diagnósticas, firmaron un documento de consentimiento aprobado por el comité de ética del hospital. El seguimiento de los casos de CP diagnosticados finalizó el 31 de diciembre de 2016.
Algoritmo diagnósticoTodas las exploraciones de TC se realizan con un TC helicoidal multidetector de 16 filas (Siemens Emotion 16, Erlangen, Alemania). Las imágenes se adquirieron con parámetros de baja dosis de radiación (≤120kVps y ≤30mAs) con CT Dose Index volumen ˂2,13mGy y depósito de energía DLP (Dose Length Product) en el rango de 80-100mGy*cm. El grosor de corte para parénquima pulmonar fue de 1mm y para mediastino, de 5mm.
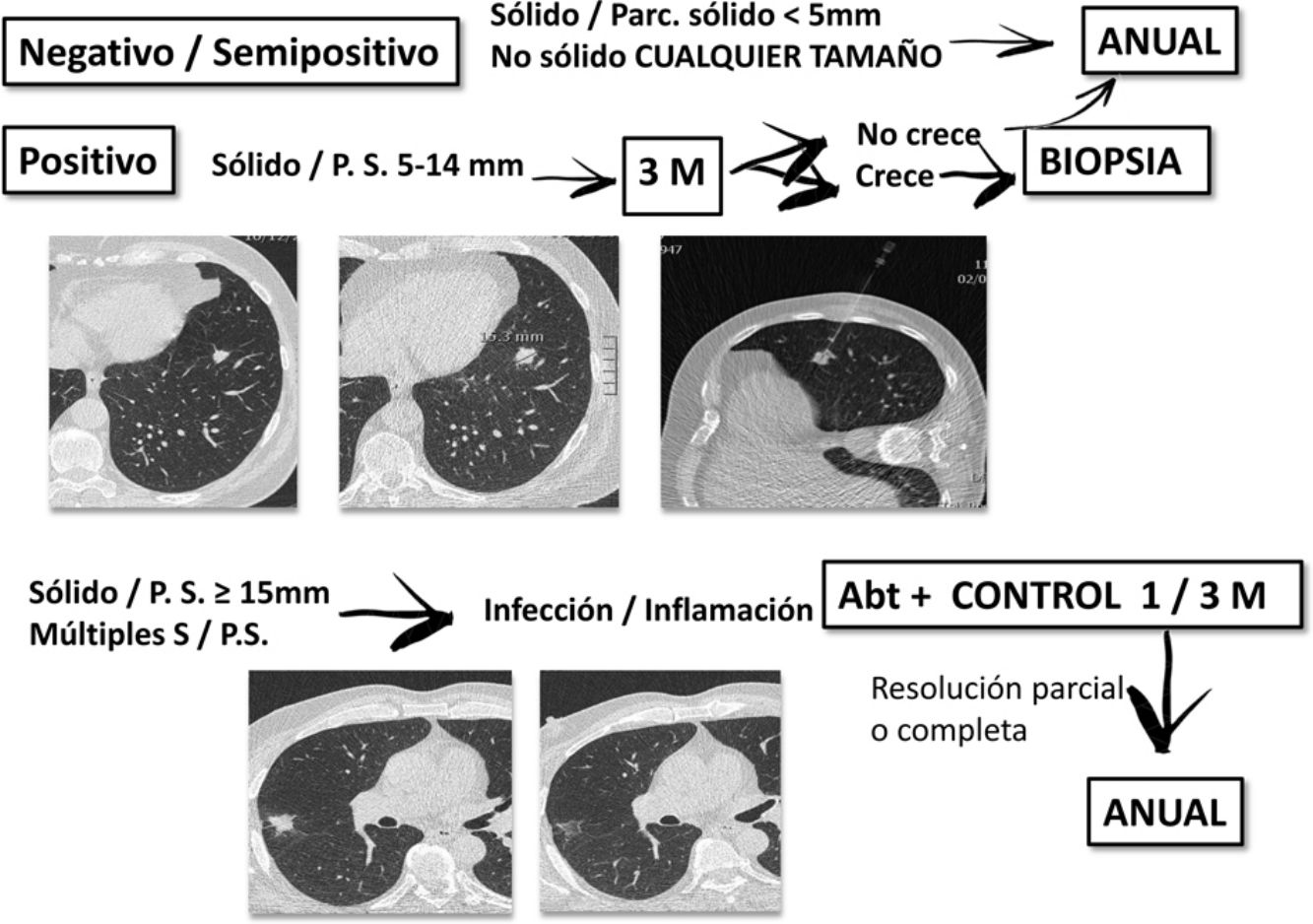
A todos los participantes se les realizó un estudio basal y, como mínimo, otro estudio al año. Siguiendo el protocolo diagnóstico de I-ELCAP (www.ielcap.org) se identificó y caracterizó los nódulos pulmonares hallados, así como otros hallazgos en tórax-abdomen superior. Se consideró el estudio basal positivo ante nódulos no calcificados (NNC) sólidos o parcialmente sólidos de ≥5mm o nódulos no sólidos ≥8mm. En dicho caso se optó por control con TCBD en 3meses, PET-TC o biopsia según criterios de tamaño o altamente sugestivos de malignidad. Si hubo sospecha de infección, se recomendó un tratamiento antibiótico y control con TCBD al mes. Si se evidenció una resolución parcial o completa, el siguiente control se realizó al año. Los casos donde el estudio basal fue dado como negativo, el siguiente control se realizó al año.
En el control anual se evaluó la aparición de nuevos nódulos, el crecimiento de los existentes y todos los parámetros del TCBD inicial. Se consideró positivo la aparición de un nódulo sólido o parcialmente sólido de ≥3mm, no sólido ≥8mm o un nódulo endobronquial sólido de ≥5mm. Se consideraron semipositivos los nódulos sólidos ˂3mm o no sólidos ˂8mm, realizando un TCBD anual. Ante nódulos sólidos entre 3 y 5mm se realizó control TCBD en 6meses. En imágenes sospechosas de un proceso infeccioso se recomendó tratamiento antibiótico. Si no se encontraron cambios ni nuevos nódulos, se indicó TCBD anual. El crecimiento de un nódulo se definió como el aumento del mismo o de su componente sólido, así como el tiempo de duplicación. Si se precisó biopsia, se eligió la mejor técnica según la localización de la lesión. La más empleada fue la punción transtorácica guiada por TC.
En los casos en que se llegó a un diagnóstico de CP se completó el estudio de extensión para estadificar la enfermedad, conocer la resecabilidad del tumor y la operabilidad del paciente. El tratamiento electivo se decidió de forma individual en consenso en el comité multidisciplinar de CP de nuestro hospital. La clasificación TNM empleada en el presente trabajo corresponde a la octava edición10.
Análisis estadísticoLas diferentes variables demográficas, radiológicas, características de los CP diagnosticados, etc., se analizaron con el paquete estadístico para Windows® SPSS® versión 22. Se realizó un análisis descriptivo y comparativo, utilizando para este el método de chi-cuadrado (χ2) o el test exacto de Fisher, la t de Student, el test U de Mann-Withney y ANOVA, o el test de correlación de Pearson para variables continuas. Para el cálculo de la supervivencia, el método de Kaplan-Meier11 y el test de log-rank12.
La tasa de prevalencia incluyó todos los casos de CP encontrados en el estudio basal y aquellos que, diagnosticados en el segundo control, eran nódulos prevalentes. La tasa de incidencia se calculó con los de nueva aparición. Los casos verdaderos positivos (VP) fueron casos CP prevalentes de cualquier estadio o casos diagnosticados en segundo control en estadioI a partir de nódulos prevalentes. Los falsos negativos (FN) fueron nódulos prevalentes que en control anual resultaron CP estadio >I y CP de intervalo. Los valores de VP y FN fueron los mismos tanto al considerar casos de CP como casos de nódulos, dado que, aunque un sujeto pueda tener más de un nódulo, y no teniendo casos de CP multicéntrico, se diagnostica como un solo CP. Los falsos positivos (FP) fueron nódulos o pacientes con nódulos positivos, según criterios radiológicos, en los que se indicó algún procedimiento diagnóstico y no resultaron CP. Los verdaderos negativos (VN) fueron los nódulos que no cumplían criterios radiológicos o sujetos que no presentaban nódulos o que, presentándolos, se mantuvieron estables o desaparecieron en el anual. Se calculó la sensibilidad (S), la especificidad (E), la precisión diagnóstica (PD), los valores predictivos positivo (VPP) y negativo (VPN), las razones de verosimilitud o cocientes de probabilidades positivo (RVP) y negativo (RVN) para caracterizar la validez de la prueba.
ResultadosIncluimos a 4.951 sujetos en el estudio (tabla 1). De ellos el 65,4% eran varones y la media de edad era de 56,89±5,26, la mediana de 56, con un rango comprendido en 50 y 79años. El consumo medio de tabaco fue de 37,45±23,41 años-paquete para los hombres y de 29,06±16,73 para las mujeres. En el estudio basal, 2.238 (45,8%) eran exfumadores.
Características de la población de estudio
| Sexo | Hombres | 3.237 (65,4%) |
| Mujeres | 1.714 (34,6%) | |
| Edad, años | 50-60 | 3.905 (78,87%) |
| 61-70 | 942 (19,02%) | |
| >70 | 104 (2,01%) | |
| Hábito tabaco | Fumadores activos | 2.713 (54,8%) |
| Exfumadores | 2.238 (45,8%) | |
| Años-paquete | Total | 34,53 |
| Hombres | 37,45 | |
| Mujeres | 29,06 | |
| Antecedentes familiares CP | Sí | 933 (18,84%) |
| No | 3.913 (79,04%) | |
| No sabe | 105 (2,12%) | |
| Contacto asbesto | Sí | 417 (8,42%) |
| Antecedentes respiratorios | Neumonía | 195 (3,94%) |
| Enfisema | 253 (5,11) | |
| Asma | 159 (3,21%) |
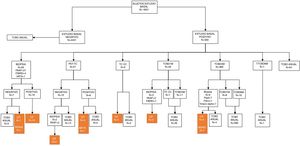
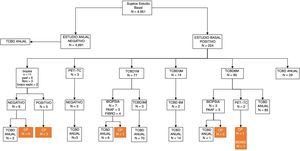
En el estudio basal, 4.401 (88,89%) sujetos presentaron un TC negativo y 550 (11,11%) mostraban uno o más nódulos que se determinaron como positivos. De 3.891 nódulos detectados, 692 cumplían criterios de positividad siguiendo el protocolo de I-ELCAP. En base a este se decidieron las pautas de seguimiento. En la mayoría de casos (80,20%) se indicó un nuevo estudio con TCBD como primera actitud, y en el 89,36% a los 3meses. En 23 (3,32%) de los casos se optó por un estudio histológico, en 21 (3,03%) por una PET-TC y en 5 casos por una broncoscopia (fig. 1). En dos casos, a pesar de una PET negativa se indicó biopsia, dado el pequeño tamaño de los nódulos y la posibilidad de FP en la PET.
En el estudio anual, excluyendo los 36 sujetos diagnosticados de tumoración pulmonar, 4.691 (95,44%) participantes presentaron una TCBD negativa y 224 (4,56%) positiva, detectando 4.081 nódulos (288 positivos). En el 79,86% de los casos positivos se indicó control con TCBD como primera opción en el 46,08% al mes, en el 47,83% a los 6meses y en 44 casos TCBD anual. Se indicó PAAF en 6, PET-TC en 3 y broncoscopia en 2. Solo en uno se indicó resección quirúrgica diagnóstica (fig. 2).
Se realizaron 40 biopsias en el estudio basal (32PAAF, 6 broncoscopias, una videocirugía y una toracotomía exploradora) y 21 en el anual (12PAAF, 7 broncoscopias y 2 toracotomías). En el total de 44 PAAF realizadas se presentaron 6 neumotórax como única complicación, de los que solo 2 precisaron drenaje. En el estudio basal, 40 (5,8%) de los 692 nódulos clasificados como positivos precisaron procedimientos invasivos. En el anual fueron el 7,3% (21/288 nódulos positivos). Diagnosticamos 38 tumores pulmonares en el estudio basal, de ellos 36CP, y 14 en el anual, de los cuales 13CP. De estos, 5 se diagnosticaron a partir de nódulos de nueva aparición. La tasa de prevalencia se estimó en el 0,89%, y la de incidencia, en el 0,1%.
Para la evaluación del programa y de la TCBD como herramienta diagnóstica calculamos la S, la E, el VPP, el VPN, la RVP y la RVN sobre individuos y sobre nódulos (tablas 2 y 3).
Evaluación de pruebas diagnósticas en el estudio TCBD basal
| Individuos | Nódulos | |||
|---|---|---|---|---|
| VP | 36 | 36 | ||
| VN | 4.398 | 2.841 | ||
| FP | 514 | 656 | ||
| FN | 3 | 3 | ||
| S (%, IC95%) | 92,31 | 78,03-97,99 | 92,31 | 78,03-97,99 |
| E (%, IC95%) | 89,54 | 88,64-90,37 | 81,24 | 79,90-82,51 |
| VPP (%, IC95%) | 6,55 | 4,69-9,03 | 5,20 | 3,72-7,20 |
| VPN (%, IC95%) | 99,93 | 99,78-99,98 | 99,89 | 99,66-99,97 |
| PD (%, IC95%) | 89,56 | 88,66-90,39 | 81,36 | 80,03-82,63 |
| RVP (n, IC95%) | 8,82 | 7,81-9,97 | 4,92 | 4,39-5,53 |
| RVN (n, IC95%) | 0,09 | 0,03-0,25 | 0,09 | 0,03-0,28 |
Evaluación de pruebas diagnósticas en el estudio TCBD anual
| Individuos | Nódulos | |||
|---|---|---|---|---|
| VP | 10 | 10 | ||
| VN | 4.691 | 3.349 | ||
| FP | 211 | 278 | ||
| FN | 3 | 3 | ||
| S (%, IC95%) | 76,92 | 45,89-93,84 | 76,92 | 45,89-93,84 |
| E (%, IC95%) | 95,70 | 95,08-96,24 | 92,34 | 91,41-93,17 |
| VPP (%, IC95%) | 4,52 | 2,32-8,41 | 3,47 | 1,77-6,49 |
| VPN (%, IC95%) | 99,94 | 99,80-99,98 | 99,91 | 99,72-99,98 |
| PD (%, IC95%) | 95,65 | 95,03-96,19 | 92,28 | 91,35-93,12 |
| RVP (n, IC95%) | 17,87 | 12,90-24,75 | 10,04 | 7,30-13,80 |
| RVN (n, IC95%) | 0,24 | 0,09-0,65 | 0,25 | 0,09-0,67 |
En el estudio basal, 692 (19,57%) fueron dados como radiológicamente positivos, y de ellos, 656 (94,8%) fueron considerados FP, tras excluir los CP. Considerando el total de nódulos no calcificados (3.536NNC), la tasa de FP fue del 18,55%. En la ronda anual los FP supusieron el 96,52% respecto los nódulos dados como positivos, y el 7,64% respecto el total de NNC.
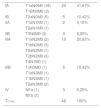
Encontramos un total de 52 tumores, 48 de ellos broncogénicos (tabla 4), una metástasis de melanoma (primario desconocido) y 3 tumores benignos (tuberculoma, histiocitosisX, aspergiloma). El 52,09% de los tumores fueron diagnosticados en estadioI (tabla 5). Cuarenta (76,92%) CP fueron sometidos a tratamiento quirúrgico. La mediana de seguimiento fue de 3,67 años (0,01 a 7,99).
Tipos histológicos de CP detectados
| Tumor carcinoide | 2 | 4,17% |
| Carcinoma epidermoide | 3 | 6,25% |
| Adenocarcinoma | 38 | 79,17% |
| Pobremente diferenciado | 3 | |
| Mixto | 9 | |
| Predominantemente papilar-acinar | 2 | |
| Predominantemente sólido | 6 | |
| Predominantemente acinar | 8 | |
| Predominantemente sólido-acinar | 4 | |
| Con diferenciación entérica | 1 | |
| Con diferenciación células claras | 1 | |
| Adenocarcinoma in situ | 4 | |
| Carcinoma adenoescamoso | 2 | 4,17% |
| Carcinoma indiferenciado | 1 | 2,08% |
| Carcinoma de células pequeñas | 2 | 4,17% |
| Total | 48 | 100% |
Estadificación de CP detectados
| IA | T1aN0M0 (18) | 20 | 41,67% |
| T1BN0M0 (2) | |||
| IB | T2aN0M0 (5) | 5 | 10,42% |
| IIA | T1aN1M0 (1) | 2 | 4,16% |
| T2aN1M0 (1) | |||
| IIB | T3N0M0 (3) | 3 | 6,25% |
| IIIA | T1aN2M0 (2) | 10 | 20,83% |
| T1bN2M0 (3) | |||
| T2aN2M0 (1) | |||
| T2bN2M0 (3) | |||
| T4N1M0 (1) | |||
| IIIB | TxN3MO (1) | 5 | 10,42% |
| T1aN3M0 (1) | |||
| T1bN3M0 (1) | |||
| T2aN3M0 (2) | |||
| IV | M1a (1) | 3 | 6,25% |
| M1b (2) | |||
| Total | 48 | 100% |
La supervivencia general de los CP detectados fue del 58,5% a los 5años, siendo del 67,1% la supervivencia cáncer específica (75,8% en los pacientes quirúrgicos y 41% en los no quirúrgicos). La supervivencia a los 5años entre los CP estadios IA fue del 89,4%, y del 80% entre los IB.
DiscusiónEste estudio presenta la TCBD como una herramienta válida para el cribado del CP, formando parte de un programa elaborado de detección precoz de nódulos pulmonares.
Existe una gran heterogeneidad entre los diferentes estudios tanto en los criterios de selección de participantes como en el diseño de los protocolos de evaluación de nódulos. Como nosotros, muchos de ellos recogen participantes voluntarios; entre ellos el NLST13, que describe el «efecto del voluntario sano» como sujetos más comprometidos con su salud y también con el programa14. Sin duda, seleccionar pacientes de mayor riesgo, cohortes con mayor prevalencia de la enfermedad, haría el cribado más rentable. Para ello, el NELSON15 seleccionó su población entre los respondedores a cuestionarios; otros estudios tienen en cuenta la existencia de EPOC/enfisema7, y los hay que utilizan modelos predictivos de riesgo que valoran múltiples factores y que, sin duda, mejoran la sensibilidad y el VPP16,17.
La proporción de nódulos considerados radiológicamente positivos en nuestro estudio fue del 19,57% en el basal y del 7,91% en el anual. Comparado con los prevalentes, los incidentes son menos frecuentes, pero con mayor probabilidad de progresar a CP. Henschke et al.1, con los mismos criterios, encuentran un 13% de nódulos positivos. La tasa del NLST18 en la primera ronda fue del 27,3%. El NELSON15 la estima en el 2,6%, aunque si tenemos en cuenta los nódulos que definen como indeterminados, a los que realizan un control con TCBD a los 3meses, es del 19,2%. En el presente estudio, el 94,8 y el 96,52% de los nódulos definidos como positivos en el estudio basal y anual, respectivamente, se podrían considerar FP, aunque relacionado con el total de NNC, supone una tasa de FP del 18,55 y del 7,64%, respectivamente. En el NLST encuentran una tasa del 96%18,19. En el NELSON, en las tres primeras rondas, sin incluir los nódulos indeterminados, de los 493 test positivos hallaron 200CP, o sea, el 64,3% de los positivos se pueden considerar FP. Ellos estiman una tasa del 3,86%20. Indudablemente, la tasa de FP depende en gran medida de cómo se defina un positivo. En opinión de los investigadores de I-ELCAP y el NELSON, un nódulo que no presente crecimiento no se debería considerar positivo.
En cualquier caso, la mayoría de los resultados positivos solo precisaron pruebas de imagen para su seguimiento. En el estudio basal, 40 (5,8%) de los 692 nódulos clasificados como positivos por la TCBD precisaron procedimientos invasivos, y en el anual, 20 (7,3%) de los 288 clasificados como positivos. Resultaron positivas el 95 y el 66% de las biopsias realizadas, lo que traduce que el protocolo de evaluación permite seleccionar muy bien aquellos que realmente requieren una biopsia. En la ronda anual, la indicación de biopsia respondía al crecimiento de nódulos existentes o aparición de nuevos (que fueron la mayoría de ellos, 275). Los nódulos incidentes son menos frecuentes que los prevalentes, pero con mayor probabilidad de malignidad. Probablemente esta fue la razón de tener un mayor número de biopsias con resultado de benignidad (o no útil para diagnóstico) en la ronda anual. En cualquier caso, las complicaciones iatrogénicas fueron escasas, ninguna grave.
Como en otras series observacionales, la tasa de prevalencia supera en mucho la de incidencia. La tasa de prevalencia (0,89%) se acerca a la presentada por P-ELCAP (1%)5, por Veronesi et al.21 (1,1%) y por el I-ELCAP (1,3%)1. Encontramos una baja tasa de incidencia (0,1%) respecto otros estudios (P-ELCAP5, 1,4%), más cercana al I-ELCAP (0,3%)1 o a la tasa de detección anual de P-ELCAP (0,41%), diferencias que podrían explicarse por los diferentes criterios de inclusión o que calculamos la tasa de incidencia solo con los nódulos de nueva aparición.
La S y la E, tanto del protocolo de evaluación considerando individuos como de la TCBD considerando nódulos, son muy altas. El VPN es un parámetro clave en cualquier programa de cribado, y en nuestro caso fue del 99,9%. El VPP definido como la probabilidad de estar enfermo cuando la prueba es positiva se situó en torno al 6,55%, dato que se reproduce en otros estudios19,22-25. Solo Henschke et al.1,26 encuentran una VPP del 11,5% en la primera ronda, que aumenta al 25% en rondas de incidencia. Es el número de FP lo que condiciona el VPP bajo. Dado la alta E y el elevado VPN hallados, un resultado negativo hace altamente improbable que el individuo esté enfermo.
La PD, entendido como porcentaje de pacientes que han sido diagnosticados correctamente, fue del 89,56 y del 95,65% en los estudios basal y anual, respectivamente. Para determinar la potencia diagnóstica utilizamos las razones de verosimilitud. La RVP que obtuvimos se puede interpretar como que es 9 o 18 veces (basal/anual) más probable encontrar un resultado positivo en un enfermo que en un sano. Esta RVP en el estudio anual indica que es una prueba muy potente que apoya fuertemente el diagnóstico. Encontramos una RVN de 0,09 en el estudio basal, que indica que es una prueba muy potente para descartar el diagnóstico. No hay publicados datos similares de otros estudios.
La prevalencia es, en definitiva, la probabilidad pre-prueba de estar enfermo. La VPP sería la probabilidad post-prueba de estar enfermo, que se sitúa entre el 5 y el 6,5%. Conocemos la tasa de prevalencia poblacional del CP (aprox. 45 por 100.000 habitantes). Luego su cociente es 111-144, lo que quiere decir que hemos multiplicado por 111-144 nuestra capacidad de detectar al enfermo.
La distribución por estadios de los CP diagnosticados es discretamente inferior a otros estudios: en el NLST el 61,6% eran estadios IA-IB2, y en el NELSON lo fueron el 70,8%27. P-ELCAP5 encuentra el 73% de los CP en estadioI. El porcentaje de estadios tempranos aumenta en rondas sucesivas (resultados no presentados).
El 76,92% de nuestros casos se sometieron a cirugía. En I-ELCAP el 85% de ellos se resecaron con una supervivencia a los 10años del 92% cuando la intervención se realizaba en el primer mes del diagnóstico1. La supervivencia cáncer-específica que encontramos fue del 67,1%, y de 75,8% en el grupo de operados. Otros estudios europeos encuentran datos similares: Bellomi et al.28 encuentran entre los CP diagnosticados en su estudio el 72% en estadioI, con una supervivencia a 5años en este grupo del 89%, siendo la global del 63%. Blanchon et al.29 encuentran una supervivencia entre los CP detectados en el grupo cribado con TC del 80%, y entre los CP en estadioI, del 88%. Estos datos resultan esperanzadores si recordamos la supervivencia global del CP en la población general.
Una de las principales limitaciones del cribado es el sobrediagnóstico, que no podemos valorar sin grupo control. Con frecuencia se confunde este con el FP. El FP es un error diagnóstico, y el sobrediagnóstico es un error de pronóstico30.
La TCBD integrada en un protocolo normalizado de evaluación con un algoritmo estudiado y definido (con criterios de inclusión delimitados, que establezca durante cuánto tiempo y con qué periodicidad se realice el cribado) es una herramienta válida de cribado porque permite diagnosticar el CP en estadios más tempranos. Es importante minimizar todas las limitaciones antes de su implementación como cribado poblacional.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.