La sarcoidosis en una enfermedad granulomatosa sistémica de etiología desconocida. La localización más frecuentemente comprometida es a nivel pulmonar, asociando compromiso extrapulmonar de forma variable. Sin embargo, la afectación pleural con o sin la presencia de derrame pleural (DP) sarcoideo, es rara1,2. Así mismo no es extraña la presencia de síntomas sistémicos inespecíficos que dificultan aún más la sospecha clínica inicial3. El diagnóstico de sospecha se establece en función de los hallazgos clínico-radiológicos con confirmación histológica donde se evidencien granulomas epitelioides no caseificantes. Los corticoides continúan siendo la base del tratamiento actual, y depende del compromiso clínico, curso progresivo y/o recaídas1, con una evolución y pronóstico variable2. Por su escasa frecuencia presentamos un caso de sarcoidosis con DP, y la importancia del diagnóstico diferencial con la infección tuberculosa.
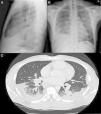
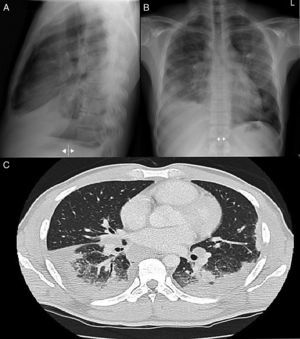
Varón de 38 años, natural de Ghana. Diagnosticado en 2003 de tuberculosis (TB) latente, sin realizar quimioprofilaxis y episodios de malaria durante la infancia. Consulta por tos con expectoración hemoptoica, disnea, dolor torácico pleurítico de 2 meses de evolución acompañado de pérdida ponderal, sin fiebre. En la exploración física destacaba hipofonesis en base derecha con crepitantes y roncus hasta campos medios bilaterales. En la radiografía de tórax se objetivaban múltiples infiltrados alveolares basales bilaterales con hilios de aspecto nodular que sugerían la presencia de adenopatías acompañado de DP derecho (figs. 1A y B). Analíticamente destaca, LDH de 134 con disminución de las proteínas y albúmina, PCR de 63mg/dl y VSG de 47. Espectro electroforético de proteínas con patrón inflamatorio sin pico monoclonal, con autoinmunidad negativa y serología para VIH y VHC negativo, con VHB y VHA pasada. ECA de 89,2 (normalidad<50). Mantoux con efecto booster negativo. En la toracocentesis se obtiene líquido seroso compatible con exudado de predominio linfocitario, ADA de 72. Las tinciones, cultivos, y técnicas moleculares específicas de micobacterias y hongos resultaron negativas; inmunofenotipo sin datos de clonalidad, mostraba importante población linfoide T con una relación CD4+/CD8+ de 4/1 (>3,5). Tras el PET/TAC tóraco-abdominal (fig. 1C) se realiza broncoscopia con biopsia transbronquial, objetivándose granulomas epitelioides necrotizantes no caseificantes. Diagnóstico final de sarcoidosis pulmonar estadio II con DP secundario.
A) Radiografía de tórax PA. B) Radiografía de tórax lateral, se observan infiltrados alveolares parcheados en LM y LSI. Derrame pleural bilateral de predominio derecho. Adenopatías hiliares y mediastínicas en rango patológico. C) Imagen axial de la TC torácica con CIV, se observa el componente adenopático en compartimentos mediastínicos, hiliares bilaterales y periesofágico. Afectación alveolar bilateral de predominio subpleural bibasal con lesiones nodulares hacinares y broncograma aéreo de distribución subpleural parcheada.
La prevalencia de DP en las distintas series de pacientes con sarcoidosis es rara, oscilando entre el 1-2%3, aunque existen datos hasta el 8-10%4,5. La afectación pleural aparece a cualquier edad, más frecuente entre los 41-60 años, sin diferencia entre sexos. Suele ser leve-moderado y habitualmente derecho (48,3%); encontrándose fundamentalmente en los estadios I y II de la enfermedad. Característicamente se presenta como exudado seroso, aunque están descritos distintos tipos, en función del mecanismo patológico que los produzca. Presenta predominio linfocitario (característicamente con una relación CD4+/CD8+ entre 2,61 y 8,6)2. En los casos descritos en la literatura2 no tenemos constancia de si previamente presentaban positividad al PPD, como ocurre en nuestro paciente, que lo negativizó durante el estudio de la clínica compatible con sarcoidosis. Este efecto conocido como «paradoja inmunológica»3, consiste en un fenómeno inmunomediado en el que, a pesar de la intensa inflamación local, se puede desarrollar anergia secundaria a una disregulación de las células T que intervienen en la inmunopatogénesis de la enfermedad.
Por tanto, en nuestro caso, con PPD positivo previo y ADA en DP intensamente elevado, interesaba descartar infección activa tuberculosa de manera fehaciente. Para ello se realizó IGRA, PCR, tinciones y cultivos a micobacterias durante 8 semanas en líquido pleural, que resultaron negativos. Baciloscopia en BAS y orina, así como biopsia pleural ciega con PCR de micobacterias, cultivos y tinciones, también negativos. A la espera de los resultados y dada la alta sospecha inicial de TB con el antecedente de TB latente no tratada, se inició terapia anti-tuberculoestática de prueba durante 10 días, sin respuesta satisfactoria. Con la obtención de los resultados microbiológicos negativos y con la alta sospecha de sarcoidosis pleuropulmonar en un paciente de raza negra, iniciamos tratamiento con corticoides. Se obtuvo mejoría clínica y analítica en los parámetros de inflamación y desaparición del DP, corroborando el diagnóstico de presunción inicial.
Por último, en nuestro paciente dado que existía constancia de la exposición previa a TB y estaba en tratamiento con corticoides se realizó quimioprofilaxis, asumiendo que la reacción cutánea PPD negativa constituía un falso negativo en relación con la modificación de la inmunidad producida por la enfermedad en sí.