Esta revisión pretende exponer de forma sucinta aquellas circunstancias clínicas previas al trasplante pulmonar que pueden repercutir negativamente en el pronóstico del trasplante a corto y largo plazo. Se plantean los métodos de rastreo y diagnóstico de comorbilidades comunes de impacto pronóstico negativo sobre el trasplante, tanto de patologías pulmonares como extrapulmonares, y se proponen medidas dirigidas a su corrección. La coordinación y el intercambio de información entre los centros que remiten a los candidatos y los centros trasplantadores permitirán detectar y corregir estas comorbilidades con el fin de minimizar los riesgos y de mejorar las expectativas de supervivencia de los pacientes trasplantados.
The aim of this review is to give an overview of the clinical circumstances presenting before lung transplant that may have negative repercussions on the long and short-term prognosis of the transplant. Methods for screening and diagnosis of common comorbidities with negative impact on the prognosis of the transplant are proposed, both for pulmonary and extrapulmonary diseases, and measures aimed at correcting these factors are discussed. Coordination and information exchange between referral centers and transplant centers would allow these comorbidities to be detected and corrected, with the aim of minimizing the risks and improving the life expectancy of transplant receivers.
El trasplante pulmonar (TP) se ha consolidado como una opción terapéutica en pacientes con enfermedad respiratoria evolucionada cuando se han agotado el resto de tratamientos disponibles. Los resultados del TP en cuanto a mejoría de la calidad de vida y también de la expectativa de vida han incrementado la demanda en las unidades de trasplante.
Los grupos de trasplante asumimos como propias las circunstancias clínicas que, aprobadas en los consensos de expertos, se erigen como contraindicaciones absolutas1,2. Sin embargo, las diferencias vienen marcadas por los riesgos que estamos dispuestos a asumir en pacientes que presentan una suma de comorbilidades con impacto pronóstico negativo tras el trasplante.
Este artículo pretende definir de forma sucinta aquellas comorbilidades que, conociéndose su relevancia en el proceso del trasplante, pueden ser detectadas y potencialmente corregidas previamente a la remisión del candidato a la unidad de trasplante o a su inclusión en lista activa. El objetivo final sería minimizar los riesgos de este procedimiento y mejorar los resultados del trasplante en términos de supervivencia y calidad de vida. Los autores creemos que la mejor metodología de trabajo para conseguir ese fin es la creación de unidades especializadas y el control multidisciplinar de estos pacientes, a semejanza de lo que ocurre con los afectados de fibrosis quística (FQ), y la colaboración entre ellas y las unidades de trasplante con la creación de protocolos de detección y manejo de comorbilidades.
Detección y manejo de comorbilidadesA la hora de la exposición didáctica de las mismas hemos determinado clasificarlas en comorbilidades pulmonares y extrapulmonares, sin que ese orden pretenda reflejar la mayor o menor prevalencia de las mismas ni su relevancia pronóstica. Estos aspectos quedarán claramente definidos en la exposición.
Comorbilidades pulmonaresControl de la infección pretrasplanteLas infecciones son una de las causas de muerte más relevantes en los pacientes trasplantados. En el periodo perioperatorio comparten protagonismo con la disfunción primaria del injerto y en estadios finales con el rechazo crónico3. Pueden ser transmitidas desde el donante, adquiridas de novo tras el trasplante o por reactivación de infecciones latentes en el receptor o por la proliferación de los patógenos previamente identificados en pacientes con infección-colonización bronquial crónica pretrasplante. Los 2 primeros puntos escapan a esta revisión.
Para evitar la reactivación de infecciones latentes es fundamental implementar los procedimientos adecuados de detección de las mismas. Entre ellos cabe destacar la valoración de la respuesta serológica al citomegalovirus (CMV), virus de Epstein-Barr (VEB), virus de la hepatitis A, B y C, virus de la inmunodeficiencia humana (VIH) y la intradermorreacción de Mantoux. Con respecto al CMV y al VEB, la serología positiva previa a la derivación del candidato no definirá ninguna actitud particular, pero para los grupos de trasplante es fundamental su conocimiento. Con ello se valorará el riesgo de enfermedad por CMV postrasplante o linfomas asociados al VEB y se implementarán las medidas preventivas y de vigilancia adecuadas.
La presencia de tuberculosis pulmonar (TB) activa contraindica el TP1,2. Aunque puede producirse como una infección de novo tras el trasplante o transmitida por el órgano donante, la TB postrasplante suele explicarse en la mayoría de los casos por la reactivación de una infección latente en el receptor. El TP es el trasplante de órgano sólido de mayor riesgo de desarrollar una TB activa4. Además de ello, la mortalidad directamente atribuible a la TB tras el TP no es despreciable, asociada fundamentalmente al retraso diagnóstico por una presentación atípica o por la falta de cumplimentación adecuada del tratamiento (toxicidad farmacológica, interacción con inmunosupresores, etc.)4,5. Por ello es fundamental detectar y tratar el estado de infección latente con la realización de la intradermorreacción de Mantoux en los candidatos a TP. Los pacientes con Mantoux positivo que van a ser incluidos en lista de espera deberían ser tratados de forma adecuada, siguiendo los criterios del documento de consenso español6. Para acortar los tiempos de tratamiento, en nuestro grupo es práctica común la profilaxis acelerada durante 3meses con isoniazida y rifampicina.
En la mayoría de los casos, los microorganismos identificados en las infecciones precoces tras el TP suelen ser los mismos patógenos colonizantes de la vía aérea previamente al TP. Por ello es fundamental minimizar su impacto con la negativización de los cultivos o, cuanto menos, el control de la supuración bronquial crónica antes del TP. Sea cual sea la patología de base, los patógenos más relevantes desde el punto de vista pronóstico son Pseudomonas aeruginosa y otros patógenos multirresistentes (Burkholderia cepacia, Achromobacter xylosoxidans, Sthenotrophomonas maltophilia y Sthaphilococcus aureus resistentes a meticilina) así como Aspergillus spp. y micobacterias no tuberculosas.
Pseudomonas aeruginosa (PsA) es el microorganismo colonizador más frecuentemente aislado en los pacientes con FQ7 y, dada la presión antibiótica continua, sistémica o nebulizada y su hipermutabilidad, es frecuente la identificación de cepas multirresistentes (multiR). Antes del trasplante, la colonización por PsA, sobre todo cepas multiR, se asocia a un rápido declinar de la función pulmonar, adelantando la indicación del TP8. El objetivo será disminuir la carga bacteriana previa al TP, optimizando la fisioterapia respiratoria y aplicando tratamiento médico para favorecer el drenaje de secreciones y antibióticos nebulizados con preparados específicos (tobramicina, colistimetato de sodio o aztreonam). Tras el trasplante, los pacientes colonizados por PsA multiR tienen una supervivencia menor cuando se compara con los colonizados por cepas no multiR9.
No hay evidencias sobre el impacto pronóstico en el TP de otros patógenos emergentes multiR. En la unidades de FQ está creciendo de forma exponencial el aislamiento de Staphylococcus aureus resistente a meticilina (SARM)7. Su presencia antes del TP se asocia con peor pronóstico10 y mayor mortalidad en los primeros 3meses tras el mismo por aumento de las infecciones del tracto respiratorio inferior con bacteriemia secundaria11. El objetivo es igualmente disminuir la carga bacteriana. Para ello se aplicarán las medidas farmacológicas y no farmacológicas antes definidas, pero sin que existan actualmente antibióticos específicos para su uso nebulizado. En la práctica clínica, en aquellos pacientes con aislamiento de SARM y mala evolución clínica es pertinente realizar un ensayo de tolerancia a vancomicina nebulizada.
Burkholderia cepacia complex (BCc) engloba 17 subespecies bacterianas con distinto grado de virulencia. Mientras que la mayoría de los genomovares de Burkholderia cepacia no tienen impacto pronóstico ni antes ni después del TP, el aislamiento repetido de BCc, genomovariii está asociado con un incremento muy significativo de la mortalidad tanto antes como después del TP, sobre todo en el primer año12,13. Ni el control de la inmunosupresión ni el tratamiento antibiótico agresivo parecen modificar, en términos generales, el mal pronóstico del trasplante en estos pacientes. Esto ha hecho que varios grupos internacionales hayan considerado la colonización crónica por BCc como una contraindicación absoluta para TP12,13. Los grupos españoles hemos considerado esta situación como una contraindicación relativa2.
El 10-25% de los pacientes con FQ presentan aislamientos de Aspergillus spp., generalmente Aspergillus fumigatus, sobre todo aquellos con menor capacidad funcional, hospitalizaciones frecuentes y con bronquiectasias muy llamativas en las exploraciones radiológicas14. Sin embargo, no está claro si esto juega un papel en el deterioro de la función pulmonar y si es necesaria una intervención terapéutica específica14,15. De entre los trasplantados de órgano sólido, el TP es el que tiene una mayor incidencia de infección fúngica invasora, aunque el aislamiento de Aspergillus spp. puede constituirse desde una simple colonización hasta una enfermedad invasora16. Por norma, se asume que su presencia pretrasplante no predice su aparición tras el TP ni empeora el pronóstico postrasplante17, pero sí parece aumentar la incidencia de traqueobronquitis aspergilar y complicaciones en la anastomosis bronquial18. Por ello, no existe un criterio uniformemente aceptado sobre la necesidad de tratamiento específico de los aislamientos repetidos de Aspergillus y cuál es la pauta más idónea. Razonablemente se debería tratar toda colonización bronquial crónica por igual, sopesando individualmente las ventajas e inconvenientes del uso de antifúngicos sistémicos y/o inhalados. Otros hongos como Scedosporium spp. son menos prevalentes, si bien muestran una alta incidencia de recurrencias tras el TP.
La prevalencia de micobacterias no tuberculosas en FQ va incrementándose de forma paralela al aumento de la edad de los pacientes y a su deterioro funcional. No todas las especies tienen el mismo comportamiento clínico19. La identificación de Mycobacterium avium complex antes del trasplante no parece asociarse a peor pronóstico tras el mismo. Mycobacterium abscessus es un patógeno muy virulento con alto riesgo de recidiva y de enfermedad invasiva tras el TP20. Por ello, se precisa de un tratamiento intensivo y cultivos negativos repetidos durante 12meses antes de incluir al paciente en lista de espera21,22.
Secuelas de procesos pleuropulmonares y deformidades torácicasLa cirugía torácica previa no supone una contraindicación para TP salvo que ocasione graves deformidades torácicas, pero sí puede complicar la cirugía del explante, aumentando el riesgo de sangrado y prolongando los tiempos de isquemia. Estas circunstancias pueden conllevar un deterioro hemodinámico y mayor riesgo de disfunción primaria del injerto. En caso de que sea necesario actuar ante un neumotórax antes del TP, es preferible evitar pleurodesis extensas y el uso de talco23.
La importancia de una TB previa en el candidato a TP, obviando el riesgo de reactivación tuberculosa, dependerá de la extensión y gravedad de las secuelas pleuropulmonares. Como normal general, el engrosamiento pleural o las adherencias pleurales no son una contraindicación en sí misma salvo que apareciera una paquipleuritis cálcica extensa. En estos casos existe un mayor riesgo de sangrado durante la cirugía por un explante difícil y de reintervención por sangrado. La presencia de asimetrías muy llamativas de tamaño entre los pulmones, por secuelas de TB, infecciones de repetición con colapsos lobares o cifoescoliosis, puede dificultar el implante en una cavidad de reducido tamaño (hilios muy posteriores con gran manipulación cardiaca, hilios retraídos o de pequeño tamaño, adenopatías calcificadas mediastínicas…).
Ventilación mecánica invasivaLa necesidad de ventilación mecánica invasiva (VMI) en un paciente que no ha sido previamente conocido por el grupo y evaluado para trasplante se considera actualmente una contraindicación para el TP2. La VMI antes del TP es un claro factor de riesgo de mortalidad tras el TP3. En aquellos pacientes en lista de espera y que, por progresión de su enfermedad o por deterioro agudo inesperado, requieran VMI, la necesidad y el riesgo del TP deben evaluarse de forma individualizada. En nuestro equipo, la experiencia acumulada y analizada en términos de supervivencia precoz y tardía nos indica que solo pacientes jóvenes, generalmente afectos de FQ y con necesidad de VMI por progresión de su enfermedad y libres de sepsis, son candidatos adecuados a TP en estas circunstancias24,25.
Hipertensión pulmonar en las patologías respiratorias crónicasLa prevalencia real de la hipertensión pulmonar (HP) en patologías respiratorias en estadio final es desconocida, ya que no suele hacerse cribado con ecocardiografía en todos los pacientes. La literatura refleja que la prevalencia aumenta con la gravedad de la enfermedad, siendo generalmente leve (menor de 30mmHg de presión media en arteria pulmonar demostrada por cateterismo derecho), salvo en un 1-3% de los pacientes con EPOC, donde puede haber una HP desproporcionada para la gravedad de la obstrucción espirométrica o de la hipoxemia en la gasometría arterial26,27. Entre los mecanismos fisiopatológicos que la explican se encuentra la hipoxia como piedra angular, pero no hay que olvidar la disfunción endotelial, el remodelado vascular pulmonar, la inflamación, la acidosis, la destrucción parenquimatosa o la hiperinflación dinámica como mecanismos interrelacionados, todos modulados por factores genéticos aún desconocidos26,27. En cualquier caso, la presencia de HP antes del TP se asocia con peor pronóstico, calidad de vida y mayor frecuencia de exacerbaciones26-28.
En los distintos consensos de expertos, su presencia es un indicador de la necesidad de listar al paciente para TP1,2. Su presencia no parece tener impacto pronóstico negativo sobre la supervivencia a largo plazo tras el TP pero sí aumenta la mortalidad en lista de espera y la mortalidad perioperatoria28-30. Estos pacientes suelen necesitar con mayor frecuencia un soporte cardiorrespiratorio exógeno, tanto previo como durante el TP, con el incremento de las complicaciones secundarias al mismo.
Comorbilidades extrapulmonaresInfecciones no pulmonaresLa sinupatía crónica, prácticamente presente en la totalidad de los pacientes con FQ, no ha sido clásicamente considerada como un factor de riesgo tras el TP. Algunos autores detectan una correlación entre la infección rinosinusal y la incidencia de traqueobronquitis y neumonías postrasplante. Igualmente sugieren la hipótesis de que el tratamiento de la sinupatía podría tener influencia positiva sobre el desarrollo del síndrome de bronquiolitis obliterante (SBO) al disminuir la inflamación y la colonización bronquial31. Esta opinión no es universalmente compartida. Otros autores comparan el pronóstico en términos de supervivencia y colonización del injerto entre pacientes con y sin cirugía de senos previa al TP y no encuentran diferencias significativas32. Ante la falta de evidencia, no parece aceptable indicar la cirugía preventiva sobre los senos paranasales de forma universal sino a aquellos pacientes en los que esté médicamente indicada.
En los documentos de consenso actuales la detección de VIH y la presencia de hepatopatía crónica por virus de hepatitis B (VHB) y C (VHC) se consideran una contraindicación absoluta para el TP1,2. Hasta ahora la exclusión de estos pacientes se debía al miedo de la progresión de la hepatopatía crónica hacia un hígado cirrótico por una inmunosupresión de alto grado, como ocurre en el TP33. Dado el buen control de la replicación de VHB alcanzado con los nuevos tratamientos, lamivudina, adefovir y entecavir, la indicación de TP en pacientes con hepatopatía crónica inactiva por VHB (antígeno de superficie positivo y ausencia de detección de replicación de VHB tras tratamiento específico) debe ser individualizada34. Aún está por definir el tratamiento antiviral más adecuado antes y después del TP, su duración, la monitorización que se precisa, la pauta de inmunosupresión en estos pacientes y las interacciones farmacológicas esperadas entre antivirales e inmunosupresores.
La ausencia de un tratamiento antiviral seguro y efectivo para el control de la hepatopatía crónica por VHC y el aumento de la incidencia de rechazo agudo postrasplante con el uso de interferón como terapia antiviral35 ha hecho que, por el momento, esta circunstancia se mantenga como una contraindicación absoluta para la mayoría de los grupos de TP1,2.
En pacientes VIH, la terapia combinada antirretroviral consigue controlar y estabilizar la replicación viral en la mayoría de los pacientes. Las publicaciones de escasos trasplantes exitosos de órganos sólidos en estos pacientes36 debe ser balanceada con la intensidad de la inmunosupresión precisada, las normativas recogidas en los documentos de consenso, la disponibilidad de órganos y los resultados a largo plazo, entre otros aspectos relevantes.
Problemas cardiovascularesLa presencia de hipertensión arterial es un factor de riesgo independiente para el desarrollo de episodios cardiovasculares en forma de enfermedad coronaria u otras enfermedades de origen ateromatoso37. Además, cuando se asocian otros factores de riesgo como la edad, el tabaquismo, le hipercolesterolemia o la diabetes, el efecto, más que sumatorio, es multiplicativo. Hoy día no supone una comorbilidad significativa para el TP pero es necesario su control estrecho tras el mismo, ya que puede incrementarse su prevalencia y la toxicidad renal por el efecto de los inmunosupresores. A modo de resumen, la hipertensión arterial, además de un factor de riesgo cardiovascular, ha sido identificada como un factor pronóstico para el desarrollo de disfunción renal tras el trasplante38,39.
Cuando hablamos de riesgo cardiovascular global nos referimos a la probabilidad de padecer un episodio coronario isquémico o una enfermedad isquémica cerebrovascular o de extremidades inferiores. Para su consideración, es necesario realizar una valoración individualizada con la detección de factores de riesgo y factores predisponentes y clasificar a los pacientes en escalas de riesgo (ecuación de Framinghan o tablas de colores)37 para establecer las medidas preventivas pertinentes. El objetivo final será minimizar la incidencia y la severidad de los episodios cardiovasculares tras el trasplante. En la actualidad esta patología supone el 10% de las causas precoces de mortalidad en TP y más del 5% de las causas tardías, incrementándose la frecuencia con la mayor supervivencia de los pacientes3.
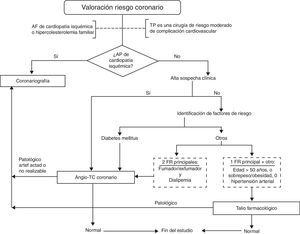
Hoy día la cardiopatía isquémica (CI), siempre que sea tratable y corregible y con función ventricular izquierda conservada, ha dejado de ser una contraindicación absoluta para el TP1,2. Su incidencia entre los candidatos a TP es muy variable, y aunque muchas enfermedades respiratorias comparten factores de riesgo cardiovasculares, la presencia de estos no parece predecir la existencia de una CI significativa40. El TP es considerado, por sí mismo, como un procedimiento de riesgo moderado para complicaciones cardiovasculares; por ser una cirugía de larga duración y con riesgo de mala oxigenación, hipovolemia e hipotensión durante el mismo41. Dado que la mortalidad perioperatoria por episodios cardiovasculares en el TP es significativa3 y la prevalencia de CI silente y grave también lo es, parece razonable establecer un protocolo de cribado en los candidatos a TP. Lo que está por definir es a quién y cómo. Valorando solo la presencia de factores de riesgo o su integración en los distintos índices de riesgo cardiovascular (ecuación de Framingham o tablas de colores) solo se detectan entre el 60 y el 65% de los pacientes en riesgo42, por lo que hay que hacer una búsqueda activa de casos. Aunque el gold standard para el diagnóstico es la angiografía, su carácter invasivo y las complicaciones intrínsecas al procedimiento limitan su generalización. Como técnicas no invasivas disponemos de aquellas que valoran las alteraciones anatómicas, como la tomografía computarizada (TC) calcio, la angio-TC coronaria o la angiorresonancia y las que valoran la función miocárdica, como la tomografía computarizada de emisión monofotónica (SPETC), la ecocardiografía o el talio farmacológico. Estas últimas están más dirigidas a evaluar el daño producido por la CI que a predecir el riesgo de futuros episodios isquémicos. Lo complejo es integrar todos los índices de riesgo con las pruebas no invasivas, fundamentalmente las que definen obstrucción coronaria, con el fin de conseguir un alto valor predictivo negativo y un ahorro de procedimientos invasivos43. La angio-TC coronaria se está erigiendo como la prueba básica para el diagnóstico de obstrucción coronaria como marcador subrogado de cardiopatía isquémica clínicamente significativa44,45. Pero además de las dificultades con la opacificación por el contraste o la presencia de calcificaciones coronarias, la interpretación de las imágenes puede verse francamente artefactada por la falta de colaboración del paciente o la imposibilidad de alcanzar una bradicardización significativa en pacientes con insuficiencia respiratoria avanzada. Por todo ello, consideramos que una propuesta práctica de cribado es la seguida por nuestro grupo de TP, la cual queda reflejada en la figura 1. Otros grupos integran la TC calcio en sus algoritmos. En esta exploración, una puntuación mayor de 400 nos informa de la necesidad de coronariografía, mientras que valores entre 100 y 400 deberían ser evaluados con angio-TC coronaria.
Un problema frecuente es convencer a los cardiólogos de la necesidad de implementar estas medidas de cribado, ya que la ausencia de clínica no descarta una obstrucción coronaria significativa. De forma similar, una obstrucción coronaria poco relevante en condiciones estándar puede tener repercusiones clínicas, en forma de arritmias o ángor, durante el estrés al que es sometido el corazón durante el TP. Por eso hay que ser activo en su búsqueda y agresivo en el tratamiento. En la población susceptible de TP no tenemos recomendaciones especiales distintas a las técnicas de repermeabilización habitualmente implantadas en los servicios de cardiología intervencionista. Solo recomendamos el uso de stents no recubiertos. Estos pueden tener mayor riesgo de oclusión tardía pero minimizan el riesgo de dehiscencias de sutura en caso de TP. La identificación y el tratamiento de la obstrucción coronaria implica antiagregación permanente, circunstancia de mayor riesgo de sangrado durante el TP pero que no necesita de tratamiento específico. Si se coloca un stent, se aconseja un periodo ventana de al menos un mes hasta su inclusión en lista de espera, tiempo suficiente para suspender la triple anticoagulación y quedar en monoterapia permanente con antiagregantes plaquetarios.
Problemas endocrino-metabólicosLa osteoporosis es muy prevalente en pacientes en lista de espera para el TP46, superando el 50% de ellos. Si bien no parece tener un impacto pronóstico directo en términos de mortalidad, sí puede condicionar la evolución tras el TP. En este periodo, la osteoporosis incrementa el riesgo de fracturas, retrasa el tratamiento fisioterápico y la incorporación del paciente a las actividades cotidianas a consecuencia del dolor. También aumenta el riesgo de enfermedad tromboembólica venosa secundario a la inmovilización. Por todo ello, es fundamental intentar predecir antes del TP el riesgo de fracturas, no solo con la realización de densitometrías óseas sino con la valoración de escalas pronósticas47 que permitan aplicar el tratamiento más adecuado a cada situación clínica.
El estado nutricional es importante como predictor pronóstico tras el TP. Con este fin, en el documento de consenso español de selección de candidatos se adjunta un anexo con un conjunto básico de datos que deberían recogerse en la historia clínica2. Entre ellos se incluyen el peso, la talla y el índice de masa corporal (IMC). La desnutrición o el bajo peso, definido como un IMC menor de 17, también se ha mostrado como un factor de mal pronóstico48,49, sobre todo en pacientes con EPOC y FQ. En estos últimos, la desnutrición incrementa la mortalidad en lista de espera50 y en el primer año tras el trasplante, sobre todo en postoperatorios complejos con estancias prolongadas en las unidades de cuidados intensivos condicionadas por un tiempo de ventilación mecánica prolongado. Por ello es necesario aplicar tantas medidas de soporte nutricional como se consideren necesarias para revertir esa situación. Se comenzará desde las más sencillas, como adecuar la ingesta proteico-calórica a las necesidades individuales hasta las más complejas como el soporte nutricional enteral oral o a través de una gastrostomía para débito continuo nocturno si es preciso. El sobrepeso previo al trasplante (IMC por encima de 25kg/m2) se considera un factor predisponente de episodios cardiovasculares37, un factor de riesgo peroperatorio para cualquier cirugía y un factor de riesgo independiente de mortalidad precoz tras el TP, con una correlación directamente proporcional al incremento del IMC48,49. Hay un estudio que correlaciona la obesidad —IMC mayor de 30— con la presencia de disfunción aguda grave del injerto tras el TP51. Al igual que la desnutrición, se deben implementar todas aquellas medidas higiénico-dietéticas y de ejercicio físico necesarias para minimizar riesgos antes de la inclusión en lista de espera.
La inmovilización o sedentarismo también se considera un factor predisponente, que no de riesgo, de episodios cardiovasculares. Además, los pacientes con una miopatía extrema de la causa que sea —falta de ejercicio físico, por insuficiencia respiratoria terminal, por esteroides o como una dimensión más de la afectación multisistémica de su enfermedad subyacente— tienen un peor pronóstico inmediato, determinado por las complicaciones secundarias a la prolongación de la ventilación mecánica invasiva tras el TP. Por ello es necesario hacer una valoración adecuada por los equipos de rehabilitación. Si es necesario, se debería completar un programa correcto de entrenamiento de músculos periféricos y respiratorios previo al TP para mejorar la fuerza muscular y la mecánica ventilatoria.
La diabetes mellitus, además de ser considerada hoy día como un equivalente isquémico y por tanto de mayor entidad que los factores clásicos de riesgo cardiovascular37, supone un factor de riesgo de mortalidad antes y después del trasplante y adelanta la indicación del mismo en pacientes con FQ3,52,53. Un estudio australiano asocia la diabetes previa al TP con un mayor número de ingresos por infecciones respiratorias y por rechazo agudo tras el TP54. El escaso número de sujetos incluidos en el estudio impide la generalización de estas conclusiones.
Las hiperlipidemias, cuya frecuencia se incrementa con la edad y la toma de esteroides, se incluyen como factor de riesgo cardiovascular cuando se identifica un exceso de colesterol total y del colesterol LDL y como factor condicionante en caso de hipertrigliceridemia. Las alternativas terapéuticas según el nivel de riesgo y de los objetivos del colesterol LDL pueden consultarse en el documento español de prevención secundaria cardiovascular37,55.
Mención especial merece la toma crónica de esteroides. Estos fármacos se utilizan con frecuencia excesiva en ocasiones, y su utilización no está apoyada en estudios fiables o incluso desaconsejados en las guías de consenso, como en la EPOC estable y la fibrosis pulmonar idiopática. Su uso no es una comorbilidad en sí, pero sí lo son las consecuencias de ello17. Entre ellas cabe destacar la osteoporosis, la necrosis avascular de cadera, la aparición de diabetes o hipertensión y la patología digestiva y neuropsiquiátrica. Las guías internacionales indican que el uso de esteroides no contraindica el TP, pero siempre se recomienda reducir al máximo la dosis administrada. El efecto en mortalidad probablemente venga condicionado por la miopatía esteroidea, agravada por la utilización de bloqueantes neuromusculares durante la anestesia y que impacta negativamente en la extubación, la rehabilitación y la salida de las unidades de cuidados intensivos. Durante la cirugía del trasplante, la fragilidad capilar y tisular que produce la toma crónica de esteroides favorece el sangrado y dificulta las anastomosis vasculares. También se argumenta que la hiperglucemia secundaria pudiera favorecer el desarrollo de infecciones graves54. No podemos definir una dosis mínima segura que garantice la ausencia de riesgo. Un estudio retrospectivo definía un punto de corte de 0,42mg/kg/m2 y día de prednisona por encima del cual empeoraba la supervivencia postoperatoria56.
Reflujo gastroesofágicoLa enfermedad por reflujo gastroesofágico (ERGE) se define como la presencia de síntomas típicos y/o presencia de complicaciones en la endoscopia digestiva alta —esofagitis, úlceras, esófago de Barret, etc.— o histología de esofagitis eosinofílica en biopsias esofágicas de mucosa ópticamente normal57. Este hallazgo histológico es característico pero no patognomónico de la ERGE. Su prevalencia es muy variable, y está presente entre el 50 y el 85% de los pacientes con enfermedades respiratorias crónicas evolucionadas58,59. Algunos autores dudan de si esta asociación es casual o causal. En la FQ es donde se ha estudiado más esta interrelación en profundidad. En ella se ha visto que el reflujo es secundario al incremento del gradiente de presión gastroesofágica por el aumento de la presión negativa inspiratoria intratorácica60. Es decir, el reflujo está aumentado en aquellas patologías que precisan un gran esfuerzo inspiratorio, condición que es común a la mayoría de los pacientes listados para TP excepto aquellos con patología primariamente vascular.
La clínica de la ERGE dependerá de la composición química del reflujo y su alcance. Mientras el reflujo ácido (gastroesofágico) cursa con síntomas clásicos, tos y broncospasmo por la activación de reflejos vagales, el reflujo biliar (duodenogastroesofágico) puede cursar sin síntomas. El riesgo del reflujo proximal, sea cual sea su composición, son las microaspiraciones crónicas, implicadas en la colonización patogénica de la vía aérea61,62 y en la respuesta inflamatoria o aloinmune tras el TP. Cada vez son mayores las publicaciones que conectan la ERGE y el síndrome de bronquiolitis obliterante (SBO), equivalente al rechazo crónico tras el TP63-65. Estas se sustentan en la identificación de la ERGE como un mecanismo activador del rechazo crónico y en las evidencias clínicas de que la corrección adecuada del reflujo frena la pérdida de función pulmonar66, retrasa el desarrollo y la gravedad del SBO67,68 y mejora la supervivencia del injerto pulmonar y de los pacientes trasplantados67.
El diagnóstico clínico es claramente insuficiente. Ni la frecuencia ni la intensidad de los síntomas son predictores del grado de esofagitis y la ausencia de los mismos no descarta la ERGE57,69. Se hace necesario investigar la función esofágica y la presencia de biomarcardores de aspiración en lavado broncoalveolar (pepsina y ácidos biliares) o datos histológicos de aspiración en el parénquima pulmonar70-72. Para realizar un estudio completo del espectro de la ERGE es necesario evaluar la presencia o no del material refluido, su composición ácida o biliar y su alcance (proximal o distal), la presencia de hernia de hiato o alteraciones endoscópicas y la actividad motora del esófago. La realidad es que la complejidad técnica de los procedimientos diagnósticos ha hecho que su implementación no se haya generalizado entre los grupos de trasplante. Cribar los pacientes exclusivamente con síntomas, manometría y medidas de pH con detección de reflujo ácido como técnicas más accesibles solo valora una parte del problema. Aun siendo esto relevante, es francamente insuficiente ya que no explora la aspiración silente del reflujo biliar.
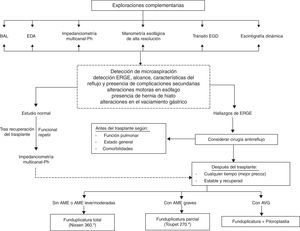
El tratamiento farmacológico de la ERGE con inhibidores de la bomba de protones es ineficaz e incluso contraproducente. El objetivo terapéutico debe ser evitar las microaspiraciones, y los fármacos inhibidores de la bomba de protones las aumentan; aumentan el reflujo no ácido y el riesgo de la colonización bacteriana al tamponar el pH gástrico73-75. Por tanto, solo los métodos de barrera o quirúrgicos son los realmente eficaces. Se asume que pacientes con ERGE y detección de biomarcadores o datos histológicos de aspiración son subsidiarios de corrección quirúrgica71,72,76. El momento de su realización, antes o después del TP, vendrá definido por el grado de deterioro de la función pulmonar y la presencia de comorbilidades. En los pacientes con insuficiencia respiratoria, cirugía abdominal previa o hipertensión pulmonar, la corrección quirúrgica pretrasplante es de alto riesgo. En cualquier caso, la intervención quirúrgica, sea cuando sea, mejorará el pronóstico en relación con pacientes con ERGE no tratada67. La corrección antes del trasplante, además de enlentecer el ritmo de deterioro funcional que provoca en la enfermedad respiratoria, concede una protección inmediata frente al SBO. Un algoritmo diagnóstico-terapéutico que pretende dar una visión global de la complejidad de la ERGE está reflejado en la figura 2. Lógicamente, cada centro tendrá que adaptarlo a sus posibilidades reales.
Algoritmo diagnóstico y terapéutico de la enfermedad por reflujo gastroesofágico.
AME: anomalías en la motilidad esofágica; AVG: alteraciones en el vaciamiento gástrico; BAL: lavado broncoalveolar; EDA: endoscopia digestiva alta; EGD: esófago-gastroduodenal; ERGE: enfermedad por reflujo gastroesofágico.
El riesgo de desarrollar neoplasias de novo en pacientes con trasplante de órganos sólidos es muy elevado comparado con la población general77,78, a excepción del cáncer de mama y del de próstata. Las neoplasias en trasplantes, de novo o por recidiva si existe una historia previa, son de rápida progresión, peor pronóstico y más refractarios al tratamiento78. Por eso es fundamental recoger la historia oncológica familiar y personal del candidato a trasplante. En la misma debe constar la estirpe histológica y su estadio, el tratamiento recibido y el tiempo libre de enfermedad. Como norma general, el riesgo de recurrencia tras el trasplante es inversamente proporcional al tiempo libre de enfermedad neoplásica antes del mismo78. Los consensos de expertos son bastantes laxos a la hora de definir el tiempo libre de enfermedad antes de incluir al paciente en lista de espera1,2, recomendando de 2 a 5años. Otras publicaciones más específicas en esta materia definen mejor esta temporalidad en virtud del tipo de tumor78. Por ejemplo, y valorando solo las neoplasias más prevalentes, se aconseja un periodo ventana de más de 3años para el cáncer de mama, 5 para el cáncer colorrectal invasivo y de cérvix y 2 para el cáncer de próstata.
Enfermedades de otros órganos y trasplantes combinadosEs frecuente identificar algún grado de hepatopatía crónica en pacientes con FQ antes del TP, sobre todo en forma de fibrosis, inflamación periportal o colestasis. Aun siendo frecuente la histología de cirrosis hepática con o sin hipertensión portal, esta no supone un impacto negativo en términos de supervivencia cuando se acomete el TP de forma aislada79. Por el contrario, la asociación de hepatopatía con una alteración nutricional grave sí es un factor de pronóstico grave79. Habrá que considerar la necesidad de trasplante hepatopulmonar combinado en pacientes con FQ y cirrosis hepática con hipertensión portal y complicaciones no controlables (ascitis, encefalopatía, etc.) o con disfunción hepatocelular grave.
En la actualidad, otros trasplantes combinados simultáneos, como el trasplante corazón-pulmón y pulmón-riñón, son excepcionales. En pacientes con hipertensión pulmonar grave con disfunción de ventrículo derecho, el soporte perioperatorio con un oxigenador de membrana extracorpórea evitará, en la mayoría de los casos salvo en cardiopatías congénitas complejas, la necesidad del trasplante cardiaco. En pacientes con bronquiectasias e infecciones de repetición y con múltiples ciclos de antibióticos nefrotóxicos habrá que valorar el grado de proteinuria y disfunción renal ante la posibilidad de amiloidosis renal que pudiera requerir además el trasplante de riñón.
En pacientes con FQ se han publicado experiencias en combinación de TP con islotes pancreáticos80 o simultáneamente páncreas-pulmón81. El objetivo sería cubrir gran parte del espectro patogénico de la FQ como es la insuficiencia pancreática exocrina y endocrina y el fracaso respiratorio. Con el trasplante simultáneo de islotes pancreáticos solo se corregían parcialmente las necesidades de insulina pero no los déficits de función del páncreas exocrino. El trasplante de páncreas-pulmón del mismo donante cadáver podría solventar esta situación. Pero el hecho de que el tratamiento farmacológico puede suplir la función del páncreas junto con el incremento del tiempo quirúrgico y de las complicaciones intrínsecas al trasplante de cada órgano ha hecho disminuir la euforia inicial.
Alteraciones psicológicas, psiquiátricas o psicosocialesEn el consenso español de candidatos a TP2 se recogen 3 circunstancias en estas esferas que, si no son corregidas adecuadamente, se constituyen como una contraindicación absoluta para trasplante: los trastornos psiquiátricos mayores, la desestructuración psicosocial o familiar que imposibilita los cuidados específicos postrasplante y la falta reiterada de adherencia al tratamiento. Trastornos menores en estos ámbitos requieren un intenso trabajo por los distintos servicios implicados para su corrección antes de la inclusión en lista de espera para TP.
ConclusiónComo conclusión final podemos decir que la detección de comorbilidades con impacto pronóstico tras el TP en pacientes candidatos a este tratamiento y la puesta en marcha de medidas dirigidas a corregirlas o controlarlas (tabla 1) es un abordaje apropiado para mejorar las expectativas de supervivencia de los pacientes trasplantados. Una buena coordinación entre los grupos de trasplante y los centros que derivan pacientes, así como un intercambio fluido de información entre las diversas especialidades implicadas, sin duda puede contribuir a mejorar las condiciones del paciente de cara al TP. El objetivo sería afrontar la cirugía con las máximas garantías posibles para conseguir una restitución plena de su estado de salud y una expectativa de vida prolongada.
Comorbilidades pretrasplante: impacto pronóstico, detección y propuestas de corrección
| Situaciones clínicas | Impacto en el trasplante | Método de detección | Propuestas de corrección |
| Comorbilidades pulmonares | |||
| Control de la infección pretrasplante | |||
| Reactivación de infecciones latentes | Enfermedad CMV y linfoma VEB | IgG e IgM de CMV, VEB | Nada especial |
| Infección tuberculosa | Riesgo TB activa con ↑mortalidad | Mantoux | Profilaxis acelerada: 3RH |
| Control de la colonización bronquial crónica | ↑ mortalidad precoz, sobre todo en multiR y recidiva | Cultivo de esputo, hongos y micobacterias atípicas | Tratamiento específico para ↓carga bacteriana |
| Secuelas de procesos pleuropulmonares y deformidades torácicas | |||
| Cirugía torácica previa | ↑ tiempo isquemia y riesgo sangrado | Técnicas de imagen | Evitar pleurodesis extensas y talco |
| Asimetrías torácicas | Implante difícil: mayor manipulación | Técnicas de imagen | Nada especial |
| Ventilación mecánica pretrasplante | ↑ mortalidad precoz | – | Evitar en la medida de lo posible |
| Hipertensión pulmonar | ↑ mortalidad en LE y perioperatoria | Ecocardiografía, cateterismo | Optimizar tratamiento: O2, SAOS |
| Comorbilidades extrapulmonares | |||
| Infecciones no pulmonares | |||
| Sinupatía crónica | ¿↑ infecciones postrasplante? | TC senos en FQ y Bq | Cirugía si hay indicación médica |
| Hepatopatía crónica por virus B | ↑ riesgo recidiva, evolución a cirrosis | PCR de VHB | Negativización con antivirales |
| Problemas cardiovasculares | |||
| Hipertensión arterial | ↑ fallo renal y patología cardiovascular | Clínica y control de factores de riesgo | Dieta y tratamiento farmacológico |
| Cardiopatía isquémica | ↑ mortalidad perioperatoria | Escalas de riesgo, angio-TC coronaria, cateterismo | Técnicas de repermeabilización pretrasplante |
| Poblemas endocrino-metabólicos | |||
| Osteoporosis | Dolor, ↑ riesgo fracturas y ETV | Densitometría, índice FRAX | Tratamiento específico pretrasplante |
| Desnutrición | ↑ mortalidad en LE y ↑ tiempo de VM | IMC, analítica, endocrinología | Soporte nutricional |
| Obesidad | ↑ muerte precoz. ¿↑disfunción precoz del injerto? | IMC, endocrinología | Control. higiénico-dietético + ejercicio |
| Inmovilización/sedentarismo | ↑ riesgo por VM prolongada | Historia clínica | Rehabilitación específica |
| Diabetes mellitus | ↑ mortalidad global y ↑patologías cardiovasculares, ¿↑infecciones y rechazo agudo? | Historia, analítica, hemoglobina glucosilada, test sobrecarga | Dieta y tratamiento farmacológico |
| Hiperlipidemias | ¿Riesgo tardío de enfermedades cardiovasculares? | Historia, analítica | Tratamiento según riesgo y objetivos |
| Toma crónica de esteroides | ↑ complicaciones específicas, ¿↑mortalidad por miopatía –↑tiempo VMI y fragilidad capilar/tisular? | Historia clínica | Valorar indicación y minimizar dosis |
| Reflujo gastroesofágico | Desarrollo precoz y grave de SBO y ↓supervivencia | BAL, manometría, pHmetría, impedanciometría, EDA, tránsito baritado | Corrección quirúrgica pretrasplante si es posible |
| Antecedentes de neoplasia | ↑ riesgo recidiva, recidiva precoz y de peor pronóstico | Antecedentes familiares y personales | Periodo ventana suficiente |
| Enfermedades de otros órganos | ↑ complejidad del trasplante | Historia y estudio específico | Trasplante de pulmón versus combinado |
| Alteraciones psicosociales | Rechazo cónico precoz por no adherencia terapéutica | Historia, estudio psicosocial | Tratamiento farmacológico y soporte psicosocial |
BAL: lavado broncoalveolar; Bq: bronquiectasias; CMV: citomegalovirus; EDA: endoscopia digestiva alta; ETV: enfermedad tromboembólica; FQ: fibrosis quística; Ig: inmunoglobulinas; IMC: índice de masa corporal; LE: lista de espera; multiR: multirresistente; PCR: reacción en cadena de la polimerasa; RH: rifampicina + isoniazida; SAOS: síndrome de apnea obstructiva del sueño; SBO: síndrome de bronquiolitis obliterante; TB: tuberculosis pulmonar; TC: tomografía computarizada; TP: trasplante pulmonar; VEB: virus de Epstein-Barr; VHB: virus de la hepatitis B; VM: ventilación mecánica; VMI: ventilación mecánica invasive.
Los autores declaran no tener ningún conflicto de intereses.