Evaluar los factores pronósticos de supervivencia en una serie de pacientes intervenidos por metástasis pulmonares de diferentes tumores y órganos.
Pacientes y métodosSe ha realizado un estudio retrospectivo de 148 pacientes intervenidos entre mayo de 2001 y mayo de 2007, y se ha aplicado un análisis multivariante para valorar la supervivencia global. Los criterios de inclusión fueron: control del tumor primario, sin recurrencia extratorácica y función cardiorrespiratoria suficiente, siempre con intención de tumorectomía. Se valoró qué influencia tenían en el pronóstico los siguientes factores: número de metástasis, diámetro de éstas, adenopatías invadidas, cirugía completa y, sobre todo, tipo histológico, para un nivel de significación del 95%.
ResultadosEn total se intervino a 90 varones (60,81%) y 58 mujeres (39,19%). La edad media ± desviación estándar era de 56,5±9,7 años. Se obtuvo una supervivencia actuarial a 6 años del 30,3% (n=45), con una mediana de supervivencia de 34 meses. Los factores que influyeron en el pronóstico fueron el número de metástasis (p<0,05), el diámetro de éstas (p<0,05), la presencia de adenopatías invadidas (p<0,05), la cirugía completa (p<0,05) y, sobre todo, el tipo histológico (p<0,05). La tumorectomía fue la intervención más realizada.
ConclusionesLos resultados avalan que aceptemos para tratamiento quirúrgico a los pacientes sin otra posibilidad terapéutica a quienes pueda realizarse una resección completa, que tengan el tumor primario controlado y no presenten otras contraindicaciones, pues, aunque en presencia de ciertos factores empeora la supervivencia, los resultados son siempre mejores que con la abstención quirúrgica, máxime si se tienen en cuenta las cifras relativamente bajas de morbilidad y mortalidad con este tipo de cirugía.
To evaluate the prognostic factors for survival in a series of patients who underwent surgery for pulmonary metastases from primary tumors in distinct organs.
Patients and methodsThis was a retrospective study of 148 patients operated between May 2001 and May 2007. Multivariate analysis was used to evaluate overall survival. Patients scheduled for tumorectomy were included provided their primary tumor was controlled and they had no extrathoracic recurrence and adequate cardiorespiratory function. The influence of the following prognostic factors was analyzed: number and diameter of the metastases, lymph node infiltration, complete resection, and, above all, histological type. A significance level of 95% was used.
ResultsA total of 90 men (60.81%) and 58 women (39.19%) were operated. The mean (SD) age was 56.5 (9.7) years. The actuarial survival at 6 years was 30.3% (n=45) and the median survival was 34 months. The factors that affected survival were the number of metastases (P<.05), diameter of the lesions (P<.05), lymph node infiltration (P<.05), complete resection (P<.05), and, above all, histological type (P<.05). Tumorectomy was the most commonly performed operation.
ConclusionsThese results suggest that, in the absence of other therapeutic options and contraindications, we should operate on patients in whom the primary tumor is controlled and in whom complete resection can be performed. Even if factors associated with poor prognosis are present, the outcomes are always better than when surgery is not performed, particularly in view of the relatively low morbidity and mortality associated with this type of surgery.
La presencia de metástasis a distancia es un signo de afectación sistémica tumoral y el principal factor pronóstico negativo. Tras el hígado, el pulmón es el órgano donde se desarrollan preferentemente las metástasis, que se presentan en el 20-54% de todos los cánceres y que pueden resecarse en el 15-25% de los casos, con lo que se consiguen supervivencias a los 5 años del 30-40%, bien con la modalidad quirúrgica sola o con quimioterapia asociada1. Los sarcomas tienen una especial predilección por metastatizar en el pulmón; la mayoría se presenta en los 2 primeros años y suele desarrollarse sin afectación adenopática2.
La primera metastasectomía se atribuye al cirujano francés Sedillot, que en 1855 resecó un tumor de pared con una metástasis pulmonar única3. En 1883 Kronlein presentó un caso intervenido cuyo origen era un sarcoma de pared y que sobrevivió 7 años4. En EE.UU., Barney y Churchill trataron en 1933 una lesión procedente de un carcinoma renal, con una supervivencia de 23 años5, y Blalock publicó en 1944 otro caso de origen colorrectal6. En 1947 Alexander y Haight presentaron la primera serie (25 casos) en que ya se incluían algunas resecciones mayores7. Thomford et al8 publicaron en 1965 los resultados de 205 metastasectomías con una supervivencia a los 5 años del 30,3%. En esa misma década aparecieron múltiples trabajos, aunque con resultados muy contradictorios debido a la heterogeneidad de las muestras.
Ante la necesidad de unificar criterios de selección de pacientes se constituyó el Registro Internacional de Metástasis Pulmonares, que en 1997 publicó sus resultados sobre 5.206 pacientes procedentes de distintos hospitales de EE.UU. y Europa9. Aunque todavía se discute el verdadero beneficio de la cirugía en este campo, generalmente se admite que la supervivencia media de los pacientes no intervenidos es de 10 meses y la tasa de supervivencia a los 5 años inferior al 5%, mientras que las series quirúrgicas recogen tasas de supervivencia del 21-43% a los 5 años10.
Algunos tumores tienen predilección por presentar metástasis pulmonares únicas, como el coriocarcinoma, el osteosarcoma, los tumores testiculares y el melanoma, y otros son los causantes de metástasis múltiples, como los sarcomas de partes blandas (85%), los de mama (60%), colon y riñón11. Hay que tener en cuenta que, cuando un paciente tiene un nódulo solitario con un tumor extratorácico conocido, la probabilidad de que sea metastático es de un 24%, y de un 3% si no se conoce el origen del primario12. Por otra parte, es infrecuente que la metástasis sea única, por lo que es necesaria una búsqueda exhaustiva, pues en caso de haber múltiples metástasis el tratamiento quirúrgico no es tan efectivo13.
Los primeros criterios para la realización de metastasectomía, descritos por Ehrenhaft en 195814, se han ampliado, de modo que el consenso actual es como sigue: a) el tumor primario debe estar controlado, lo que se comprobará con todos los medios disponibles; b) no debe haber metástasis en otros órganos (si ante otra metástasis única se decide intervenir, la pulmonar se intervendrá posteriormente); c) deben resecarse todos los nódulos, si bien no está claro el número máximo aceptado; d) las pruebas de función respiratoria deben asegurar una adecuada función pulmonar tras la intervención, y e) no debe haber contraindicaciones mayores para este tipo de cirugía9. En la actualidad hay otras indicaciones unánimemente aceptadas: a) que se pueda disponer de una efectiva quimioterapia combinada; b) la dificultad de diagnóstico entre metástasis y tumor primario; c) la inexistencia de otro tipo de tratamiento que no sea el quirúrgico, y d) metástasis pulmonares sintomáticas (hemoptisis, hemotórax, neumotórax, etc.).
Pacientes y métodosEntre mayo de 2001 y el mismo mes de 2007 se realizaron 161 intervenciones en 148 pacientes (13 de ellos fueron reintervenidos por nuevas metástasis), cuyo promedio ± desviación estándar de edad era de 56,5 ± 9,7 años (rango: 15 a 78 años) y de los que 58 eran mujeres (62 intervenciones) y 90 varones (99 intervenciones).
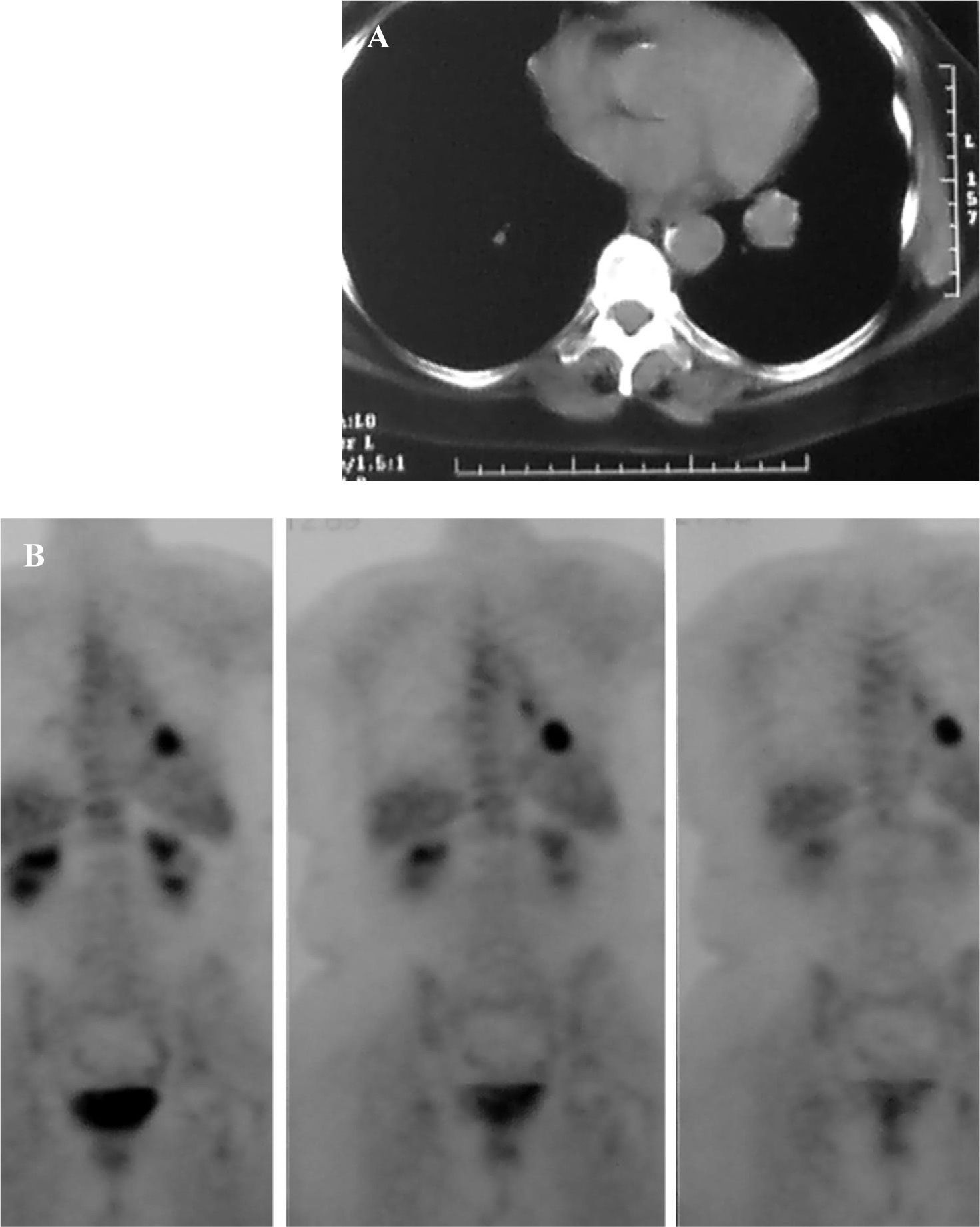
El 88% de los pacientes se encontraban asintomáticos y la metástasis se descubrió en el curso de estudios de control como consecuencia del seguimiento del tumor primario. Se realizó a todos ellos un estudio radiológico básico, que fue diagnóstico en el 93%, aunque no exacto. Se efectuó tomografía computarizada (TC) convencional en el 44% y helicoidal en el resto. La tomografía por emisión de positrones (PET), que se realizó en 16 pacientes, tuvo un importante valor predictivo negativo y resultó más efectiva para la detección de posibles adenopatías mediastínicas que para los nódulos menores de 8mm (fig. 1). Se realizó a todos los pacientes una fibrobroncoscopia para asegurarse de que no había lesiones endobronquiales. Todos tenían estudios de extensión previos según el caso (TC abdominal con contraste, PET, gammagrafía, etc.) y en ningún paciente se dejó de estudiar la función respiratoria, basada en el estudio de la capacidad vital forzada, el volumen espiratorio forzado en el primer segundo y la capacidad de difusión de monóxido de carbono. La gammagrafía de ventilación-perfusión se reservó para los casos de posible neumonectomía.
La localización del tumor primario, que para incluirlo en este estudio debía estar controlado y sin signos de recidiva, se presenta en la tabla I. El tipo de exéresis como tratamiento de las lesiones se muestra en la tabla II. La localización de las lesiones intervenidas por toracoscopia fue visual en 27 pacientes, por palpación instrumental en 17, digital en 14 (ampliando mínimamente uno de los orificios de entrada) y por colocación previa de un arpón guiado por TAC en 9, cuando la lesión era central o menor de 1cm.
Localización del tumor primario
| Colon | 50 |
| Mama | 23 |
| Osteosarcoma | 13 |
| Sarcoma de partes blandas | 10 |
| Melanoma cutáneo | 10 |
| Pulmón | 9 |
| Recto-sigma | 9 |
| Tiroides | 5 |
| Hígado | 5 |
| Riñón | 5 |
| Tumores germinales | 4 |
| Endometrio | 3 |
| Leiomiosarcoma | 3 |
| Timo | 3 |
| Teratoma maduro | 2 |
| Adenocarcinoma de páncreas | 1 |
| Esófago | 1 |
| Vejiga | 1 |
| Carcinoma de células epiteliales | 1 |
| Mucoepidermoide de parótida | 1 |
| Vesícula | 1 |
| Ovario | 1 |
La técnica quirúrgica elegida fue la resección en cuña con un margen de 1–2cm, realizada con endograpadoras (Endogia carga 3,5mm/Autosuture), que desde hace 3 años recubrimos con fundas de poliglicólico (Butress) para evitar fugas en el margen de sutura. Nunca efectuamos la enucleación. Sólo cuando la lesión era mayor de 4cm, central o multilobular optamos por la lobectomía. Si se decide practicar la resección por cirugía videotoracoscópica (metástasis única en TC y menor de 4cm, o para obtención de diagnóstico), se hacen 3 puertas de entrada: una en la línea axilar media, en los espacios 7–8; otra en la línea axilar anterior, en los espacios 3–4, y la tercera en la línea posterior, en los espacios 5–6. Cuando se realizó lobectomía por cirugía torácica asistida por vídeo (VATS) se añadió una pequeña incisión submamaria de 4–5cm. La linfadenectomía no se efectuó sistemáticamente a todos los pacientes. El criterio seguido fue, tras la exploración del espacio mediastínico, extirpar las adenopatías cuyo aspecto macroscópico era indicativo de afectación.
Hemos analizado qué influencia tienen en el pronóstico los siguientes factores: número de metástasis, diámetro de éstas, adenopatías invadidas, cirugía completa y, sobre todo, tipo histológico, para un nivel de significación del 95%.
Análisis estadísticoLa supervivencia y los datos multivariados se analizaron con el paquete estadístico BMDP (Statistical Software, Los Ángeles, California, EE.UU.). Las curvas de supervivencia se calcularon con la prueba de Kaplan-Meier y la diferencia entre grupos por rangos. Se consideraron significativos los valores de p < 0,050. Se aplicó este análisis estadístico para valorar los factores pronósticos. La prueba de Cox se utilizó en el análisis de variables múltiples.
ResultadosLas vías de abordaje utilizadas se indican en la tabla III. En cuanto al número de metástasis con demostración anatomopatológica postoperatoria, 88 eran únicas, 59 múltiples unilaterales y 14 bilaterales, con una media de 2,2 metástasis (entre 1 y 13). El tamaño medio de éstas, según el informe del anatomopatólogo, era de 2,90cm.
Vía de abordaje
| Toracotomía lateral | 79 |
| Videotoracoscopia | 58 |
| Toracotomía lateral bilateral | 11 |
| Toracotomía posterolateral | 4 |
| Cirugía torácica asistida por vídeo | 2 |
| Esternotomía media | 4 |
| Videotoracoscopia derecha y toracotomía izquierda | 1 |
| Videotoracoscopia izquierda y toracotomía derecha | 1 |
| Toracotomía anterolateral, bilateral y transesternal (clamshell) | 1 |
La estancia postoperatoria fue de 7,4 ± 3 días (rango: 4–19). Presentaron morbilidad 17 pacientes (10,6%), en general complicaciones menores, tales como 10 cámaras apicales y 6 fugas aéreas prolongadas que cedieron en su totalidad. Además, hubo un empiema que se resolvió con drenaje y un absceso de pulmón que fue una de las causas de fallecimiento, junto con una tromboembolia pulmonar y una insuficiencia hepatorrenal postoperatoria; estos 3 casos representan el 1,86%.
La supervivencia actuarial calculada a 6 años, con un seguimiento de 2–72 meses, tuvo un promedio del 30,3%. La mediana de supervivencia fue de 34 meses. Cuando la resección fue completa (n = 147), la supervivencia fue del 32,2% y cuando fue incompleta (n = 14), el 11% vivía a los 3 años y ninguno a los 5 (diferencia significativa, p = 0,003). Igualmente fue significativo el número de metástasis resecadas, ya que cuando se intervinieron menos de 4 la supervivencia media fue de 38 meses, y cuando presentaron un número mayor fue de 21 meses (p = 0,002). El diámetro de los tumores también fue significativo: cuando era menor de 3,5cm, la supervivencia media fue de 37,2 meses, frente a los 28 meses cuando el diámetro fue mayor (p = 0,004).
No obstante, el factor predictivo más importante parece ser el tipo histológico del tumor primario. Los tumores de células germinales, además de tener una magnífica respuesta a la quimioterapia, tras la cirugía presentaron una supervivencia del 66% a los 5 años, mientras que los pacientes con metástasis de melanomas sobrevivieron en el 19,3%. Habría un amplio grupo de resultados medios (mama, colon y riñón), con una supervivencia del 34,5-37,3% a los 5 años (p = 0,002).
Se hallaron adenopatías en un 26,4% de las metástasis sincrónicas (37 pacientes), que se clasificaron como N2 en 9 casos (6,4%). La supervivencia fue del 30,3% a los 5 años sin adenopatías frente al 9% cuando eran N2 (p = 0,003). Sin embargo, no encontramos diferencias entre los grupos N0-N1.
DiscusiónEn 1997 se constituyó el Grupo Internacional para el Estudio de las Metástasis Pulmonares9, formado por importantes equipos de cirugía torácica de Europa y EE.UU., con el fin de destacar ciertos factores pronósticos y calcular la supervivencia de los pacientes intervenidos por esta enfermedad. Llegaron a la conclusión de que había 3 factores pronósticos reseñables: el intervalo de tiempo sin enfermedad (peor en < 36 meses), metástasis única o múltiple, y resecabilidad. Con ellos se establecieron 4 grupos cuya mediana de supervivencia a los 5 años oscilaba entre 61 y 14 meses. Con posterioridad se han añadido otros factores, como la histología del tumor, el tipo de resección pulmonar, la afectación ganglionar y la resección completa.
Todos nuestros pacientes cumplieron con los criterios exigibles de selección: a) el tumor primario estaba controlado, lo que se comprobó con diferentes estudios radiográficos (TC, resonancia magnética, ecografía, gammagrafía, etc., según el caso), endoscópicos, analíticos (antígeno carcinoembrionario en los tumores digestivos, gonadotropina coriónica humana en los gonadales, etc.); b) no presentaban metástasis extrapulmonares, para cuya comprobación resultó eficaz la realización de una PET (sólo se aceptan en algunos casos de localización hepática en carcinomas colorrectales); c) el margen de resección era amplio o, lo que es lo mismo, cirugía completa, de modo que la supervivencia osciló entre el 63% a los 3 años y el 51% a los 5 años, frente al 33 y el 23%, respectivamente, cuando fue incompleta; d) número y tamaño de las metástasis (con una o 2 es mejor que con un número mayor, y 3cm es un tamaño valorable para establecer un pronóstico; la supervivencia fue del 48 y el 27% según fueran menores o mayores); e) la unilateralidad o bilateralidad de las lesiones no tuvo ninguna influencia15, y f) en los estudios funcionales se demostraron los criterios exigibles para realizar la intervención con éxito.
Por lo que se refiere a los factores pronósticos, en nuestra experiencia son importantes el tipo histológico (con muy buenos resultados cuando el tumor es de células germinales16 y muy malos cuando el primario es un melanoma); el período sin enfermedad (cuando es mayor de 12 meses, el pronóstico es mejor, de manera que cuando pasa de 36 ya no se considera un factor predictor)9, y la ausencia de metástasis ganglionares mediastínicas. Varios trabajos conceden un importante valor pronóstico a la existencia de diseminación linfática mediastínica17, pues su presencia conlleva una tasa de recurrencias mayor y una supervivencia inferior18, teniendo un mejor pronóstico la afectación de una sola estación ganglionar19. Sin embargo, en otras publicaciones no encuentran estas diferencias20. En nuestra casuística sí es importante.
A la hora de elegir la vía de abordaje, se considera que ésta debe cumplir las siguientes condiciones: que sea la menos agresiva; que permita, en la mayoría de los casos, la palpación manual, y que puedan realizarse todas las exéresis necesarias. Creemos que las 2 vías que cumplen con dichos requisitos son la esternotomía media, en presencia de metástasis bilaterales, y la toracotomía lateral para las de localización unilateral. Únicamente consideraríamos la toracotomía anterior bilateral con esternotomía transversa ante nódulos de localización posterior, y más en el hemitórax izquierdo, por la dificultad que presentan con una esternotomía. En este caso también puede practicarse una toracotomía lateral secuencial, con un intervalo aconsejable de 6 semanas21. Carecemos de experiencia en la realización de neumonectomía ampliada22 en este tipo de cirugía, cuyos resultados podrían aceptarse, en vista de la mejora en la supervivencia obtenida, si bien puede parecer, a priori, muy agresiva.
Sigue siendo muy discutido el papel de la videotoracoscopia en el tratamiento de metástasis unilaterales. Muchos de los trabajos que la desaconsejan se realizaron con aparatos de temprana generación. Merece destacarse el estudio de McCormack et al23, en el que se detecta un 56% de metástasis no diagnosticadas previamente. Creemos que estos criterios al menos deben revisarse hoy día, tras la aparición de aparatos de TC de nueva generación, sobre todo la TC helicoidal de corte fino. Cuando se han comparado sus resultados con los de la TC de alta resolución, su sensibilidad fue del 82,3%, frente al 75% de ésta, y para la detección de nodulos menores de 6mm fue de un 61,5%, frente al 48% con la TC de alta resolución24. Así pues, la videotoracoscopia podría utilizarse cuando el número de lesiones en los estudios preoperatorios sea inferior a 3, de localización periférica, unilaterales, de un tamaño menor de 3cm, bilaterales con fines diagnósticos y no sarcomatosas. Algunos autores han publicado sus resultados, que son iguales o mejores que con la toracotomía25. Igualmente hay que tener en cuenta que con la videotoracoscopia la afectación de la función pulmonar es menor, aunque con el tiempo se igualen. Ninomiya et al26 comprueban un descenso de la capacidad vital del 21,3% con VATS frente a un 61% tras cirugía convencional. Landrenau et al27 comparan el dolor y el ejercicio postoperatorio tras la aplicación de ambas formas de tratamiento y los resultados son mucho mejores tras la videotoracoscopia. También se ha comprobado28 que es más fácil la reintervención cuando la previa ha sido por VATS, con menos adherencias y más laxas, y con una intervención mejor tolerada29. En cualquier caso, la reintervención no ha supuesto peores resultados en cuanto a la supervivencia global, del mismo modo que en la serie de Muñoz-Llarena et al30. Por último, se ha demostrado que cuando se comprueba la presencia de lesiones unilaterales no es necesaria la exploración contralateral para detectar otras posibles metástasis31.
Si bien la localización de la lesión o lesiones resulta a veces difícil por videotoracoscopia, cuando son subpleurales es en general sencilla, ya que se manifiesta por sí sola o con alguna lesión atelectásica que la define. A veces es preciso el paso de algún instrumento de trabajo repetidas veces hasta su localización, y en ocasiones el tacto digital por una de las puertas. Se puede recurrir a la ayuda de un arpón colocado horas antes en la TC32, técnica que es habitual entre nosotros, o con inyección de azul de metileno.
En cuanto al tipo de resección quirúrgica, se debe escoger la que permita resecar el nódulo o nódulos con 1–2cm de margen y sea lo más conservadora posible con el tejido pulmonar. Cumplidas ambas condiciones, la metastasectomía puede realizarse con grapadoras mecánicas, con electrocauterio o con láser. Rolle et al33 defienden que con este último pueden efectuarse más metastasectomías que con bisturí eléctrico y grapadoras, además de realizar menos lobectomías al ser mayor la posibilidad de preservar más parénquima. Por otra parte, los pacientes sin enfermedad con metástasis recurrentes pueden beneficiarse hasta de una cuarta reintervención34.
La lobectomía sólo está indicada cuando no pueda realizarse la metastasectomía por resección incompleta, por lesiones grandes y centrales, o por múltiples lesiones lobulares. La neumonectomía sólo está indicada en casos muy seleccionados, en localizaciones centrales y de gran tamaño, o en lesiones endobronquiales, que son relativamente frecuentes cuando el origen es el colon, el riñón o la mama. Cuando la lesión es por un carcinoma hay que ser más restrictivo que si es por un sarcoma, y la supervivencia a los 5 años es del 20%35. Cuando hay adenopatías invadidas (el 28,6% de los casos), la supervivencia es menor y el tratamiento no se considera curativo.
También nos parece un factor predictivo importante el intervalo sin enfermedad, ya que, de los pacientes intervenidos con un tiempo mayor de 24 meses, el 43% continúa con vida a los 5 años, con una supervivencia de 49 meses, mientras que de los que no han superado dicho tiempo sólo el 8% sigue vivo, con un promedio de supervivencia de 29 meses (p = 0,004).
Cuando la resección es completa, con una mortalidad perioperatoria del 0,5-1%, la supervivencia a los 5 años se sitúa en el 25-35% y a los 10 años, en el 15-25%, naturalmente en los casos que presentan los indicadores pronósticos que a continuación se citan: tiempo de duplicación corto; intervalo sin enfermedad cuanto más largo, mejor (con un tiempo superior a 36 meses la supervivencia a los 5 años es mayor del 46%), y número de metástasis (mejor cuando es única ¿supervivencia del 40% a los 5 años y del 30% a los 10¿, que cuando son más de 4, con unas cifras de 25% a los 5 años y del 15% a los 10 años).
Otro factor añadido de indudable importancia es el tipo histológico: los tumores germinales son los que tienen mejor pronóstico (supervivencia de hasta un 68% a los 5 años) y los melanomas son los de peor supervivencia (un 21% a los 5 años). Los sarcomas, que suelen metastatizar en el pulmón, tienen mayor tendencia a la recidiva y son resistentes a los tratamientos conservadores, han pasado, gracias a la metastasectomía, aun repetida en 3 o 4 ocasiones, de una supervivencia del 17 al 48% tras cirugía36. Hay un amplio grupo que podríamos definir de respuesta media, cuyas cifras se encuentran entre el 38 y el 18% a los 5 y 10 años, y cuyo origen es ovarios, mama, riñón, colon, entre otros37.
Aunque la elección de un tratamiento local pueda parecer insuficiente para una enfermedad sistémica, los resultados lo avalan. Debe aceptarse a todos los pacientes a los que no pueda ofrecerse otra posibilidad terapéutica y a quienes pueda realizarse una resección completa, que tengan controlado el tumor primario y no presenten otras contraindicaciones, pues, aunque los factores pronósticos empeoran la supervivencia, los resultados son siempre mejores que con la abstención quirúrgica, y más si se tienen en cuenta las cifras relativamente bajas de morbilidad y mortalidad con este tipo de cirugía38.