El presente trabajo describe el método y la organización del trabajo del estudio COPD History Assessment in SpaiN (CHAIN), cuyo objetivo principal es evaluar a largo plazo la historia natural de una cohorte de pacientes con enfermedad pulmonar obstructiva crónica (EPOC) desde un punto de vista multidimensional y la identificación de fenotipos clínicos comparándola con otra cohorte control sin EPOC.
Pacientes y métodoCHAIN es un estudio observacional multicéntrico de cohortes prospectivas realizado en 36 hospitales españoles. Ambas cohortes se seguirán durante un periodo de 5 años con visitas completas cada 12 meses y controles telefónicos cada 6 meses para valorar las exacerbaciones y el estado vital del sujeto. El periodo de reclutamiento de casos se realizó entre el 15 de enero de 2010 y el 31 de marzo de 2012. En cada visita anual se recoge información sobre: a) aspectos clínicos (situación socioeconómica, datos antropométricos, comorbilidades, tabaquismo, clínica respiratoria, exacerbaciones, calidad de vida, escala ansiedad-depresión, actividades de la vida diaria, tratamientos); b) función respiratoria (espirometría, gasometría arterial, hiperinsuflación, difusión, presiones respiratorias); c) índice BODE (variable principal del estudio); d) función muscular periférica, y e) analítica sanguínea (incluida IgE y factores de riesgo cardiovascular). Además, se creará una seroteca para la futura determinación de biomarcadores. Los datos de los pacientes son anonimizados en una base de datos con un acceso jerárquico para garantizar la seguridad en los accesos a la información. El estudio CHAIN aportará información sobre la progresión de la EPOC y establecerá una red de investigadores para futuros proyectos relacionados con la enfermedad.
This present paper describes the method and the organization of the study known as the COPD History Assessment In SpaiN (CHAIN), whose main objective is to evaluate the long-term natural history of a chronic obstructive pulmonary disease (COPD) patient cohort from a multidimensional standpoint and to identify clinical phenotypes, in comparison with another non-COPD control cohort.
Patients and methodsCHAIN is a multicenter, observational study of prospective cohorts carried out at 36 Spanish hospitals. Both cohorts will be followed-up during a 5-year study period with complete office visits every 12 months and telephone interviews every 6 months in order to evaluate exacerbations and the vital state of the subjects. The recruitment period for cases was between 15 January 2010 and 31 March 2012. At each annual visit, information will be collected on: (i) clinical aspects (socio-economic situation, anthropometric data, comorbidities, smoking, respiratory symptoms, exacerbations, quality of life, anxiety-depression scale, daily life activities, treatments); (ii) respiratory function (spirometry, blood gases, hyperinflation, diffusion, respiratory pressures); (iii) BODE index (main study variable); (iv) peripheral muscle function, and (v) blood work-up (including IgE and cardiovascular risk factors). In addition, a serum bank will be created for the future determination of biomarkers. The data of the patients are anonymized in a database with a hierarchical access control in order to guarantee secure information access. The CHAIN study will provide information about the progression of COPD and it will establish a network of researchers for future projects related with COPD.
Los estudios que intentan valorar la evolución natural de las enfermedades crónicas son complejos, ya que requieren múltiples evaluaciones, equipos multidisciplinares y un largo periodo de seguimiento. Estas dificultades se incrementan en la enfermedad pulmonar obstructiva crónica (EPOC) por su heterogeneidad y por la pérdida importante de pacientes en su seguimiento debido a la elevada morbimortalidad de esta enfermedad. Por este motivo, el estudio de la historia natural de la EPOC constituye una de las prioridades de investigación sobre esta enfermedad y un reto de actualidad1,2.
Uno de los primero trabajos publicados sobre la historia natural de la limitación al flujo aéreo fue el de Fletcher y Peto, que ha sido una referencia para los neumólogos3. En este estudio la población analizada fueron únicamente hombres, con un periodo de seguimiento de 8 años realizado en la década de los sesenta, en la cual la espirometría no estaba bien estandarizada y no disponíamos de los fármacos actuales que han demostrado poder influir en la evolución de la enfermedad. Estudios más recientes, con un mayor tiempo de seguimiento e incluyendo mujeres, han mostrado diferencias importantes en la susceptibilidad al daño por el tabaco en relación con la pérdida del FEV14,5.
Actualmente hay en marcha otros estudios de cohortes que, con una perspectiva multidimensional y longitudinal, tienen por objetivo estudiar diversos aspectos de la enfermedad. Entre estos estudios destacan las cohortes ECLIPSE6 y PAC-EPOC7, cuyo objetivo es la posible caracterización fenotípica de la enfermedad; la cohorte BODE8, dirigida al desarrollo de la valoración multidimensional de la enfermedad; la cohorte del estudio COPDGene9, enfocada al estudio de condicionantes genéticos de la enfermedad; la cohorte de Hokkaido en Japón10, que estudia la caracterización del enfisema, o los estudios SAPALDIA 1 y 211,12, realizados en Suiza para evaluar el papel de la contaminación ambiental y las diferencias de género en el declive del FEV1.
Estos estudios descritos están aportando información muy relevante, pero como limitaciones destaca el tener por objetivo evaluar aspectos concretos de la enfermedad en lugar de toda su complejidad multidimensional, periodos de seguimiento relativamente cortos para una enfermedad crónica como la EPOC y en ocasiones tener tamaños muestrales ajustados o tomar con frecuencia al FEV1 como principal parámetro evolutivo. En este sentido, sabemos que el FEV1, aun siendo un buen parámetro pronóstico, se ha mostrado insuficiente para evaluar la heterogeneidad fenotípica de la EPOC, en la que medidas multidimensionales han demostrado ser superiores en la evaluación del pronóstico de los pacientes8.
De lo expuesto se deduce que son necesarios nuevos estudios observacionales longitudinales que nos permitan conocer cuál es la evolución natural de la enfermedad desde un punto de vista multidimensional y según fenotipos clínicos13. Con este objetivo se ha diseñado el estudio CHAIN (Chronic obstructive pulmonary disease History Assessment In SpaiN), un estudio multicéntrico nacional sobre una cohorte de pacientes fumadores con EPOC y fumadores sin EPOC (grupo control). Este artículo describe el método y la organización del estudio CHAIN.
MétodoCHAIN (clinicaltrials.gov NCT01122758) es un estudio observacional multicéntrico de cohortes prospectivas realizado en hospitales españoles en el que se seguirán 2 cohortes: a) un grupo de pacientes fumadores activos o exfumadores con EPOC (cohorte EPOC) y b) un grupo de pacientes fumadores activos o exfumadores sin EPOC (cohorte control). Ambas cohortes se seguirán durante un periodo de al menos 5años con visitas completas cada 12meses y controles telefónicos cada 6 meses para valorar el número de exacerbaciones y el estado vital del sujeto. El proyecto se encuadra dentro de los programas integrados de investigación (PII) de EPOC de la Sociedad Española de Neumología y Cirugía Torácica (SEPAR) y sus objetivos se resumen en la tabla 1.
Objetivos principales y secundarios de CHAIN
| Objetivos principales |
| Evaluación de la progresión multidimensional con un seguimiento a largo plazoCaracterización fenotípica de la EPOC |
| Objetivos secundarios |
| Progresión de la enfermedad según el grado de severidadEfecto del tratamiento sobre la progresión de la enfermedad y variabilidad de respuesta según fenotiposDiferencias geográficasImpacto de las exacerbacionesImportancia de las comorbilidades y las manifestaciones extrapulmonaresRelación de biomarcadores con la afectación pulmonar y extrapulmonar |
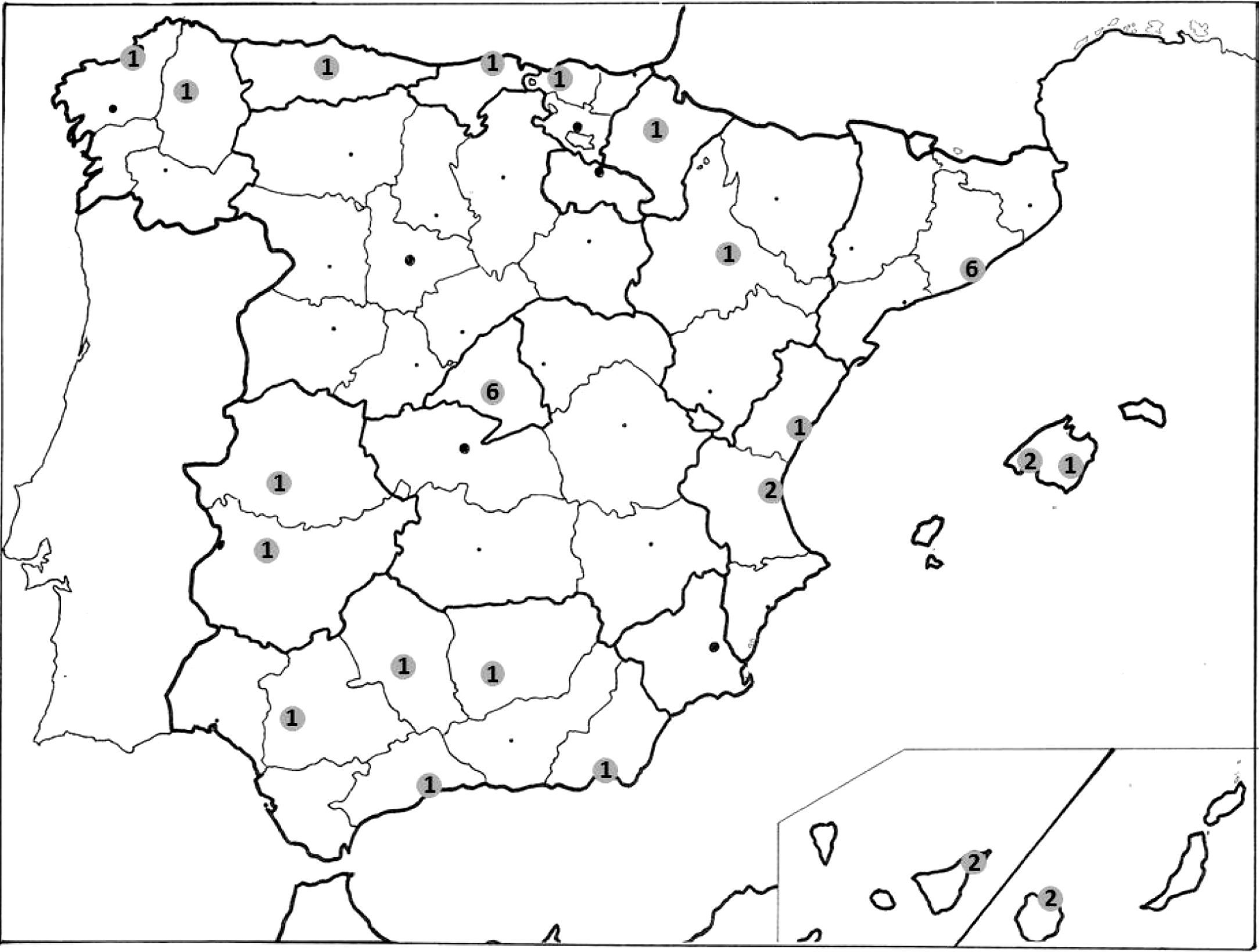
Desde el Comité Directivo del PII en EPOC de la SEPAR se contactó con miembros del área de EPOC para proponer la realización del estudio. Con este objetivo se realizó una primera reunión presencial en abril de 2009. En dicha reunión se seleccionaron los objetivos del proyecto y se seleccionó al comité científico del mismo. Durante los siguientes meses el comité científico del proyecto trabajó en el diseño de un primer borrador del estudio. Posteriormente se invitó a neumólogos con trayectoria científica en el área de la EPOC o aquellos que habían mostrado interés en participar a acudir a una reunión presencial, antes del inicio del periodo de reclutamiento, para valorar su participación en el proyecto y terminar de consensuar el protocolo de estudio. Esta reunión tuvo lugar en noviembre de 2009. En estas reuniones se decidió que hubiera un investigador principal por cada unidad participante. Tras un primer contacto con 52 hospitales, 36 centros distribuidos en 13 regiones españolas decidieron participar en el estudio (fig. 1). Posteriormente, una vez iniciado el reclutamiento de casos se realizó una tercera reunión presencial en abril de 2010 para evaluar la puesta en marcha del proyecto y valorar posibles problemas tras el inicio del reclutamiento de pacientes.
Selección de pacientesDebido a la naturaleza multidimensional del proyecto, se estableció el índice BODE8 como variable principal del estudio y base del cálculo del tamaño muestral. Considerando un error alfa del 5% y una potencia del 80%, para la comparación de progresión de índice BODE entre 2 muestras de participantes EPOC (EPOC grave versus muy grave, o EPOC leve versus moderada), ya que en el grupo de referencia el BODE es 0 por definición, y considerando una media de BODE de 3 y desviación estándar de 210, se requerirían al menos 300 participantes por grupo para detectar un incremento de 0,6 unidades o superior en el índice BODE entre grupos. Debido al número de centros participantes, se puso como referencia 50 casos y 10 controles por centro.
Los criterios de inclusión y exclusión de cada grupo de estudio se definen en la tabla 2. Los pacientes fueron reclutados de forma consecutiva de las consultas externas en una visita reglada. Los pacientes se encontraban en situación clínica estable libre de exacerbaciones por al menos 8 semanas. Se consideró que casos y controles deberían ser seleccionados apareados por edad y sexo.
Criterios de inclusión y exclusión
| Inclusión | Exclusión | |
| Cohorte EPOC | Pacientes ≥ 35 añosDiagnóstico de EPOCEstar en fase estable de la enfermedad (8 semanas sin exacerbación)Consumo acumulado ≥ 10 paquetes-añoAusencia de otra enfermedad respiratoria crónica que justifique el trastorno ventilatorioAusencia de neoplasia o comorbilidades muy grave que no permita la realización de las pruebas | No dar el consentimiento informado por escritoBronquiectasias difusas no asociadas a la EPOCImposibilidad de realizar un adecuado seguimiento (residente en otras ciudades, etc.) |
| Cohorte control | Sujetos ≥ 35 añosConsumo acumulado ≥ 10 paquetes-añoAusencia de una enfermedad respiratoria crónicaAusencia de neoplasia o comorbilidades muy grave que no permita la realización de las pruebas | No dar el consentimiento informado por escritoImposibilidad de seguimiento, por cualquier razón |
Las variables a recoger durante el seguimiento fueron consensuadas con los investigadores. Debido a que el objetivo era realizar una evaluación multidimensional de la EPOC, el número de variables tenía que ser elevado. Durante el desarrollo del método, algunas variables fueron excluidas en aras de hacer el protocolo más sencillo y viable, pero se dejó a los investigadores la posibilidad de registrarlas, por si algún grupo de investigadores deseara realizar un sub-estudio que incluyera estos datos. Tras varias sesiones de consenso las variables seleccionadas se agruparon en los siguientes aspectos: datos socioeconómicos, comorbilidades, tabaquismo, datos clínicos, tratamientos y estudios complementarios.
Los datos socioeconómicos que se registran son: estado civil, nivel de educación, ocupación, situación laboral y situación social. La ocupación laboral se recoge en un campo abierto. Además de las comorbilidades incluidas en el índice de Charlson14, se establece un amplio cuestionario para la recogida sistemática de otras comorbilidades. En el caso de la depresión y la ansiedad, estas se evalúan mediante la escala hospitalaria de ansiedad y depresión (HADS)15.
En relación con el tabaquismo, se registra si el paciente es fumador activo o exfumador, la edad de inicio y el consumo acumulado calculado en paquetes-año. Además, en cada visita se realiza una cooximetría en aire exhalado para verificar si se hubieran producido cambios en el hábito tabáquico. Las cooximetrías se realizan todas con el mismo dispositivo, un PiCO Smokerlyzer (Bedfont Scientific, Kent, Reino Unido) adquirido específicamente para este proyecto.
Los datos clínicos que se obtienen abarcan los siguientes aspectos: la fecha del diagnóstico, la presencia de síntomas respiratorios (disnea, tos, expectoración, coloración del esputo), síntomas relacionados con el sueño (roncador habitual, insomnio) y síntomas cardiológicos (presencia de edemas maleolares y ortopnea). La disnea se cuantifica mediante la escala modificada del Medical Research Council (MRC)16. El impacto de los síntomas se valora mediante el cuestionario Clinical COPD Questionnaire (CCQ)17. Además, se evalúan las actividades de la vida diaria mediante la escala London Chest Activity of Daily Living (LCADL)18. Las variables sobre agudizaciones en el año previo se registran de manera protocolizada (tabla 3), identificando si esta información era revelada por el paciente o bien obtenida de la historia clínica. La calidad de vida se evalúa mediante el cuestionario COPD Assessment Test (CAT)19.
Variables registradas en relación con agudizaciones anuales
| Número de visitas a su médico no programadas por EPOCNúmero de visitas a urgencias del centro de atención primariaNúmero de visitas a urgencias hospitalariasNúmero de ingresos hospitalarios: en sala y en UCINúmero de episodios con necesidad de ventilación no invasivaNúmero de episodios con necesidad de ventilación invasivaNúmero de ciclos de antibióticos por agudizaciónNúmero de ciclos de corticoides sistémicosFecha de la última agudización |
Sobre el tratamiento, se recogen los fármacos reflejados en la tabla 4. Además, se registran las vacunaciones antigripal y antineumocócica, las terapias domiciliarias como oxigenoterapia y ventilación mecánica domiciliaria, así como cualquier programa de rehabilitación respiratoria. Los pacientes de la cohorte EPOC incluidos serán tratados según las recomendaciones actuales nacionales e internacionales para el tratamiento de la EPOC, a juicio del investigador responsable. A todos los sujetos incluidos que sean fumadores activos se les realiza una intervención mínima en tabaquismo, intentando avanzar en el proceso de deshabituación según el esquema de Prochaska y DiClemente20 y ofreciendo tratamiento deshabituador completo según las normativas nacionales21.
Grupos farmacológicos recogidos en la anamnesis
| BroncodilatadoresCorticoides inhalados y oralesMetilxantinasMucolíticos/antioxidantesTratamiento farmacológico del tabaquismoDiuréticosInhibidores de la enzima convertidora de angiotensina y antagonistas de receptores de angiotensina-2Bloqueadores betaAntiagregantes-anticoagulantesAnsiolíticos-antidepresivosEstatinasAntidiabéticos orales-insulinaTerapia hormonal sustitutiva |
Los estudios complementarios solicitados se recogen en la tabla 5. Todas las determinaciones analíticas reflejadas se realizan en los laboratorios de referencia de cada centro. Se extrae una muestra sanguínea con objeto de realizar un hemograma y una bioquímica general (con especial interés en parámetros de riesgo cardiovascular, IgE total), y en la primera determinación se incluye una determinación de los niveles de α1-antitripsina. Finalmente, se extraen 3 tubos EDTA de 5ml para centrifugar (3.000rpm durante 10min a temperatura ambiente) y extraer el suero, que se conserva a –80°C para posterior estudio de biomarcadores. Para su almacenamiento se requiere separar al menos 6 alícuotas de 500μl antes de congelar la muestra. A cada centro se les proporcionaron etiquetas con objeto de poder rotular cada alícuota identificando el número de centro, el número de caso y el número de alícuota.
Pruebas complementarias solicitadas en las visitas anuales de la cohorte EPOC
| Analítica |
| Hemograma |
| Bioquímica general: glucosa, creatinina, urea, albúmina, perfil lipídico |
| Fibrinógeno |
| Alfa-1-antitripsina |
| Proteína C reactiva |
| IgE total |
| Hemoglobina glucosilada |
| Muestra para seroteca |
| Radiografía simple del tórax |
| Cooximetría |
| Valoración nutricional |
| Índice de masa corporal |
| Perímetro de cintura y cadera |
| Bioimpedancia corporal |
| Pruebas de función pulmonar |
| Espirometría con test broncodilatador |
| Volúmenes pulmonares |
| Pruebas de difusión |
| Gasometría arterial |
| Pruebas de función muscular |
| Presiones inspiratorias y espiratorias máximas |
| Fuerza muscular en las extremidades superiores |
| Prueba de marcha de los 6 minutos |
Para la valoración nutricional se calcula el índice de masa corporal y se realiza un estudio de bioimpedancia corporal. Todos los estudios de bioimpedancia se realizan con el mismo dispositivo, un Omron BF500 (Omron Corporation, Kioto, Japón) adquirido específicamente para este proyecto. Mediante esta técnica podemos estimar la masa grasa corporal y visceral. Las pruebas de función respiratoria se realizan con los equipos disponibles en cada hospital participante, registrando los valores absolutos de cada determinación para poder aplicar los mismos valores teóricos en el momento del análisis de los resultados. El estudio de la fuerza muscular periférica se realizó con un dinamómetro de mano GRIP-A (Takei Scientific Instruments, Niigata, Japón), adquirido específicamente para este proyecto. La prueba de marcha de los 6min22 se realiza siguiendo las recomendaciones internacionales23. Si el paciente no conoce la prueba se realiza un segundo test (separado por al menos 30min de reposo) para considerar el posible efecto del entrenamiento.
En cada visita anual y semestral se registrará el estado vital del sujeto y, en caso de fallecimiento, la causa de la muerte (codificada como: respiratoria, cardiovascular, cerebrovascular, neoplasia pulmonar, otras neoplasias, muerte súbita, otras o desconocida) y las variables de agudizaciones (tabla 3). La adjudicación de la causa de la muerte en cada caso concreto será responsabilidad del investigador local, debiendo tener en cuenta la información aportada por los familiares y la historia clínica.
Se administrará un cuaderno de recogida de las exacerbaciones que incluya las variables: el tiempo de agudización en días, el lugar de asistencia principal (domicilio, ambulatorio, urgencias hospitalarias, hospitalización o UCI), los criterios de Anthonisen24 y el tratamiento recibido.
Para la cohorte control se recogen los mismos datos que en la cohorte de casos, pero se simplifica la exploración funcional respiratoria, exigiéndose al menos la espirometría y una medición de la saturación de oxígeno por pulsioximetría.
SeguimientoEl periodo de reclutamiento de casos se extendió durante 26 meses, entre el 15 de enero de 2010 y el 31 de marzo de 2012. Tras la finalización del periodo de inclusión, se registraron 991 casos y 132 controles. El seguimiento de los sujetos incluidos se realiza mediante visitas anuales presenciales, en las que se recoge toda la información de cada caso. Además, cada 6 meses se programa una llamada telefónica en la que se recogen datos sobre el número de agudizaciones y se verifica el estado vital del sujeto. Finalmente, a los pacientes se les indica que podrían acudir a la consulta en cualquier momento si tenían una agudización con objeto de recoger datos sobre las agudizaciones. De esta manera, el proyecto establece un cuaderno de recogida de datos (CRD) para las visitas regladas anuales y las llamadas semestrales.
Se seleccionó una empresa con experiencia en el diseño de aplicaciones médicas web (Claveweb, Sevilla, España) para la creación de la página web del proyecto (www.chain.org.es). En la página web se ofrece información sobre el proyecto y sirve de acceso a los datos para los investigadores y el comité científico del proyecto. La web tiene una estructura jerárquica de manera que el comité científico tiene acceso a toda la información, pero los investigadores locales solo pueden acceder a los datos de su centro. La aplicación web tiene también una opción de descarga de datos para el comité científico con objeto de poder descargar los datos y hacer controles de calidad.
Se contrataron los servicios de un gestor de datos que tenía las funciones de comunicación con los investigadores y de resolución de incidencias, mantenimiento de la base de datos y control de calidad. El control de calidad se limitó a la veracidad de los datos registrados. Los controles de calidad de los procedimientos realizados en cada centro se realizaron por cada hospital participante según su normativa interna. El gestor del proyecto revisa la base de datos semanalmente para identificar valores perdidos, inconsistentes o extremos. En estos casos, se pone en contacto con el investigador para confirmar o corregir el valor final. Además, el gestor del proyecto enviaba periódicamente a los investigadores un correo electrónico con la información del reclutamiento de casos y el estado del proyecto.
ÉticaEl presente protocolo fue aprobado por los Comités Éticos de Investigación Sanitaria de los centros participantes, y en él ser observan los principios de la Declaración de Helsinki para proyectos de investigación con seres humanos. Todos los participantes fueron informados de la naturaleza del estudio y de sus objetivos, y otorgaron su participación en el mismo mediante firma del consentimiento informado, pudiendo retirarlo en cualquier momento.
Todos los procedimientos y variables relacionadas con este trabajo se recogen en un CRD. Se dispone de un CRD por cada sujeto incluido, independientemente del grupo al que pertenezca, y en dicho CRD se anotan todas las variables relacionadas con el estudio.
Durante el estudio no se recogen datos personales de los pacientes participantes en el estudio que permitan identificar al sujeto. Estos datos eran anonimizados en la aplicación web. Los datos obtenidos se mantendrán bajo estricta confidencialidad (Ley Orgánica 15/1999, de protección de datos de carácter personal) y solo el investigador responsable del proyecto en cada centro tendrá acceso a ellos.
Las muestras biológicas relacionadas con el estudio, así como los CRD, están numerados con un código para garantizar la confidencialidad de la muestra y los datos. Durante el periodo de estudio, los CRD se guardaban bajo llave, que tendrá exclusivamente el investigador responsable del proyecto en ese centro y que, tras su transcripción a la base de datos, serán destruidos.
EstadísticaLos resultados de cada variable se presentarán según la media, la desviación estándar, el mínimo, la mediana, el máximo y el número de casos válidos en el caso de las variables continuas, y utilizando el recuento de casos por cada categoría y la frecuencia relativa al total de respuestas en el de las variables categóricas. Para las comparaciones estadísticas entre grupos, en variables continuas se realizará una ANOVA inicial y posteriormente un test bilateral de t de Student, o una χ2 para las variables categóricas. La prueba de Spearman se utilizará para determinar correlación entre variables no paramétricas, y la de Pearson para las paramétricas. En todas las pruebas estadísticas realizadas se utilizará un nivel de significación estadística del 0,05.
DiscusiónEl presente trabajo pretende dar una visión detallada del método empleado, la organización del trabajo y los objetivos que se plantearon en el estudio CHAIN, así como mostrar los pasos dados para superar la complejidad de un estudio ambicioso en el que han participado un considerable número de centros e investigadores siguiendo un protocolo extenso. CHAIN tiene el potencial de contribuir al conocimiento de la EPOC aportando datos sobre las características de la enfermedad y la evolución de cada variable estudiada en el tiempo, tanto de manera aislada como de manera conjunta. Esto permitirá no solo describir el comportamiento de la enfermedad a largo plazo, sino también establecer relaciones entre estos comportamientos clínicos y marcadores biológicos de los pacientes incluidos.
CHAIN pretende cubrir un hueco no abordado suficientemente por otros estudios de cohortes en marcha. A pesar del reconocimiento de la complejidad multidimensional de la EPOC, pocos trabajos han abordado la evolución de esta enfermedad en el tiempo con objeto de evaluar su historia natural desde el punto de vista multidimensional.
Tras la finalización del reclutamiento de centros y el establecimiento del completo protocolo de estudio, 36 centros han conseguido incluirse al proyecto de manera completa con la inclusión de casos de manera efectiva durante el periodo de reclutamiento. Algunos centros interesados en el proyecto no pudieron iniciar el estudio: unos por problemas organizativos locales, otros por lo extenso de los datos a registrar, o en ocasiones por obras o cambios en la ubicación del centro o por no disponer de personal investigador dedicado al proyecto.
Las variables a registrar fueron objeto de un intenso debate. Durante los meses de trabajo del comité científico previos a la puesta en marcha del estudio, con las sesiones presenciales de noviembre 2009 y abril 2010 y los diferentes intercambios de opiniones entre el comité científico y los hospitales participantes, el protocolo de estudio fue mejorando poco a poco, incluyendo algunas variables, descartando otras y matizando algunas ya seleccionadas. Algunas de las propuestas que se plantearon fueron muy interesantes, pero tuvieron que ser descartadas para poder hacer el protocolo accesible a la mayoría de los centros o bien por limitaciones de coste. Algunos de estos ejemplos son el registro de los trastornos respiratorios durante el sueño, la realización de un TAC, el estudio de esputo inducido, el estudio de bronquiectasias o estudios complementarios para valorar de manera objetiva la comorbilidad cardiovascular. Estos aspectos no fueron incluidos en el estudio, pero se mantuvieron como idea para poder realizar sub-estudios entre los investigadores que estuvieran interesados. De esta manera, CHAIN tiene previsto incorporar sub-estudios que, manteniendo la esencia troncal del estudio, permitan profundizar en aspectos concretos de la EPOC.
Uno de los aspectos claves para el éxito de este tipo de proyectos es la adecuada programación de la base de datos en la página web y el trabajo del gestor de datos que debe estar encima del proyecto, supervisando constantemente la calidad de la información recibida y animando a los investigadores que se queden retrasados. En concreto, el establecimiento de un boletín informativo periódico contribuyó a la concienciación de los investigadores en la inclusión de casos.
Debido al plazo distinto de aprobación del protocolo por parte de los comités de ética, existió una gran variabilidad en el momento de iniciar el estudio en los distintos centros. Algunos centros dieron su visto bueno de manera más rápida, otros tardaron varias semanas, y en algunos casos se solicitó el pago de unas tasas para poder ejecutar la valoración.
Entre las limitaciones del proyecto figura, en primer lugar, la imposibilidad de incluir todas las variables posibles. Como ya se ha comentado, algunas tuvieron que ser descartadas en las reuniones de trabajo con objeto de hacer el protocolo viable. Aunque no se pusieron criterios de exclusión en relación con las características de la enfermedad, algunos fenotipos, como el mixto EPOC-asma, actualmente en debate, no se recogieron de manera exhaustiva según los criterios diagnósticos actuales25, ya que los criterios diagnósticos no se habían publicado en el momento de iniciar el estudio. La segunda limitación es la complejidad del protocolo de recogida de información clínica. La EPOC es una enfermedad multidimensional compleja y, a pesar de que desde el comité científico se intentó en las diversas reuniones hacer un protocolo lo más sencillo posible, la enorme variabilidad de la presentación clínica de esta enfermedad hace que la recogida de información sea necesariamente compleja con vistas a disponer de una información completa. La selección de centros e investigadores no fue aleatoria sino de acuerdo a su disponibilidad, lo que puede limitar su posterior representatividad y extrapolación de resultados. Deberá monitorizarse la magnitud de la probable pérdida de participantes durante el seguimiento.
En definitiva, CHAIN es un estudio observacional de cohortes prospectivas con el objetivo de valorar a largo plazo la historia natural de la enfermedad desde un punto de vista multidimensional. Las características de los pacientes aportarán información relevante sobre la progresión de la EPOC y se establecerán las bases para la estratificación fenotípica de los pacientes, lo que debe permitir avanzar en el conocimiento de esta enfermedad. Finalmente, este estudio creemos que ayudará a crear una estructura sólida de investigadores nacionales en el campo de la EPOC que promoverá el desarrollo de futuros proyectos de excelencia.
FinanciaciónCHAIN está financiado en sus 3 primeros años por AstraZeneca bajo las cláusulas existentes en el contrato firmado con la Fundación Respira, Fundación Española del Pulmón.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores del presente trabajo quieren dar las gracias a AstraZeneca por la financiación del proyecto y el apoyo logístico para las reuniones. Igualmente, los autores quieren dejar patente su agradecimiento a los investigadores del proyecto, sin los que este estudio nunca hubiera visto la luz.
Comité científico. Ciro Casanova Macario (coordinador), Pilar de Lucas, Juan Pablo de Torres, José Luis Lopez-Campos, José María Marín, German Peces-Barba, Juan José Soler Cataluña, Joan B Soriano.
Investigadores locales.
ANDALUCÍA. José Calvo Bonachera, Hospital de Torrecárdenas, Almería. Nuria Feu Collado, Hospital Universitario Reina Sofía, Córdoba. Celia Lacárcel Bautista, Hospital Ciudad de Jaén, Jaén. Adolfo Domenech, Hospital Universitario Carlos Haya, Málaga. Inmaculada Alfageme Michavila, Hospital Universitario de Valme, Sevilla.
ARAGÓN. José María Marín Trigo, Hospital Universitario Miguel Servet, Zaragoza.
ASTURIAS. Cristina Martínez González, Hospital Central de Asturias, Oviedo.
BALEARES. Rosa Irigaray, Hospital de Manacor, Manacor. Borja García-Cosío Piqueras, Hospital Son Espases, Mallorca. Isabel Mir Viladrich, Hospital Son Llátzer, Mallorca.
CANARIAS. Carlos Cabrera López, Hospital Dr. Negrín, Las Palmas de Gran Canaria. Alejandro Sánchez Acosta, Hospital Insular de Las Palmas, Las Palmas de Gran Canaria. Ciro Casanova Macario, Hospital Universitario de la Candelaria, Santa Cruz de Tenerife. Juan Abreu González, Hospital Universitario de Canarias, Santa Cruz de Tenerife.
CANTABRIA. Ramón Agüero Balbin, Hospital Marqués de Valdecillas, Santander.
CATALUÑA. Eva Balcells, Hospital del Mar, Barcelona. Elena Miguel Campos, Hospital Sant Joan Despí, Barcelona. Alicia Marin, Hospital German Trias y Pujol, Badalona, Barcelona. Ingrid Solanes García, Hospital San Pablo y la Santa Cruz, Barcelona. Antonia Llunel Casanova, Hospital de Tarrasa, Tarrasa. Amalia Moreno, Hospital Parc Taulí, Sabadel.
EXTREMADURA. Francisca Lourdes Márquez Pérez, Hospital Infanta Cristina, Badajoz. Juan Antonio Riesco Miranda, Hospital San Pedro Alcántara, Cáceres.
GALICIA. Julia Tabara Rodríguez, Hospital Juan Canalejo, La Coruña. Rafael Golpe Gómez, Hospital General Calde, Lugo.
MADRID. Germán Peces-Barba Romero, Fundación Jiménez Díaz, Madrid. Miriam Calle Rubio, Hospital Clínico San Carlos, Madrid. Javier de Miguel Díez, Hospital Gregorio Marañón, Madrid. Pilar de Lucas Ramos, Hospital Gregorio Marañón, Madrid. Francisco García Río, Hospital La Paz, Madrid. Salvador Díaz Lobato, Hospital Ramón y Cajal, Madrid.
NAVARRA. Juan Pablo de Torres Tajes, Clínica Universitaria de Navarra, Pamplona.
PAÍS VASCO. Juan Bautista Galdiz Iturri, Hospital de Cruces, Bilbao.
VALENCIA. Margarita Marín Royo, Hospital General de Castellón, Castellón. Juan José Soler Cataluña, Hospital General de Requena, Requena. Alfredo de Diego Damia, Hospital Universitario La Fe, Valencia.
Gestor de datos. Domingo León Mora, Hospital Universitario de la Candelaria, Santa Cruz de Tenerife.
En el Anexo 1 se incluye el listado de los investigadores del grupo (CHAIN).