La inmunodeficiencia común variable es una de las alteraciones de la inmunidad más frecuentes. Suele manifestarse con infecciones respiratorias de repetición, desde neumonías hasta otitis, y puede asociarse a otras patologías, como bronquiectasias o enfermedades intersticiales. Presentamos el caso de un paciente de 28 años con infecciones respiratorias frecuentes e infiltrados nodulares pulmonares, que fue diagnosticado de inmunodeficiencia común variable y bronquiolitis folicular. La bronquiolitis folicular se asocia, en algunos casos, a inmunodeficiencias y debe realizarse un diagnóstico diferencial con la hiperplasia nodular linfoide, la neumonía intersticial linfocítica y el linfoma BALT de bajo grado.
Common variable immunodeficiency is one of the most frequent immunity alterations. The most common clinical presentation occurs with recurrent respiratory infections, from pneumonia to otitis, and may be associated with other diseases such as bronchiectasis or interstitial lung diseases. We report the case of a 28-year-old patient with frequent respiratory infections and nodular pulmonary infiltrates, who was diagnosed with common variable immunodeficiency and follicular bronchiolitis. In some cases, follicular bronchiolitis is associated with immunodeficiencies and should be included in a differential diagnosis with lymphoid nodular hyperplasia, lymphocytic interstitial pneumonia and low-grade BALT lymphoma.
La inmunodeficiencia común variable (ICV) es una de las inmunodeficiencias primarias más conocidas, con una incidencia de 1/10.000 pacientes en la población general1. Los síntomas aparecen en la infancia y en adultos, y son frecuentes las infecciones respiratorias de repetición; puede asociar otra patología a nivel pulmonar, como enfermedad intersticial, entre otras.
Caso clínicoVarón de 28 años, sin hábitos tóxicos, portador de prótesis ocular por microftalmia congénita en ojo izquierdo y trabajador de hostelería que consulta en neumología por clínica respiratoria que se inició unos 4 años antes. Refería catarros e infecciones respiratorias de repetición, con múltiples pautas de antibióticos sin clara mejoría clínica, con tos y expectoración verdosa persistente. A la exploración destacaba palidez de piel y mucosas con disminución del murmullo vesicular en bases y algún crepitante en la base izquierda.
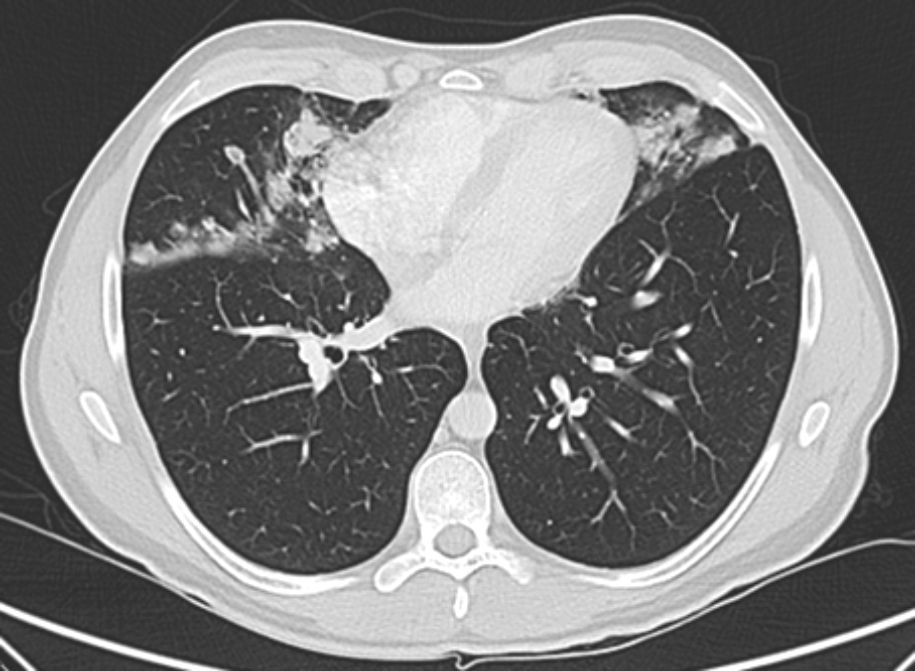
Se solicitó radiografía de tórax posteroanterior y lateral y posteriormente tomografía computarizada (TC) de tórax, que mostró la presencia de nódulos irregulares (acinares), e infiltrados alveolares en lóbulo medio, língula y lóbulos inferiores, de distribución perilinfática y subpleural (fig. 1). Las pruebas de función pulmonar resultaron normales, con FVC 4.830ml (97%) FEV1 3.870ml (93%) FEV1/FVC 80% con DLCO 94%, KCO 94% y VA 97%. Se realizó analítica sanguínea completa y fibrobroncoscopia con toma de biopsia transbronquial con criosonda.
El estudio analítico demostró un descenso de plaquetas 84.000×103μl y un descenso en los niveles de inmunoglobulinas con IgG <140mg/dl (700-1.600), IgA <33mg/dl (70-400), IgM <21mg/dl (40-230), IgE 1,8mg/dl (23-94), con descenso en subclases de IgG, subclase 1: 57mg/dl (402-712), subclase 2: 4mg/dl (216-523), subclase 3: 53mg/dl (36-139), subclase 4: <1mg/dl (9-104).
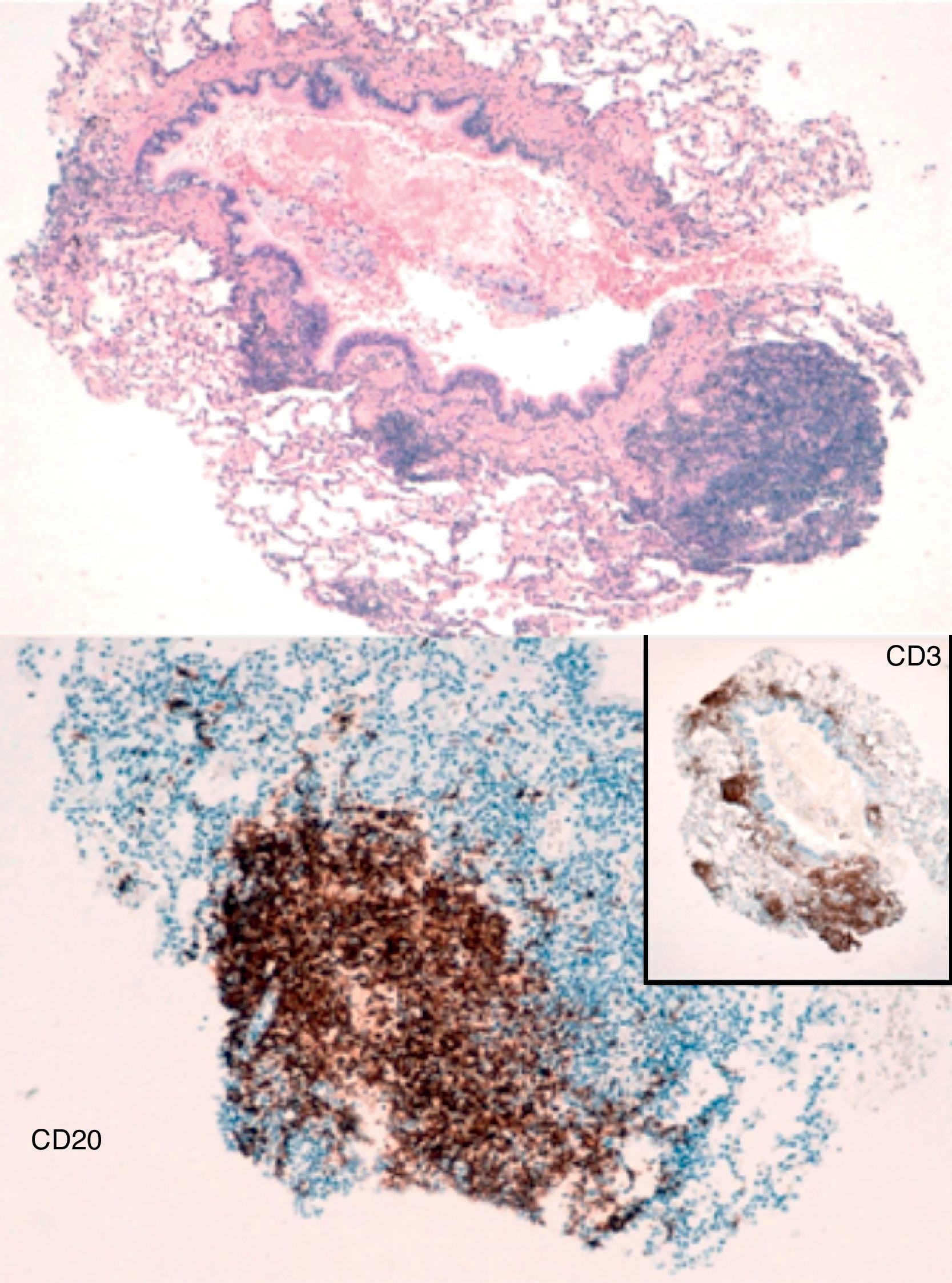
El resultado de la biopsia mostró fragmentos de parénquima pulmonar con agregados linfoides intersticiales pero predominantemente adyacentes a bronquiolos y folículos linfoides. Con técnicas de inmunohistoquímica se detectó un componente predominante de células T, y entre ellas prevalencia de población CD4+ con escasos agregados de células B reactivas. Todo ello compatible con una hiperplasia linfoide reactiva con imágenes de bronquiolitis folicular (fig. 2). El paciente se remitió a hematología y fue diagnosticado de ICV, por lo que inició tratamiento con gammaglobulina intravenosa.
DiscusiónLa ICV es una inmunodeficiencia primaria con ausencia de producción de anticuerpos y asociada a múltiples fenotipos clínicos. Su incidencia es variable: de 1/25.000 a 1/50.000 recién nacidos vivos, según las series2. Se han descrito 2 picos de inicio de la enfermedad: de 1 a 5años y de 16 a 20años.
Las manifestaciones respiratorias son múltiples, con frecuencia se trata de infecciones de repetición desde neumonía, otitis media o sinusitis causadas habitualmente por patógenos encapsulados. Otras manifestaciones respiratorias son bronquiectasias o enfermedades intersticiales: enfermedades granulomatosas, neumonía intersticial linfocítica, neumonía intersticial no específica o neumonía organizada1.
Recientemente se ha descrito el término de enfermedad pulmonar intersticial granulomatosa-linfocítica (GLILD), cuando en un paciente con ICV coexisten datos histológicos de enfermedad granulomatosa y enfermedad linfoproliferativa (neumonía intersticial linfocítica, bronquiolitis folicular, hiperplasia linfoide)3. Es frecuente la presencia de adenopatías mediastínicas, hiliares, axilares, abdominales y hepatoesplenomegalia. El pronóstico de los pacientes que presentan esta entidad se ve reducido a la mitad, siendo de unos 30 años en los que no asocian GLILD4.
Radiológicamente se caracteriza por la existencia de áreas de consolidación, nódulos en vidrio deslustrado y engrosamiento de septos interlobulillares de predominio por lóbulos inferiores3.
En nuestro caso los hallazgos anatomopatológicos fueron compatibles con bronquiolitis folicular. Esta entidad se caracteriza por la hiperplasia del tejido linfoide a lo largo de la vía aérea y por el desarrollo de folículos linfoides y centros germinales de distribución peribronquial o peribronquiolar. Puede tratarse de un hallazgo único o asociarse a bronquiectasias o asma, entre otras. Suele ocurrir en el contexto de una enfermedad del colágeno subyacente, artritis reumatoide o ante una inmunodeficiencia: congénita o adquirida como sida, ICV y también de causa idiopática5.
Se ha descrito a cualquier edad, aunque la entidad no asociada a enfermedad del colágeno o inmunodeficiencia tiende a aparecer en individuos de mediana edad. La clínica es inespecífica, y desde el punto de vista funcional respiratorio puede darse cualquier patrón, e incluso ser normal6.
La bronquiolitis folicular podría considerarse una manifestación de la hiperplasia nodular linfoide, como una respuesta inmunológica frente a un antígeno con la consiguiente proliferación linfocítica. Aunque la mayoría de pacientes no desarrollan una bronquiolitis folicular tras la exposición antigénica, por lo que esta estimulación no sería suficiente para explicar su patogenia. Pueden considerarse 2 etapas en su desarrollo desde el inicio de los síntomas, con una exposición a antígenos inicial que estimularía el sistema BALT, y posteriormente la disfunción inmunológica conllevaría la proliferación linfocítica7.
Los hallazgos radiológicos más comunes son opacidades nodulares bilaterales, generalmente menores de 3mm, aunque se han descrito casos de más de 12mm, con distribución centrilobulillar o peribronquiolar. Podemos ver áreas de vidrio deslustrado parcheadas bilaterales de distribución no segmentaria8.
Desde el punto de vista histológico aparecen numerosos folículos linfoides asociados a centros germinales alrededor de bronquios y bronquiolos, que en ocasiones asocian un infiltrado inflamatorio intersticial en los septos alveolares adyacentes. En el 20% de casos llega a ser significativo y hay que plantear diagnóstico diferencial con neumonía intersticial linfocítica, hiperplasia nodular linfoide y linfoma BALT de bajo grado5.
Distinguir una entidad de otra no resulta sencillo y suele basarse en la extensión del infiltrado, con una distribución peribronquial o peribronquiolar en la bronquiolitis folicular y difuso en la neumonía intersticial linfocítica8.
La hiperplasia nodular linfoide se distingue tanto por sus características radiológicas como histológicas. Se presenta como masas únicas o múltiples con proliferación de centros germinales que tienden a la confluencia, con células plasmáticas interfoliculares. En el linfoma BALT de bajo grado aparecen masas sólidas bien definidas o múltiples, con infiltrado compuesto por linfocitos B monoclonales, y en algunos casos puede haber centros germinales5.
A pesar de que el tratamiento con inmunoglobulinas puede disminuir significativamente la frecuencia y la severidad de las infecciones, la progresión de las lesiones pulmonares ocurre pese a un adecuado tratamiento. Se ha propuesto el número de neumonías previas al diagnóstico como el parámetro más sensible para detectar alteraciones en el TC de tórax9.
En estos pacientes es frecuente el retraso en el diagnóstico por la baja prevalencia y baja sospecha clínica, de manera que la presencia de neumonías de repetición es un criterio suficiente para plantear la existencia de una inmunodeficiencia.