Evaluar el efecto de una preparación con ribosomas bacterianos y proteoglicanos de Klebsiella pneumoniae «R» sobre la expresión in vitro de las moléculas CD11c y CD103 en neutrófilos de sangre periférica.
MétodosAislamiento de neutrófilos de sangre periférica con Ficoll-Paque, incubación con R y detección de CD11c y CD103 mediante citometría de flujo.
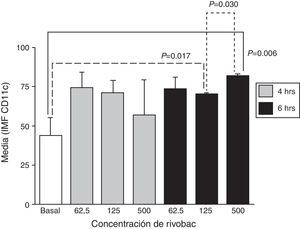
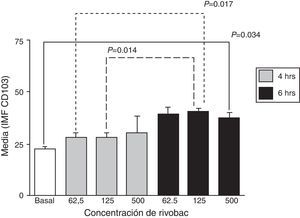
ResultadosA las 6h postincubación, la expresión de CD11c aumentó de manera significativa respecto al control con 125 y 500μg/ml de R (p=0,017 y p=0,006, respectivamente). La expresión de CD103 inducida con 125μg/ml de R a las 6h fue significativamente mayor que la observada a las 4h a la misma concentración (p=0,014) y que la encontrada con 62,5μg/ml (p=0,017).
ConclusionesEl aumento en la expresión de CD11c y CD103 inducido por R en neutrófilos podría contribuir al mecanismo de acción de R contra patógenos respiratorios.
To evaluate the effect of a preparation with bacterial ribosomes and proteoglycans from Klebsiella pneumoniae «R» on the in vitro expression of CD11c and CD103 molecules in neutrophils from peripheral blood.
MethodsIsolation of neutrophils from peripheral blood with Ficoll-Paque, incubation with R and detection of CD11c and CD103 through flow cytometry.
ResultsSix hours after the incubation period, CD11c expression increased significantly compared with the control with 125 and 500μg/ml of R (P=.017 and P=.006, respectively). CD103 expression induced with 125μg/ml of R after 6hours was significantly higher than that observed after 4hours at the same concentration (P=.014) and that found with 62.5μg/ml (P=.017) of R.
ConclusionsThe increased expression of CD11c and CD103 induced by R in the neutrophils could contribute to the R mechanism against respiratory pathogens.
Las infecciones agudas de las vías respiratorias son uno de los problemas de salud más importantes en los países en desarrollo: causan 2 millones de muertes en niños menores de 5 años y representan una carga económica muy significativa para los sistemas regionales de salud1. Esto ha llevado a la implementación de estrategias para el manejo de dichas infecciones en las que la Organización Mundial de la Salud ha enfatizado los efectos perjudiciales del uso indiscriminado de antibióticos2. Una alternativa al uso de antibióticos es la inmunoterapia con las fracciones ribosomales de Klebsiella pneumoniae, Streptococcus pneumoniae, Streptococcus pyogenes, Haemophilus influenzae y los proteoglicanos de K. pneumoniae contenidos en Ribovac® (una formulación de ribosomas bacterianos y proteoglicanos de K. pneumoniae), también comercializado como Ribomunyl® e Immucytal®, del cual se ha demostrado su eficacia para disminuir la recurrencia y la duración de las infecciones de vías respiratorias y la necesidad de antibióticos para su control3.
Uno de los efectos que R ejerce en el sistema inmune es el aumento en la adhesividad de neutrófilos de sangre periférica4, lo cual se ha asociado a la sobreexpresión de la subunidad β2 (CD18) de la familia de integrinas heterodiméricas CD11(α)/CD185, las cuales además participan en el rodamiento y la diapédesis leucocitaria6. La función específica de cada miembro de esta familia de proteínas depende del tipo de subunidadα a la cual se asocia CD18. Debido a posibles efectos pleiotrópicos atribuibles a la amplia variedad de ligandos para los diferentes miembros de CD11, es preciso determinar el impacto de R sobre CD11c, el cual es muy importante en el proceso de adhesión leucocitaria.
Otra molécula de adhesión que es crucial para las respuestas innatas a nivel de las mucosas de vías respiratorias es la integrina αE(CD103)/β7, que está involucrada en la adhesión y la transmigración de los leucocitos entre las células epiteliales para permitir la captura de antígenos en el lumen de las vías respiratorias y su posterior presentación a células T vírgenes en el nodo linfático bronquial7.
El objetivo de este estudio fue evaluar el efecto de R sobre la expresión de las moléculas CD11c y CD103 en neutrófilos de sangre periférica.
Materiales y métodosObtención de neutrófilosLa separación de neutrófilos se realizó a partir de sangre periférica de donantes sanos, quienes nunca fumaron, mediante la separación con Ficoll-Paque (δ=1,113) (Amersham Biosciences, Piscataway, Nueva Jersey, EE.UU.) de acuerdo a los procedimientos indicados por el fabricante. La viabilidad celular se determinó antes de cada experimento por el método de exclusión de azul de tripano. Se aceptó una viabilidad celular ≥95%.
Tratamientos con una formulación de ribosomas bacterianos y proteoglicanos de K. pneumoniae y detección de CD11c y CD103Las células (2×105células/100μl) se trataron con volúmenes de 20μl de R a concentraciones finales de 0, 62,5, 125 y 500μg/ml y se incubaron durante 4 y 6h a 37°C en una atmósfera humidificada de CO2 al 5%. Se eligieron tales concentraciones porque con estas se indujeron las máximas concentraciones de citocinas IL-6 e IL-1 en ensayos previos realizados en nuestro laboratorio. La detección de las moléculas de adhesión se realizó con un citómetro de flujo EPICS XCL (Beckman Coulter, Brea, California, EE.UU.) utilizando los anticuerpos monoclonales anti-CD11c-PE y anti-CD103-FITC, adquiridos de Beckman Coulter (Brea, California, EE.UU.).
La concentración de R se eligió sobre la base de que a esas concentraciones tanto en nuestro laboratorio como en otros laboratorios se ha reportado la mayor inducción de la producción de citocinas por células mononucleadas activadas por R, y el tiempo de cultivo de neutrófilos se limitó a 4 y 6h porque su tasa de mortalidad suele ser mayor en tiempos mayores y nos propusimos trabajar con una viabilidad celular superior al 95% para las células que se colocaron en los cultivos celulares.
Análisis estadísticoLos resultados fueron expresados como la media±EE de al menos 3 experimentos independientes. La significancia estadística entre las medias se comparó utilizando la prueba t de Student, aceptándose un valor de confianza ≥95% y un valor de p<0,05. Todos los procedimientos se realizaron con el paquete estadístico SPSS versión 18.0 (SPSS Inc., Chicago, Illinois, EE.UU.).
ResultadosExpresión de CD11cNo se observaron cambios estadísticamente significativos respecto al control en la expresión de CD11c a todas las concentraciones probadas de R a las 4h de incubación (fig. 1). A las 6h, la expresión de CD11c aumentó de manera significativa respecto al control con 125 y 500μg/ml de R (p=0,017 y p=0,006, respectivamente). Asimismo, se observó que la expresión de CD11c inducida con 500μg/ml de R fue significativamente mayor que la expresión de este marcador en células tratadas con 125μg/ml (p=0,030).
Efectos de la concentración de la formulación con ribosomas bacterianos y proteoglicanos de K. pneumoniae y el tiempo de incubación sobre la expresión de CD11c en neutrófilos. Los resultados se expresan como la media±EE de la intensidad media de fluorescencia (IMF) de 3 experimentos independientes. Las concentraciones se expresan en μg/ml de R.
No se observaron cambios estadísticamente significativos respecto al control en la expresión de CD103 a todas las concentraciones probadas de R a las 4h de incubación (fig. 2). A las 6h, la expresión de CD103 fue mayor respecto al control y a todas las concentraciones ensayadas de R, siendo estadísticamente significativa solo con 500μg/ml (p=0,034). Sin embargo, la expresión de CD103 inducida con 125μg/ml de R a las 6h fue significativamente mayor que la observada a las 4h a la misma concentración (p=0.014) y que la encontrada con 62,5μg/ml (p=0,017).
Efectos de la concentración de la formulación con ribosomas bacterianos y proteoglicanos de K. pneumoniae y el tiempo de incubación sobre la expresión de CD103 en neutrófilos. Los resultados se expresan como la media±EE de la intensidad media de fluorescencia (IMF) de 3 experimentos independientes. Las concentraciones se expresan en μg/ml de R.
El hecho de encontrarse un aumento sostenido de la expresión de las moléculas CD11c y CD103 en neutrófilos tratados con R tanto durante 4 como 6h respecto a células no estimuladas con R indica que el R induce un efecto sostenido al menos hasta las 6h in vitro, lo cual es importante para explicar la capacidad del neutrófilo para mediar eventos de adhesión celular importantes para activar poblaciones celulares implicadas en la respuesta contra infecciones respiratorias. La máxima expresión tanto de CD11c como de CD103 se alcanzó a las 6h de tratamiento de neutrófilos con R, aunque a diferentes concentraciones del preparado, lo cual pudiera estar relacionado con diferente respuesta de receptores dependientes de la dosis y con la activación de diferentes vías de señalización necesarias para la expresión de estas moléculas. El estudio de estas condiciones y de la participación de dichas moléculas en eventos de la inmunidad innata contra patógenos de las vías respiratorias son recomendaciones para estudios posteriores.
Uno de los ligandos de CD11c es la molécula de adhesión intracelular ICAM-18, la cual participa en la adhesión firme al endotelio y la transmigración leucocitaria mediada por CD11b9. En virtud de que CD11b y CD11c comparten las mismas funciones10, la sobreexpresión de CD11c inducida por R podría implicar un aumento en la capacidad de los neutrófilos para adherirse firmemente al endotelio y transmigrar, lo cual podría estar relacionado con incrementos en la adhesividad y la migración quimiotáctica asociados a la sobreexpresión de CD18 inducida por R4,5. La fracción del complemento iC3b es otro de los ligandos para CD11c11; por lo tanto, la sobreexpresión de CD11c podría favorecer la fagocitosis mediada por esta opsonina y contribuir al aumento en la capacidad fagocítica inducida por R12. Por otro lado, se ha detectado una sobreexpresión de CD11b pero no de CD11c en neutrófilos de pacientes fumadores con enfermedad pulmonar obstructiva crónica13; en contraste, se ha observado un incremento en la expresión de CD11c en neutrófilos de pacientes con trombosis venosa profunda14. Lo anterior refleja la importancia de conocer los efectos de R sobre la expresión de los diferentes miembros de CD11 para predecir efectos adversos potenciales de R durante enfermedades inflamatorias respiratorias y otros padecimientos no relacionados; a este respecto, una de las limitaciones de este trabajo es que no se estudiaron los efectos de R sobre la expresión de CD11a y CD11b.
Respecto a CD103, los autores no han encontrado reportes de su expresión en neutrófilos, y esta molécula se ha detectado en diferentes subconjuntos de células T y de células dendríticas7. La sobreexpresión de CD103 inducida por R puede ser importante en su mecanismo de acción farmacológica debido al papel que esta molécula desempeña en la retención leucocitaria en la mucosa del tracto respiratorio; esto implicaría que R podría estimular las respuestas innatas locales promoviendo la migración de neutrófilos hacia el sitio de inflamación durante las infecciones respiratorias. Por otro lado, se ha demostrado que un aumento en algunas subpoblaciones de leucocitos que expresan CD103 puede preceder al desarrollo de enfermedades alérgicas respiratorias15. Por lo tanto, se necesitan estudios más amplios para corroborar la función de CD103 en neutrófilos y su papel en la inmunidad de mucosas del tracto respiratorio, lo que facilitaría evaluar si los beneficios de R sobrepasan sus potenciales efectos negativos en pacientes atópicos o con enfermedades inflamatorias. La sobreexpresión de moléculas de adhesión importantes en neutrófilos puede ser uno de los mecanismos que explican la disminución de las infecciones respiratorias inducidas por R y abre la posibilidad de estudiar por un lado las vías de señalización en las que participan estas moléculas para analizar la magnitud de su contribución al mecanismo de acción de R y por otro lado investigar si la sobreexpresión de estas moléculas explica en parte la tasa de respondedores o no a este biopreparado.
En conclusión, R estimula en neutrófilos de sangre periférica la expresión de las moléculas de adhesión CD11c y CD103. Estos efectos sugieren que la citoadhesión mediada por estas moléculas inducida por R potencia la capacidad de los neutrófilos como células efectoras activas en la defensa contra patógenos de vías respiratorias.
FinanciaciónEl Laboratorio Pierre Fabre México ha brindado financiamiento parcial para la realización de este estudio a través del proyecto RIBO-MEX-001-08.
Conflicto de interesesSe recibió financiamiento parcial de Laboratorios Pierre Fabre México para la realización del estudio.