La dinámica de fluidos computacional (CFD) se define como la técnica informática que busca la simulación del movimiento de los fluidos. Las principales ventajas de la técnica de CFD sobre otro tipo de estudios de mecánica de fluidos son la reducción sustancial de tiempo y costes en los experimentos, la posibilidad de analizar sistemas o condiciones muy difíciles de simular experimentalmente, como es el caso de las vías aéreas, y un nivel de detalle prácticamente ilimitado. Utilizamos el programa de CFD Ansys-Fluent para elaborar un modelo de la vía aérea de conducción que permite la simulación de distintos caudales de flujo inspiratorio, así como del depósito de partículas inhaladas de diferentes diámetros, obteniendo resultados concordantes con la literatura existente utilizando otros procedimientos. De este modo se pretende abrir una nueva vía a la individualización de los tratamientos para las distintas patologías respiratorias.
Computational Fluid Dynamics (CFD) is a computer-based tool for simulating fluid movement. The main advantages of CFD over other fluid mechanics studies include: substantial savings in time and cost, the analysis of systems or conditions that are very difficult to simulate experimentally (as is the case of the airways), and a practically unlimited level of detail. We used the Ansys-Fluent CFD program to develop a conducting airway model to simulate different inspiratory flow rates and the deposition of inhaled particles of varying diameters, obtaining results consistent with those reported in the literature using other procedures. We hope this approach will enable clinicians to further individualize the treatment of different respiratory diseases.
Las técnicas de dinámica de fluidos computacional (Computational Fluid Dynamics [CFD]) son de gran interés en la investigación neumológica actual. La Food and Drug Administration (FDA) anunció en 2012 un proyecto de investigación titulado «Modelos predictivos del depósito pulmonar para la eficacia y seguridad de fármacos inhalados». Su objetivo principal era desarrollar un modelo de CFD de medicación inhalada que permitiese explicar las características y los parámetros fisiológicos del depósito pulmonar de los fármacos. En los últimos congresos mundiales de CFD, su aplicación a la medicina ha tenido una presencia cada vez mayor. Por ejemplo, el congreso «Bio-engineering» en 2003 únicamente contó con una comunicación dedicada al estudio de la circulación sanguínea, mientras que en 2007 se presentaron 7 comunicaciones dedicadas a la circulación y 5 centradas en la respiración.
La CFD se define como la técnica informática que busca la simulación del movimiento de los fluidos. Es una rama de la mecánica de fluidos que emplea métodos numéricos y algoritmos para analizar y resolver los problemas que implican a los flujos de los fluidos. Comprende una gran variedad de ciencias, como las matemáticas, la informática, la ingeniería o la física, las cuales van a trabajar conjuntamente para proporcionar los medios para modelar fluidos1. La creciente potencia de cálculo de los ordenadores, así como su menor precio, han permitido el progreso de la CFD, en la que las ecuaciones de Navier-Stokes son resueltas bajo el dominio a estudio. Estas ecuaciones son las que gobiernan el movimiento de los fluidos y fueron descubiertas hace más de 150años simultáneamente por el ingeniero francés Claude Navier y el matemático irlandés George Stokes. Se derivan de las leyes del movimiento de Newton y son las mismas para cualquier flujo. Su resolución permite conocer la velocidad y la presión de un fluido en cualquier punto del espacio, y por lo tanto también su comportamiento. La particularización a los casos concretos viene definida por las denominadas condiciones de contorno y por los valores iniciales que se señalen. Estas ecuaciones son lo suficientemente complejas como para que su solución analítica solo sea posible en casos muy elementales, y por ello es imprescindible disponer de software avanzado diseñado para el tratamiento y la resolución de estos datos.
Las ventajas que proporciona el análisis por CFD se pueden resumir en: reducción sustancial de tiempos y costes en los nuevos diseños, posibilidad de analizar sistemas o condiciones muy difíciles de simular experimentalmente, y un nivel de detalle prácticamente ilimitado.
Considérese, por ejemplo, el flujo del aire en las vías aéreas. Junto con las ecuaciones, hay que introducirle al programa de CFD las condiciones iniciales y de contorno referentes a las variables y a la superficie sólida. Las condiciones referentes a las variables vienen definidas por la velocidad y la presión del aire, y las condiciones de las superficies sólidas por la forma de las vías aéreas, expresada matemáticamente en coordenadas. Para resolver las ecuaciones de Navier-Stokes globalmente en la vía aérea, el programa primero debe resolverlas en un número finito de puntos del espacio. Por eso, lo primero que hay que hacer es representar el pulmón mediante lo que se conoce como una malla de cálculo; cuanto mayor sea el número de puntos de esta malla, mayor será la precisión y realismo de la simulación y más difícil de generar y resolver. En casos con geometría compleja, esta fase puede ocupar días e incluso semanas.
Confección del modelo geométrico de la vía aéreaPara la elaboración del modelo tridimensional de la vía aérea se ha optado por seguir el diseño propuesto por Kitaoka et al.2, complementado con el de Weibel3. El modelo clásico de Weibel3 indica los modos de bifurcación de la vía aérea. En él se designa a la tráquea como la primera vía aérea (orden 0), y presume que cada vía aérea da origen a 2 ramificaciones (dicotomía regular). Así, los bronquios principales izquierdo y derecho son de orden1, y hay un mínimo de 23 generaciones bronquiales hasta los conductos alveolares. Por lo tanto, existirían 223 (8.388.608) vías aéreas de orden23, lo cual resulta fácil de imaginar que es prácticamente imposible de simular mediante técnicas de CFD sin realizar algún tipo de simplificación. El diámetro de cada ramificación disminuye según la fórmula dZ=d0·2-z/3, donde z es el orden de la generación de vía aérea y d su diámetro. Esta relación se mantiene hasta la generación16 (vía aérea de conducción). A partir de la generación17 existen pocos cambios en las dimensiones de la vía respiratoria, ya que las vías están más o menos alveolizadas (vía aérea transicional y zona respiratoria).
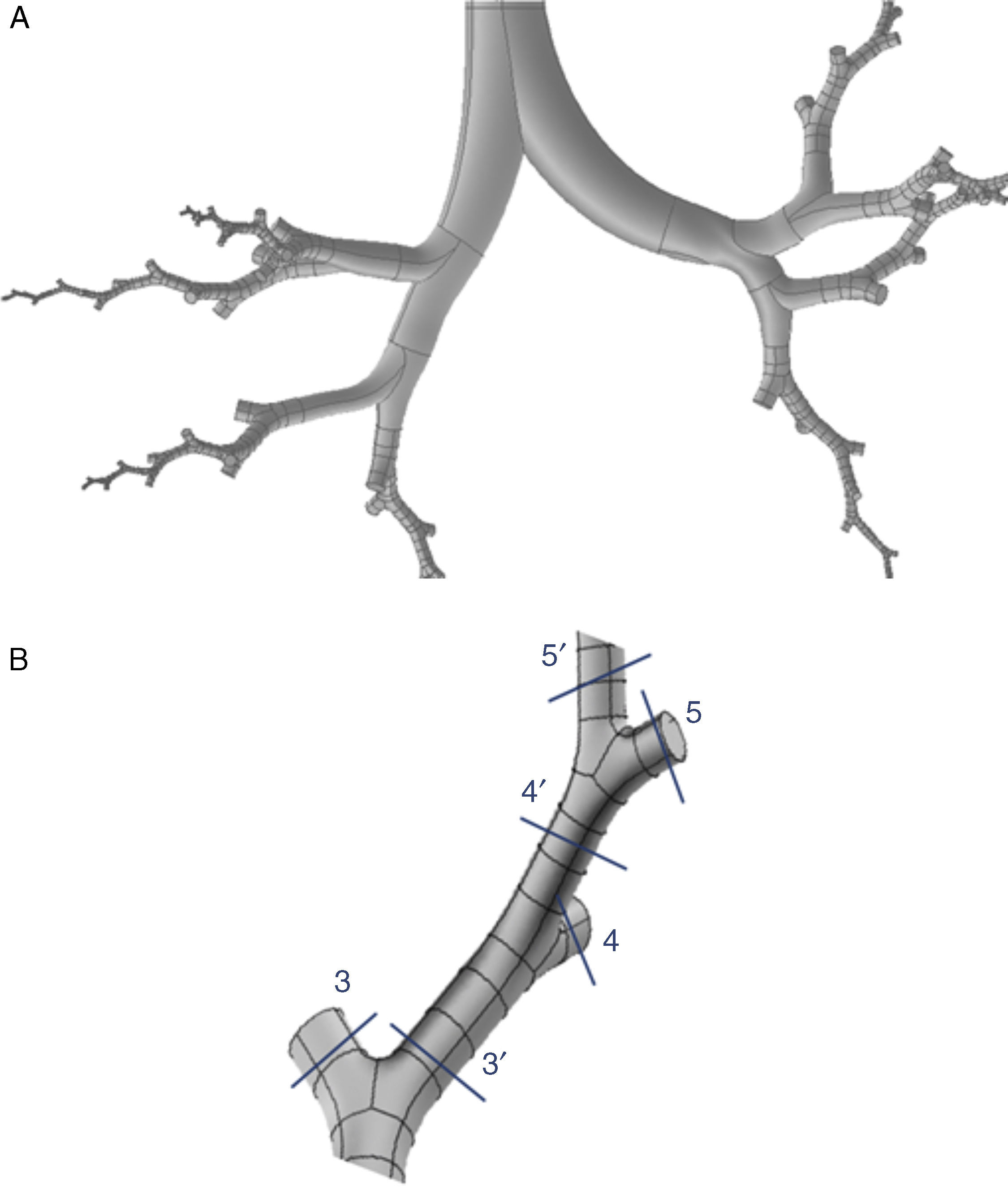
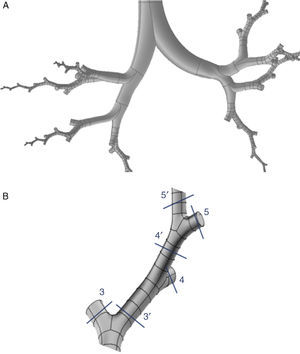
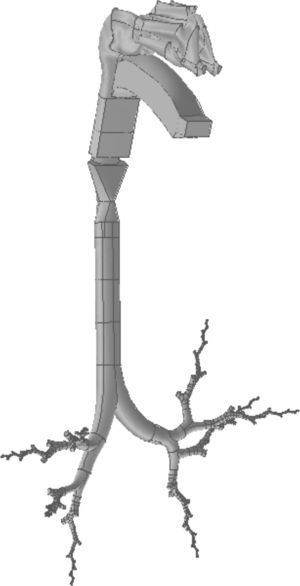
En el modelo de Weibel3 no se tuvo en cuenta la disposición espacial de las ramificaciones, por lo que para realizar un modelo tridimensional de la vía aérea es necesario ampliar sus indicaciones con las de otros trabajos más recientes. Kitaoka et al.2 consiguieron diseñar un modelo tridimensional realista del pulmón, elaborado a través de 9 reglas básicas, las cuales indican los ángulos y planos de bifurcación entre ramas, la relación entre el diámetro de una rama madre y sus ramas hijas, la longitud de las ramas, etc. Basándose en estas normas se confeccionó el modelo geométrico del árbol bronquial hasta la generación16 de la vía aérea con el programa Gambit, que forma parte del paquete de simulación CFD denominado Ansys-Fluent4. El modelo completo hasta el final de la vía aérea de conducción constaría de un total de 65.536 bronquiolos terminales, lo cual implica tiempos de cálculo elevadísimos para resolver las ecuaciones de Navier-Stokes en el mismo y hace necesaria su simplificación. Para ello se introdujo una mejora en el programa a través de lo que se conoce como una función definida por el usuario (User Defined Function [UDF]). Esta UDF consiste en un nuevo código especialmente desarrollado para la vía aérea que permite simular globalmente el comportamiento del aire en las 65.536 ramas del modelo completo, trabajando únicamente con 8 ramales. Para ello es necesario imponer las condiciones de contorno de las ramas desarrolladas en sus homólogas truncadas. Por lo tanto, lo que sucede con el aire en la rama desarrollada se aplica a su homóloga truncada. En la figura 1 se muestra el aspecto del modelo desarrollado únicamente con 8 ramales. Este tipo de modelo parcialmente desarrollado ha sido investigado por varios grupos de trabajo5–8, demostrando ser un método efectivo para la simulación de la vía aérea completa ahorrando costes computacionales.
A)Modelo tridimensional de la vía aérea de conducción (hasta la generación16) desarrollado únicamente a través de 8 ramales que tratan de respetar la distribución anatómica de los lóbulos pulmonares. B)Detalle de uno de los ramales desarrollados. La UDF aplica las características del aire en cada una de las porciones de la vía aérea desarrollada a sus ramales homólogos truncados. Es decir, lo que sucede con el aire en 3′ se aplica a su homólogo truncado 3; lo que sucede en 4′ se aplica a 4, etc.
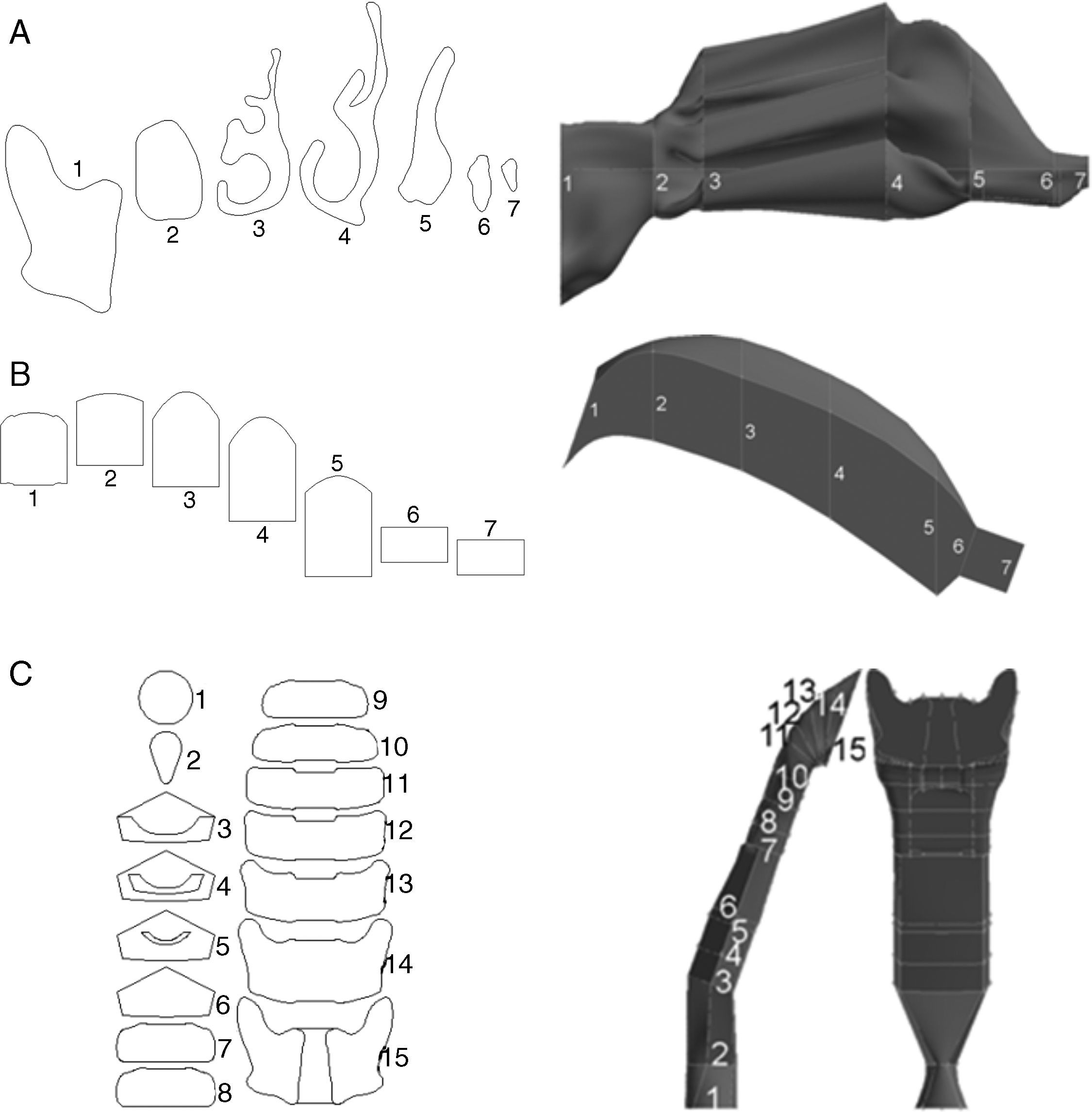
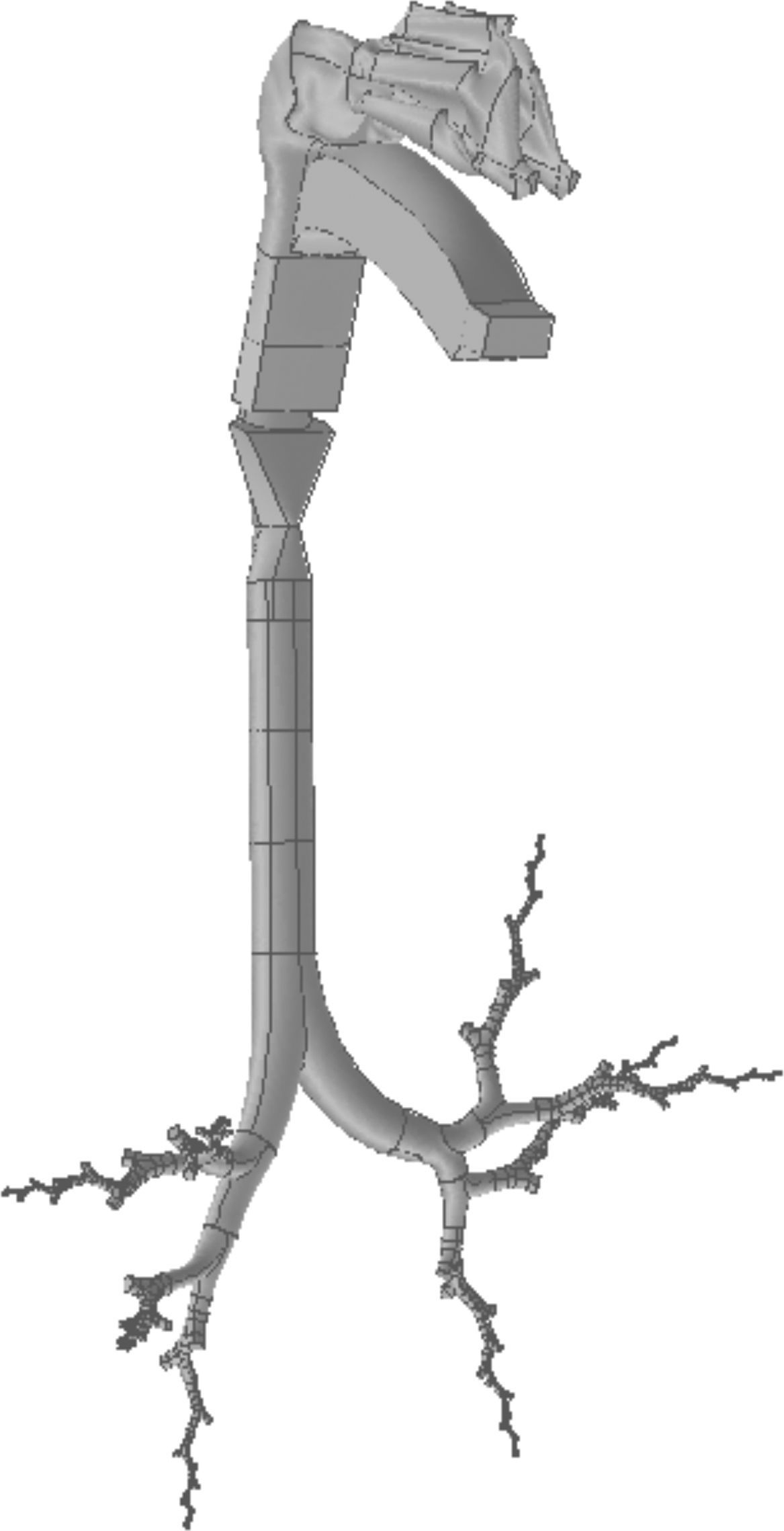
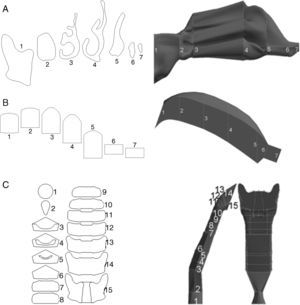
A este modelo además se le añadió la vía aérea superior (nariz, boca y región faringolaríngea) para completar toda la vía aérea de conducción. La nariz (fig. 2A) es un modelo simplificado del empleado por Castro-Ruiz9. El modelo fue desarrollado a partir de imágenes de cortes coronales obtenidos por tomografía computarizada (TC), cuyos perímetros han permitido la reconstrucción de las superficies longitudinales. La boca (fig. 2B) y la región faringolaríngea (fig. 2C) son una reproducción del modelo de Stapleton et al.10.
A)Geometría de la nariz, basada en el modelo desarrollado por Castro-Ruiz en 2003. A la izquierda se muestran los cortes coronales a determinados niveles de las fosas nasales, obtenidos por TC, con su correspondencia en el modelo (imagen de la derecha). El perímetro de los cortes coronales permitió la reconstrucción de las superficies longitudinales del modelo. B)Geometría de la boca. Se presentan diversos cortes coronales (izquierda), con su correspondencia en el modelo (derecha). C)Geometría de la región faringolaríngea. Se presentan distintos cortes en el modelo (izquierda), cuya localización se muestra en la imagen de la derecha.
Para la construcción de la boca se siguieron los mismos pasos que con la nariz. La geometría de la región faringolaríngea es más compleja, puesto que sus 3 orificios de entrada (las 2 coanas de las fosas nasales y el istmo de las fauces en la boca) deben fusionarse en un único conducto (la región faringolaríngea), cuya salida es la tráquea. El modelo completo de la vía aérea de conducción, desde la nariz y la boca hasta la generación 16 bronquial, se presenta en la figura 3.
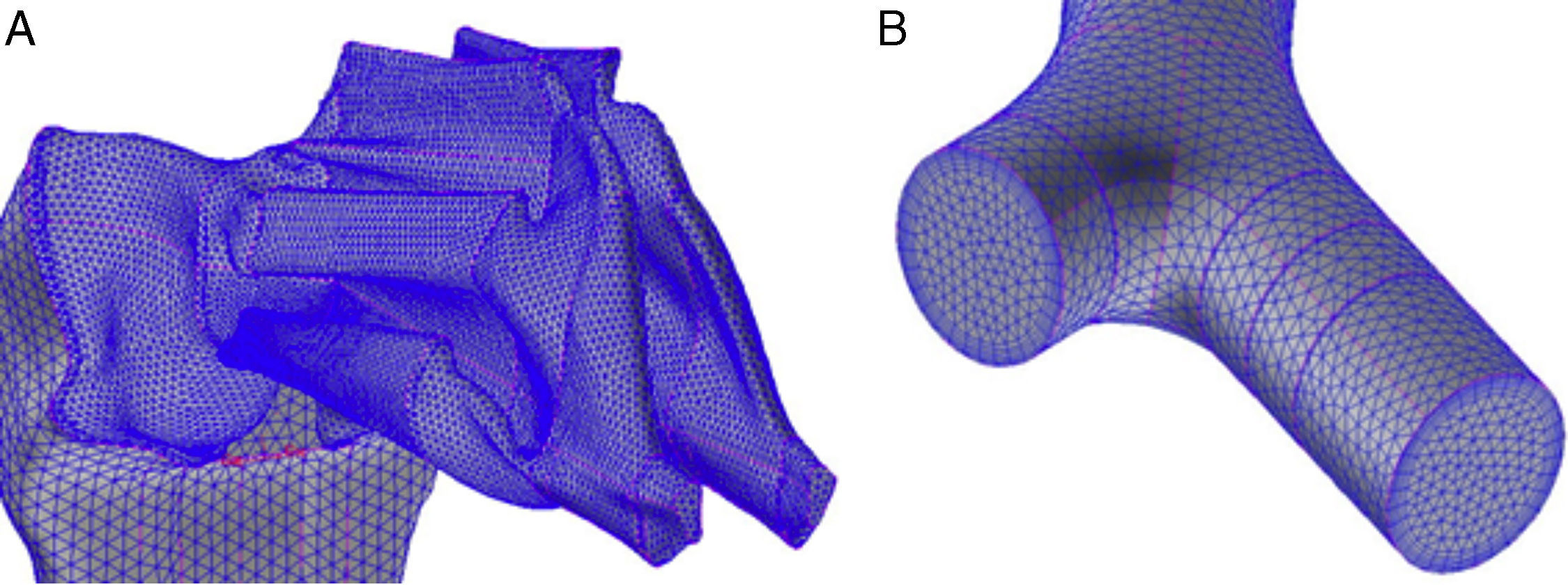
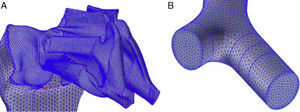
Preparación del modelo numéricoMalladoEs una parte fundamental del proceso, ya que de ella depende la correcta resolución de las ecuaciones de Navier-Stokes. Se parte del modelo geométrico antes descrito y se trata de dividirlo en celdas lo más regulares posible. Dada la morfología de las vías aéreas, la forma geométrica que mejor se adapta para realizar el mallado es el tetraedro. Las dimensiones de dichos tetraedros han de ser acordes a las dimensiones de los conductos y su forma ha de cumplir unos requisitos para que las ecuaciones se puedan resolver en ellas: tetraedros muy deformados o con mucha diferencia de tamaño entre zonas vecinas hacen que los resultados puedan ser incorrectos. Este proceso de mallado se realiza también con el programa Gambit del paquete Ansys-Fluent4 de CFD. Como resultado del proceso se obtienen aproximadamente un millón de celdas. Otros mallados con mayor y menor número de celdas fueron testados, comprobándose que un millón de celdas es un número adecuado para este modelo de la vía aérea, permitiendo reducir costes computacionales sin perder calidad de la información. Varios detalles del modelo con el mallado se presentan en la figura 4A,B.
Condiciones de contornoLa resolución de las ecuaciones de Navier-Stokes para cada problema depende de las condiciones iniciales y de contorno referentes a las variables (en este caso, la velocidad y la presión del aire) y a la superficie sólida (el modelo geométrico de la vía aérea). Hay que indicarle al programa Fluent del paquete de CFD Ansys-Fluent4 cuál va a ser la superficie de entrada del aire en el modelo (los orificios nasales o la boca) y cuáles van a ser las superficies de salida (los bronquiolos terminales). Las condiciones de contorno de entrada serán los caudales de respiración que deseen ser simulados (se emplearon caudales de 15, 30, y 75l/min), y como condición de contorno de salida se fija una presión relativa de cero. El valor de la presión no importa, ya que lo que se va a obtener como resultado son diferencias de presión: en la inspiración esta presión será negativa y en la espiración positiva, para permitir la entrada y salida de aire en el modelo. También hay que indicarle al programa con qué clase de fluido se va a trabajar, que en este caso será aire.
Resolución de las ecuacionesUna vez especificadas las condiciones de contorno con las que vamos a trabajar, el programa ya está preparado para resolver las ecuaciones de Navier-Stokes dentro de cada una de las celdas del modelo. Con todas las soluciones para las ecuaciones en cada una de las celdas, el programa conoce el comportamiento del aire globalmente en el modelo de la vía aérea. Las ecuaciones se resuelven mediante un método iterativo, partiendo de una solución aproximada y acercándose en cada iteración a la solución real. El proceso termina cuando la diferencia en los resultados entre una iteración y la anterior es inferior a 10−5, y por lo tanto se ha producido convergencia. Se establece un número determinado de iteraciones en el programa. Si se cumplen los criterios de terminación indicados, la simulación se para, y si no se cumplen el programa las realiza todas. Si a pesar de ello no se da la convergencia, se le debe indicar que realice más.
Simulación del depósito de partículas en el modeloEl programa, una vez simulado el flujo dentro del pulmón, permite calcular la trayectoria de las partículas que se introduzcan en el modelo, acorde con su velocidad, su tamaño y su peso. Se le deben indicar al programa las características de las partículas a estudiar:
- •
Material inerte: densidad de 1.000kg/m3.
- •
Tamaño: partículas de 1, 5, 10, 15 y 20μm de diámetro.
- •
Velocidad: la misma que el aire, ya que son transportadas por él
- •
Densidad de sembrado: 0,5%
- •
Número de partículas inyectadas en el modelo: 98.658.
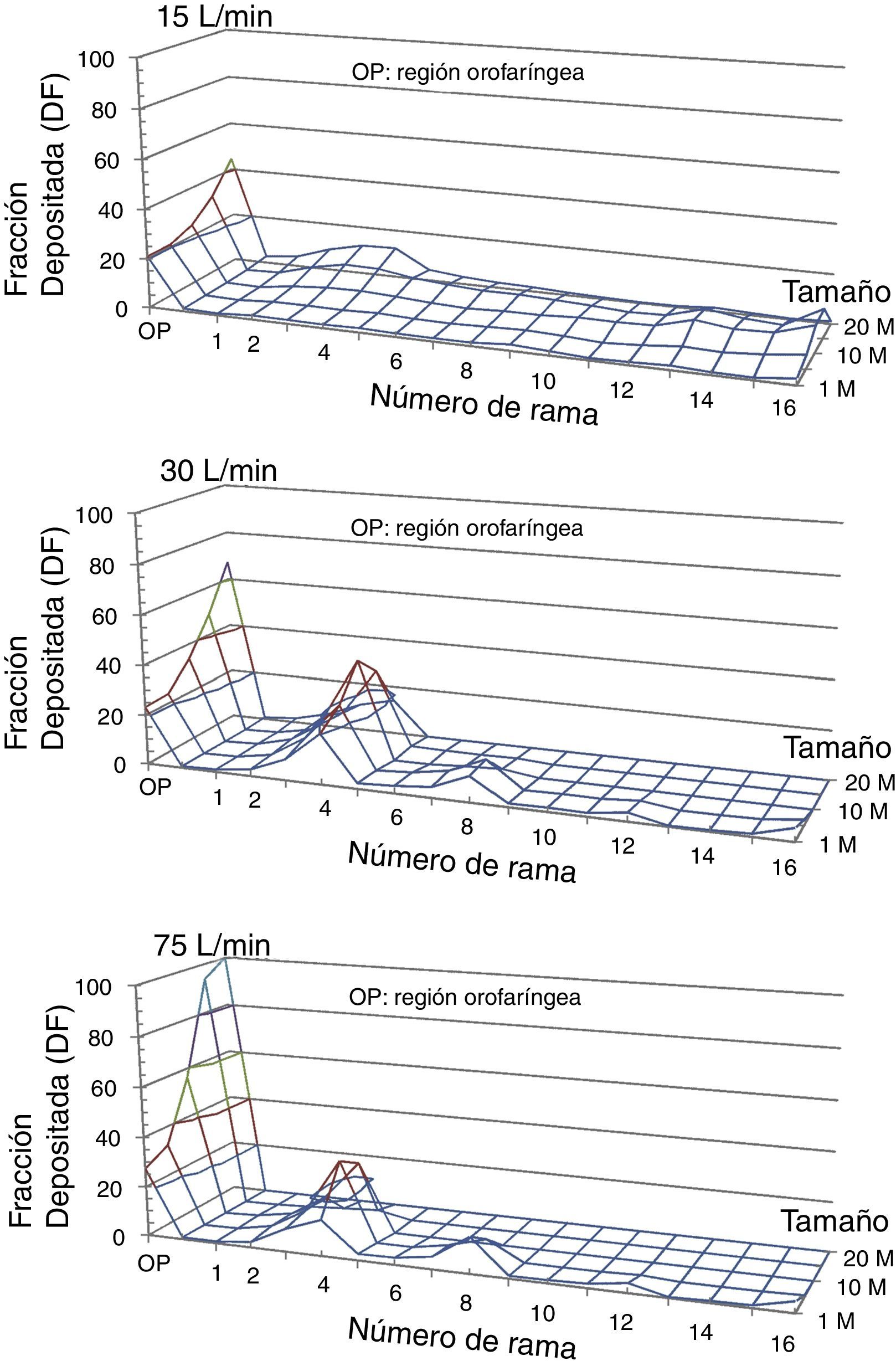
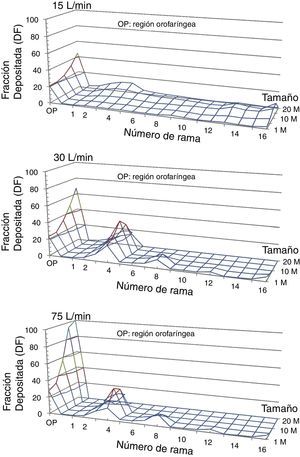
Se activa la opción por la cual cualquier partícula que choque contra la pared, queda atrapada por esta. Las partículas pueden ser introducidas bien a través de los orificios nasales o bien a través de la boca. Puesto que la administración de fármacos inhalados es a través de la boca, esta segunda opción será la elegida. El programa Fluent calcula la trayectoria de las partículas, permitiendo conocer la fracción de depósito (FD) en cada una de las generaciones del modelo. La FD se define como la relación entre la masa de las partículas atrapadas en una zona determinada del modelo y la masa del total de partículas que penetran en el modelo. En la figura 5 se presenta la FD para los caudales y el tamaño de partículas estudiados. Se puede observar cómo, cuando aumenta el tamaño de las partículas y se incrementa el caudal, las partículas tienden a quedar atrapadas en las primeras generaciones de la vía aérea, especialmente entre la orofaringe y la generación5.
Fracción de depósito en el modelo de la vía aérea (DF) de partículas de 1, 5, 10, 15 y 20μm de diámetro empleando flujos inspiratorios de 15, 30 y 75l/min. Puede observarse como, según se incrementa el flujo inspiratorio, las partículas tienden a quedar atrapadas en la región orofaríngea (OP) y en las primeras generaciones bronquiales. Lo mismo sucede con las partículas de mayor diámetro.
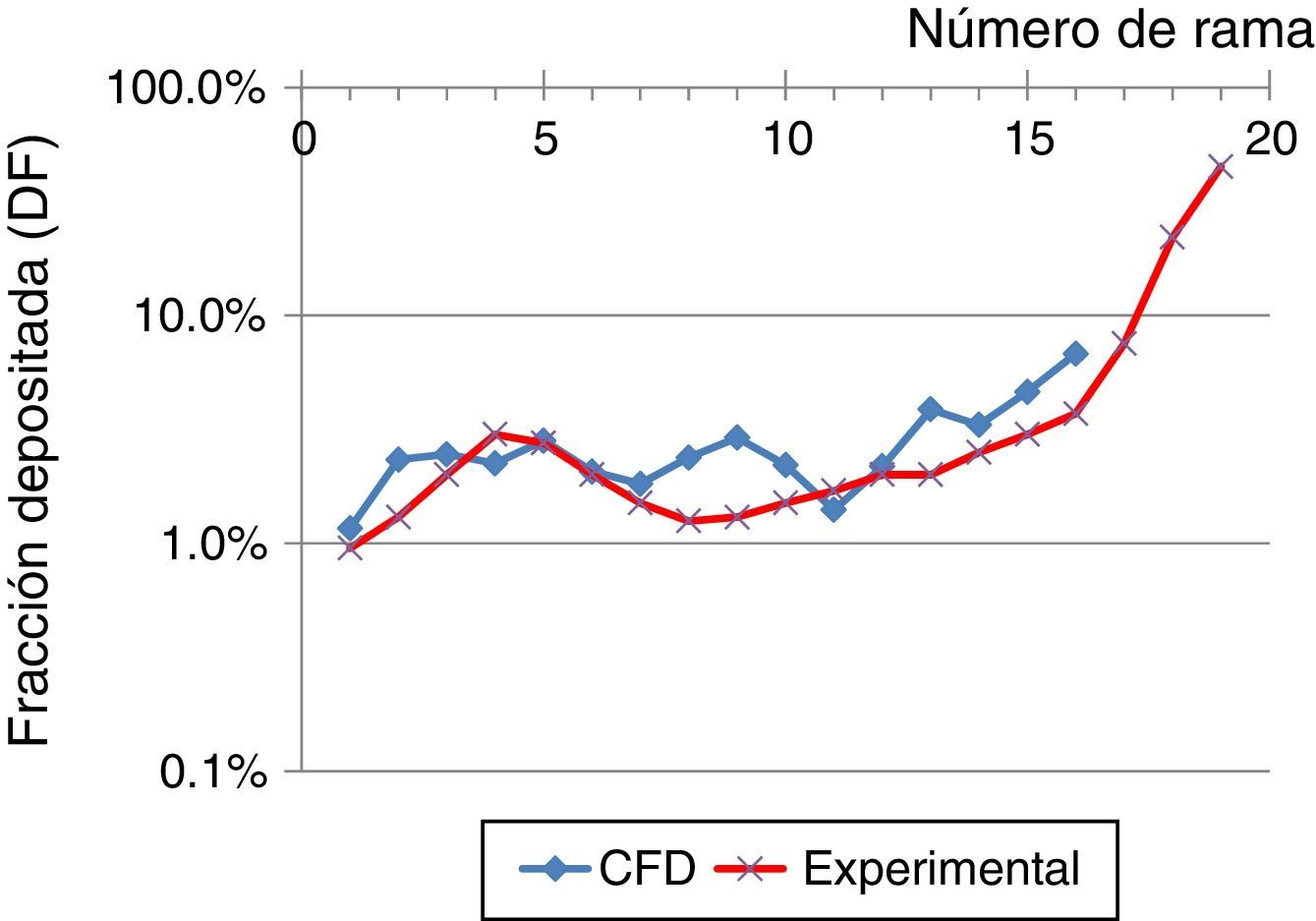
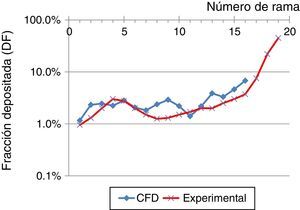
Estos resultados se compararon con los obtenidos por Conway et al.11, tal y como se muestra en la figura 6, estando excluida la región orofaríngea. El estudio de Conway se centró en el depósito de aerosoles en el tracto respiratorio de voluntarios sanos empleando técnicas de gammagrafía y SPECT. Las condiciones empleadas fueron un caudal inhalatorio de 18l/min con un diámetro de partículas de aerosol de 5,76μm. Estos resultados se compararon con los obtenidos mediante la simulación CFD empleando un flujo de 15l/min y partículas de 5μm hasta la generación16 de la vía aérea. La tendencia básica en ambos trabajos es un aumento del depósito pulmonar con la generación. Las diferencias entre ambos estudios pueden estar en relación con las condiciones de contorno empleadas y/o el modelo numérico empleado, pero puede observarse que ambos resultados muestran la misma tendencia.
Comparación en la fracción de depósito, empleando un flujo inspiratorio de 15l/min y partículas de 5μm, obtenidas en el estudio experimental de Conway et al.11, y las simulaciones mediante CFD de este trabajo.
Un aspecto destacable de la CFD es su carácter multidisciplinar. La CFD es una técnica que ya lleva años desarrollándose, pero casi siempre centrada en el entorno de la industria aeroespacial o en el diseño de nuevos prototipos de coches. Tímidamente, en los últimos años ha ido despuntando aplicada a la medicina, pero casi siempre aplicada al estudio de la dinámica circulatoria. Su aplicación al estudio de las patologías pulmonares y al depósito pulmonar de partículas inhaladas supone una gran novedad. Son muy pocos los grupos que han investigado una manera correcta de simular la cinética de los flujos de materia en los pulmones, empleando por lo general diseños que generalmente asumen simplificaciones que no los hacen comparables a un pulmón real. Nuestros trabajos tratan de aunar los conocimientos aplicados a toda la vía aérea de conducción y sus resultados han demostrado ser concordantes con el conocimiento actual del tema, obtenido a través de mediciones en laboratorio empleando métodos mucho más complejos, como la gammagrafía o el SPECT. Por otra parte, la CFD abre una nueva vía a la individualización de los tratamientos para las distintas patologías respiratorias. Disponer en la práctica clínica de un modelo de la vía aérea que determine con bastante exactitud patrones de depósito de fármacos inhalados permitirá establecer planes de tratamiento individualizados para los pacientes, acorde con sus características anatómicas y funcionales y a los requerimientos para su enfermedad. En el modelo aquí descrito se reconstruyó la vía aérea inferior hasta el nivel3 basándose en datos geométricos promedio de pacientes sanos, siguiendo después el modelo simétrico de Weibel hasta el nivel16. Con las técnicas actuales de tratamiento de imágenes se puede reconstruir la vía aérea de pacientes hasta los niveles3-4, complementando el resto con el modelo geométrico comentado. La reconstrucción del pulmón a partir de dichas imágenes exige disponer de programas específicos que permitan transferir el modelo creado al programa Ansys-Fluent (o similar) para su acople al resto de niveles y simulación posterior.
Hasta la actualidad los únicos métodos disponibles en la práctica clínica para estudiar el depósito de fármacos inhalados requerían someter al paciente a múltiples exploraciones tras haber inhalado en estrictas condiciones de laboratorio un radiofármaco. Además, estas exploraciones usualmente requieren exponer al paciente a dosis de radiación que no deben ser desdeñadas. Todo esto hace que estos métodos de estudio queden relegados únicamente al ámbito de la investigación. La CFD permite realizar estudios completos de pacientes sin someterlos a exploraciones innecesarias con riesgo para su salud, por lo que es una herramienta que debe ser tenida en consideración para la práctica clínica. Permite realizar ensayos de depósito de fármacos sin ninguna limitación, para seleccionar los que puedan resultar de interés y aplicarlos en pacientes.
No obstante, las técnicas de CFD también presentan limitaciones. Elaborar un modelo adaptado a cada paciente requiere inicialmente varios días de trabajo, aunque según se han ido explorando nuevos métodos para simplificar su desarrollo, como el empleo de modelos parcialmente desarrollados a través de una serie de ramales, se han ido reduciendo los tiempos de modelado y simulación. Además hay que tener en consideración que muchas de las enfermedades que afectan al aparato respiratorio modifican profundamente la arquitectura de la vía aérea. Por lo tanto, debe profundizarse en la simulación bajo estas condiciones, modificando la geometría del modelo. Asimismo, también se debe trabajar en la inclusión de la zona respiratoria en el modelo.
Hay que recordar que el éxito en el uso de las técnicas de CFD reside fundamentalmente en disponer de personal con suficiente experiencia y conocimientos en su manejo. Nuestro trabajo pretende dejar abiertas las puertas a futuras investigaciones en el tema, proporcionando las bases para iniciarse en la aplicación de la CFD a la neumología.
FinanciaciónLos autores quieren agradecer el apoyo económico prestado por la Fundación para el Fomento en Asturias de la Investigación Científica Aplicada y la Tecnología (FICYT) a través del proyecto «Depósito pulmonar de fármacos y partículas inhaladas: nuevas aplicaciones mediante la técnica de modelos de dinámica de fluidos computacional».
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.