La evidencia acumulada en los 3 últimos años sobre el manejo clínico de la tuberculosis (TB) con resistencia a fármacos ha sido tan importante que hace necesario actualizar la normativa que SEPAR publicó en 2017, sobre todo en lo referente a nuevos métodos diagnósticos, a la clasificación racional de los fármacos con actividad frente a Mycobacterium tuberculosis y a los esquemas básicos a recomendar en los pacientes con TB con resistencia a isoniacida, con resistencia a rifampicina o con multifarmacorresistencia. En el diagnóstico de la enfermedad recomendamos la utilización de métodos moleculares rápidos que son útiles además para la detección precoz de mutaciones asociadas a resistencias a fármacos. Para el tratamiento de los enfermos con TB con multifarmacorresistencia se hace necesario dar prioridad a esquemas orales acortados que incluyan bedaquilina, una fluoroquinolona (levofloxacino o moxifloxacino) y linezolid en lugar de los esquemas cortos previamente recomendados con aminoglucósidos y otros muchos fármacos de menor eficacia y más tóxicos. La recomendación de la normativa es que el diseño de los tratamientos en estos pacientes, tanto el inicial como si se precisan cambios, sea consultado siempre con expertos en el manejo de TB con resistencia a fármacos y que se realicen por personal con experiencia en TB y en unidades que garanticen la supervisión de los tratamientos y el abordaje de sus reacciones adversas.
New evidence and knowledge about the clinical management of drug-resistant tuberculosis (TB) in the last 3 years, makes it necessary to update the recent guideline published by SEPAR in 2017, mainly in relation to new diagnostic methods, drug classification, and regimens of treatment recommended to treat patients with isoniazid-resistance TB, rifampicin resistance TB and multidrug-resistant TB. With respect to tuberculosis diagnosis, we recommend the use of rapid molecular assays that also help to detect mutations associated with resistance. In relation to the treatment of multidrug-resistant TB we prioritize effective all-oral shorter treatment regimens including bedaquiline, a fluoroquinolone (levofloxacin or moxifloxacin), bedaquiline and linezolid, instead of the previously recommended short-course treatment with aminoglycosides and other less effective and more toxic drugs. The design of these regimens (initial schedule and changes in the regimen if necessary) should be made in accordance with drug-resistant TB experts; the treatment should be the responsibility of personnel with experience in the treatment of TB and in TB units guaranteeing the follow-up of the treatment and the management of drugs adverse effects.
En el año 2017, la Sociedad Española de Neumología y Cirugía Torácica (SEPAR) publicó su normativa sobre diagnóstico y tratamiento de la tuberculosis (TB) con resistencia a fármacos (TB-DR [se ha preferido TB-DR y no TB-FR, para seguir la terminología aceptada universalmente de Drug-resistant tuberculosis])1. Desde entonces ha habido publicaciones relevantes que han aportado nueva evidencia sobre el manejo de estos enfermos2-4, hecho que ha motivado la publicación de 2 nuevas guías por parte de la Organización Mundial de la Salud (OMS)5,6, y otra de la American Thoracic Society (ATS)/Centers for Disease Control and Prevention (CDC)/European Respiratory Society (ERS)/Infectious Diseases Society of America (IDSA)7, así como comunicaciones recientes de la OMS acerca del diagnóstico y tratamiento de la TB8-10.
Todo ello hace necesario actualizar la normativa SEPAR de 2017 de acuerdo con los nuevos conocimientos.
Diagnóstico de la tuberculosisXpert® MTB/RIF UltraEl Xpert® MTB/RIF Ultra (Cepheid) ha sido desarrollado como una nueva generación de la técnica para mejorar la sensibilidad, utilizando 2 dianas de amplificación (IS6110 e IS1081) y una cámara de reacción en cadena de la polimerasa más extensa (50μl en Ultra, vs. 25μl en Xpert® MTB/RIF), permitiendo un límite de detección micobacteriano más bajo para el Ultra (16 unidades formadoras de colonias por mililitro frente a las 131 de Xpert® MTB/RIF)11,12.
El Xpert® MTB/RIF Ultra utiliza las mismas categorías semicuantitativas que Xpert® MTB/RIF (alto, medio, bajo y muy bajo), añadiendo una nueva categoría denominada «trace detected» (trazas) que produce aumento de la sensibilidad (en TB pulmonar sensibilidad del 90% con relación al cultivo de esputo)8. En personas infectadas por el virus de la inmunodeficiencia humana (VIH), niños y TB extrapulmonar, los resultados «trace detected» deberían ser considerados resultados verdaderos positivos, lo mismo que en los pacientes en los que se realice esta prueba por sospecha de TB11.
La recomendación actual de la OMS para el uso del Xpert® MTB/RIF también se aplica para el Ultra como la prueba diagnóstica inicial para todos los adultos y niños con signos y síntomas de TB y para el estudio de muestras extrapulmonares seleccionadas (líquido cefalorraquídeo, nódulos linfáticos y muestras de tejidos) así como muestras en niños (nasofaríngeas, gástricas, heces8,11).
Posibilidad de utilizar otros métodos moleculares rápidos para el diagnóstico de la tuberculosis y la tuberculosis con resistencia a fármacosCon posterioridad a 2017 se ha acumulado evidencia para recomendar otros métodos moleculares, bien en sustitución del Xpert® MTB/RIF (versión normal o Ultra) o complementándolo, ya que esta prueba solo detecta mutaciones en rpoB; por ello mencionamos diferentes alternativas existentes: BD MAX® MDR-TB (Becton Dickinson)13; Abbott RealTime® MTB RIF/INH assay; FluoroType® MTBDR (Hain); Anyplex® MTB/NTM y Anyplex® MTB/MDR/XDR (Seegene); TrueNat® (Molbio Diagnostics)14. Todos ellos emplean sistemas de amplificación mediante reacción en cadena de la polimerasa en tiempo real para dianas específicas, con diferentes grados de automatización y que, además de la detección de Mycobacterium tuberculosis complex y de la resistencia a rifampicina (RR), algunos de ellos permiten (en uno o 2 pasos) ampliar el espectro de detección de resistencias a la isoniacida (H) (BD MAX® MDR-TB, Abbott RealTime® MTB RIF/INH assay, FluoroType® MTBDR, Anyplex® MTB/MDR/XDR), incluso la detección simultánea de micobacterias no tuberculosas (Anyplex® MTB/NTM) que son importantes en el diagnóstico diferencial cuando el diagnóstico de enfermedad por M. tuberculosis no se confirma por cualquiera de las técnicas utilizadas; o ampliar resistencias detectadas a fluoroquinolonas (FQ) y aminoglucósidos/polipeptídicos (Anyplex® MTB/MR/XDR), este último similar al GenoType®MDRsl ya mencionado en nuestra recomendación de 2017.
Es previsible que debamos estar atentos a nuevas tecnologías en un futuro inmediato dados los avances realizados en el diagnóstico de la enfermedad.
Por último, destacar que la utilización de las pruebas moleculares sirven además para mejorar el resultado final del manejo de los pacientes con TB (se ha demostrado, con la utilización del Xpert® MTB/RIF como prueba inicial en sustitución de la baciloscopia, una mejoría en la proporción de curación, reducción de mortalidad y de pérdida de casos antes del inicio del tratamiento8).
Discrepancias en los resultados de la resistencia a rifampicina por diferentes métodosCon la evidencia actual se acepta que cualquier método, correctamente realizado, que detecte la presencia de TB con RR (TB-RR) (ya sea fenotípico o molecular) debería ser tenido en cuenta y tratar al paciente como tal, aun cuando otros métodos aporten resultados discrepantes15. La secuenciación del genoma completo de M. tuberculosis ayuda a la resolución de las discrepancias y permite detectar mutaciones no identificadas por otros medios16,17. Es una prueba que sin lugar a duda formará parte de la rutina diagnóstica a medida de que su uso se difunda y generalice.
Bases del tratamiento de todas las formas de tuberculosis, tanto sensibles como con resistencia a los fármacosNúmero de fármacos necesarios para tratar la tuberculosisLa recomendación de emplear al menos 4 fármacos no utilizados previamente, o con certeza de que M. tuberculosis sea sensible a los mismos, se efectuó en base a que pudiese haber resistencia a alguno de ellos (caso de H en el esquema inicial) y porque algunos de ellos se consideraban poco eficaces, como es el caso de etionamida (Eto)/protionamida (Pto), cicloserina o ácido paraaminosalicílico en el caso de los enfermos con TB-RR/multifarmacorresistente (MDR, TB con resistencia, al menos, a H+R. Se ha preferido llamarla TB-MDR y no TB-MFR para seguir la terminología aceptada universalmente de multidrug-resistant tuberculosis)18,19. En la actualidad, con la posibilidad de conocer la sensibilidad a H+R al comienzo del tratamiento, o la de incorporar fármacos tan potentes como las FQ, linezolid (Lzd), bedaquilina (Bdq) y clofazimina (Cfz), con una bajísima probabilidad de que sean resistentes (o llevando a cabo una prueba molecular rápida en el caso de las FQ) y con buena actividad bactericida y esterilizante18-21, podría ser suficiente una pauta con solo 3 medicamentos nuevos, administrados durante 6-9 meses, para curar la TB con un mínimo riesgo de seleccionar resistencias o de posteriores recaídas18–20.
En aquellos casos en los que no se pudiera disponer de resultados de sensibilidad de alguno de los fármacos fundamentales en los que hay pruebas de sensibilidad fiables (H, R, FQ), o bien que dichas pruebas no existan (como en el caso de la Bdq) y pueda plantearse dudas de resistencias y se tenga que recurrir al alguno de dudosa eficacia, la recomendación de al menos 4 fármacos para tratar la TB seguiría vigente18,20,22. En el caso de la Bdq hay publicaciones en las que se alerta de la existencia de resistencias23,24, pero siguen siendo excepcionales y en entornos en los que no se ha utilizado adecuadamente dicho fármaco. Hemos de estar atentos a estas comunicaciones pero, de momento, en nuestro país se debe aceptar la sensibilidad a este fármaco.
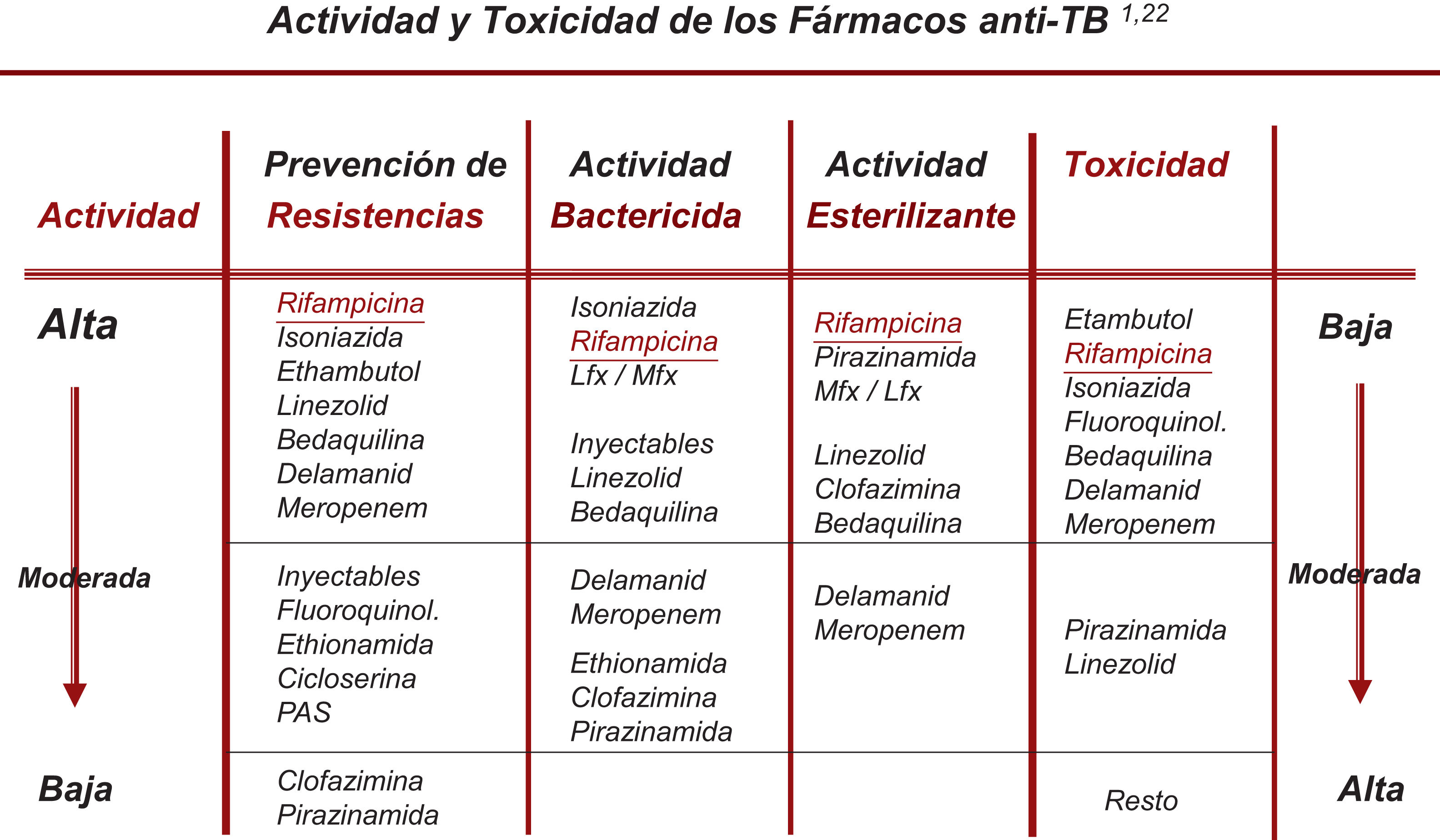
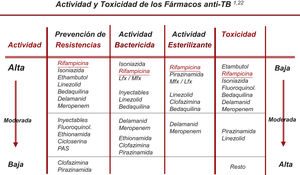
Cambio en la selección de los denominados fármacos esenciales y acompañantesTodos los nuevos fármacos (FQ, Lzd, Bdq, Cfz) incorporados ya de pleno al tratamiento de la TB-RR/MDR pueden ser considerados como esenciales (con buena capacidad bactericida y/o esterilizante), por lo que no sería necesario recurrir a los medicamentos acompañantes salvo en situaciones de resistencias muy extendidas19,20. En la actualidad, la recomendación debe ser la de utilizar al menos 3 fármacos esenciales, con al menos 1-2 con buena actividad bactericida y 1-2 con buena actividad esterilizante. Y no incluir ningún acompañante a no ser que no quede otra posibilidad22 (fig. 1).
Clasificación racional de los fármacos con actividad frente a M. tuberculosisEn este apartado se han producido cambios sustanciales que se exponen en la tabla 1, basados en los resultados del metaanálisis realizado por la OMS, en la posterior clasificación que recomendó esta organización y en los datos actualizados de la actividad bactericida y/o esterilizante de estos fármacos3,6,21.
Clasificación racional y uso secuencial que se debería hacer de los fármacos antituberculosos en el diseño de un esquema de tratamiento para la tuberculosis, tanto sensible como resistente a fármacos. (Esta tabla actualiza la tabla 3 de la normativa de 20171)
| Grupo 1. Fármacos de primera línea de administración oral |
| - Esenciales: rifampicina, isoniacida y pirazinamida |
| - Acompañante: etambutol |
| Grupo 2. Se correspondería con el actual grupo A de la OMS6. Se incluirían aquí 3 grupos de fármacos, para ser utilizados, de manera prioritaria y en el siguiente orden: |
| a Levofloxacino o moxifloxacino. Idealmente se debería descartar la resistencia a estos fármacos por métodos moleculares rápidos como el GenoType® o Anyplex® |
| b Linezolid |
| c Bedaquilina |
| Grupo 3. Se correspondería con el actual grupo B de la OMS6. Se incluirían aquí 2 fármacos, uno de ellos (clofazimina) con mucha mayor evidencia de su acción que el otro (cicloserina), si se tiene que elegir entre uno de los 2, siempre se le dará prioridad a clofazimina3,6 |
| a Clofazimina. Debe ser el fármaco de elección si no se puede emplear alguno de los fármacos del grupo 2 |
| b Cicloserina. En algunos casos concretos se podría anteponer alguno de los fármacos del grupo 4, en base a su mejor acción bactericida y/o esterilizante |
| Grupo 4. Se correspondería con el actual grupo C de la OMS6, pero la secuencia de su introducción en los esquemas debería ser la siguiente20: |
| a Meropenem, o imipenem/cilastatina. Ambos se deberían dar a la vez que amoxicilina/clavulánico para facilitar su eficacia |
| b Delamanid. En ocasiones se puede preferir utilizar este fármaco antes que los carbapenémicos por la posibilidad de utilizarlo por vía oral |
| c Amikacinaa. Solo se debería dar si se cumplen estas 3 condiciones. |
| 1 Existe un test molecular rápido que descarte posible resistencia |
| 2 Se pueden hacer controles audiométricos periódicos |
| 3 No existen otros fármacos disponibles de los previamente expuestos en los grupos 2 y 3 |
| d Etionamida o protionamida |
| e Pirazinamida. Aquí se refiere a su uso en casos de tuberculosis con resistencia a la rifampicina/tuberculosis multifarmacorresistente |
| f Etambutol. Aquí se refiere a su uso en casos de tuberculosis con resistencia a la rifampicina/tuberculosis multifarmacorresistente |
| g Ácido paraaminosalicílico |
aEn ocasiones se puede valorar el utilizar estreptomicina en lugar de amikacina si existe resistencia a amikacina y sensibilidad a estreptomicina, pero cumpliéndose también las 3 condiciones previamente expuestas en la tabla.
Hay cambios importantes sobre todo en el caso de la TB-RR/MDR y TB extensamente farmacorresistente (TB-XDR, [TB-MDR más resistencia al menos a una FQ y a un fármaco inyectable de segunda línea –kanamicina, amikacina, capreomicina–. Se ha preferido llamarla TB-XDR y no TB-XFR para seguir la terminología aceptada universalmente de extensively drug-resistant tuberculosis]) que se pueden ver en las tablas 2 y 3.
Esquemas básicos recomendados para los pacientes con tuberculosis sensible y mono-polirresistencia1,20,22. (Esta tabla actualiza la tabla 4 de la Normativa de 2017)
| 1. Casos TB iniciales con sensibilidad a R (sensibilidad a H conocida o desconocidaa,b |
| - 2 HRZE/4 HR, o 2 HRZ/4 HR |
| * 2 HRZ/4 HR en los casos en que se puede conocer la sensibilidad a H en las 2 primeras semanas |
| 2. Casos TB con resistencia a H (mono- o polirresistencia), pero con sensibilidad a Rc,d |
| - 9HRZE, o 6 Lfx-RZE (H) |
| 3. Casos con resistencia a R (mono- o polirresistencia), pero con sensibilidad a H, o si no se conoce la sensibilidad a H |
| - Mismo tratamiento que la TB-MDR, que se aborda en tabla 4, añadiendo H al régimen, pero sin contarla entre los 4 fármacos nuevos |
E: etambutol; H: isoniacida; Lfx: levofloxacino; R: rifampicina; TB: tuberculosis; Z: pirazinamida.
No cambiar a la fase de continuación (4HR) hasta que no se dé una de las 2 siguientes circunstancias: que ya la baciloscopia sea negativa, o que se sepa que existe sensibilidad a H y R.
Prolongar el tratamiento por encima de los 6 meses en aquellos pacientes en los que la negativización de las baciloscopias y/o cultivos se demora más allá de los 2 meses1,18. Como referencia, a estos pacientes se les prolongará el tratamiento con H+R hasta un mínimo de 4 meses después de que se negativicen los cultivos.
6 Lfx-RZE) solo se debe introducir en el régimen si se administra todo el esquema (incluyendo Lfx) desde el inicio. No se debe utilizar si el resultado de resistencia a la H se recibe después de 3-4 semanas de tratamiento, por el posible riesgo de realizar una monoterapia encubierta. En ese caso utilizar 9HRZE.
Esquemas básicos recomendados para los pacientes con TB-MDR6,9,10,19,20,22,30-32. (Esta tabla actualiza la tabla 5 de la normativa de 2017)
| 1. Casos con TB-MDR, pero sin resistencia a fármacos de segunda línea. Se podría utilizar uno de los siguientes esquemas, que se exponen por orden de prioridad: |
| A. Esquemas acortados orales, con Bdq |
| 1. Opción a: Si baciloscopia negativa al cuarto mes |
| 4 Bdqa-Lfx/Mfx-Cfz-Eto/Pto-E-Z-Hh/2 Bdq-Lfx/Mfx-Cfz-Z-E/3 Lfx/Mfx-Cfz-Z-E |
| Opción b: Si baciloscopia positiva al cuarto mes |
| 6 Bdqa-Lfx/Mfx-Cfz-Eto/Pto-E-Z-Hh / 5 Lfx/Mfx-Cfz-Z-E. |
| 2. 6b Bdq-hLfx-Lzd-Cfz / 3 hLfx-Lzd-Cfz |
| 3. 6-9 Bdq-hLfx-Lzdc |
| B. Esquema alargado por vía oral |
| 6 Bdq-Lfx-Lzd-Cfz/12 Lfx-Lzd-Cfz |
| 2. Casos con TB-MDR y resistencia añadida a las FQ, FISL, a ambos, o incluso patrones más amplios de resistencia de la TB-XDR |
| a. Consultar con expertos y diseñar un esquema que siga todas las recomendaciones efectuadas en esta normativa, buscando un mínimo de 3-4 fármacos nuevos, siguiendo la clasificación racional expuesta (grupos 1 a 4) en la tabla 1 de este documento y tratando de que el esquema lleve el máximo número de medicamentos bactericidas y esterilizantes |
| b. Para los casos que solo tienen TB-XDR y no resistencias a Bdq ni Lzd, se debe valorar el esquema de pretomanid que aún no está comercializado en España: |
| 6 Bdq-Lzd-pretomanid |
Bdq: bedaquilina; Cfz: clofazimina; E: etambutol; Eto: etionamida; FISL: fármacos inyectables de segunda línea; FQ: fluoroquinolonas; Hh: altas dosis de H (15-20mg/kg peso); hLfx: altas dosis de Lfx (1.000mg/día); Lfx: levofloxacino; Lzd: linezolid; Mfx: moxifloxacino; Pto: protionamida; TB-MDR: tuberculosis multifarmacorresistente; TB-XDR: tuberculosis extensamente farmacorresistente; Z: pirazinamida.
Si la baciloscopia continúa positiva al final del cuarto mes, esta fase intensiva se debería prolongar hasta los 6 meses con los mismos fármacos, todos (opción b). Si a los 6 meses sigue positiva se debe considerar como un indicador de que el esquema está fracasando y se debe valorar el diseñar un esquema alternativo.
No hay cambios con respecto a la normativa previa. El régimen de tratamiento ideal para los casos nuevos de TB en los que se presume sensibilidad a todos los fármacos, o bien se constata la ausencia de mutaciones en el gen rpoB (detección molecular de resistencia a R) mediante una prueba molecular, sería 2 HRZE/4 HR. Pero, en el caso de que se disponga de una prueba molecular que permita confirmar la ausencia de mutaciones tanto en rpoB como en katG e inhA (detección molecular de resistencia a H) en los primeros días del tratamiento, sería suficiente con 2 HRZ/4 HR14,18(recomendación fuerte, alta calidad de evidencia [⊕⊕⊕⊕]).
Para disminuir la posibilidad de errores y de posible selección de resistencias, estos fármacos deben administrarse siempre en dosis fijas combinadas y bajo tratamiento directamente observado en los pacientes que tienen factores de riesgo de mal cumplimiento terapéutico1.
Tratamiento de la tuberculosis con resistencia a isoniacida (mono- o polirresistencia), pero con sensibilidad a rifampicinaSe recomienda seguir dando prioridad al esquema 9 HRZE recomendado como prioritario en las recomendaciones de 20171(recomendación condicional, baja [⊕] a muy baja [] calidad de evidencia), valorando utilizar altas dosis de H, sobre todo si se tiene acceso a una prueba molecular rápida (GenoType®) que demuestre que no hay mutación en el gen katG. Pero el otro esquema recomendado en nuestra normativa de 2017, de 2 FQ-REZ/7 FQ-RE (E: etambutol, Z: pirazinamida), debería ser sustituido por el recomendado por la OMS de 6 Lfx-REZ(H) (Lfx: levofloxacino)5,6, pero atendiendo a las recomendaciones previas que exponíamos para el esquema que lleva la FQ, o sea, que Lfx solo se debe introducir en el régimen si se administra desde el inicio con el resto fármacos. No se debe añadir si el resultado de la resistencia a H se recibe después de 3-4 semanas de tratamiento, por el posible riesgo de realizar una monoterapia encubierta. Estas recomendaciones que dieron lugar a recomendar Lfx en este esquema, se basan en un metaanálisis2 en el que la gran mayoría de los pacientes provenían de lugares donde el resultado de la resistencia a H se conocía muy pronto, hecho que no es lo más habitual aún en nuestro medio. También hay que destacar que otro metaanálisis25 demuestra que con 9 RZE se curan por igual los casos con resistencia o sensibilidad a H.
Tratamiento de la tuberculosis con resistencia a rifampicina (mono- o polirresistencia), pero con sensibilidad a isoniacidaSe sigue manteniendo que casos de resistencia aislada a R son poco frecuentes en la práctica clínica, y que como la R es la que condiciona el pronóstico en los enfermos con TB-MDR, se debe enfocar a estos enfermos como pacientes TB-MDR, y tratarlos como tal, por supuesto añadiendo al esquema H, porque si se confirma su sensibilidad va a ser una importante aportación al tratamiento1,6(recomendación condicional, baja [⊕] a muy baja [] calidad de evidencia).
Tratamiento de la tuberculosis multifarmacorresistente (TB-MDR)La evidencia tan importante acumulada en este apartado3,4,6,19,20 obliga a cambiar notablemente las recomendaciones efectuadas en la normativa de 20171. Esta evidencia está conllevando, afortunadamente, cambios casi continuos en los últimos meses. Así, mientras en la guía de la OMS de marzo de 20196 se recomendaba de manera prioritaria los esquemas alargados (18-20 meses) orales, individualizados, tras los estudios con nuevos fármacos, la propia OMS ha publicado una comunicación rápida en diciembre de 20199 recomendando que se dé prioridad a los esquemas acortados orales con Bdq; y una nueva publicación en enero de 202010 donde, en base a la evidencia acumulada, se recomienda que sea un esquema acortado con Bdq el que sea utilizado de manera prioritaria.
Por lo tanto, en base a la evidencia más reciente, en el tratamiento de la TB-RR/MDR se debería dar prioridad a los esquemas acortado orales, basados en Bdq9,10, y no se deberían utilizar más en la TB-RR/MDR los esquemas acortados (o alargados) con inyectable. Como consecuencia, el esquema que se recomendó como prioritario en nuestra normativa de 2017 ya no se debería seguir utilizando, sobre todo porque se ha acumulado evidencia de que los esquemas orales son mejores y mucho menos tóxicos.
En base a esto, en estos pacientes se podría recomendar uno de los siguientes esquemas:
- A)
Esquemas acortados orales con Bdq
En este apartado se podrían valorar uno de los siguientes 3 esquemas, donde se analizarán sus ventajas e inconvenientes:
1° En este primer esquema hay 2 posibilidades:
- a)
Si la baciloscopia es negativa al cuarto mes: 4 Bdq*-Lfx/moxifloxacino (Mfx)-Cfz-Eto/Pto-E-Z-Hh/2 Bdq-Lfx/Mfx-Cfz-Z-E/3 Lfx/Mfx-Cfz-Z-E.
- b)
Si la baciloscopia es positiva al cuarto mes: 6 Bdq*-Lfx/Mfx-Cfz-Eto/Pto-E-Z-Hh/5 Lfx/Mfx-Cfz-Z-E.(recomendación condicional, baja [⊕] a muy baja [] calidad de evidencia)
*En ambas opciones la Bdq debe ser administrada durante 6 meses, en la primera opción acompañada de los fármacos de la fase intensiva durante los 4 primeros meses y de los de la fase de continuación en los 2 siguientes, completando el tratamiento con 3 meses más de los fármacos de la fase de continuación solos (9 meses en total). Pero si la baciloscopia sigue siendo positiva al final del cuarto mes, todos los fármacos de esta fase intensiva y la Bdq se administrarán durante 6 meses, seguidos de los fármacos de la fase de continuación durante 5 meses, siendo la duración total del tratamiento de 11 meses (opción b). Si la baciloscopia sigue siendo positiva al final del sexto mes, se aceptará el fracaso de este esquema y se deberá diseñar uno diferente. Hh significa altas dosis de H.
Este régimen de tratamiento tiene la ventaja de que es del que se tiene más evidencia y, por eso, es el que recomienda de manera prioritaria la OMS en su última publicación de enero 202010. Es prácticamente el mismo que recomendábamos en la normativa de 20171, y que estaba avalado por un metaanálisis26 y un ensayo clínico aleatorizado27, el único cambio de la sustitución de amikacina por Bdq. Pero tiene el inconveniente de que aún utiliza 7 fármacos en la fase intensiva, incluyendo algunos con muy escasa o dudosa eficacia3 como Eto/Pto, E, Z y Hh; alguno de ellos tan mal tolerado como Eto/Pto.
Debido a la rapidez con la que se están acumulando nuevas evidencias en este tema es de prever que la OMS modifique en breve sus recomendaciones en favor de una de las otras 2 opciones que se exponen a continuación.
2° 6 Bdq-hLfx-Lzd-Cfz/3 hLfx-Lzd-Cfz (recomendación condicional, baja [⊕] a muy baja [] calidad de evidencia)
Si la baciloscopia sigue siendo positiva al final del sexto mes, se aceptará el fracaso de este esquema y se deberá diseñar un esquema individualizado diferente. (hLfx significa altas dosis de Lfx). Se prefiere hLfx porque prolonga menos que Mfx el intervalo QTc en el electrocardiograma28, teniendo en cuenta que el esquema lleva otros 2 fármacos que también prolongan el QTc (Bdq y Cfz).
Este esquema tiene las ventajas de utilizar los 4 fármacos a los que se les da prioridad en las recomendaciones de la OMS de 20196 y que, como todos ellos tienen actividad esterilizante21, sería suficiente con estos 9 meses totales de tratamiento. Además, como Bdq, Lzd y Cfz apenas se han utilizado en el tratamiento de la TB-RR/MDR en España, hay que asumir una elevada probabilidad de que haya sensibilidad a los fármacos.
Idealmente, para empezar este esquema se debería tener un test de sensibilidad que descarte resistencia a las FQ, aunque se podría aplicar también en pacientes con TB-RR/MDR que nunca hayan recibido estos fármacos para el tratamiento de la TB.
3° 6-9 Bdq-hLfx-Lzd (recomendación condicional, baja [⊕] a muy baja [] calidad de evidencia)
En base a todo lo expuesto en el apartado del número de fármacos necesarios para tratar la TB, un esquema de 6 meses con altas dosis de Lfx+Lzd+Bdq18,19 cumpliría con todos los requisitos para ser considerado un esquema eficaz. Consta de 3 fármacos nuevos, con sensibilidad que se debe confirmar en el caso de Lfx, y todos ellos con capacidad bactericida y esterilizante18-21. En este esquema se prefiere Lfx a Mfx, por ser un fármaco que prolonga menos el espacio QTc en el electrocardiograma28, teniendo en cuenta que ya el régimen lleva otro medicamento con el mismo efecto (Bdq). En los casos en que al final del segundo mes la baciloscopia siga siendo positiva, se debería prolongar el régimen hasta los 9 meses, siempre y cuando esta baciloscopia y el cultivo sean negativos al final del cuarto mes de tratamiento15.
Este esquema es muy parecido al que se está probando con éxito en los ensayos clínicos aleatorizados para pacientes con TB-XDR, denominados NIX TB y BPal29,30(6 meses con Lzd+Bdq+pretomanid), que ha sido aprobado por la FDA de Estados Unidos31, con buenos resultados publicados recientemente32 y que ya ha sido incluido en las recomendaciones de la OMS9. El pretomanid no está comercializado en España. El estudio30,32 tiene limitaciones señaladas en el reciente comunicado de la OMS: pequeño número de pacientes (108) y observación de efectos adversos (alteraciones hematológicas, hepáticas, neuropatía óptica y periférica) aunque gran parte de estos estaban en relación con la utilización de dosis elevadas de Lzd (1.200mg/día), pudiendo ser suficiente con 600mg/día. El esquema acortado oral propuesto en esta normativa solo conllevaría, en relación con el NIX TB, el cambio de Lfx por pretomanid porque el NIX TB estaba indicado para pacientes con resistencia a las FQ. Y con los datos disponibles, pretomanid no es mejor que Lfx en el tratamiento de la TB33.
Las ventajas de estos esquemas orales de 6-9 meses (Lfx+Lzd+Bdq en TB-MDR y Lzd+Bdq+pretomanid en TB-XDR) serían que todos los fármacos se administran por vía oral y que utilizan los mejores fármacos de segunda línea, además de que no son ototóxicos, no necesitan controles de iones y que, al ser mucho más cortos, reducen el riesgo potencial de posibles abandonos. Los inconvenientes que tendrían estos esquemas también los tienen los otros, como son la necesidad de controlar el espacio QTc (al llevar 2 fármacos –Lfx y Bdq– que prolongan el QTc) y de realizar un buen control de la posible toxicidad por Lzd, aunque esta debería ser menor que en el resto de esquemas al utilizarse por un período de tiempo más corto.
Un esquema como el comentado, acortado y administrado por vía oral, ha de ser utilizado en condiciones programáticas de investigación (control, soporte e inclusión adecuada del paciente, principios de buena práctica clínica, consentimiento informado del paciente, monitorización y tratamiento activo de efectos secundarios de fármacos, monitorización del tratamiento, evaluación de la evolución final, recogida de datos estandarizada), que serían las condiciones mínimas para el manejo de estos enfermos9.
Es por lo tanto muy posible que de forma inmediata se pueda tratar a los pacientes con estos novedosos tratamientos en las condiciones citadas9.
Una limitación a destacar relacionada con la Bdq es su precio elevado y difícil accesibilidad. Dado su papel esencial en los nuevos esquemas de tratamiento, es necesario hacer esfuerzos a nivel institucional para facilitar su disponibilidad a nivel nacional.
- B)
Esquema alargado por vía oral.
Aunque hasta hace pocos meses era el recomendado como prioritario por la OMS6, en la actualidad debería relegarse a un segundo escalón10,11.
Constaría de una fase intensiva de 6 meses con Bdq+Lfx/Mfx+Lzd+Cfz, más una fase de continuación de 12 meses con Lfx/Mfx+Lzd+Cfz (recomendación condicional, baja [⊕] a muy baja [] calidad de evidencia), cumpliría con las premisas de las recomendaciones de OMS de marzo de 20196. El esquema propuesto por ATS/CDC/ERS/IDSA7 sigue el mismo orden de prioridad y grupos de fármacos que el de la OMS, aunque difiere en cuanto a mayor número de fármacos (5 en la fase intensiva y 4 en la de continuación) y con un tiempo más prolongado del tratamiento (15 a 21 meses después de la conversión del cultivo)7.
No queda duda de que este esquema debe ser muy eficaz, porque utiliza los fármacos mejores de los que se dispone en el tratamiento de la TB-RR/MDR3,6. Sin embargo, en base a lo expuesto con anterioridad, sería un esquema que podría estar utilizando demasiados fármacos (4) y demasiado tiempo, sobre todo al ser todos ellos muy potentes, con más que probable sensibilidad y con capacidad esterilizante19,20,34.
La disparidad entre dichas guías internacionales6,7 puede estar motivada porque las recomendaciones tienen un grado de baja o muy baja calidad de evidencia; y además porque ambas guías se basan en un metaanálisis que realizó la propia OMS para obtener el valor de cada uno de los fármacos en los diferentes esquemas de TB-RR/MDR3 en el que se concluyó que Lzd, carbapenémicos, Lfx/Mfx, Bdq y Cfz eran los fármacos más eficaces, y que el resto de medicamentos apenas aportaban nada al posible éxito del tratamiento de TB-RR/MDR; entre estos últimos se incluían Eto/Pto, cicloserina, ácido paraaminosalicílico, E y Z. Además, se evidenció que la inclusión de fármacos como kanamicina o capreomicina, se asociaba a un peor resultado terapéutico. Y fue en este metáanálisis3 en el que se concluyó que 4-5 fármacos efectivos y una duración mínima de 18 meses era la pauta más eficaz. Pero una limitación reconocida de este estudio es que en prácticamente todos los regímenes analizados había bastantes fármacos asociados con muy ligera o ninguna mejoría en los resultados (fármacos poco eficaces, débiles)3, y con escasa actividad esterilizante19.
Tratamiento de los pacientes con tuberculosis extensamente-farmacorresistente (TB-XDR) o incluso con patrones más amplios de resistenciaAunque en este apartado también se han producido avances importantes, seguimos opinando que estas formas de TB son de tan difícil manejo (clínico y programático) que deben ser tratadas por personal muy experto en el tema y en unidades que puedan garantizar una buena supervisión del tratamiento y el abordaje adecuado de sus reacciones adversas.
Manejo de los contactosLa novedad reseñable en este apartado es que se ha acumulado evidencia como para poder recomendar, como alternativa a revisiones periódicas que siguen siendo la recomendación más aceptada, un esquema preventivo con una FQ (Mfx o Lfx)35 en contactos íntimos de casos de TB-RR/MDR en los que se descarta enfermedad, sobre todo en niños o portadores de alguna inmunodeficiencia. Se debería dar por un periodo de 6 meses (recomendación condicional, muy baja [] calidad de evidencia).
Tratamiento de la tuberculosis en infectados por virus de la inmunodeficiencia humanaEl tratamiento de la TB, sensible o resistente a fármacos, en infectados por VIH es el mismo que en no infectados. En los pacientes que presenten ambas infecciones y que no hayan iniciado ningún tratamiento, se priorizará el inicio del tratamiento para la TB. Si el paciente presenta CD4<50/mm3 a las 2 semanas, tras la observación de una buena adherencia y de que no ha presentado efectos secundarios, se iniciará el tratamiento antirretroviral (cART). Con cifras superiores de CD4 el cART puede iniciarse después del segundo mes, cuando el paciente ya toma menos fármacos para la TB. Con estas pautas se ha observado una mejor supervivencia36,37. En los casos de meningitis tuberculosa, el cART debe iniciarse después de 8 semanas de tratamiento para la TB38.
Deben tenerse en cuenta las interacciones entre las rifamicinas y algunos antirretrovirales; en estos casos rifabutina sería una alternativa a la rifampicina pero imposibilitaría usar dosis fijas medicamentosas por lo que sería aconsejable un cART basado en efavirenz39.
Estos pacientes deben ser manejados por clínicos expertos en ambas infecciones, supervisando la adherencia a ambos tratamientos (usar tratamiento directamente observado si es necesario, en heroinómanos los programas de mantenimiento con metadona ayudan al tratamiento), vigilando efectos secundarios, posibilidad de síndrome de reconstitución inmune y siguiendo los controles habituales39. A escala mundial el problema de la TB asociada al VIH es muy grave y solo se resolverá con un gran compromiso político40.
Conclusiones- 1.
En el diagnóstico de la TB se recomienda el uso sistemático de pruebas moleculares rápidas para aumentar la sensibilidad diagnóstica de la enfermedad, realizar una detección precoz de las resistencias a fármacos y conseguir mejores resultados del tratamiento de los pacientes.
- 2.
A pesar de que las resistencias en TB complican el tratamiento y las posibilidades de éxito, con unas reglas básicas de manejo se pueden conseguir tasas aceptables de curación en la gran mayoría de los enfermos. Estas reglas básicas, que resumen prácticamente toda la normativa, se exponen en la tabla 4.
Tabla 4.Resumen de buenas prácticas en el manejo de TB-MDR. Esta tabla actualiza la 8abla 8 de la normativa de 20171
Pasos Consideraciones 1. Diagnóstico Tener en cuenta• Historia de fármacos: un mes de monoterapia, o el añadir un solo fármaco a un régimen de tratamiento que no está siendo eficaz, es un indicador importante de posible resistencia a este fármaco, o de su posible menor eficacia• Pruebas de sensibilidad a fármacos (PSF): Muy fiable para R, H, FQ y FISL. Menos fiable para S, E y Z. Muy poco fiable para Eto/Pto, Cs y PAS. Aún por estandarizar el método para Lzd, Bdq, Dlm, Cfz y carbapenémicos• Realizar un test molecular rápido que detecte TB-RR o TB-MDR en todos los casos en los que se presuma TB• A todos los casos con TB-RR o TB-MDR realizar una prueba molecular rápida para detectar resistencias a FQ y FISL• Realizar test de VIH 2. Número de medicamentos • Consulta y asesoramiento con expertos para diseñar un régimen efectivo• Al menos 3-4 medicamentos efectivos: nunca usados en el pasado o con sensibilidad demostrada por PSF, teniendo en cuenta fiabilidad de PSF comentada en punto 1 y posibles resistencias cruzadas• Al menos 1-2 fármacos con buena capacidad bactericida y al menos 1-2 con buena capacidad esterilizante. Intentar evitar fármacos sin capacidad bactericida, o esterilizante 3. Selección de medicamentos • Introducción racional según tabla 1• Dar siempre prioridad a los 3 fármacos del grupo 2 (FQ, Bdq, Lzd), siempre que haya sensibilidad demostrada (FQ) o presumida (Bdq, Lzd)• Utilizar altas dosis Lfx o moxifloxacino• En el caso de tener que recurrir al grupo 3, dar siempre prioridad a Cfz• En el caso de tener que recurrir al grupo 4, introducirlos siempre siguiendo este orden: carbapenémicos, Dlm, Am, Eto/Pto, Z, E y PAS 4. Esquemas de tratamientoa Pacientes TB-RR/MDR:• Ver la tabla 3, con recomendación de 3 esquemas acortados orales con Bdq, opción A (1a y b, 2,3*). *6-9 Bdq-hLfx-Lzd se usará si hay una prueba que demuestre sensibilidad a las FQ; y si Bdq y Lzd no se han utilizado previamente para el tratamiento de la TB del enfermo• También en dicha tabla ver esquema alargado por vía oral (opción B)• Pacientes TB-XDR: Valorar 6 Bdq-Lzd-pretomanid• Necesario controlar en todos ellos el espacio QTc en el electrocardiogramab• Siempre con tratamiento directamente supervisado 5. Cirugía Considerar solo si se cumplen estas 3 condiciones• 1. Menos de 4 fármacos efectivos; 2. Lesiones localizadas; 3. Reserva respiratoria suficiente tras la resección• Valorar sobre todo en TB-XDR y pre-TB-XDR por resistencia a FQ Am: amikacina; Bdq: bedaquilina; Cfz: clofazimina; Cs: cicloserina; Dlm: delamanid; E: etambutol; Eto: etionamida; FISL: fármacos inyectables de segunda línea; FQ: fluoroquinolonas; hLfx: altas dosis de Lfx (1.000mg/día): H: isoniacida; Lfx: levofloxacino; Lzd: linezolid; PAS: ácido paraminosalicílico; PSF: prueba sensibilidad a fármacos; Pto: protionamida; R: rifampicina; S: estreptomicina; TB-MDR: tuberculosis multifarmacorresistente; TB-RR: tuberculosis con resistencia a la rifampicina; TB-XDR: tuberculosis extensamente farmacorresistente; VIH: virus de la inmunodeficiencia humana; Z: pirazinamida.
aSiempre se debe consultar con un experto a la hora de diseñar un esquema de tratamiento para estos pacientes.
bLevofloxacino, moxifloxacino y clofazimina, al igual que bedaquilina y delamanid pueden producir alteraciones del QTc en el ECG. Recomendamos dos documentos42,43 acerca de los efectos que producen los fármacos utilizados en el tratamiento de la tuberculosis MDR y XDR en el QTc del ECG.
- 3.
Los esquemas de tratamiento para estos pacientes, tanto los iniciales como sus modificaciones, se deben consultar siempre con expertos. A tal fin, las autoridades sanitarias41 y/o las sociedades científicas deberían promover la organización de grupos de expertos a nivel estatal.
- 4.
La prioridad principal seguirá siendo dar un tratamiento adecuado a todos los pacientes con TB sensible y conseguir una buena adherencia para evitar el desarrollo de resistencias.
La presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro. No tiene financiación
Conflicto de interésLos autores declaran no tener ningún conflicto de interés ni directa ni indirectamente con el contenido del manuscrito.