La enfermedad pulmonar intersticial (EPI) es una de las principales causas de muerte en los pacientes con esclerosis sistémica (ES). En este estudio se investigaron biomarcadores en el aire exhalado (AE) y en el condensado de aire exhalado (CAE) y se analizó su posible papel como factores pronóstico de la EPI en pacientes con ES.
MétodosSe analizó prospectivamente la fracción exhalada de óxido nítrico (FeNO) y el monóxido de carbono exhalado (COe) en AE, y se determinaron los valores de pH, nitritos, nitratos e interleucina-6 en CAE, en 35 pacientes con ES. La tomografía computarizada de alta resolución (TACAR) torácica mostró signos de EPI en 12 pacientes, no estando presentes en los 23 restantes. En el momento de la inclusión se determinaron los biomarcadores en el AE y en el CAE, y durante los 4 años de seguimiento se efectuaron anualmente pruebas de función respiratoria.
ResultadosNo se observaron diferencias entre grupos en los valores iniciales de los diferentes biomarcadores. En todos los pacientes examinados los valores disminuidos de pH en CAE se asociaron con una reducción en la capacidad de difusión de monóxido de carbono (DLCO) durante el seguimiento. Valores disminuidos de FeNO se correlacionaron con una menor capacidad vital forzada (FVC) inicial y a los 4años, así como con una reducción de FVC y DLCO durante el seguimiento. En los pacientes con EPI los valores más altos de COe se correlacionaron con FVC más disminuidas al inicio. En el conjunto de la cohorte se identificó una menor supervivencia libre de progresión en los pacientes con un pH en CAE inferior a 7,88 y en los que presentaban un FeNO inferior a 10,75ppb (Log Rank: p=0,03 y p<0,01, respectivamente).
ConclusionesLos biomarcadores en el AE y en el CAE son útiles para detectar pacientes con una mayor probabilidad de presentar un deterioro de la función pulmonar durante el seguimiento de la enfermedad.
Interstitial lung disease (ILD) is one of the major causes of death in systemic sclerosis (SSc). This study investigated exhaled breath (EB) and exhaled breath condensate (EBC) biomarkers in patients with SSc and analyzed their role as a prognostic tool in SSc-related ILD.
MethodsFraction exhaled nitric oxide (FeNO) and exhaled carbon monoxide (eCO) measured in EB, together with pH, nitrite, nitrate and interleukin-6 levels measured in EBC were prospectively analyzed in 35 patients with SSc. Twelve patients had established ILD by chest high-resolution computed tomography (HRCT), and 23 patients showed no evidence of ILD. EB and EBC biomarkers were determined at inclusion, and pulmonary function tests were annually performed during 4 years of follow-up.
ResultsNo differences at baseline biomarkers levels were found between groups. In all patients studied, low EBC pH levels were associated with a decreased diffusing capacity for carbon monoxide (DLCO) during follow-up. Low FeNO levels were correlated with lower forced vital capacity (FVC) at baseline, 4years of follow-up and with a decrease in FVC and DLCO during monitoring. Among ILD patients, high eCO levels were correlated with lower baseline FVC. In the global cohort, a worse progression-free survival was identified in patients with EBC pH values lower than 7.88 and FeNO levels lower than 10.75ppb (Log Rank P=.03 and P<.01, respectively).
ConclusionsEB and EBC could help to detect patients likely to present a deterioration on lung function during follow up.
La esclerosis sistémica (ES) es una enfermedad del tejido conjuntivo caracterizada por una disfunción endotelial que condiciona una vasculopatía de pequeño vaso, disfunción fibroblástica con una producción excesiva de colágeno y alteraciones inmunológicas1. En la actualidad, la enfermedad pulmonar intersticial (EPI) es una de las primeras causas de muerte en la ES2,3. La prevalencia de EPI en la ES varía dependiendo de la población estudiada, la definición y la sensibilidad de los métodos utilizados para su diagnóstico de comprobación. Goh et al.4 propusieron un sencillo esquema de estratificación basado en la extensión de la enfermedad en la tomografía computarizada de alta resolución (TACAR) y su repercusión en las pruebas de función respiratoria (PFR), con el que se obtenía la mejor predicción de progresión de la enfermedad y de mortalidad a largo plazo. Recientemente se ha descrito que la interleucina-6 (IL-6) sérica es un factor de predicción de progresión de la EPI-ES, en concreto en pacientes con enfermedad leve en estadios iniciales5.
Una característica frecuente de la EPI-ES es el aumento de células inflamatorias en el lavado broncoalveolar6,7. Sin embargo, este hallazgo no se correlaciona con la supervivencia ni con la progresión a largo plazo8, por lo que únicamente se utiliza para excluir la presencia de una infección y con fines de investigación3. Aunque se ha descrito que el análisis de diversos biomarcadores tanto en el esputo inducido como en el aire exhalado (AE) y en el condensado de aire exhalado (CAE) en la afectación pulmonar de la esclerodermia pueden ser útiles9-13, su posible valor sigue siendo motivo de controversia y es necesario disponer de otros biomarcadores obtenidos por métodos no invasivos capaces de pronosticar la progresión de la enfermedad.
El propósito de nuestro estudio fue determinar mediante métodos no invasivos (AE y/o CAE) el proceso inflamatorio autoinmune que provoca la EPI-ES. En este contexto, se plantearon 2 objetivos principales. El primero fue analizar biomarcadores en AE y CAE de pacientes con ES en función de la presencia o ausencia de EPI, y estudiar su asociación con las PFR iniciales. El segundo fue determinar si dichos biomarcadores se correlacionaban con la progresión de la enfermedad al cabo de 4años y si tenían un posible valor pronóstico.
MétodosPacientesSe llevó a cabo un estudio prospectivo en el que se incluyó a 35 pacientes de raza blanca (32 mujeres) con diagnóstico de ES que cumplían los criterios de clasificación ACR/EULAR 201314, que disponían de una TACAR inicial y en los que se realizó un seguimiento durante 4años. Los pacientes fueron evaluados consecutivamente en la Unidad de Esclerodermia de nuestro hospital y controlados por el mismo médico especialista cada 4meses en los casos que presentaban EPI moderada-grave o cada 6meses en aquellos sin afectación pulmonar o con EPI leve, de acuerdo con las recomendaciones de las guías internacionales15. El Comité ético del hospital aprobó el estudio y, en cumplimiento con la Declaración de Helsinki, todos los pacientes otorgaron su consentimiento informado para participar. Los criterios de exclusión comprendieron la presencia de otras enfermedades respiratorias inflamatorias (tales como asma, EPOC u otras), atopia o una infección respiratoria durante el mes anterior a la inclusión en el estudio.
Grupos del estudioLa población de estudio se dividió en 2 grupos: el grupo de EPI, formado por 12 pacientes con EPI, definida como evidencia radiológica de enfermedad intersticial en la TACAR, y que incluyó un paciente con hipertensión pulmonar asociada a EPI (HP-EPI), y el grupo de control, formado por 23 pacientes con ES que no presentaban signos de EPI, entre los cuales se incluyeron 2 pacientes con hipertensión arterial pulmonar (HAP) aislada. La HP se definió como presión arterial pulmonar media (PAPm) ≥25mmHg medida por cateterismo cardíaco derecho (CCD). La presencia de HP-EPI se consideró si el diagnóstico de HP se realizaba ante un paciente con EPI y capacidad vital forzada (FVC) inferior al 60% del valor teórico o enfermedad intersticial moderada o grave en la TACAR16. La HAP aislada se diagnosticó mediante CCD, de acuerdo con las guías internacionales16,17. También se registraron otras comorbilidades de la ES, como se ha descrito anteriormente18. Al inicio del estudio, a todos los pacientes se les realizó PFR completas y se les recogió la fracción exhalada de NO (FeNO), monóxido de carbono (CO) exhalado (COe) y el CAE. Se indicó a los pacientes que no consumieran alimentos ni fumaran durante las 2 y 24h previas a la extracción de las muestras, respectivamente. Todas las muestras se analizaron en el mismo laboratorio.
Pruebas de función respiratoriaLas espirometrías, volúmenes pulmonares estáticos y estudios de difusión pulmonar anuales se efectuaron mediante un equipo MasterLab (MasterLab, Jaegger, Alemania), siguiendo las recomendaciones de la ERS-ATS19. Se analizaron las PFR en la evolución según el cambio en el porcentaje teórico de FVC o en la capacidad de difusión de monóxido de carbono (DLCO), en comparación con la visita de inicio.
Determinación de la fracción exhalada de óxido nítricoLas determinaciones de FeNO se realizaron mediante el dispositivo NIOX MINO® (Aerocrine AB, Solna, Suecia) de acuerdo con las guías vigentes20. Durante el proceso los pacientes permanecieron en sedestación y con una pinza nasal, inhalando aire libre de NO a través del dispositivo y a continuación exhalaban a un flujo fijo de 50ml/s durante aproximadamente 10s. Para el análisis se utilizó la primera medición técnicamente aceptable de la FeNO21.
Determinación de monóxido de carbono exhaladoEl CO exhalado se determinó con un sensor electroquímico mediante un dispositivo MicroCO (MicroCO; Micro Medical Ltd., Rochester, Kent, Reino Unido). Se solicitó a los pacientes que realizasen una inspiración profunda hasta la capacidad pulmonar total, retuviesen el aire durante 20s y luego espirasen lenta y completamente a través de la boquilla. Se efectuaron 2 registros sucesivos, y los cálculos se efectuaron a partir de los valores máximos.
Obtención y procesamiento de las muestras de condensado de aire exhaladoEl CAE se obtuvo mediante un condensador comercializado (EcoScreen; Jaeger, Würzburg, Alemania). Con la pinza nasal puesta, los pacientes respiraron a volumen corriente a través de una boquilla conectada al condensador. Se recogió un volumen fijo de 150l de aire exhalado por paciente22. Las muestras de CAE se dividieron en alícuotas de 500μl para su procesamiento, una de las cuales se utilizó para determinar el pH tras la desgasificación y el resto se conservaron de inmediato a −70°C, y se analizaron durante el mes siguiente a su obtención.
El pH del CAE se determinó tras la desgasificación con helio (350ml/min durante 10min) mediante un pH-metro calibrado (Modelo GLP 21; Crison Instruments SA, Barcelona, España) con una precisión en el pH de ±0,01 y una sonda para pequeños volúmenes (Crison 50 28; Crison Instruments SA, Barcelona, España). La sonda se calibró diariamente con tampones estándar de 7,02 y 4,0023.
Las concentraciones de nitritos (NO2−) y nitratos (NO3−)se determinaron mediante una prueba colorimétrica basada en la reacción de Griess (Cayman Chemical Company, EE.UU.). Los valores de concentración se obtuvieron mediante un lector de microplacas a 540nm de absorbancia. La sensibilidad de la prueba fue de 1μM para los nitritos y de 2,5μM para los nitratos.
Las concentraciones de IL-6 se evaluaron mediante un análisis de inmunoabsorción ligado a enzimas (ELISA) de alta sensibilidad disponible comercialmente (Bender MedSystems GmbH, Austria). La sensibilidad de la prueba era de 0,03pg/ml.
Análisis estadísticoSe efectuaron pruebas no paramétricas para evaluar la existencia de diferencias estadísticamente significativas. Los datos categóricos se analizaron mediante la prueba de chi-cuadrado y la prueba exacta de Fisher. En cuanto a los datos continuos, las diferencias intergrupos se analizaron mediante la prueba de la U de Mann-Whitney, y para las comparaciones intragrupo se utilizó la prueba de Wilcoxon para datos apareados. Las asociaciones entre variables se estudiaron mediante la correlación de Spearman. Se utilizaron curvas de eficacia diagnóstica (ROC) junto con el método del índice de Youden para determinar el valor umbral de cada biomarcador que demostrara la mayor sensibilidad y especificidad en la predicción de una disminución de un 10% en la FVC o de un 15% en la DLCO, o la muerte. La prueba de Log Rank se utilizó para determinar la supervivencia libre de progresión (SLP) durante el seguimiento, cuyo objetivo primario fue la aparición de un evento combinado negativo, definido por la disminución desde la visita de inicio de un 10% en la FVC, la disminución del 15% en la DLCO o muerte. Los valores de p<0,05 se consideraron significativos. Los diferentes análisis estadísticos se efectuaron mediante SPSS 20.0 para Windows (SPSS Inc., Chicago) y GraphPad InStat4 (GraphPad Software Inc., San Diego).
ResultadosDatos inicialesLos datos demográficos y las características iniciales de la población del estudio se muestran en la tabla 1. La mediana (rango intercuartílico [RIC]) de edad fue de 59,0 (42,0 a 68,0) años. En todos los pacientes con EPI, la TACAR fue compatible con neumonía intersticial no específica, y no se observó ningún signo de EPI en los sujetos del grupo control. La mediana de duración de la enfermedad pulmonar en el grupo de EPI fue de 1,4años. En el momento de la inclusión, 7 pacientes recibían tratamiento inmunosupresor.
Variables demográficas y características iniciales de los pacientes incluidos en el estudio
| Total (n=35) | EPI (n=12) | Controles (n=23) | p | |
|---|---|---|---|---|
| Mujeres | 32 (91,4) | 10 (83,3) | 22 (95,7) | 0,26 |
| Edad, años | 59,0 (42,0 a 68,0) | 64,5 (52,5 a 70,2) | 58,0 (36,0 a 67,0) | 0,31 |
| Fumadores activos | 4 (11,4) | 1 (8,3) | 3 (13,0) | 1,0 |
| ES limitada | 28 (80,0) | 8 (66,7) | 20 (87,0) | 0,20 |
| Tiempo transcurrido desde el primer síntoma, años | 13,0 (3,5 a 28,3) | 10,2 (1,5 a 35,4) | 13,3 (5,0 a 28,3) | 0,69 |
| Tiempo transcurrido desde el primer síntoma no FR, años | 7,1 (1,5 a 12,6) | 7,6 (1,7 a 10,0) | 7,1 (1,5 a 13,3) | 0,71 |
| ANA | 35 (100) | 12 (100) | 23 (100) | n.a. |
| ACA | 18 (51,4) | 5 (41,7) | 13 (56,5) | 0,40 |
| Scl-70 | 4 (11,4) | 3 (25,0) | 1 (4,3) | 0,10 |
| EPI | 12 (34,2) | 12 (100) | 0 (0) | < 0,001 |
| Duración de la EPI, años | – | 1,4 (0,3 a 5,0) | – | n.a. |
| HP | 3 (8,6) | 1 (8,3) | 2 (8,6) | 1,0 |
| HP-EPI | 1 (2,9) | 1 (8,3) | 0 (0) | 0,34 |
| HAP aislada | 2 (5,7) | 0 (0) | 2 (8,6) | 0,53 |
| Afección gastrointestinal | 32 (91,4) | 11 (91,7) | 21 (91,3) | 1,0 |
| Afección de la motilidad esofágica | 30 (85,7) | 11 (91,7) | 19 (82,6) | 0,64 |
| Afección gástrica | 7 (20,0) | 2 (2,4) | 5 (21,7) | 1,0 |
| Afección cardíaca | 13 (37,1) | 6 (50,0) | 7 (30,4) | 0,29 |
| Insuficiencia renal crónica | 1 (2,9) | 0 (0) | 1 (4,3) | 1,0 |
| Hipertensión arterial | 10 (28,6) | 3 (25,0) | 7 (6,6) | 1,0 |
| Dislipidemia | 2 (5,7) | 1 (8,3) | 1 (4,3) | 1,0 |
| Diabetes mellitus | 0 (0) | 0 (0) | 0 (0) | n.a. |
| Tratamiento inmunosupresor | 7 (20) | 5 (41,7) | 2 (8,7) | 0,03 |
| Prednisona ≤ 5mg/día | 5 (14,3) | 3 (25,0) | 2 (8,7) | 0,31 |
| Micofenolato sódico | 4 (11,4) | 3 (25,0) | 1 (4,3) | 0,10 |
| Ciclofosfamida i.v. | 1 (2,9) | 1 (8,3) | 0 (0) | 0,34 |
| Fármacos no inmunosupresores | 35 (100) | 12 (100) | 23 (100) | 1,0 |
| Inhibidores de la bomba de protones | 35 (100) | 12 (100) | 23 (100) | 1,0 |
| Bloqueantes de los canales de calcio | 22 (62,9) | 7 (58,3) | 15 (65,2) | 0,72 |
| Antiagregantes plaquetarios | 15 (42,9) | 6 (50,0) | 9 (39,1) | 0,72 |
| IECA o ARA-II | 10 (28,6) | 1 (8,3) | 9 (39,1) | 0,11 |
| N-acetilcisteína | 2 (5,7) | 2 (16,7) | 0 (0) | 0,11 |
| Terapia con liberadores de NO | 2 (5,7) | 0 (0) | 2 (8,7) | 0,53 |
ACA: anticuerpos anticentrómero; ANA, anticuerpos antinucleares; ARA-II: antagonistas del receptor de la angiotensinaii;EPI: enfermedad pulmonar intersticial; ES: esclerosis sistémica; FR: fenómeno de Raynaud; HAP: hipertensión arterial pulmonar; HP: hipertensión pulmonar; IECA, inhibidores de la enzima conversora de angiotensina; i.v.: intravenoso; n.a.: no aplicable.
Para las variables continuas los datos se presentan mediante la mediana (rango intercuartílico [RIC]); para las variables categóricas, mediante n (%).
Las pruebas de imagen, PFR y biomarcadores iniciales se detallan en la tabla 2. Al inicio del estudio los grupos presentaban diferencias significativas en FVC, TLC, DLCO y KCO, con valores más disminuidos en el grupo de EPI. En ambos grupos se analizaron los biomarcadores del AE y del CAE iniciales. No se observaron diferencias estadísticas en la FeNO ni en el COe. Sin embargo, se halló una asociación positiva entre la FeNO y la FVC inicial (r=0,41, p=0,03). En el grupo de EPI se observó una correlación negativa entre los niveles de COe y la FVC inicial (r=−0,75, p<0,01). En cuanto a los biomarcadores del CAE, no hubo diferencias significativas entre grupos. Sin embargo, al analizar a 11 pacientes que presentaban opacidades en vidrio deslustrado en la TACAR, la mediana del pH del CAE fue significativamente más baja que en los pacientes en los que no se constató este patrón radiológico (7,4 vs. 8,0, p=0,02). No se observaron otras asociaciones entre los hallazgos de la TACAR y los valores de biomarcadores al inicio del estudio.
TACAR, PFP, ecocardiografía y biomarcadores del aire exhalado y del condensado de aire exhalado al inicio del estudio
| EPI (n=12) | Controles (n=23) | p | |
|---|---|---|---|
| Hallazgos en la TACAR | 12 (100) | 0 (0) | < 0,001 |
| Opacidades en vidrio esmerilado | 11 (91,7) | 0 (0) | < 0,001 |
| Opacidades reticulares | 6 (50,0) | 0 (0) | < 0,01 |
| Panalización | 1 (8,3) | 0 (0) | 0,36 |
| Pruebas de función pulmonar | |||
| FVC* | 73,3 (62,3 a 91,9) | 90,9 (83,7 a 103,0) | 0,03 |
| FEV1* | 81,2 (65,7 a 108,4) | 98,9 (85,2 a 107,9) | 0,09 |
| FEV1% (FEV1/FVC) | 80,9 (76,1 a 88,3) | 80,6 (76,0 a 83,2) | 0,13 |
| TLC* | 82,7 (70,9 a 92,6) | 104,3 (95,8 a 111,5) | 0,001 |
| DLCO* | 47,7 (41,2 a 59,1) | 70,9 (59,1 a 86,6) | < 0,01 |
| KCO* | 55,2 (46,9 a 66,5) | 67,3 (63,6 a 85,3) | 0,02 |
| Ecocardiografía | |||
| PSVD, mmHg | 35,0 (29,5 a 45,0) | 31,0 (25,5 a 41,2) | 0,60 |
| Aire exhalado | |||
| FeNO, ppb | 10,5 (7,5 a 16,5) | 12,0 (9,2 a 20,7) | 0,23 |
| COe, ppm | 3,0 (2,0 a 4,0) | 3,0 (2,0 a 8,2) | 0,77 |
| Condensado del aire exhalado | |||
| pH | 7,5 (6,9 a 7,9) | 8,0 (7,4 a 8,2) | 0,05 |
| Nitrito, μM | 3,7 (1,9 a 5,8) | 3,2 (1,4 a 4,8) | 0,57 |
| Nitrato, μM | 6,4 (3,5 a 10,9) | 8,7 (5,8 a 13,8) | 0,38 |
| IL-6, pg/ml | 0,06 (0,03 a 0,10) | 0,07 (0,05 a 0,10) | 0,61 |
COe: monóxido de carbono exhalado; DLCO: capacidad de difusión de monóxido de carbono; EPI: enfermedad pulmonar intersticial; FeNO: fracción exhalada de óxido nítrico; FEV1: volumen espiratorio forzado en el primer segundo; FEV1%: cociente FEV1/FVC expresado en porcentaje; FVC: capacidad vital forzada; IL-6: interleucina-6; KCO: DLCO/volumen alveolar; n.a.: no aplicable; PSVD: presión sistólica ventricular derecha; TACAR: tomografía computarizada de alta resolución; TLC: capacidad pulmonar total.
Datos expresados mediante la mediana (RIC).
En un subestudio en el que se excluyó a los 7 pacientes que recibían tratamiento inmunosupresor se observaron las mismas diferencias en las PFR y los biomarcadores del AE y CAE iniciales.
Datos del seguimientoUn paciente del grupo control con un valor de pH de 8,09 en el CAE y de una FeNO de 14,5ppb al inicio del estudio presentó durante el seguimiento una EPI leve, diagnosticada mediante TACAR, y FVC superior al 70% a los 45meses de seguimiento, y posteriormente HP-EPI identificada mediante CCD a los 47meses. Durante el seguimiento fallecieron 4pacientes, 2 del grupo de EPI y 2 del grupo de control, uno por HAP y otro por un ictus.
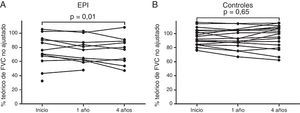
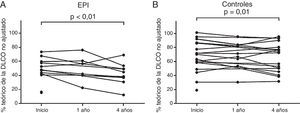
En las figuras 1 y 2 se muestran los valores de FVC y DLCO, respectivamente, de los 2 grupos del estudio durante el periodo de seguimiento.
Valores de FVC iniciales y durante el seguimiento. En A y B se muestra la variación no ajustada del porcentaje teórico de FVC durante el seguimiento (cada punto representa un paciente) de los pacientes con EPI y los sujetos de control, respectivamente. En el grupo de EPI se observó una disminución de un 6,4% en la media de los valores de FVC durante el periodo de 4años, en comparación con los valores iniciales (IC95%: −11,2 a −1,6; p=0,01) (A), mientras que en el grupo control no se observaron diferencias significativas (B). En el grupo de EPI la disminución de la FVC fue mayor que en el grupo de control (p<0,01).
Valores de DLCO iniciales y durante el seguimiento. En A y B se muestra la variación no ajustada del porcentaje teórico de la DLCO durante el seguimiento (cada punto representa un paciente) de los pacientes con EPI y los sujetos de control, respectivamente. Los valores de DLCO fueron significativamente más bajos al cabo de 4años de seguimiento, en comparación con los valores iniciales, en el grupo de EPI, con una disminución media de un 11,1% (IC95%: −18,0 a −4,3; p<0,01) (A), y en el grupo de control, con una disminución media de un 5,5% (IC95%: −10,0 a −1,1; p=0,01) (B).
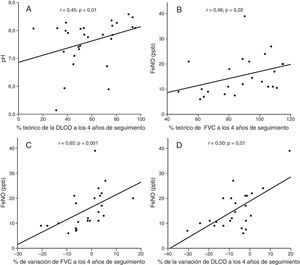
Las correlaciones entre los biomarcadores del CAE y las PFR se muestran en la figura 3. En el conjunto de todos los pacientes, los valores disminuidos de pH se correlacionaron con valores disminuidos de DLCO al final del seguimiento de 4años (fig. 3A). Asimismo, los valores disminuidos de FeNO se asociaron con menor FVC al final del seguimiento (fig. 3B). Los valores disminuidos de FeNO al inicio del estudio se asociaron con descensos de la FVC y la DLCO a los 4años de seguimiento (fig. 3C y D). En los pacientes con EPI se observó una correlación negativa entre los valores elevados de COe y los valores más disminuidos de FVC al final del seguimiento (r=−0,66; p=0,03). Además, se observó una tendencia hacia una correlación entre altas concentraciones de IL-6 y los valores más disminuidos de DLCO al final del estudio en los pacientes con EPI (r=−0,53; p=0,10). En el resto de los biomarcadores del CAE no hubo asociaciones significativas.
Correlación entre el pH del CAE y FeNO y las pruebas de función respiratoria. En la figura se representan las correlaciones que incluyen a todos los pacientes. Las variaciones en los porcentajes de FVC y de DLCO se calcularon en relación con los parámetros iniciales (PFR a los 4años menos PFR iniciales). FeNO: fracción exhalada de NO.
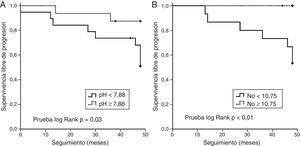
Para cuantificar la precisión de las predicciones de deterioro funcional o muerte según los valores iniciales de cada biomarcador se utilizaron curvas ROC. El área bajo la curva (AUC) del pH del CAE fue de 0,65 (IC95%: 0,41 a 0,89; p=0,23) y el valor umbral de 7,88 fue establecido por el método del índice de Youden, con una sensibilidad de 0,71 y una especificidad de 0,58. El AUC de la FeNO fue de 0,81 (IC95%: 0,65 a 0,96; p=0,01) y se determinó un valor umbral de 10,75ppb, con una sensibilidad y una especificidad de 0,85 y 0,77, respectivamente. Las curvas de Kaplan-Meier ilustran la SLP en función de los anteriores valores de corte de pH y FeNO (fig. 4). Un valor de pH en el CAE inferior a 7,88 se asoció a una disminución de los parámetros de función pulmonar o a muerte durante el seguimiento (log Rank: p=0,03). Un valor de FeNO inferior a 10,75ppb se relacionó con peor SLP (log Rank: p<0,01). No se observaron diferencias estadísticas en la supervivencia en relación con los valores iniciales de COe.
Gráficos de supervivencia de Kaplan-Meier que representan la supervivencia libre de progresión desde la recogida del CAE. El objetivo primario fue el siguiente: la disminución de la FVC inicial de al menos un 10% o la disminución de la DLCO del 15% o muerte durante el seguimiento. A) En el gráfico de supervivencia se muestra mejor supervivencia libre de progresión en los pacientes con valores de pH en el CAE iguales o superiores a 7,88. B) En el gráfico de supervivencia se muestra mayor supervivencia libre de progresión en los pacientes con valores de FeNO iguales o superiores a 10,75ppb.
En el subestudio en el que fueron excluidos los pacientes que recibían tratamiento inmunosupresor, el AUC para el pH del CAE fue de 0,66 (IC95%: 0,44 a 0,88; p=0,18) al utilizar el mismo valor umbral de 7,88, pero no hubo diferencias estadísticas en cuanto a la SLP (log Rank: p=0,09). Respecto al FeNO, se obtuvo un AUC de 0,88 (IC95%: 0,74 a 1,0; p=0,18), con un valor umbral de 10,25ppb, con una sensibilidad de 0,80 y una especificidad de 0,84. Además, se identificó peor SLP en los pacientes cuyos valores de FeNO eran inferiores a 10,25ppb (log Rank: p<0,01).
DiscusiónEn los pacientes con ES estudiados, los valores bajos de pH en el CAE o de FeNO se asociaron a peor SLP a lo largo de los 4años de seguimiento. En los pacientes con EPI-ES, los valores altos de COe se asociaron con un valor de FVC inicial menor, y también tras 4años de seguimiento, aunque no se ha demostrado un valor pronóstico.
En nuestro estudio, un único paciente del grupo de control, que al inicio del estudio presentaba valores de pH en el CAE y de FeNO elevados, desarrolló EPI tras 45meses de seguimiento. Esto es indicativo de que los biomarcadores del CAE no predicen el desarrollo de EPI-ES a largo plazo, pero desafortunadamente carecemos de datos a corto plazo que nos permitan verificar estos resultados.
En algunos estudios anteriores se ha observado que los valores de pH en el CAE pueden disminuir en el asma no controlada, en las infecciones respiratorias en pacientes con bronquiectasias, en la EPOC o en la fibrosis quística24. Sin embargo, en enfermedades pulmonares intersticiales se ha observado que los valores aumentan en la fibrosis pulmonar25 y disminuyen en la asbestosis26. No existen estudios al respecto en ES, sea como marcador de la enfermedad o del pronóstico. En este trabajo hemos observado que los pacientes con opacidades en vidrio esmerilado en la TACAR muestran valores bajos de pH en el CAE, lo que respalda la hipótesis de que los biomarcadores del CAE podrían estar influenciados por el tipo de inflamación presente en el pulmón. El papel pronóstico del pH en el CAE no se pudo confirmar al examinar únicamente a aquellos pacientes que no recibían tratamiento inmunosupresor, lo cual se podría explicar por la exclusión de los pacientes con EPI más grave y por el pequeño tamaño de la población analizada. Los procesos inflamatorios activan diversos mecanismos que acidifican las vías aéreas proximales, como consecuencia de un posible mecanismo de defensa innato27. Estos mecanismos consisten en: una producción y excreción de iones superóxido y protones por las células epiteliales respiratorias, así como una inhibición de la actividad glutaminasa en dichas células y, finalmente, el reclutamiento de macrófagos y neutrófilos, cuya lisis incrementa la acidez del entorno28. A pesar de que en la esclerodermia es característica la presencia de una infiltración linfocitaria en los alvéolos, se ha demostrado también una inflamación de tipo neutrofílico en los bronquios, de manera más notable en los pacientes que presentan fibrosis pulmonar13. De hecho, la acidificación producida por el reclutamiento de neutrófilos podría explicar este componente inflamatorio.
En cuanto a la IL-6, en un estudio transversal previo los valores de esta citocina en el CAE se correlacionaron negativamente con la TLC, DLCO y KCO en el momento de la evaluación de la EPI9. En la EPI-ES se han observado altas concentraciones de IL-6 en el lavado broncoalveolar29. Recientemente, las concentraciones séricas elevadas de IL-6 se han relacionado con una reducción en los valores espirométricos o muerte durante el primer año en pacientes con EPI más leve5. En este sentido, nosotros observamos una tendencia hacia una asociación entre concentraciones elevadas de IL-6 en el CAE al inicio del estudio y las DLCO más bajas al final del seguimiento.
En el presente trabajo, los valores bajos de NO al inicio se correlacionaron con la FVC inicial y con disminuciones de FVC y DLCO al cabo de 4años de seguimiento. Este estudio es el primero que demuestra el valor pronóstico de la FeNO en la EPI-ES, al observarse una relación entre los valores iniciales inferiores a 10,75ppb y peor SLP. La FeNO representa la cantidad de NO exhalado, correspondiente a la mezcla de la concentración alveolar de NO exhalada (CaNO) y del NO difundido a partir de la pared de la vía aérea (JawNO)30. Con flujos superiores a 50ml/s, a diferencia del estudio actual, la concentración alveolar de NO predomina respecto a la fracción total, pero los flujos más lentos representan la difusión en la vía aérea31. Moodley y Lalloo32 describieron valores más altos de NO en pacientes con ES sin fibrosis pulmonar al comparar con pacientes con EPI-ES o sujetos control. Malerba et al.33 también encontraron que los valores de FeNO eran más bajos en pacientes con EPI-ES que en los que no presentaban EPI. Otros autores han comparado la FeNO en la ES y no han observado diferencias estadísticas entre pacientes con y sin EPI, e incluso al compararlos frente a sujetos sanos34. De hecho, a pesar de no haber encontrado diferencias estadísticas, nuestro trabajo y todos los estudios anteriores han descrito que los valores de FeNO son más bajos en pacientes con ES y EPI que en los que no presentan esta complicación pulmonar34,35.
Pese a ello, en trabajos centrados en el análisis de la CaNO se han observado incrementos de este parámetro en pacientes con ES, en comparación con sujetos sanos36, y particularmente en pacientes con ES y EPI12,35. Los valores elevados de CaNO se han asociado con una reducción en la función pulmonar o la muerte, con una especificidad del 90%12.
En nuestro estudio, el flujo seleccionado podría haber afectado a los resultados debido a la baja representación del espacio alveolar. Asimismo, no determinamos la CaNO, lo que impide la exploración de resultados divergentes en comparación con la FeNO. Los valores reducidos de FeNO se podrían explicar por una restricción en la producción de NO por parte de la NO sintetasa en las vías aéreas proximales, como consecuencia de su inhibición por los altos valores de CaNO, secundarios a la inflamación pulmonar con incremento de la producción alveolar por parte de la NO sintetasa inducible. Sin embargo, estos datos demuestran que los pacientes con ES y valores bajos de FeNO presentaron peores resultados durante el seguimiento, lo que podría indicar la presencia de una EPI más agresiva. Debido a que la FeNO y la CaNO representan diferentes componentes de la respiración, son necesarios otros estudios que puedan dilucidar el papel fisiopatológico del NO en la EPI asociada a ES.
Un resultado novedoso de este estudio es la correlación entre los valores más altos de COe y la menor FVC al inicio del estudio y tras 4años de seguimiento en pacientes con ES-EPI, a pesar de que este hallazgo no ha demostrado ser un factor pronóstico. Es bien sabido que muchas enfermedades pulmonares inflamatorias cursan con niveles elevados de COe37. Hasta donde alcanza nuestro conocimiento, no existe ningún estudio en la esclerodermia, aunque algunos autores han apoyado la posibilidad de que patologías que cursan con alteraciones microcirculatorias podrían incrementar los niveles endógenos de CO13,38. El hecho de que únicamente uno de los pacientes con EPI fuese fumador activo y que se le recomendase no fumar permitiría descartar que el tabaco fuera el responsable de esta relación.
La principal limitación del estudio fue el reducido tamaño muestral, lo que no permitió efectuar un análisis multivariante. La duración de la afectación pulmonar no fue homogénea, por lo cual algunos biomarcadores inflamatorios se podrían haber infraestimado debido a la inclusión de pacientes con enfermedad en estadios muy avanzados, en los que el estado de inflamación pulmonar es menor. Siete pacientes recibían tratamiento inmunosupresor, lo que podría haber afectado a las concentraciones iniciales de biomarcadores. No obstante, en el subestudio en el que se excluyó a estos pacientes no se observaron diferencias sustanciales, con la excepción del rol pronóstico del pH en el CAE, que no pudo demostrarse. La falta de mediciones estandarizadas de estos biomarcadores podría constituir una limitación, al igual que la no repetitividad de las muestras de CAE en los estudios que incluyeron a pacientes con EPI-ES. Finalmente, no se pudo conseguir la correlación entre los valores de FeNO y de CaNO por la falta de datos de CaNO en los pacientes con ES.
La EPI es una de las primeras causas de muerte en la ES, lo que explica los esfuerzos realizados para hallar herramientas de pronóstico indispensables para dilucidar el curso de esta enfermedad. Este estudio es el primero que ha establecido el rol del pH en el CAE, la FeNO y el análisis del COe como factores de pronóstico en la EPI asociada a ES. Son necesarios más estudios que permitan confirmar nuestros resultados y aclarar la correlación existente entre los valores de FeNO y de CaNO en pacientes con esclerodermia. En este sentido, los biomarcadores del AE o del CAE podrían ser relevantes tanto para el seguimiento como para la identificación de los pacientes con EPI en la ES, con la ayuda de pruebas no invasivas. Esto conducirá a la identificación de los pacientes con mayor riesgo de deterioro y que precisan una estrecha supervisión.
FinanciaciónA. Guillén-del Castillo ha recibido una beca Contratos Predoctorales de Formación en Investigación (PFIS) del Instituto de Salud CarlosIII [FI14/00643]. M.J. Cruz ha recibido financiación del programa Miguel Servet del Instituto de Salud CarlosIII [CP12/03101].
Conflicto de interesesLos autores han declarado no tener ningún conflicto de intereses directa o indirectamente relacionado con el contenido del manuscrito.