Introducción
Estudios recientes con un elevado nivel de evidencia científica han establecido que los pacientes con síndrome de apneas-hipopneas durante el sueño (SAHS) presentan una mayor prevalencia de hipertensión arterial (HTA) que la población general, incluso tras ajustar los resultados para distintas variables de confusión como el índice de masa corporal (IMC), la edad o el sexo1,2. Se han propuesto varios mecanismos fisiopatológicos como responsables de una posible relación de causalidad entre ambas entidades, de los que probablemente el mejor estudiado sea el incremento intermitente del tono simpático nocturno producido por un exceso de trastornos respiratorios durante el sueño (TRS)3,4. Esta relación parece además comportarse de un modo lineal, de forma que a mayor número de TRS, cuantificados habitualmente mediante el índice de apneas-hipopneas (IAH), mayor probabilidad existe tanto de presentar HTA1,2 como de desarrollarla en el futuro5, en ocasiones con un difícil control médico pese a la utilización de varios fármacos antihipertensivos6.
Más del 50% de los pacientes hipertensos tratados no consiguen controlar sus cifras de presión arterial (PA)7,8. Aproximadamente un 10% de ellos se mantienen con cifras elevadas a pesar del tratamiento con una combinación de 3 o más fármacos antihipertensivos a una dosis y con un cumplimiento terapéutico adecuados9. Estos pacientes resistentes al tratamiento suelen acumular una incidencia elevada de eventos vasculares y, por lo tanto, precisan un control médico exhaustivo10. En un porcentaje variable de casos se desconoce la causa de este descontrol de la PA, a pesar de haber descartado todas las posibles causas de HTA secundaria habituales11. Existen pocos datos acerca de la relación existente entre un exceso de TRS y un peor control de las cifras de la PA, si bien se ha planteado que el SAHS podría funcionar como un factor de riesgo en este sentido, dada su elevada prevalencia en pacientes con HTA mal controlada6,12,13. Sin embargo, la presencia de la obesidad como variable de confusión (muy prevalente tanto en pacientes con SAHS como en hipertensos)14 y la heterogeneidad en la definición de la HTA utilizada en los diversos estudios en cuanto a su resistencia al tratamiento han hecho que en ocasiones los resultados sean difícilmente comparables.
El objetivo del presente estudio ha sido analizar la relación existente entre los TRS y la HTA de difícil control, entendida como aquella que permanece elevada a pesar del tratamiento con 3 o más fármacos antihipertensivos, así como la influencia de otras variables de confusión en esta relación.
Pacientes y método
Se incluyó inicialmente en el estudio a todos los pacientes controlados en nuestro centro con sospecha de HTA de difícil control, es decir, que seguían presentando HTA según el control ambulatorio habitual a pesar de recibir tratamiento estable con 3 o más fármacos y tener un buen cumplimiento terapéutico al menos durante los últimos 3 meses previos al comienzo del estudio. La definición de HTA se estableció siguiendo los criterios establecidos por la Organización Mundial de la Salud, es decir, valores superiores o iguales a 140 mmHg de PA sistólica (PAS) y/o 90 mmHg de PA diastólica (PAD)15.
Los criterios de exclusión del estudio fueron los siguientes: formas secundarias de HTA, falta de cumplimiento del tratamiento antihipertensivo, toma de medicación concomitante que puede generar HTA, como corticoides o antiinflamatorios no esteroideos, cambios en la medicación antihipertensiva a lo largo del estudio o diagnóstico previo de SAHS. El diagnóstico de HTA secundaria se estableció mediante la aplicación de un protocolo diagnóstico que incluyó: angiotomografía axial computarizada de arterias renales, función renal (se excluyó del estudio a los pacientes con concentraciones plasmáticas de creatinina superiores a 1,5 mg/dl), hormonas tiroideas y valores de catecolaminas y cortisol en orina de 24 h, así como otras pruebas complementarias especiales en algunos pacientes según sospecha clínica. La exclusión del paciente del estudio tras el análisis del resultado del este protocolo fue valorada por el especialista correspondiente. El cumplimiento terapéutico se valoró mediante el test de Haynes-Sackett, que se basa en el porcentaje de cumplimentación16. Según este test, se considera buen cumplimiento del tratamiento la toma de al menos el 80% de los comprimidos prescritos evaluados durante el último mes de prescripción.
Por último, siguiendo las directrices de la normativa de la European Society of Hypertension-European Society of Cardiology, se consideró HTA de difícil control la presencia de cifras iguales o superiores a 125 mmHg de PAS media y/o 80 mmHg de PAD media en 2 estudios de monitorización ambulatoria durante 24 h de la PA (MAPA-0 y MAPA-1) realizados en cada paciente sin que existieran cambios en la toma de medicación antihipertensiva entre ellos11. Por lo tanto, de los pacientes hipertensos inicialmente incluidos (PA ≥ 140/80 mmHg) se excluyó a aquellos con cifras de PA medias inferiores a 125/80 mmHg en la MAPA-0 o en la MAPA-1.
El estudio fue aprobado por nuestro Comité Ético Local y todos los pacientes dieron su consentimiento para participar en él.
Características de los pacientes
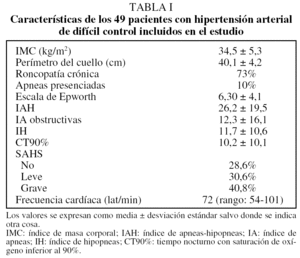
De todos los pacientes se recogieron datos referentes a variables antropométricas, entre ellas el IMC (kg/m²) y el perímetro del cuello (cm); eventos vasculares pasados; toma de medicación antihipertensiva u otra que pudiera interferir en las cifras de la PA (número, tipo y posología) y clínica relacionada con el SAHS (presencia de roncopatía crónica, apneas presenciadas e hipersomnia diurna, esta última valorada mediante la versión española del test de Epworth17).
Medición ambulatoria de la presión arterial
Los estudios de MAPA (Tonoport V, Marquette) se realizaron mediante la medición de la PA con un intervalo de 20 min durante el día y de 30 min durante la noche. Se analizaron los siguientes parámetros: PAS media diurna y nocturna; PAD media diurna y nocturna; variabilidad diaria de las cifras de PAS o PAD según el análisis de sus desviaciones estándar y frecuencia cardíaca. Se consideró válida para cálculos posteriores la media aritmética simple de cada par de medidas de cada parámetro analizado en ambos estudios de MAPA. Los períodos de medida diurna y nocturna de los valores de la PA se determinaron solicitando al paciente que apuntara la hora aproximada a la que se había quedado dormido y aquélla a la que despertó en los días de los estudios de MAPA. También se determinó el número de pacientes dippers y non-dippers. Se definieron como dippers aquellos que presentaron un descenso mínimo de la PAS nocturna del 10% con respecto a la PAS diurna
Estudio poligráfico diagnóstico
A todos los pacientes incluidos se les efectuó una poligrafía con intención diagnóstica (Autoset Portable Plus II, Resmed, Australia) en un plazo máximo de 30 días desde la realización de la MAPA-1. Las características del dispositivo Autoset, así como las definiciones de los eventos respiratorios durante el sueño utilizadas, se han expuesto en publicaciones previas de nuestro grupo18. La capacidad del Autoset para el diagnóstico de eventos obstructivos ha sido validada convenientemente por diversos autores19-22. Así, para una población con un IAH medio cercano a 30, se ha observado que la correlación existente entre el IAH medido mediante polisomnografía y el determinado mediante Autoset fue de 0,95, con una diferencia media en el IAH de 4,2 eventos/h, mayor en el Autoset20. Por otra parte, también se ha publicado que la capacidad diagnóstica del Autoset aumenta si se aplica a poblaciones con un IAH medio elevado21 o con alta prevalencia pretest de SAHS22. Todos los estudios se realizaron en nuestro centro en una habitación convenientemente acomodada para este fin. Se repitieron los estudios en los que el paciente manifestó haber dormido menos de 3 h o cuando existió sospecha de ello en el análisis del registro nocturno. Se consideró el diagnóstico de SAHS leve ante la presencia de un IAH entre 10 y 29, ambos inclusive, y de SAHS grave en el caso de un IAH mayor o igual a 30. En estas definiciones no se tuvieron en cuenta parámetros clínicos, aunque sí se recogieron.
Análisis estadístico
Se utilizó el programa estadístico SPSS 11.5 (Chicago, IL, EE.UU.). Las variables cuantitativas se presentan como media ± desviación estándar, mientras que las variables cualitativas se expresan como porcentaje sobre el total de pacientes. Para el estudio bivariado se comprobó la normalidad de todas las variables mediante la prueba de Kolgomorov-Smirnov. Para la comparación de más de 2 medias se utilizaron un análisis de la variancia (ANOVA) en caso de variables con distribución normal y el test no paramétrico de Friedman en caso contrario. La correlación entre variables se analizó mediante el test de Pearson o Spearman según la distribución de las variables. Para el estudio de la correlación existente entre el IAH y la obesidad con las cifras de PA se utilizó un análisis de la covariancia con ajuste para la edad y el sexo. Finalmente se aplicó una regresión lineal múltiple (stepwise) para determinar los factores pronósticos independientes de las cifras de PAS y PAD introduciendo inicialmente en la ecuación como posibles variables explicativas la edad, el sexo, el IAH y el IMC. En cualquier caso se consideró significativo un valor de p < 0,05.
Resultados
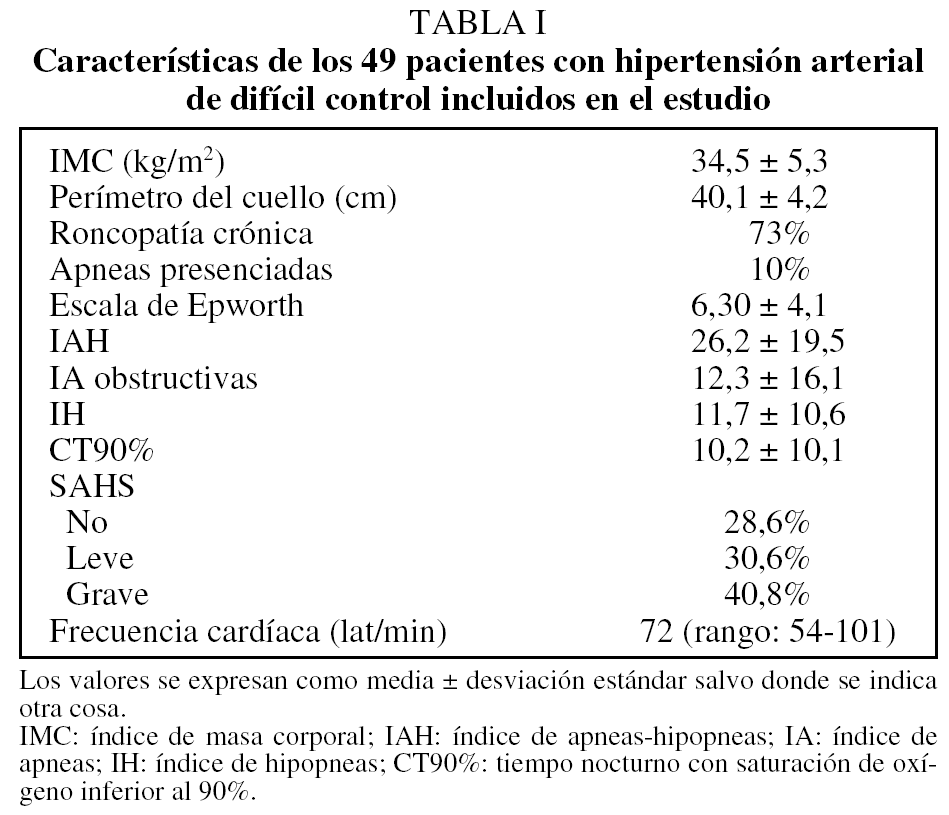
Inicialmente se incluyó en el estudio a 65 pacientes. De ellos se excluyó a los siguientes pacientes: 2 con PAS inferior a 125 mmHg en la MAPA inicial; 7 que no acudieron a la realización del estudio del sueño o de alguno de los estudios de MAPA o bien que rechazaron seguir participando en el estudio; 6 por falta de cumplimiento del tratamiento, y uno con el diagnóstico previo de SAHS y en tratamiento con presión positiva continua de la vía respiratoria. No se observó en ningún paciente la presencia de HTA secundaria, de cambios en la medicación antihipertensiva ni ningún nuevo evento vascular a lo largo del estudio. Por lo tanto, la muestra final del estudio estuvo constituida por 49 pacientes con una edad media (± desviación estándar) de 68,1 ± 9,1 años; de ellos, el 40,8% eran varones. La PAS media fue 152,5 ± 13 mmHg, mientras que la PAD media fue 89,2 ± 8,5 mmHg. El 62,5% había padecido en el pasado algún evento vascular (un 35% episodios de fibrilación auricular, un 28% cardiopatía isquémica y un 5% accidente cerebrovascular). El número medio de fármacos tomados fue de 3,5 ± 0,68 (rango: 3-6). El 86% tomaba algún diurético (el 14% restante no tomaba diuréticos por contraindicación o efectos adversos), siguiendo en frecuencia los antagonistas de la angiotensina 2 (59%), antagonistas del calcio (57%), inhibidores de la enzima de conversión de la angiotensina (48%), bloqueadores alfa (47%), bloqueadores beta (46%) y otros (3%). Las cifras de PAS y PAD medidas en la MAPA-1 descendieron 2,1 ± 11,5 y 1,7 ± 5,2 mmHg con respecto a las cifras de la MAPA-0, respectivamente, descenso que no fue significativo. El IMC y el perímetro del cuello no variaron de forma significativa a lo largo del estudio. Las características basales de los pacientes referentes a variables antropométricas, clínica relacionada con el SAHS y TRS aparecen en la tabla I.
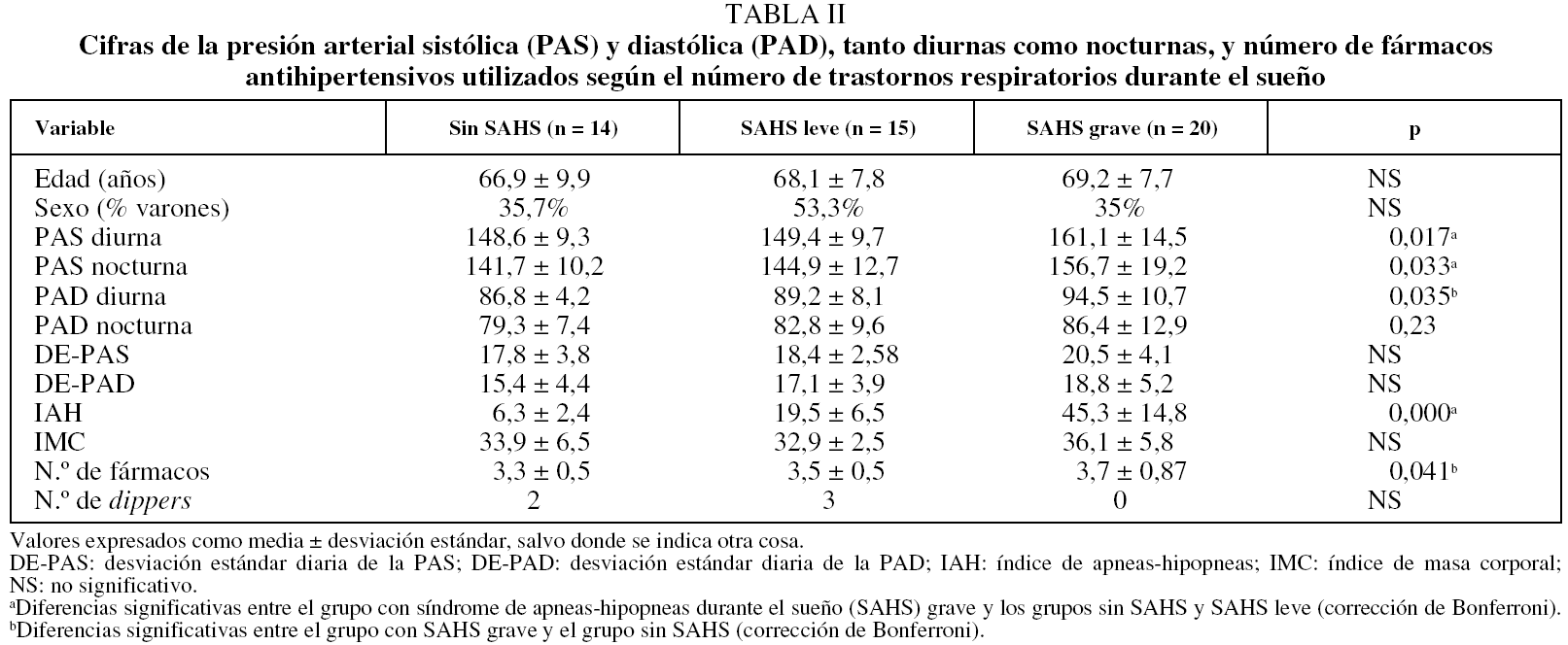
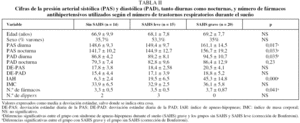
En la tabla II se observan las cifras de PAS y PAD tanto nocturnas como diurnas según el número de TRS existentes. Los pacientes con SAHS grave presentaron de forma significativa mayor descontrol de las cifras de la PAS tanto diurna como nocturnas y de la PAD diurna, así como mayor número de fármacos antihipertensivos utilizados que los pacientes sin SAHS. Por otra parte, las cifras de PAS tanto diurna como nocturna también fueron significativamente mayores en los pacientes con SAHS grave que en los pacientes en que éste era leve. Hubo una mayor variabilidad de las cifras tanto de la PAS como de la PAD en relación a un número mayor de TRS, si bien las diferencias entre grupos no resultaron estadísticamente significativas. Tan sólo hubo 5 pacientes dipper. Tres de ellos correspondieron a SAHS leves y 2 a pacientes sin SAHS.
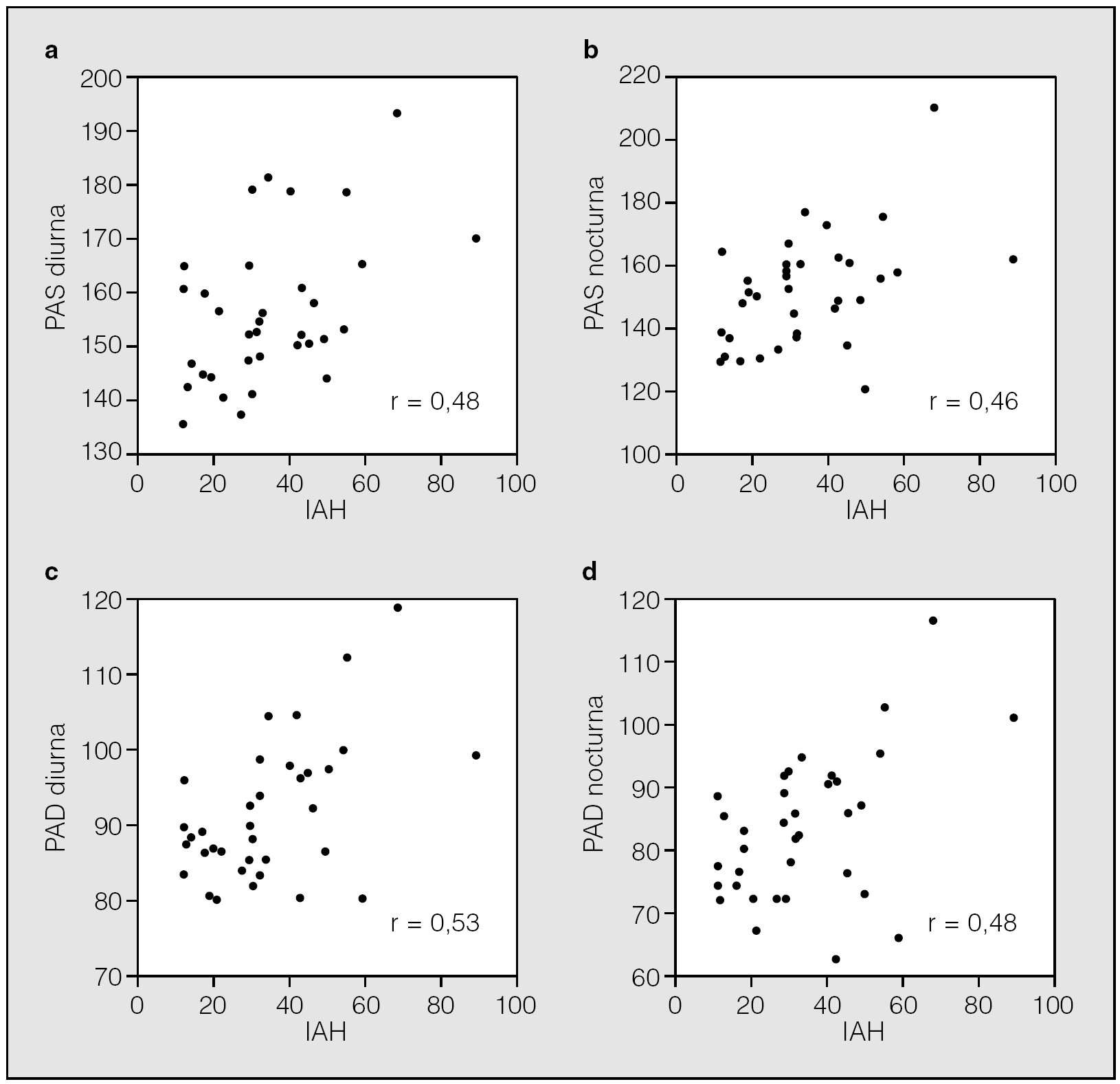
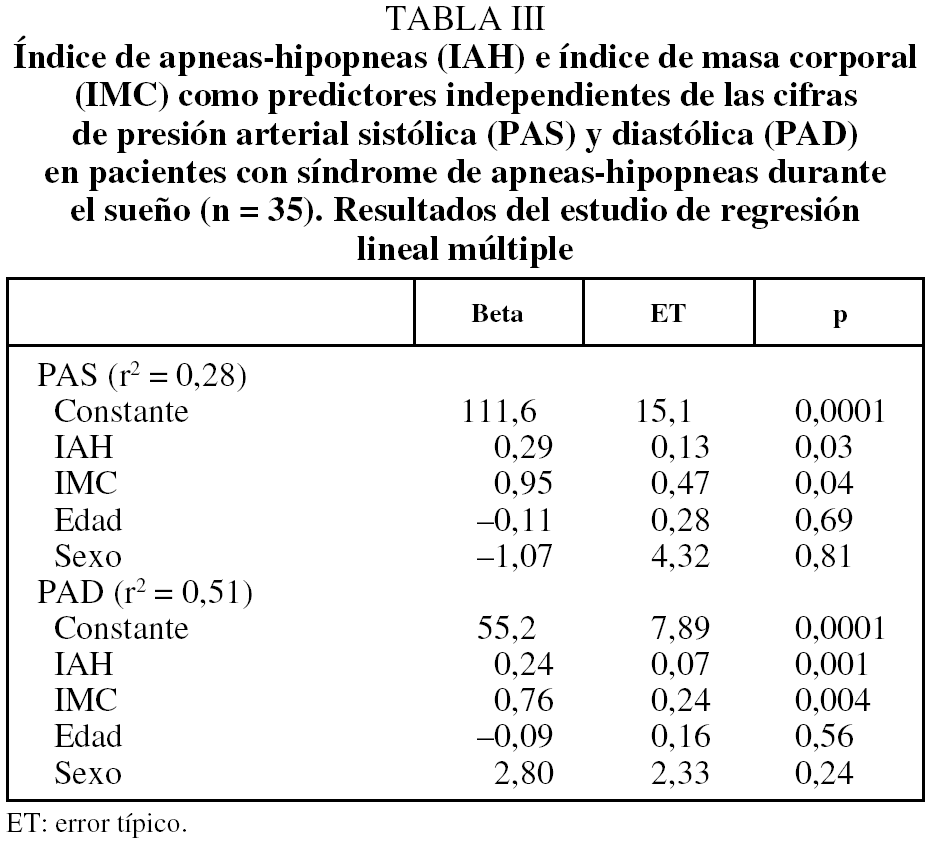
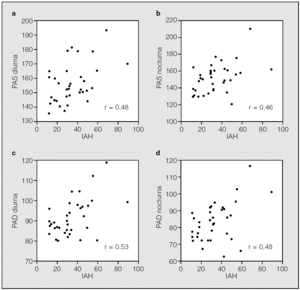
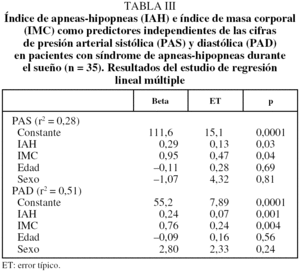
En los pacientes sin SAHS (n = 14) existió una correlación significativa ajustada según edad y sexo de las cifras de la PAS y la PAD con el IMC (r = 0,58, p = 0,02, y r = 0,51, p = 0,04, respectivamente) pero no con el IAH (r = 0,21, p = 0,23, y r = 0,28, p = 0,32, respectivamente). Sin embargo, en los pacientes con SAHS (n = 35) existió una correlación significativa de las cifras de PAS y PAD tanto con el IMC (r = 0,41, p = 0,007, y r = 0,46, p = 0,009, respectivamente) como con el IAH (r = 0,47, p = 0,001, y r = 0,50, p = 0,001, respectivamente) ajustando también los resultados según la edad y sexo de los pacientes. Estas correlaciones de la PAS y la PAD con el IAH en los pacientes con SAHS fueron semejantes para las cifras de PA tanto diurna como nocturna (fig. 1). En la tabla III se resume el análisis de regresión múltiple aplicado a los pacientes con SAHS. Tras introducir como variables independientes en la ecuación la edad, el sexo, el IMC y el IAH, se observó que tanto el IAH como, en menor medida, el IMC aparecen como los 2 factores predictivos independientes más importantes de las cifras de PAS y PAD.
Fig. 1. Correlaciones en pacientes con síndrome de apneas-hipopneas durante el sueño (n = 35) entre el índice de apneas-hipopneas (IAH) y: a) cifras de presión arterial sistólica (PAS) diurna; b) cifras de PAS nocturna; c) cifras de presión arterial diastólica (PAD) diurna, y d) cifras de PAD nocturna. Correlaciones ajustadas según edad y sexo de los pacientes.
Discusión
Según nuestros resultados, existe una prevalencia elevada de TRS en pacientes con HTA de difícil control. En los pacientes con SAHS el IAH correlacionó de forma significativa con las cifras de la PA tanto diurna como nocturna, además de ser el factor predictivo que más influyó en ellas.
Es indudable que la HTA es el factor de riesgo vascular conocido más importante en términos de morbimortalidad, especialmente cuando permanece incontrolada10. Se calcula que más de un 50% de los pacientes presentan cifras de PA superiores a las normales a pesar del tratamiento antihipertensivo7,8. En sus formas más graves, estos pacientes permanecen hipertensos a pesar de la toma de varias combinaciones de fármacos y en muchas ocasiones no se conoce la causa de este fenómeno23,24.
Existen importantes discrepancias sobre la definición de HTA de mal control, mal controlada, refractaria o resistente al tratamiento que utilizan los diversos estudios que han analizado la relación entre la presencia de SAHS y un peor control de la PA, circunstancia que hace que los resultados en ocasiones no sean comparables. En nuestro estudio hemos preferido utilizar el término de HTA de difícil control para hacer referencia a aquellos pacientes que permanecían con cifras elevadas de PA a pesar de la toma de 3 o más fármacos a las dosis habitualmente prescritas, incluyendo un diurético y habiendo comprobado un cumplimiento terapéutico adecuado. Hemos evitado el término de HTA refractaria o resistente al tratamiento, cuya definición incluye la toma de dosis máximas toleradas de antihipertensivos11. La situación más frecuente en la práctica clínica habitual es que el facultativo opte por la utilización de la combinación de varios fármacos antihipertensivos a dosis medias en un intento de minimizar los efectos adversos del tratamiento a dosis máximas, sin perder con ello eficacia terapéutica.
Setaro y Black9, en una puesta al día sobre el tema realizada en 1992, ya describieron el SAHS como una posible causa de HTA refractaria al tratamiento, si bien las normativas internacionales recientemente revisadas todavía no lo reconocen como tal11,25. Lavie y Hofftein6 observaron que, en un grupo de 1.485 pacientes con SAHS, aquellos con HTA mal controlada presentaron de forma significativa un mayor IAH que aquellos con un buen control de la PA (44 frente a 33; p < 0,005), incluso tras ajustar los resultados para del IMC, el sexo y la edad. De forma similar, Grote et al13 calcularon que la probabilidad de descontrol hipertensivo aumentaba un 2% por cada unidad de aumento xel IAH. Por otra parte, en un estudio realizado sobre un reducido número de pacientes con verdadera HTA refractaria al tratamiento, Logan et al12 observaron una prevalencia de SAHS del 83%. Los resultados de nuestro estudio apuntan en esta misma dirección. Así, la prevalencia de SAHS se situó en el 71%, con un 41% de pacientes con SAHS grave. Dado que hasta el momento no se ha demostrado que la HTA pueda generar un aumento de la prevalencia de SAHS, se podría hipotetizar que un exceso de TRS podría funcionar como un factor de riesgo independiente para una mayor dificultad en el control de las cifras de la PA. Por otra parte, en los pacientes con SAHS se observó una relación estrecha de las cifras de PAS y PAD tanto nocturna como diurna con la gravedad del SAHS, independientemente de otras variables de confusión como la edad o el sexo. El IAH aparecía en estos pacientes como la variable predictora más importante de las cifras de PA independientemente del IMC que presentaran. Además, una mayor gravedad del SAHS marcaba una mayor dificultad en el control de la HTA a tenor del número de fármacos utilizados. Analizados en su conjunto, de nuestros resultados parece desprenderse que existe un comportamiento diferente entre los pacientes con SAHS y sin SAHS en cuanto a las variables que influyen en un mayor descontrol de la HTA. Así, por encima de un número patológico en el IAH (en nuestro estudio, un IAH ≥ 10), es este exceso de TRS el que arrebata a la obesidad el protagonismo como factor que más influye en el descontrol de la HTA en estos pacientes, manteniéndose lógicamente en todos ellos (tanto si presentaron SAHS como si no) una correlación significativa con el IMC, conocido e importante factor de riesgo para la HTA y su descontrol. Por otra parte, si bien analizados por separado el IAH presentó un valor explicativo de las cifras de la PA en pacientes con SAHS algo mayor que el IMC, analizados de forma conjunta en un único modelo multivariado ambas variables fueron capaces de explicar tan sólo algo más del 25% de la variancia de las cifras de PAS y algo más del 50% de las cifras de PAD. Este hecho podría explicarse por los múltiples factores --algunos de ellos no medidos en el presente estudio-- capaces de modificar de forma significativa la PA y que formarían parte del porcentaje de la variancia no explicado por el IAH y el IMC. Ello supone que probablemente en estos pacientes el control de la obesidad o las medidas dietéticas no sean suficientes para el óptimo control de la PA y que sería necesario además la reducción en el número de TRS.
Destaca en nuestro estudio el hecho de que hayamos observado un número muy escaso de pacientes dipper. Podría explicarse tanto por la alta prevalencia de SAHS en nuestra muestra como por el escaso control de las cifras de la PA (también nocturnas) de estas formas graves de HTA incluso en pacientes sin SAHS. En cualquier caso, se observa que 3 de los 5 pacientes dipper se encontraban en el grupo con SAHS leve. Este fenómeno presenta una relevancia considerable, ya que es conocido que la presencia de un SAHS puede convertir a un paciente hipertenso dipper en un paciente hipertenso non-dipper26,27, y que este último estado se ha relacionado con un mayor número de eventos y complicaciones cardiovasculares28,29, así como con una mayor probabilidad de lesión de los órganos diana afectados por un incremento constante de las cifras de la PA30.
La relación observada en nuestra serie entre el SAHS y la HTA de difícil control presentó algunas características peculiares. Algunos estudios demuestran que la correlación entre SAHS y HTA, incluso en las formas de difícil control, suele ser mayor en personas jóvenes y no obesas1,13,31, aunque esta relación no se ha confirmado en todos los estudios6. Según nuestros resultados, la relación entre un exceso de TRS y las cifras de PA no varió respecto a la edad o el sexo de los individuos estudiados. Por otra parte, en nuestros pacientes el grado de correlación entre el IAH y las cifras de PA fue elevado tanto para la PAS como para la PAD, y tanto en las formas nocturnas como las diurnas, siendo incluso algo mayor con las cifras de PAD, al contrario de lo que se muestra en el estudio de Logan et al12, en el que el IAH se relacionó fundamentalmente con las cifras de PAS. Por último, nuestros pacientes, seleccionados de una consulta externa de hipertensión, en general no presentaron una clínica llamativa de SAHS, ya que, aunque más del 70% se declararon roncadores habituales, probablemente en relación con el elevado IMC que presentaron, tan sólo un 10% relató apneas presenciadas con una puntuación en la escala de Epworth tan sólo algo mayor de 6 puntos.
Pensamos que la limitación principal del presente estudio deriva de la utilización del Autoset como método diagnóstico de SAHS, si bien la alta prevalencia de TRS observada en nuestra muestra y el elevado valor medio del IAH mostrado por nuestros pacientes, circunstancias que incrementan el valor diagnóstico del Autoset con respecto a la polisomnografía21,22, que es la prueba de referencia, hacen que probablemente este error sea escaso.
Por lo tanto, dado el gran impacto en términos de morbimortalidad tanto del SAHS como de la HTA de difícil control, así como el gran beneficio que supondría conseguir descensos de tan sólo unos mmHg en la PA de estos pacientes mal controlados con tratamiento hipotensivo, consideramos necesaria la realización de nuevos estudios que demuestren una posible relación de causalidad entre ambas entidades y que analicen el efecto del tratamiento con presión positiva continua de la vía respiratoria32 sobre las cifras de la PA en estos pacientes.
En conclusión, en nuestra serie existió una elevada prevalencia de TRS en pacientes con HTA de difícil control. En aquellos con SAHS, el IAH fue el factor predictivo más importante de las cifras de la PA y mostró una correlación positiva con las cifras medias de PAS y PAD tanto diurnas como nocturnas.
Correspondencia: Dr. M.A. Martínez-García.
Unidad de Neumología. Servicio de Medicina Interna. Hospital General de Requena.
Pasaje Casablanca, s/n. 46230 Requena. Valencia. España.
Correo electrónico: med013416@saludalia.com
Recibido: 11-4-2005; aceptado para su publicación: 2-9-2005.