Valorar la prevalencia de los trastornos del sueño en pacientes en lista de espera de trasplante renal, comparados con un grupo control.
Pacientes y métodosSe ha realizado un estudio observacional en 23 pacientes en lista de espera para trasplante renal, cuyos resultados se compararon con los de 20 personas sanas que accedieron voluntariamente a participar en él. Se emparejaron por edad, sexo e índice de masa corporal. Se efectuó una polisomnografía de noche completa y el diagnóstico de síndrome de apneas-hipopneas durante el sueño se estableció cuando el índice de apneas-hipopneas era como mínimo de 10.
ResultadosLOS pacientes en lista de espera para trasplante renal (16 varones y 7 mujeres; edad media ± desviación estándar: 51±15 años; índice de masa corporal: 25±3,8kg/m2) presentaron en un 82% de los casos algún trastorno del sueño. Los más frecuentes fueron el síndrome de apneas-hipopneas durante el sueño (48%) e insomnio y síndrome de movimiento periódico de piernas (30%). Los pacientes presentaron, respecto al grupo control, una menor eficiencia del sueño (el 75,4 frente al 87,8%; p=0,01) y un menor porcentaje de sueño de ondas lentas y REM (un 24,5 frente a un 40%; p=0,001), mientras que los trastornos respiratorios del sueño mostraron un mayor índice de apneas-hipopneas (17,7 frente a 3,6; p=0,001) e índice de desaturación (31,5 frente a 8,2; p=0,001).
ConclusionesLOS trastornos del sueño son frecuentes en pacientes en lista de espera para trasplante renal, quienes, respecto al grupo control, tienen una menor cantidad y calidad del sueño, con un número significativamente elevado de eventos respiratorios, que pueden influir en la morbimortalidad.
To evaluate the prevalence of sleep disorders in patients awaiting kidney transplants compared to a control group.
Patients and methodsWe carried out an observational study of 23 patients on a kidney transplant waiting list in comparison with 20 healthy volunteers matched for age, sex, and body mass index (BMI). Overnight polysomnography was performed and a diagnosis of sleep apnea-hypopnea syndrome (SAHS) established when the apnea-hypopnea index (AHI) was 10 or higher.
ResultsEighty-two percent of the patients awaiting kidney transplants (16 men and 7 women with a mean [SD] age of 51 [15] years and a mean BMI of 25 [3.8] kg/m2) had some type of sleep disorder. The most frequent disorders were SAHS (48%) and insomnia and periodic limb movement disorder (30%). Patients showed poorer sleep efficiency compared to the control group (75.4% vs 87.8%; P=.01) and a lower percentage of slow-wave and rapid eye movement sleep (24.5% vs 40%; P=.001). Those with sleep-disordered breathing had a higher AHI (17.7 vs 3.6; P=.001) and oxygen desaturation index (31.5 compared to 8.2; P=.001).
ConclusionsSleep disorders are common in patients awaiting kidney transplants. Such patients show reduced quantity and quality of sleep compared to controls and a significantly elevated number of respiratory events that may affect morbidity and mortality.
En la población general, el síndrome de apneas-hipopneas durante el sueño (SAHS) se asocia con un aumento de la morbimortalidad cardiovascular1, 2 que, a su vez, es la causa de muerte más frecuente entre los pacientes en hemodiálisis3, 4, lo que indica que el SAHS puede contribuir a mantener una mortalidad alta en esta población. En este sentido, recientemente se han descrito la importancia de los episodios de hipoxemia nocturna asociados al SAHS y la gravedad de la arteriopatía coronaria en pacientes con insuficiencia renal crónica (IRC) en hemodiálisis5, 6. Se han realizado varios estudios con el objetivo de determinar una posible asociación entre la IRC y el SAHS. Aunque el mecanismo no ha sido bien establecido, se postula que las toxinas urémicas pueden estar involucradas en la aparición del SAHS7-9. A favor de esta hipótesis apuntan varios casos publicados de mejora de los trastornos respiratorios durante el sueño una vez restablecida con éxito la función renal tras el trasplante10-12. Estos aspectos han aumentado el interés por los trastornos del sueño en pacientes con IRC13.
En cuanto a la prevalencia del SAHS en los pacientes con IRC, los estudios muestran gran disparidad, con cifras que oscilan entre un 14,5 y un 80%7, 9, 14, lo que se justifica por los diferentes métodos utilizados, ya que muchos se realizaron en población seleccionada, con una muestra reducida y con técnicas diagnósticas distintas de la polisomnografía, que es la prueba para los trastornos del sueño15. Aún se ha investigado menos en una población con unas características clínicas diferentes como son los pacientes en lista de espera para trasplante renal16, en quienes no se han estudiado adecuadamente la calidad del sueño y los posibles trastornos respiratorios que pueden aparecer durante el mismo. Por tanto, nuestro objetivo ha sido evaluar, mediante polisomnografía de noche completa, la calidad del sueño y los trastornos respiratorios en un grupo de pacientes en lista de espera de trasplante renal, cuyos resultados se han comparado con los observados en un grupo control de sujetos sanos.
Pacientes y métodosSujetos del estudioEl estudio se ha realizado en la Unidad de Trastornos Respiratorios del Sueño del Hospital Universitario Reina Sofía de Córdoba. Se consideró población elegible a todos los pacientes en programa de hemodiálisis en una unidad satélite dependiente del Servicio de Nefrología que se encontraban en lista de espera para recibir un trasplante renal. En todos los casos la cifra de hemoglobina era mayor de 11g/l y la dosis de hemodiálisis (eKt/V > 1,3), adecuada. La hemodiálisis se realizó 3 veces a la semana en sesiones de 3,5-5h utilizando un líquido de diálisis con bicarbonato. La tasa de flujo sanguíneo varió entre 300 y 400ml/min, y la tasa de flujo de líquido de diálisis osciló entre 500 y 800ml/min.
Los sujetos incluidos en el estudio como grupo control pertenecían a la plantilla del hospital o eran familiares de los pacientes estudiados y accedieron a participar de forma voluntaria. Parte de esta cohorte pertenecía a un estudio previo12. Ninguno presentaba enfermedades respiratorias, renales ni del sueño conocidas, y su exploración física era normal, con una saturación arterial de oxígeno (SaO2) en vigilia del 95% o superior. La cifra media ± desviación estándar de creatinina era de 0,92 ± 0,23mg/dl y el aclaramiento de creatinina de 123 ± 9,70ml/min.
A todos los participantes se les realizaron una historia clínica y exploración física completa, y fueron interrogados sobre sus hábitos de sueño mediante una historia clínica normalizada y dirigida a la detección de posibles trastornos del sueño. La somnolencia diurna se determinó con una versión validada al castellano de la escala de Epworth17, que evalúa la posibilidad de quedarse dormido en determinadas circunstancias cotidianas18. Una puntuación mayor de 11 indica un grado de somnolencia significativo19. El registro de la SaO2 se determinó en vigilia, después de 10min de reposo como mínimo.
El protocolo de estudio fue aprobado por el Comité Ético del Hospital Universitario Reina Sofía de Córdoba.
Estudio de sueñoAl realizar la polisomnografía ningún participante presentaba enfermedad aguda. En el caso de los pacientes se efectuó la noche anterior a la hemodiálisis de mitad de semana. El método del estudio polisomnográfico se ha descrito previamente12. En resumen, se registraron los canales de electroencefalografía (C4/A1 y C3/A2), electrooculografía, electromiograma submentoniano y tibial anterior. La señal de flujo aéreo se estudió mediante termosensores. Igualmente se registraron el ronquido, el esfuerzo torácico y abdominal con bandas de impedancia, electrocardiograma y SaO2 mediante pulsioxímetro digital (Pulxox-7, Minolta, Japón). Todos los estudios se corrigieron manualmente siguiendo las recomendaciones de Rechtschaffen y Kales20.
Se definió la apnea como la ausencia de flujo oronasal durante al menos 10s, y la hipopnea como un descenso claramente discernible en la señal del flujo aéreo mayor del 30% y menor del 90%, junto a un descenso de la SaO2 de por lo menos el 3% y/o un microdespertar15. Se estableció la presencia de microdespertares como el cambio brusco en la frecuencia del electroencefalograma, incluidas ondas theta, alfa y/o frecuencias mayores de 16Hz de una duración superior a 3 s21. El índice de apneas-hipopneas (IAH) se determinó como el número total de apneas e hipopneas dividido por las horas de sueño.
Durante la polisomnografía se analizaron la eficiencia del sueño, la latencia del sueño en minutos, los porcentaje de vigilia intrasueño, de sueño REM y de fases NREM, el índice de mircrodespertares y el índice de movimiento periódico de las piernas. La eficiencia se definió como el porcentaje del cociente entre el tiempo total de sueño y el tiempo en cama. Como indicador de la estabilidad y calidad del sueño se determinó el porcentaje de sueño de ondas lentas (fases III y IV) sumado al porcentaje de sueño REM. Las variables respiratorias registradas fueron: SaO2 en vigilia, valor mínimo alcanzado durante el sueño, número de descensos de la SaO2 de un 3% o más por hora de sueño, porcentaje del tiempo de sueño con una SaO2 superior al 90%, porcentaje del tiempo de sueño en apnea e hipopnea, y número de apneas e hipopneas por hora de sueño.
La variable principal utilizada en el estudio fue el IAH, que se consideró patológico e indicativo de SAHS cuando era como mínimo de 10. Para el diagnóstico de piernas inquietas se utilizaron los criterios actualmente aceptados22. El diagnóstico de síndrome de movimiento periódico de piernas (MPP) se estableció cuando el paciente manifestó insomnio o somnolencia diurna y en la polisomnografía se observó un índice de MPP de 15/h o más, siempre que dichos movimientos no estuviesen asociados a los eventos respiratorios. El diagnóstico de insomnio se estableció ante una historia clínica indicativa (mala calidad o insuficiente cantidad de sueño percibida por el paciente) y un resultado polisomnográfico con alargamiento de la latencia del sueño más allá de 30min y una eficiencia inferior al 60%. Se diagnosticó el cuadro como ronquido simple si éste fue el principal síntoma registrado y en la polisomnografía no se constató un número significativo de trastornos respiratorios (≥ 5).
Análisis estadísticoLas variables cualitativas se expresan en valor absoluto y porcentaje, y las cuantitativas como media ± desviación estándar. Para el análisis de las variables cualitativas se aplicó el test de la χ2. La comparación de medias se llevó a cabo mediante la prueba no paramétrica de la U de Mann–Whitney, considerando un intervalo de confianza del 95% y valores estadísticamente significativos aquéllos con p < 0,05. El análisis estadístico de los resultados se realizó con el programa informático SPSS versión 11.1.
ResultadosEn el momento de realizar el estudio se encontraban en lista de espera para recibir un trasplante renal 25 de los 60 pacientes en programa de hemodiálisis (41%). De ellos, uno rechazó el estudio polisomnográfico y en otro no fue posible retirar la medicación hipnótica. Los restantes (92%) accedieron a participar en el estudio.
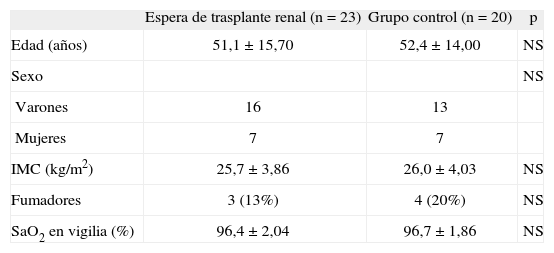
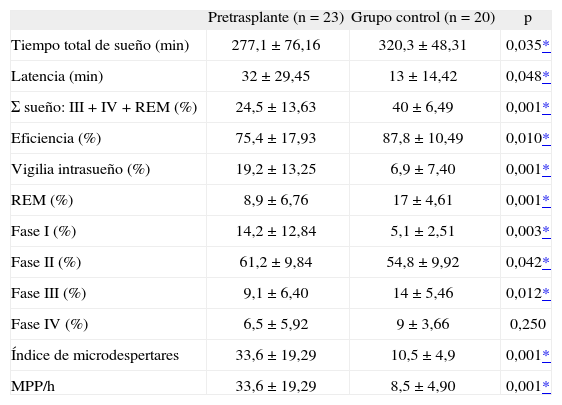
En la tabla I se muestran las características de los 2 grupos estudiados (pacientes y controles), entre los que no se objetivan diferencias en edad, sexo, índice de masa corporal, consumo de tabaco y SaO2 en vigilia. Los resultados de la comparación de las variables del sueño en ambos grupos se recogen en la tabla II. Se observó significación estadística en todos los valores que estudian la calidad del sueño, salvo en el porcentaje de sueño en fase IV. La latencia de sueño en el grupo en lista de espera de trasplante renal fue de 32min, y el porcentaje de vigilia intrasueño, del 19%. Ambos parámetros mostraron diferencias significativas respecto al grupo control y condicionaron que la eficiencia del sueño en los pacientes con IRC fuese significativamente menor que en el grupo control (p = 0,010). Igualmente, la suma del porcentaje de sueño profundo y de sueño REM fue menor en los pacientes que en el grupo control (el 24 frente al 40%; p = 0,0001). Por último, el índice de microdespertares y el de MPP (p = 0,0001) fueron significativamente más elevados en el grupo con IRC.
Características de los 2 grupos del estudio
| Espera de trasplante renal (n = 23) | Grupo control (n = 20) | p | |
| Edad (años) | 51,1 ± 15,70 | 52,4 ± 14,00 | NS |
| Sexo | NS | ||
| Varones | 16 | 13 | |
| Mujeres | 7 | 7 | |
| IMC (kg/m2) | 25,7 ±3,86 | 26,0 ± 4,03 | NS |
| Fumadores | 3 (13%) | 4 (20%) | NS |
| SaO2 en vigilia (%) | 96,4 ± 2,04 | 96,7 ± 1,86 | NS |
Valores expresado como número de pacientes (porcentaje) y media ± desviación estándar. IMC: índice de masa corporal; NS: no significativo; SaO2: saturación arterial de oxígeno.
Comparación de la media ± desviación estándar de las principales variables del estudio de sueño en los pacientes en lista de espera para trasplante renal y los controles sanos
| Pretrasplante (n = 23) | Grupo control (n = 20) | p | |
| Tiempo total de sueño (min) | 277,1 ±76,16 | 320,3 ±48,31 | 0,035* |
| Latencia (min) | 32 ± 29,45 | 13 ± 14,42 | 0,048* |
| Σ sueño: III + IV + REM (%) | 24,5 ± 13,63 | 40 ± 6,49 | 0,001* |
| Eficiencia (%) | 75,4 ± 17,93 | 87,8 ± 10,49 | 0,010* |
| Vigilia intrasueño (%) | 19,2 ±13,25 | 6,9 ± 7,40 | 0,001* |
| REM (%) | 8,9 ± 6,76 | 17 ±4,61 | 0,001* |
| Fase I (%) | 14,2 ±12,84 | 5,1 ±2,51 | 0,003* |
| Fase II (%) | 61,2 ±9,84 | 54,8 ±9,92 | 0,042* |
| Fase III (%) | 9,1 ±6,40 | 14 ±5,46 | 0,012* |
| Fase IV (%) | 6,5 ± 5,92 | 9 ± 3,66 | 0,250 |
| Índice de microdespertares | 33,6 ± 19,29 | 10,5 ±4,9 | 0,001* |
| MPP/h | 33,6 ± 19,29 | 8,5 ±4,90 | 0,001* |
MMP: movimientos periódicos de las piernas.
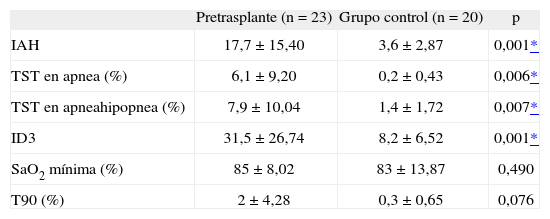
El estudio comparativo de los trastornos respiratorios durante el sueño se muestra en la tabla III. Los pacientes en lista de trasplante renal tuvieron un IAH mayor que el grupo control (p = 0,001), así como mayores porcentajes de tiempo en apnea (p = 0,006) y de tiempo en apnea-hipopnea (p = 0,007). En el grupo de pacientes, el registro de la SaO2 nocturna presentó un número significativamente elevado de descensos de un 3% o más por hora de sueño (p = 0,001). El porcentaje del tiempo de sueño con una SaO2 inferior al 90% también fue mayor en los pacientes que en el grupo control, aunque sin alcanzar la significación estadística (p = 0,076).
Resultados, expresados como media ± desviación estándar, de los trastornos respiratorios en el grupo en lista de espera de trasplante renal, comparado con el grupo control
| Pretrasplante (n = 23) | Grupo control (n = 20) | p | |
| IAH | 17,7 ±15,40 | 3,6 ± 2,87 | 0,001* |
| TST en apnea (%) | 6,1 ±9,20 | 0,2 ± 0,43 | 0,006* |
| TST en apneahipopnea (%) | 7,9 ± 10,04 | 1,4 ±1,72 | 0,007* |
| ID3 | 31,5 ±26,74 | 8,2 ± 6,52 | 0,001* |
| SaO2 mínima (%) | 85 ± 8,02 | 83 ± 13,87 | 0,490 |
| T90 (%) | 2 ±4,28 | 0,3 ± 0,65 | 0,076 |
IAH: índice de apneas-hipopneas; ID3: número de desaturaciones con descenso de la saturación arterial de oxígeno (SaO2) > 3% por hora de sueño; T90: porcentaje de tiempo de sueño con SaO2 < 90%; TST: tiempo total de sueño.
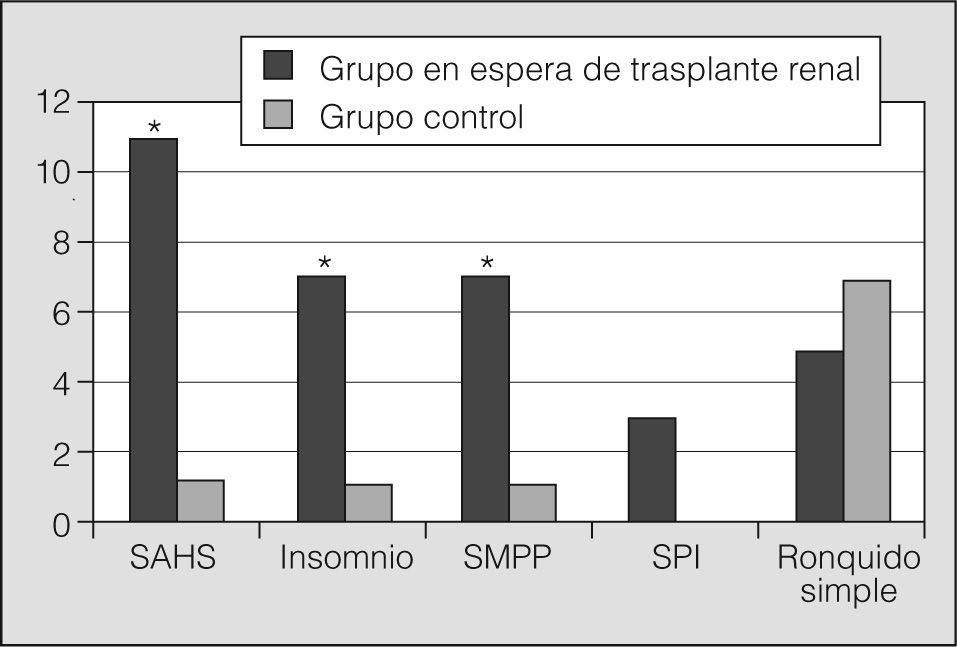
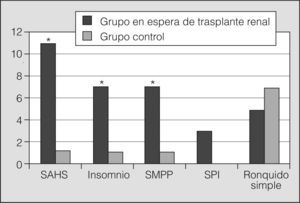
Teniendo en cuenta los síntomas del paciente y el resultado de la polisomnografía, se emitieron los diagnósticos que se recogen en la figura 1. Se observaron diferencias significativas en la frecuencia del SAHS, insomnio y síndrome de MPP. Hay que subrayar que algunos participantes presentaron más de un trastorno del sueño y que un 82% de los pacientes en lista de trasplante renal tuvo alguno, destacando el SAHS (n = 11; 48%), insomnio (n = 7; 30%), síndrome de MPP (n = 7; 30%), síndrome de piernas inquietas (n = 3; 13%) y ronquido simple (n = 4; 21%).
DiscusiónNuestro trabajo, realizado con la técnica de referencia para estudios de sueño y con una tasa de participación elevada, muestra una alta prevalencia de trastornos del sueño en los pacientes en lista de espera para trasplante renal. Por su frecuencia destacan el SAHS, el insomnio y el síndrome de MPP, que hacen que estos pacientes tengan una mala calidad del sueño. Un hallazgo relevante ha sido constatar que estos pacientes presentan un número significativamente elevado de eventos respiratorios y de episodios de hipoxemia nocturna, complicaciones que deben evitarse en esta población con una tasa elevada de mortalidad cardiovascular3, 4.
La prevalencia de distintos trastornos del sueño es elevada en los pacientes con IRC7-9, 12, 23. En nuestro estudio, un 82% de ellos presentó al menos un trastorno del sueño, un porcentaje elevado que no difiere del obtenido en una cohorte de pacientes en programa de hemodiálisis12, si bien hay diferencias respecto a los resultados de otros grupos, probablemente debido a los distintos métodos utilizados9, 16, 23-25. También puede influir en los resultados observados el hecho de que los pacientes en programa de trasplante son generalmente más jóvenes que los excluidos y no presentan comorbilidad grave, como hepatopatía, insuficiencia respiratoria y enfermedad cardiovascular.
El insomnio se ha descrito en el 50% de los pacientes en hemodiálisis26. En nuestra casuística alcanzó un 30% de los casos y, como es habitual, se asoció a otros trastornos del sueño25. Entre éstos, además del SAHS, cabe mencionar el síndrome de piernas inquietas, diagnosticado en un 13% de los pacientes, porcentaje similar al obtenido por otros autores27-29.
Como ya se ha comentado en nuestro estudio, los trastornos respiratorios del sueño se han relacionado con la IRC7-9, 13. Los pacientes en lista de trasplante renal presentaron un IAH medio de 17,7/h y un porcentaje de sueño en apnea y en apnea-hipopnea significativamente elevado. Estos datos apoyan la gravedad de los trastornos respiratorios en esta población. En este sentido es necesario subrayar algunos datos del estudio. En nuestros pacientes la repercusión de los eventos respiratorios sobre la SaO2 fue importante, pues se observaron 31 caídas significativas por hora de sueño. Éste es un dato de gran interés. Por una parte, estos episodios de hipoxemia-reoxigenación favorecen la producción de radicales libres, que se postula como un posible mecanismo de aterogenia30-32. Además, los descensos bruscos de la SaO2 nocturna se han relacionado, en la población general, con un incremento de la morbimortalidad de causa vascular1, 2, 33. Se desconoce qué influencia pueden tener estas desaturaciones en los pacientes en lista de trasplante renal. Sin embargo, se sabe que, a pesar de los avances en la hemodiálisis y en el mejor control de algunos factores de riesgo cardiovascular, la mortalidad de causa vascular se mantiene alta. Por tanto, debe de haber otros factores actualmente no bien controlados. Entre ellos, la presencia de eventos respiratorios durante el sueño es una teoría razonable. Aunque ésta es una cuestión aún no aclarada, algunos estudios recientes apoyan tal hipótesis5, 6, 34, 35.
En cuanto a los mecanismos que en la IRC pueden relacionarse con la aparición de trastornos respiratorios del sueño, uno de los más frecuentemente involucrados es la elevación de las toxinas urémicas7-9, 13. En este sentido, se ha comprobado que la hemodiálisis diaria nocturna puede mejorar los trastornos respiratorios del sueño en comparación con la hemodiálisis convencional36, 37. También el inadecuado control central de la respiración por alteración de la quimiosensibilidad ha sido un mecanismo propuesto para explicar los trastornos respiratorios durante el sueño en la IRC38.
En cualquier caso, mientras se estudian estos aspectos, hay que prestar especial atención a síntomas que, como el ronquido y las apneas observadas por algún conviviente, frecuentemente se asocian al SAHS tanto en población general39, 40 como en pacientes con IRC12. Es evidente que la sospecha clínica facilitará un diagnóstico precoz y un control adecuado del SAHS mediante la aplicación de presión positiva continua de la vía aérea (CPAP)15, 41. Sin embargo, así como en la población general existe consenso sobre la indicación de la CPAP15, 42, no ocurre lo mismo en los pacientes con IRC, en los que, por otra parte, la adaptación al tratamiento no es buena12, 43. Mientras esto se dilucida, debe considerarse el tratamiento con CPAP si hay comorbilidad cardiovascular15, 44.
En relación con el control de los trastornos respiratorios del sueño, se ha postulado que el trasplante renal puede mejorarlos10, 11. Nuestro grupo, al estudiar una serie de 4 casos antes y después de recibir con éxito un trasplante renal, observó una menor presencia de eventos respiratorios y una mejoría de los parámetros relacionados con la SaO2 nocturna12. Además de la mejoría global, medida en salud y calidad de vida del paciente, el trasplante renal puede corregir los trastornos respiratorios del sueño.
Nuestro trabajo, realizado sobre la totalidad de la población de pacientes en lista de espera para trasplante renal, añade evidencia sobre la prevalencia y potencial gravedad de los trastornos respiratorios del sueño. Sin embargo, conviene tener en cuenta algunas limitaciones del estudio. En primer lugar, a pesar de incluir al 92% de la población elegible, el número de pacientes, aunque reducido, es suficiente para establecer comparaciones y obtener resultados concluyentes. En segundo lugar, en estos pacientes la sensación de sueño no reparador puede ser de causa multifactorial, y la fatiga y el cansancio físico pueden ser atribuibles a la propia IRC. Por este motivo se consideró diagnóstico de SAHS un IAH de 10 como mínimo, con la intención de no magnificar el diagnóstico utilizando el punto de corte actualmente recomendado de 5 o superior15. En tercer lugar, en nuestro estudio el grupo control se seleccionó entre el personal sanitario y los familiares de los pacientes, personas que muestran un alto grado de colaboración y fiabilidad, lo que hace improbable la existencia de un sesgo de selección.
En conclusión, en los pacientes con IRC en lista de espera de trasplante renal son frecuentes los trastornos del sueño, siendo el SAHS el más común. Estos pacientes tienen menor calidad y cantidad de sueño, lo que puede repercutir en su calidad de vida. Por otra parte, los eventos respiratorios y los episodios bruscos de hipoxemia nocturna, que se encuentran significativamente elevados, pueden condicionar una alta morbimortalidad en estos pacientes. No obstante, serán necesarios más estudios para demostrar que un diagnóstico y tratamiento adecuado del SAHS pueden modificar la morbimortalidad de causa vascular en esta población.