Presentar la experiencia inicial en el tratamiento de las lesiones pulmonares malignas (primarias y metastá-sicas) mediante la ablación por radiofrecuencia (RF).
Pacientes y métodosDe agosto de 2004 a enero de 2007 tratamos a 19 pacientes (mediante 26 procedimientos) con intención curativa o paliativa. Todos los casos correspondían a lesiones no quirúrgicas, tratadas o no previamente. La técnica se practicó en la sala de radiología, con sedoanalgesia consciente llevada a cabo por el anestesiólogo. Se trató a 14 pacientes con lesión pulmonar y a 5 con enfermedad metastásica pulmonar, con la enfermedad primaria controlada. En 15 casos el tratamiento se realizó con intención curativa y en 4 era paliativo.
ResultadosLa técnica de RF pudo realizarse en los 26 procedimientos. La media de seguimiento fue de 8,68 meses. Las principales complicaciones derivadas del tratamiento de RF fueron: neumotórax en 4 pacientes, de los que sólo 2 requirieron drenaje; neumonitis en 4; hemorragia pulmonar autolimitada en 1, y derrame pleural en 5. No hubo mortalidad en relación con el procedimiento. Durante el período de seguimiento fallecieron 6 pacientes.
ConclusionesSegún nuestra experiencia, la RF puede ser una opción segura y mínimamente invasiva para el tratamiento de las lesiones pulmonares malignas en pacientes no quirúrgicos adecuadamente seleccionados, con una baja morbilidad. La combinación con otros tratamientos ofrece un amplio abanico de posibilidades pendientes de discernir.
To present our early experience in the treatment of primary malignant and metastatic lung lesions by radiofrequency ablation.
Patients and methodsFrom August 2004 through January 2007 we treated 19 patients (in 26 procedures) with curative or palliative intent. None of the lesions was amenable to surgery and some had been treated previously. The procedure was performed in the radiology room under conscious sedation-analgesia administered by an anesthesiologist. Fourteen patients were treated for pulmonary lesions and 5 for metastatic lung disease in a context of controlled primary disease. Treatment was with curative intent in 15 cases and palliative in 4.
ResultsThe radiofrequency technique was applicable in 26 procedures and the mean follow-up was 8.68 months. The principal complications of radiofrequency treatment were pneumothorax in 4 patients, requiring drainage in only 2 cases; pneumonitis in 4; self-limiting pulmonary hemorrhage in 1; and pleural effusion in 5. There were no procedure-related deaths. Six patients died during the follow-up period.
ConclusionsIn our experience, radiofrequency offers a safe and minimally invasive option for the treatment of malignant lung lesions in appropriately selected, nonsurgical patients. Morbidity is low, and in combination with other treatments this technique opens up a wide range of possibilities still to be explored.
La ablación de lesiones mediante radiofrecuencia (RF) se considera un tratamiento mínimamente invasivo1 que se utiliza con éxito en neoplasias de localización renal, de mama, ósea, hepática y de glándula suprarrenal2. La RF se emplea desde 1990, fecha en que se trataron los primeros tumores hepáticos, bien primarios o metastásicos3. Se basa en el empleo de una corriente alterna de alta frecuencia (460-480kHz) para generar un campo electromagnético localizado que calienta el tejido diana hasta la desecación o la necrosis coagulativa4, de modo que las células del tejido diana mueren al verse expuestas a dichas dosis térmicas. Su aplicación en el tratamiento de las lesiones pulmonares se encuentra en fase de desarrollo y la experiencia es limitada tanto por el número de pacientes tratados como por el tiempo de evolución de los resultados.
Aunque la resección quirúrgica sigue siendo el tratamiento de elección5, algunos pacientes no son candidatos a la cirugía por mala reserva funcional pulmonar y/o morbilidad asociada. Este grupo representa una población diana para el control local de la enfermedad mediante RF. El uso de ésta también está indicado para la paliación de síntomas (p. ej., el dolor) y como complemento a otros tratamientos tradicionales, como la radioterapia o quimioterapia6, campo de gran interés aún por investigar. La técnica se basa en la evidencia de un adecuado control local de la enfermedad que aporta efectos positivos tanto en la calidad de vida como en la supervivencia de la población seleccionada7.
El objetivo de este trabajo es presentar la experiencia inicial del equipo interdisciplinario encargado de indicar, tratar y realizar el seguimiento de las lesiones pulmonares subsidiarias de dicho tratamiento en nuestro centro.
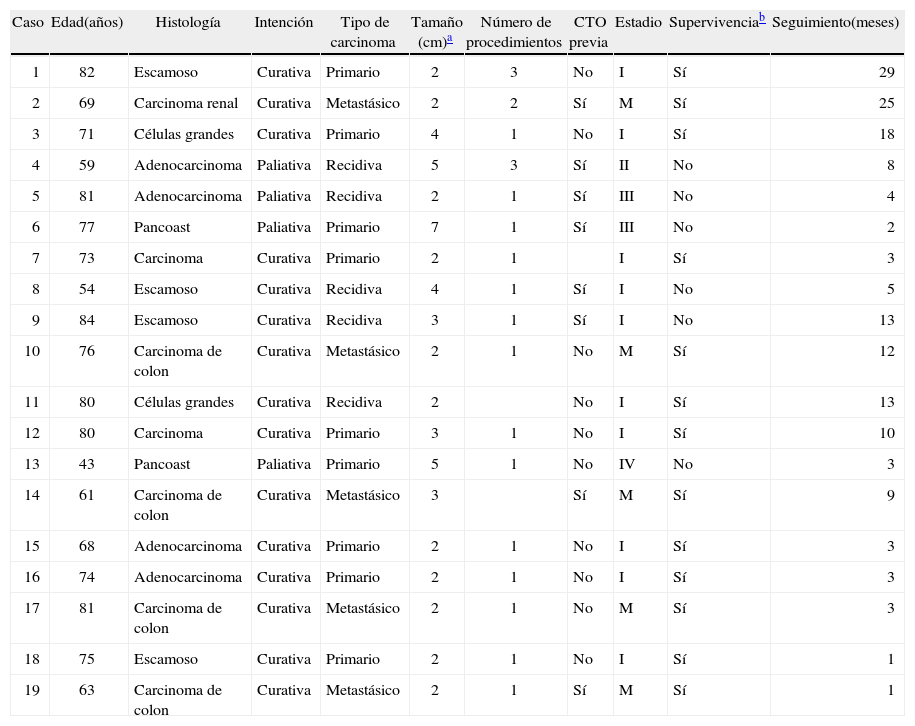
Pacientes y métodosSelección de pacientesDesde agosto de 2004 a enero de 2007 se trató con intención curativa o paliativa a 19 pacientes (18 varones y una mujer; en total 26 procedimientos) con lesiones neoplásicas pulmonares primarias o metastásicas, cuya edad media ± desviación estándar era de 71,05 ± 10,87 años (rango: 43-84 años). Sus características se detallan en la tabla I.
Características de los pacientes a los que se aplicó radiofrecuencia pulmonar
| Caso | Edad(años) | Histología | Intención | Tipo de carcinoma | Tamaño (cm)a | Número de procedimientos | CTO previa | Estadio | Supervivenciab | Seguimiento(meses) |
| 1 | 82 | Escamoso | Curativa | Primario | 2 | 3 | No | I | Sí | 29 |
| 2 | 69 | Carcinoma renal | Curativa | Metastásico | 2 | 2 | Sí | M | Sí | 25 |
| 3 | 71 | Células grandes | Curativa | Primario | 4 | 1 | No | I | Sí | 18 |
| 4 | 59 | Adenocarcinoma | Paliativa | Recidiva | 5 | 3 | Sí | II | No | 8 |
| 5 | 81 | Adenocarcinoma | Paliativa | Recidiva | 2 | 1 | Sí | III | No | 4 |
| 6 | 77 | Pancoast | Paliativa | Primario | 7 | 1 | Sí | III | No | 2 |
| 7 | 73 | Carcinoma | Curativa | Primario | 2 | 1 | I | Sí | 3 | |
| 8 | 54 | Escamoso | Curativa | Recidiva | 4 | 1 | Sí | I | No | 5 |
| 9 | 84 | Escamoso | Curativa | Recidiva | 3 | 1 | Sí | I | No | 13 |
| 10 | 76 | Carcinoma de colon | Curativa | Metastásico | 2 | 1 | No | M | Sí | 12 |
| 11 | 80 | Células grandes | Curativa | Recidiva | 2 | No | I | Sí | 13 | |
| 12 | 80 | Carcinoma | Curativa | Primario | 3 | 1 | No | I | Sí | 10 |
| 13 | 43 | Pancoast | Paliativa | Primario | 5 | 1 | No | IV | No | 3 |
| 14 | 61 | Carcinoma de colon | Curativa | Metastásico | 3 | Sí | M | Sí | 9 | |
| 15 | 68 | Adenocarcinoma | Curativa | Primario | 2 | 1 | No | I | Sí | 3 |
| 16 | 74 | Adenocarcinoma | Curativa | Primario | 2 | 1 | No | I | Sí | 3 |
| 17 | 81 | Carcinoma de colon | Curativa | Metastásico | 2 | 1 | No | M | Sí | 3 |
| 18 | 75 | Escamoso | Curativa | Primario | 2 | 1 | No | I | Sí | 1 |
| 19 | 63 | Carcinoma de colon | Curativa | Metastásico | 2 | 1 | Sí | M | Sí | 1 |
CTO: cirugía torácica oncológica de resección previa a la radiofrecuencia.
El tamaño medio de las lesiones fue de 2,86 ± 1,43cm (rango: 1,2-7). El valor medio del volumen espiratorio forzado en el primer segundo (FEV1) fue del 65,89 ± 23,79% (rango: 22-92%). Sin embargo, al desglosar según la indicación dicho valor varió, con cifras inferiores en el grupo de carcinoma pulmonar primario (FEV1: 54%).
Seleccionamos a los pacientes según un protocolo diseñado al efecto (tabla II) y en todos los casos se descartó la cirugía como opción terapéutica en ese momento de la enfermedad. Antes de la técnica se realizó una cuidadosa evaluación clínica, con exploraciones de laboratorio, pruebas de imagen, función pulmonar y broncoscopia. Se informó debidamente a los pacientes, que cumplimentaron el consentimiento informado detallado al efecto. La decisión de aplicar la técnica correspondió a un equipo interdisciplinario, con componentes del Comité de Tórax del Hospital Universitario de La Ribera (Alcira, Valencia), tras la aprobación del Comité Ético del hospital.
Indicaciones de la radiofrecuencia pulmonar
|
|
|
|
|
|
|
Una vez colocado el paciente, se le aplicaron 4 electrodos rectangulares (placas dispersoras), 2 en la parte anterior de cada muslo. Tras infiltrar con un anestésico local se procedió a insertar la aguja en la lesión mediante técnica coaxial. En la medida en que lo permitió la topografía del tumor, se intentó hacer un abordaje anterior para una mayor comodidad y mejor manejo del paciente por parte del anestesiólogo.
La guía del procedimiento se llevó a cabo mediante un dispositivo de tomografía computarizada (TC) con fluoroscopia (Xpress SX, Toshiba®, Japón). En los 5 primeros pacientes el dispositivo de RF que se empleó fue el generador de RITA 1500 (RITA Medical®, Mountain View, CA, EE.UU.), con registro en tiempo real de la temperatura, potencia e impedancia. El dispositivo de punción fue el Starburst® XL (RITA Medical Inc, Mountain View, California, USA) de 10 o 15cm, con un diámetro de 14G y 7-9 electrodos extensibles (esferas de 3-5cm). En el resto de pacientes el procedimiento se llevó a cabo con un electrodo tipo array (LeVeen Electrode, Boston Scientific®, Natick, Massachusetts, USA) con diámetros que oscilaron entre los 2 y 4cm. En todos los pacientes en que se utilizó este dispositivo se empleó un introductor coaxial con el sistema de LeVeen. La potencia del generador de RF (RF 3000, Boston Scientific®, Natick, Massachusetts, USA) se administró de forma escalonada. El final de la ablación lo determinó un incremento radical de la impedancia (llamado roll-off).
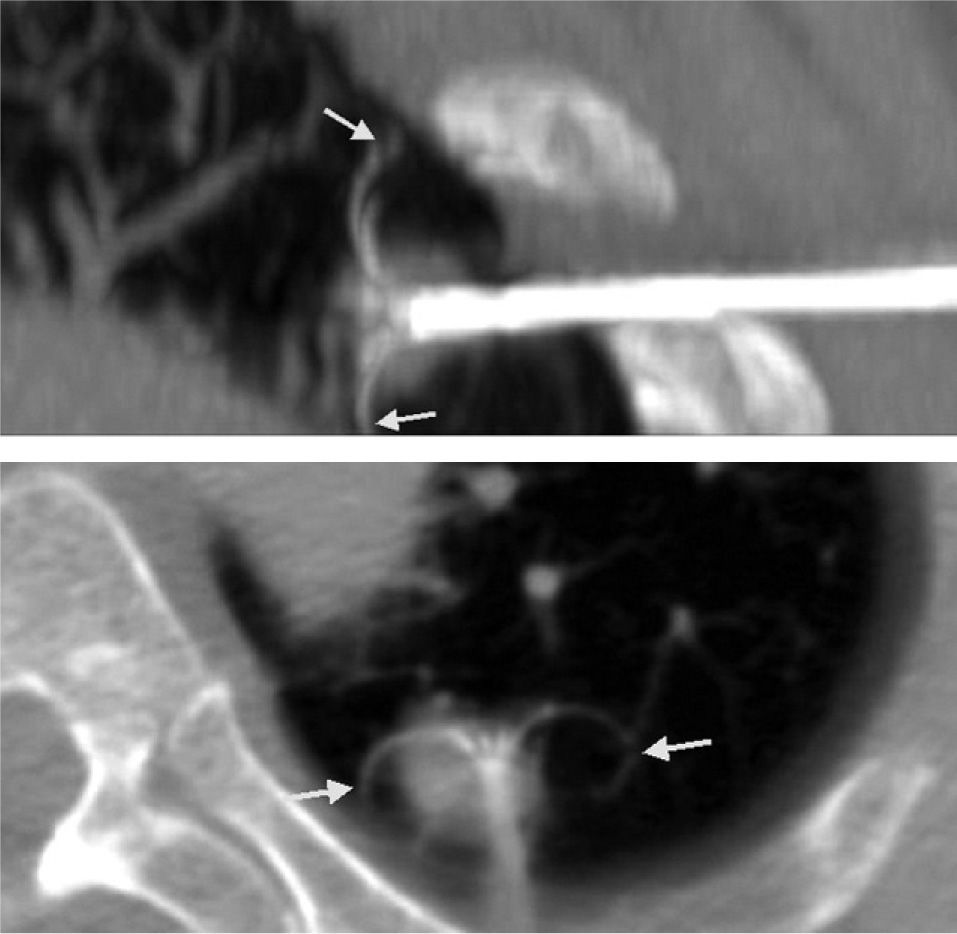
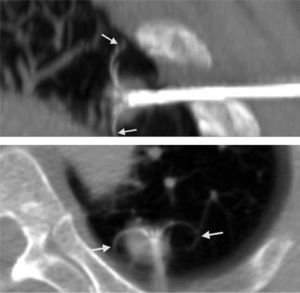
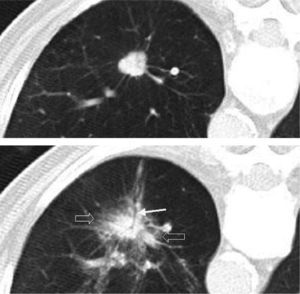
En los casos en que hubo dudas sobre la cobertura adecuada del tumor por los electrodos o para delimitar adecuadamente la relación con las estructuras vecinas, se realizaron reconstrucciones multiplanares y/o proyecciones de máxima intensidad (fig. 1). Para las lesiones de más de 3cm, ante la duda de que hubiera una cobertura adecuada del tumor, se hicieron esferas solapadas.
Técnica anestésicaSe evaluó a todos los pacientes en la consulta de preanestesia, con un preoperatorio completo. Se les informó de la técnica anestésica y de las posibles complicaciones, tras lo cual dieron su consentimiento informado.
El día del procedimiento, se les premedicó y realizó un seguimiento estándar continuo. La sala de radiología dispone de un carro de paradas, equipo para colocación de drenajes torácicos, toma de oxígeno y el material que el anestesiólogo aporta en el momento del procedimiento. Se realizó sedoanalgesia consciente, entendiendo por tal una mínima depresión del nivel de conciencia que permita al paciente mantenerse despierto, sin necesidad de soporte respiratorio, y recibir y responder a órdenes simples.
Análisis estadísticoDada la distribución no paramétrica de las variables cuantitativas, para su descripción se utilizaron la mediana y los percentiles 25 y 75. Para la estimación de la función de supervivencia se utilizó el método de Kaplan-Meier, y para la comparación de las funciones entre grupos se aplicó el test de rangos logarítmicos. El valor de significación estadística establecido en los contrastes de hipótesis fue de p < 0,05.
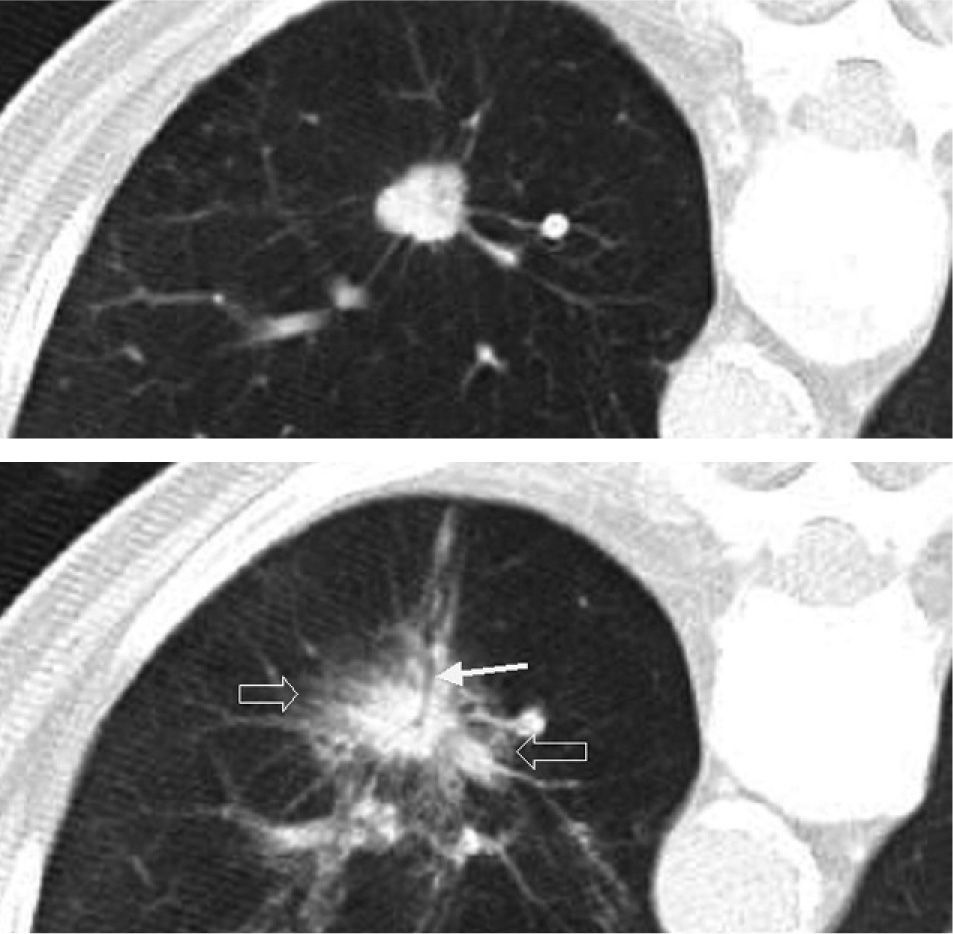
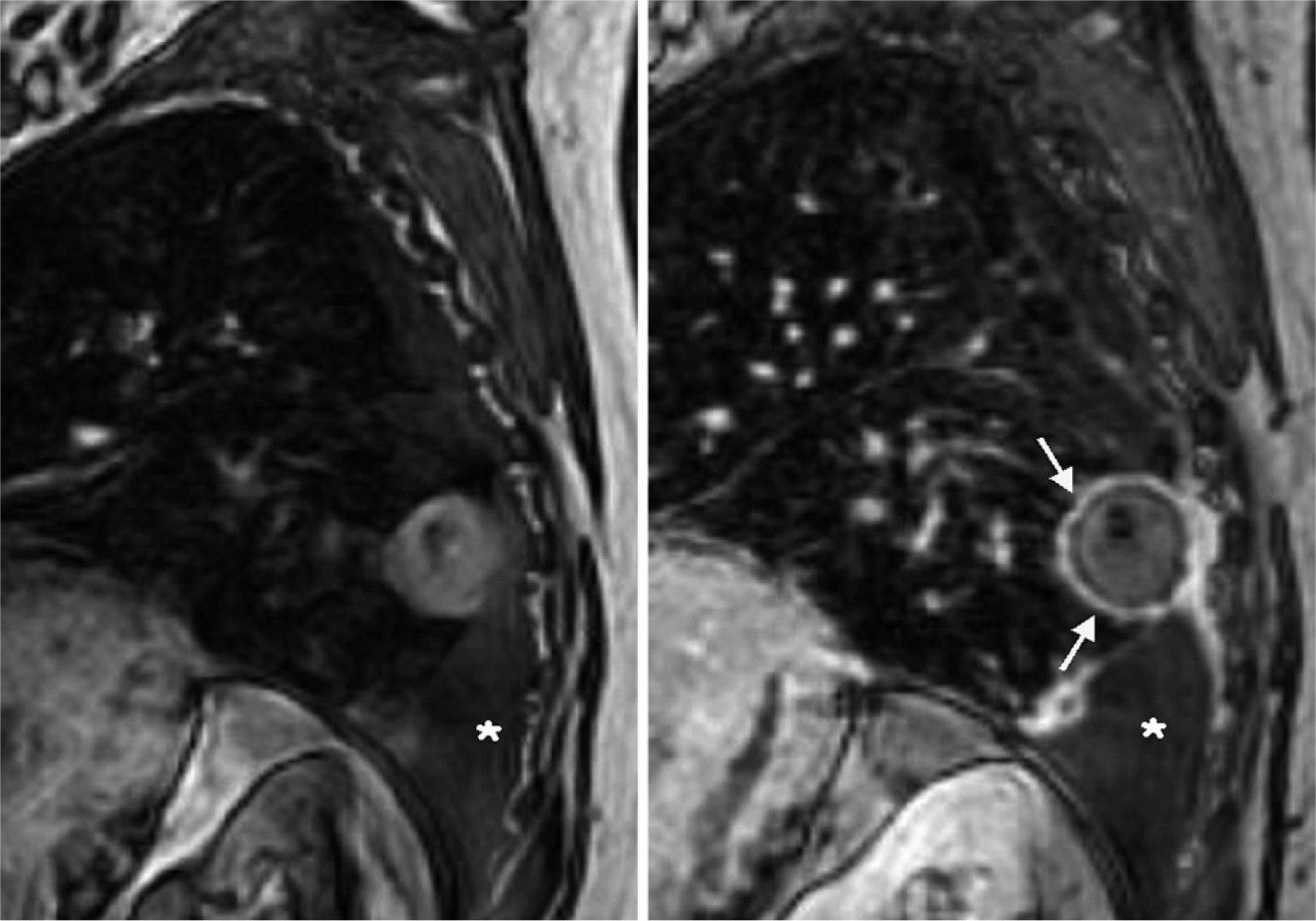
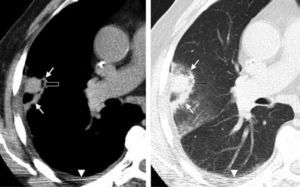
ResultadosProcedimientoEn todos los pacientes en que se programó el tratamiento con RF el procedimiento se llevó a cabo con éxito. En los pacientes tratados con finalidad curativa se definió como éxito técnico la cobertura completa del tumor, con el desarrollo de un halo de patrón alveolar alrededor como margen de seguridad (fig. 2). En los casos tratados con finalidad paliativa se consideró éxito técnico la ablación completa de la pleura parietal en contacto con la neoplasia.
Cuando toda la lesión ha sido adecuadamente tratada, en el control inmediatamente posterior al tratamiento aparece un halo en vidrio deslustrado (flechas huecas). Nótese la oquedad lineal en el trayecto de inserción de la aguja (flecha). Hemorragia parenquimatosa visible en la tomografía computarizada realizada inmediatamente después de la ablación mediante radiofrecuencia.
En todos los pacientes se realizó control de imagen a las 24h, al mes y cada 3 meses con TC torácica sin y con contraste, con estudio dinámico en fase precoz (30s), fase venosa (50s) y de equilibrio, y con resonancia magnética (RM) sin y con gadolinio, realizándose también un estudio dinámico con contraste sobre el nódulo.
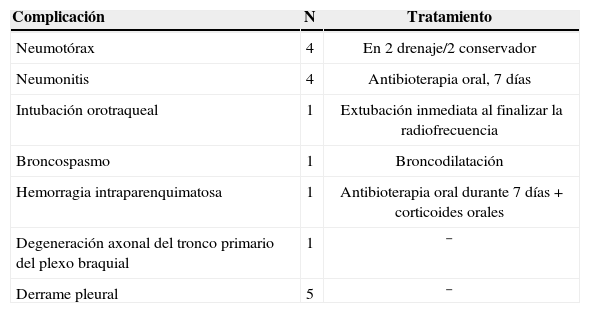
Complicaciones inmediatasLas complicaciones y su tratamiento se recogen en la tabla III. En los casos de neumotórax que precisaron drenaje, éste se colocó en la misma sala de radiología. El drenaje se colocó si el neumotórax fue mayor del 10% o la saturación de oxígeno descendió más de 5 puntos. Se emplearon drenajes de 16 Fr de diámetro. Ningún neumotórax se aspiró con aguja tras el procedimiento.
Complicaciones inmediatas de la radiofrecuencia en nuestra serie
| Complicación | N | Tratamiento |
| Neumotórax | 4 | En 2 drenaje/2 conservador |
| Neumonitis | 4 | Antibioterapia oral, 7 días |
| Intubación orotraqueal | 1 | Extubación inmediata al finalizar la radiofrecuencia |
| Broncospasmo | 1 | Broncodilatación |
| Hemorragia intraparenquimatosa | 1 | Antibioterapia oral durante 7 días + corticoides orales |
| Degeneración axonal del tronco primario del plexo braquial | 1 | − |
| Derrame pleural | 5 | − |
No se observaron complicaciones anestésicas, salvo una reconversión a anestesia general por dolor incontrolable y nula colaboración del paciente.
Tras la realización de la ablación se trasladó a los pacientes a la sala de despertar y posteriormente a la sala de hospitalización. Ninguno precisó ingreso en la Unidad de Cuidados Intensivos.
La estancia media fue de 1,24 días (rango: 1-4 días). La estancia más prolongada se debió a que el paciente presentó dolor en el hombro por la infiltración de un tumor de Pancoast; aprovechamos el ingreso para intensificar la analgesia intravenosa hasta acusar el efecto de la ablación.
Seguimiento ambulatorio y supervivenciaA todos los pacientes se les realizó una primera consulta ambulatoria a los 3-5 días de la ablación. En esta primera revisión ambulatoria, 3 refirieron esputo hemoptoico, 8 dolor pleurítico inespecífico en la zona tratada y 2 febrícula durante las primeras 48h. En el control evolutivo a medio-largo plazo, en caso de detectar una imagen residual o recurrencia de la misma (captación nodular o irregular de la periferia), se procedió a repetir la RF (n = 5). Seis pacientes fallecieron durante el período de estudio. Los 4 casos en que la indicación fue con intención paliativa fallecieron por progresión de la enfermedad a los pocos meses, aunque se consiguió un control local del dolor. De ellos, los que presentaban tumores de Pancoast fueron los que mostraron un peor pronóstico (fallecieron a los 2 y 3 meses). Los otros fallecimientos correspondieron a pacientes con recidiva local de la neoplasia tras la cirugía oncológica; la enfermedad acabó progresando en otras localizaciones y ésta fue la causa de la muerte.
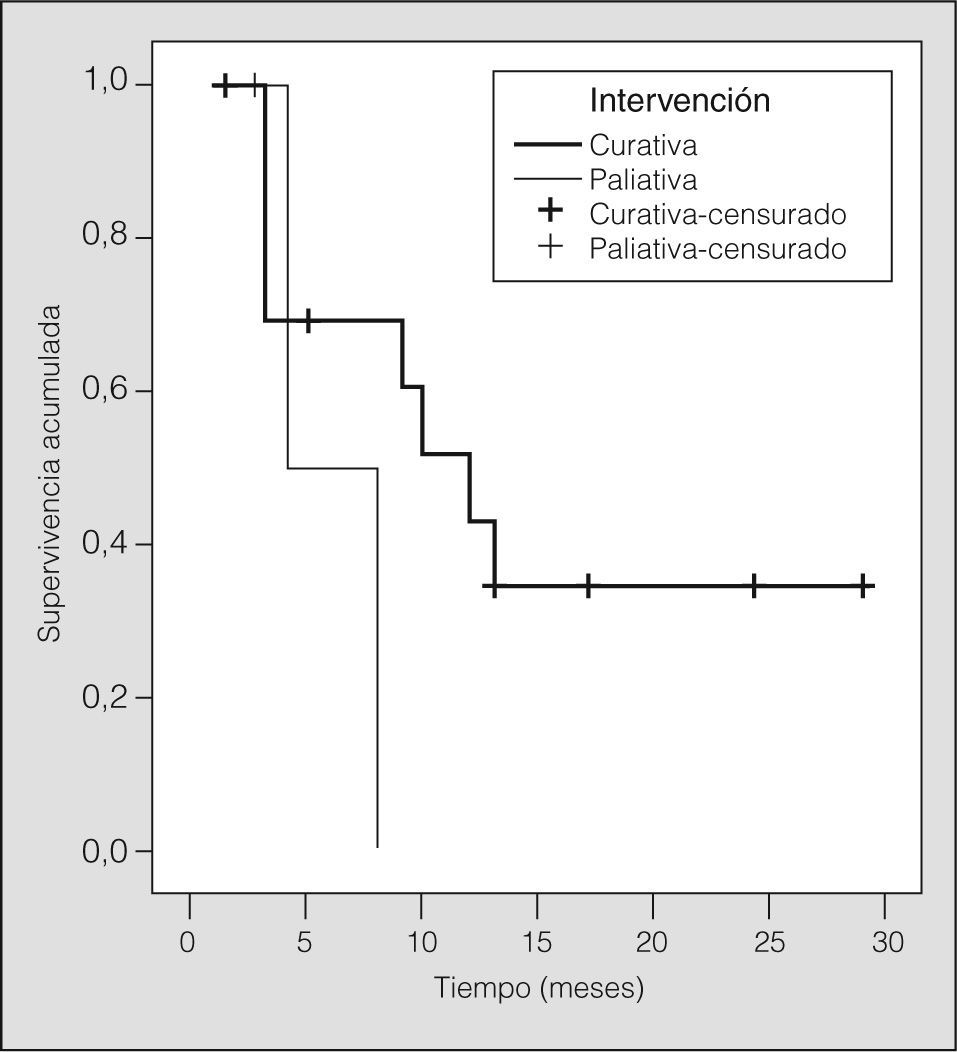
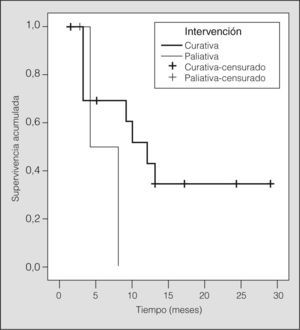
Con una media de seguimiento de 8,68 ± 8,08 meses (rango: 1-29), la supervivencia global fue de 10 meses (fig. 3) y varió en función de la indicación de la RF (paliativa o curativa) y del tipo de tumor tratado (primario o recurrencia de la enfermedad). La supervivencia mediana entre los pacientes tratados con intención paliativa fue de 4 meses, y en los tratados con intención curativa de 12 meses (p = 0,26).
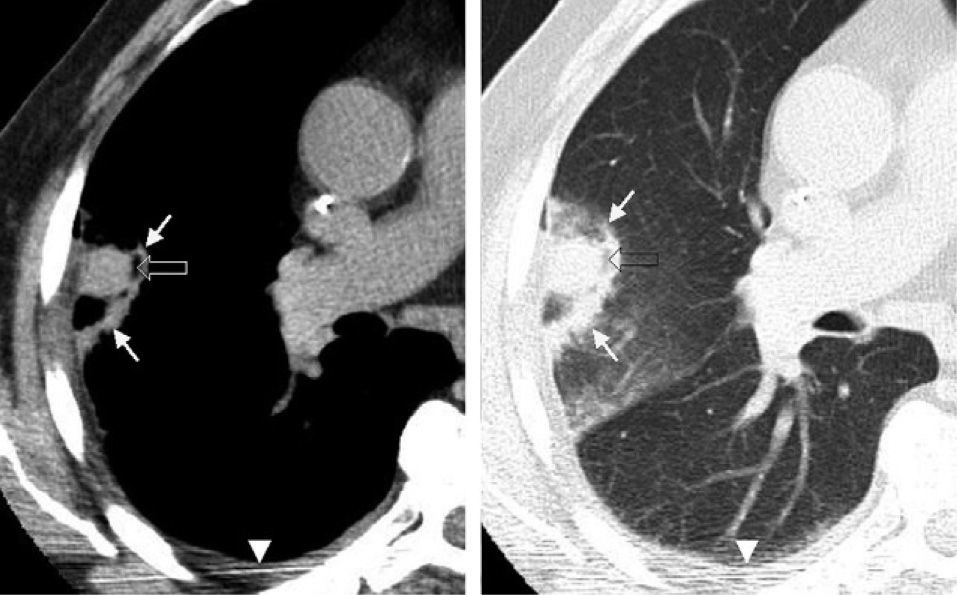
Respuesta radiológicaComo ya se ha comentado, en el control inmediato al tratamiento se evaluó la presencia de un halo de características en vidrio deslustrado que circundase el contorno del tumor. Dicho hallazgo se cotejó con las imágenes obtenidas inmediatamente después de la punción, ya que las opacidades en vidrio deslustrado pueden ser secundarias a hemorragia alveolar por la manipulación de la aguja dentro del parénquima. A las 24h del procedimiento la imagen que se obtiene como respuesta al tratamiento se define como "fenómeno de la escarapela" (fig. 4). En los controles sucesivos, en la lesión tratada se valoraron el tamaño del nódulo, la captación del contraste y la presencia de cavitación.
Signo de la escarapela: en el control realizado a las 24h se aprecia el nódulo tratado, de características hiperdensas (secundario a la necrosis coagulativa), con un halo de baja atenuación (flecha hueca) rodeado por otro halo de mayor densidad (flechas). Mínimo derrame pleural secundario (punta de flecha).
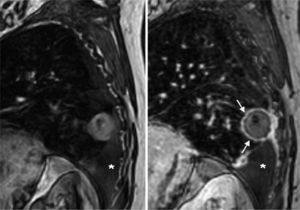
Tanto en la TC como en la RM se valoró la captación de la lesión. Se definió como reacción inflamatoria del parénquima pulmonar la existencia de un halo de captación periférico liso (fig. 5). Las captaciones irregulares y principalmente las nodulares en la periferia suelen ser indicativas de progresión de la enfermedad. Se consideró respuesta completa cuando ni en la TC ni en la RM había captación de contraste en la lesión.
DiscusiónComo sabemos, el cáncer pulmonar es la neoplasia más frecuente en todo el mundo. A menudo, cuando se diagnostica, los pacientes presentan importante morbilidad o el estadio de la enfermedad es avanzado, lo que descarta la cirugía como opción terapéutica. En tales casos la alternativa es la aplicación de quimioterapia-radioterapia o la combinación de ambas. La RF se considera una nueva opción8 de tratamiento local por sí sola o en combinación con algunas de las anteriores. Es un procedimiento relativamente sencillo y ofrece a los pacientes una alternativa terapéutica efectiva. Además, en el caso del pulmón, el aire presente en los tejidos proporciona un aislante adecuado9 que permite concentrar la energía aplicada en la zona pertinente. La selección cuidadosa de los pacientes por un equipo interdisciplinario es uno de los primeros pilares sobre los que se sustenta el éxito de la técnica10.
En el caso de las metástasis, la RF abre una puerta para los pacientes con resecciones pulmonares previas, en los que una nueva toracotomía presenta una elevada morbilidad añadida y las opciones de exploración quirúrgica del tórax son limitadas11. Además, muchas de estas lesiones no son radiosensibles y algunas son resistentes a la quimioterapia12. Una de las ventajas de la RF es que, en caso de recurrencia de las lesiones metastásicas, la técnica puede repetirse13, dado que economiza tejido pulmonar sano. Nosotros tratamos a 2 pacientes con metástasis mediante repetición del procedimiento de la RF. Este grupo de pacientes fue el que presentó un menor número de complicaciones y mejor respuesta en el seguimiento, al tratarse de pacientes con menor edad, mayor FEV1 y menor comorbilidad. También hay que resaltar la posibilidad del tratamiento simultáneo de lesiones hepáticas y pulmonares mediante RF; así lo hicimos en otros 2 pacientes, que mostraron una buena tolerancia.
En los casos de dolor por afectación de la pleura parietal (que tratamos con intención paliativa) la RF ayuda a controlarlo, con buenos resultados debido a su efecto citorreductor. Todos los casos fueron pacientes con mal pronóstico vital, que fallecieron a los pocos meses.
En el control de la enfermedad pulmonar primaria en estadio I los resultados son especialmente prometedores14, con mínimas complicaciones15, excelente tolerancia al procedimiento y escaso efecto sobre la función pulmonar16. Este grupo ha sido el de mayor seguimiento y supervivencia en la serie que presentamos, pese a ser pacientes en quienes, dado su estado funcional y/o morbilidad, se descartó la cirugía.
En los casos de recurrencia local de la enfermedad tras la cirugía oncológica la RF también constituye una posibilidad a valorar, aunque la supervivencia es mucho menor que en los pacientes a quienes tratamos el carcinoma primario con RF como primera opción terapéutica. Estos datos coinciden con los presentados por Lee et al17, que también distinguen a un grupo de pacientes con carcinoma pulmonar en estadio I en los que la RF se instaura como primer tratamiento y cuya supervivencia supera a la de otro grupo de pacientes con carcinoma ya tratado y a la de los casos tratados con intención meramente paliativa.
Una de las indicaciones donde la RF ofrece un mayor campo de trabajo es en combinación con otros tratamientos como la radioterapia, donde se perfila como una opción interesante. En un estudio reciente18 se discute la eficacia de la radioterapia externa al comentar los resultados obtenidos en 60 pacientes en estadio I-II, en los que se hubo progresión local en el 53%, con un intervalo sin enfermedad de 18,5 meses de mediana, y neumonitis posradiación en el 8,3%. Nosotros aplicamos dicho tratamiento de forma secuencial en un paciente con carcinoma primario buscando el efecto sumatorio de ambas técnicas: RF en las regiones centrales, donde la hipoxia es mayor, y radioterapia para el control de las regiones más periféricas del tumor, donde el aumento de flujo sanguíneo y de oxígeno hace más eficaz su aplicación19.
La técnica de RF debe realizarse con una estancia hospitalaria lo suficientemente amplia y con los medios necesarios para tratar las posibles complicaciones20. En nuestro caso, la practicamos en la sala de radiología, que previamente se dotó del material necesario para el tratamiento de las complicaciones, y con la presencia del anestesista.
No hay consenso sobre cuál es la mejor técnica anestésica en estos casos21. La anestesia local por sí sola no ofrece un adecuado control del dolor y la mayoría de los centros la asocian a sedación. Nosotros realizamos un seguimiento adecuado y una sedación-analgesia óptima que ofrezca garantías al paciente y permita la inmovilización necesaria para el trabajo del radiólogo. En un caso de tumor grande, muy adherido a la pleura parietal, fue necesaria la intubación orotraqueal por el dolor secundario a la ablación.
Se han descrito diversas complicaciones, de las cuales la más común es el neumotórax, que alcanza una frecuencia del 20 al 40%22 según las series, aunque sólo la mitad precisa drenaje23. La zona de pulmón necrosada y el grado de enfisema de éste son 2 factores que marcarán el riesgo de fugas aéreas. En nuestra serie hubo 4 casos de neumotórax (tabla III). Es relativamente frecuente la presencia de esputo herrumbroso en las horas posteriores, reflejo de la necrosis del parénquima pulmonar, cuadro bien tolerado con las medidas de broncodilatación y cobertura antibiótica de amplio espectro. En el seguimiento ambulatorio a los pocos días del procedimiento, constatamos la presencia de algunas complicaciones consideradas menores24, como esputo hemoptoico, derrame pleural, febrícula, acumulación de secreciones y dolor de tipo pleurítico, tal como han descrito otros autores25. Atribuimos la ausencia de complicaciones mayores a la localización periférica de las lesiones y a la adecuada inmovilidad de los pacientes (óptimo grado de sedación y analgesia), que permitió practicar la técnica con seguridad.
Una de las mayores dificultades es la evaluación de la respuesta al tratamiento26. Con la TC pueden apreciarse cambios en la lesión tratada, con o sin disminución del volumen de la lesión27. Pensamos que la tomografía por emisión de positrones-TC es una prueba de gran valor que ayuda a decidir la estrategia terapéutica evolutiva, al proporcionar información sobre la actividad de la lesión tratada y la posible progresión de la enfermedad en otras regiones28. Nosotros la solicitamos en 3 ocasiones por dudas respecto a la presencia de tejido tumoral en la zona tratada, con un intervalo superior a 6 meses desde la ablación. En un caso se apreció progresión de la enfermedad ganglionar hiliar homolateral, y en otro paciente se observó cierto grado de actividad tumoral en la lesión ya tratada, motivo por el que se practicó una tercera RF a esa lesión.
No realizamos biopsia percutánea en el seguimiento, pues son escasos los trabajos donde se ha efectuado. Como otros autores, nos planteamos la dificultad de obtener tejido del lugar exacto donde pueda haber algún resto tumoral29 y de momento confiamos en las técnicas de imagen para la valoración y el seguimiento de las lesiones tratadas.
Queda abierto un interesante debate sobre la eficacia de la RF en el control del carcinoma broncopulmonar frente a las técnicas quirúrgicas con resección limitada (videotoracoscopia, segmentectomía, etc.). Sin embargo, la dudosa eficacia de las técnicas quirúrgicas paliativas en el control local de la enfermedad oncológica y su inherente morbilidad, acentuada en pacientes de alto riesgo, pueden definir el lugar de la RF como alternativa frente a ellas, aunque son necesarios estudios entre centros con mayor número de pacientes para responder a estas incógnitas30.
En conclusión, la ablación por RF de lesiones pulmonares es un procedimiento mínimamente invasivo que resulta de utilidad en los tumores primarios y metastásicos. El escaso número de pacientes tratados y el corto período de seguimiento no permiten extraer conclusiones en la actualidad, aunque queda claro que, debido a su excelente tolerancia, puede ser una alternativa (complementaria o única) en el tratamiento de pacientes no candidatos a la cirugía. Es necesaria la formación grupos de trabajo que permitan definir y seguir los procedimientos realizados, así como establecer una guía de trabajo de utilidad para todos los centros interesados.
AddendaEl desarrollo de la técnica descrita ha sido posible gracias al trabajo coordinado del Comité de Tórax del Hospital Universitario de La Ribera, cuyos miembros, pertenecientes a distintas especialidades y centros de trabajo, se detallan a continuación: José Fornet Fayos (Servicio de Radiología Hospital de La Ribera), Pedro Cordero Rodríguez (Servicio de Neumología. Hospital de La Ribera), Elsa Naval Sendra (Servicio de Neumología. Hospital de La Ribera), Cristóbal Gaspar Martínez (Servicio de Oncología. Hospital de La Ribera), Regina Gironés Sarrió (Servicio de Oncología. Hospital de Luis Alcañiz. Játiva), Enrique Mollá Olmos (Servicio de Radiología. Hospital de La Ribera), María Jesús Mengual (Servicio de Medicina Interna. Hospital de La Ribera), Miguel Soler (Servicio de Radioterapia. Hospital de La Ribera), José Luis Monroy (Servicio de Radioterapia. Hospital de La Ribera), Miquel Forment (Servicio de Radiología. Hospital de La Ribera).