Introducción
El primer trasplante pulmonar (TP) humano fue realizado por Hardy en 1963, en un paciente con carcinoma broncogénico en estadio avanzado, que murió a los 18 días por fallo renal y malnutrición1. En los 20 años siguientes, se realizaron unos 40 trasplantes en el mundo, pero sólo 1 paciente fue dado de alta hospitalaria a los 8 meses de la intervención, y falleció poco después por sepsis2. El Grupo de Trasplante Pulmonar de la Universidad de Toronto hizo, en 1983, el primer trasplante unipulmonar con éxito3 y, en 1986, comunicó la primera serie de supervivientes tras trasplante bipulmonar4. Hasta 1990 el número de TP realizados en el mundo no alcanzaba el medio millar. Desde entonces, la cifra fue aumentando hasta 1995, cuando alcanzó la meseta, cifrada por el Registro de la International Society for Heart and Lung Transplantation (RI) en unos 1.500 TP anuales, aproximadamente5. En cualquier caso, las cifras internacionales son sólo aproximadas, ya que el RI es voluntario. Por el contrario, en España, gracias a la Organización Nacional de Trasplantes, contamos con cifras rigurosamente exactas.
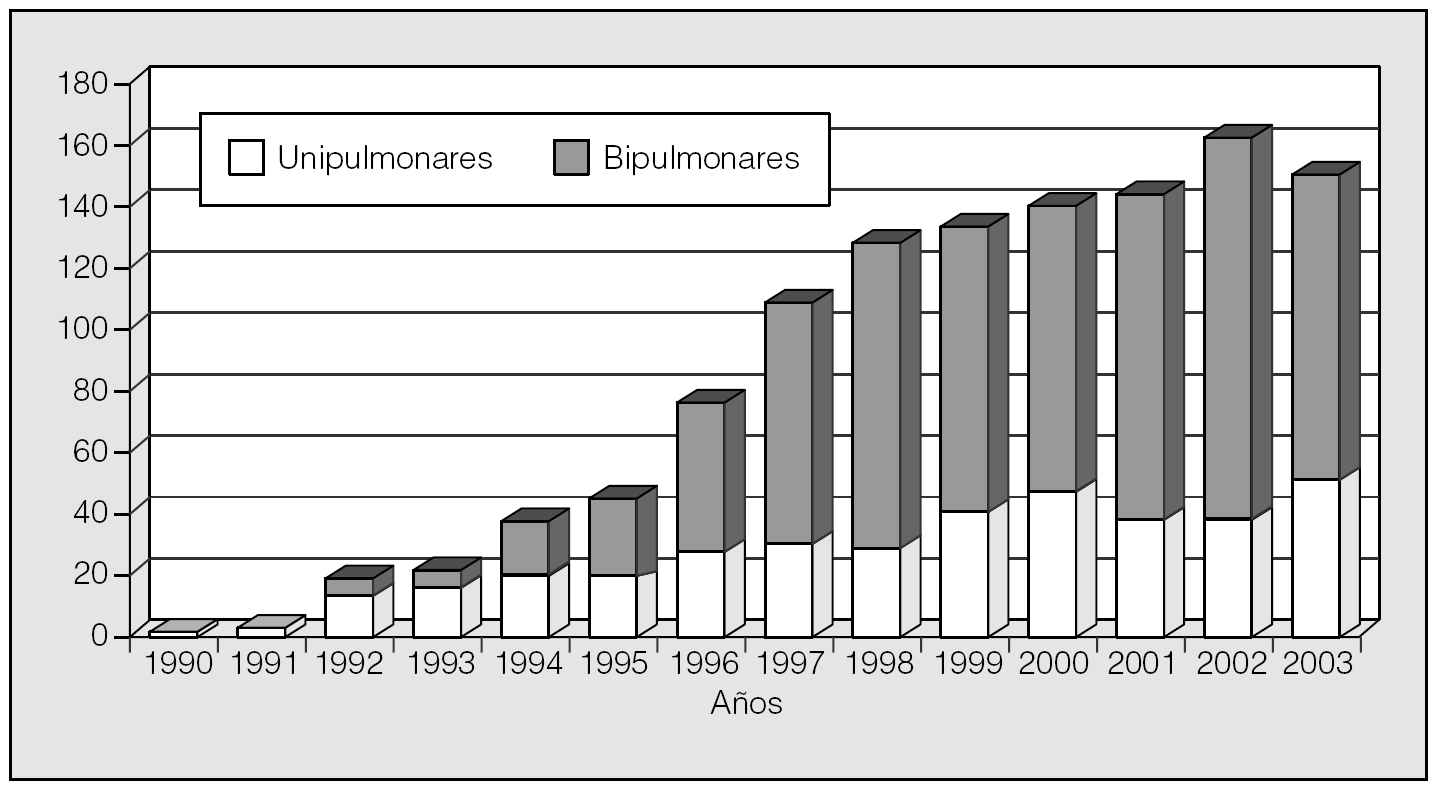
Excluyendo los trasplantes corazón-pulmón, el primer TP en España se hizo en el Hospital Gregorio Marañón de Madrid, en 1990. Sin embargo, no se han vuelto a realizar TP en este hospital. También en 1990 inicia su programa de TP el Hospital Vall d'Hebron de Barcelona. En 1991 comienza su andadura en TP la Clínica Puerta de Hierro de Madrid; en 1992, el Hospital La Fe de Valencia, que realizó su primer trasplante de corazón-pulmón en 1990; en 1993, el Hospital Reina Sofía de Córdoba; en 1997, el Hospital Marqués de Valdecilla de Santander; en 1998, el Hospital Ramón y Cajal de Madrid, y en 1999, el Hospital Juan Canalejo de La Coruña. Hasta finales de 2003, se habían realizado en España un total de 1.162 de TP. El número de trasplantes por centros, desde el inicio de los respectivos programas, está representado en la tabla I, y el número global de TP por año, en la figura 1.
Fig. 1. Trasplante de pulmón en España.
La gran mayoría de los grupos de TP españoles realizan, de forma bastante estable, entre 20 y 30 TP al año. Desde el punto de vista cuantitativo, y prescindiendo de la distribución geográfica, esta actividad es la óptima, si tenemos en cuenta que un volumen bajo de TP por centro es, como demuestra el análisis de los datos del RI, un factor de riesgo significativo de mortalidad al año y a los 5 años, siendo la cifra de 20 TP anuales el punto de inflexión5.
La tasa media de indicación de TP por 1.000.000 de habitantes en España es de 7,8, aunque las oscilaciones entre las diferentes comunidades autónomas son grandes, con una tasa mínima de 1,6 en Aragón y una máxima de 18,2 en Cantabria. Esta tasa es relativamente alta en comparación con la de los países europeos exceptuando Austria y Bélgica y es similar a la de Estados Unidos6. La tasa de TP por 1.000.000 de habitantes en España es de 3,4, cifra superior a la de la mayoría de los países europeos exceptuando Austria, Dinamarca, Bélgica, Suiza y Noruega y similar a la de Estados Unidos y Canadá7.
La probabilidad de que un candidato a TP reciba su órgano en España es alta. Ello se debe, sin duda alguna, a la generosidad del pueblo español y a la extraordinaria labor de la Organización Nacional de Trasplantes. España es, desde hace más de una década, el país con un mayor número de donantes multiorgánicos por 1.000.000 de habitantes (33,8 en 2003)7. Así, el tiempo medio en lista de espera para TP en España es de 187 días, mientras que en Estados Unidos es de aproximadamente el triple8. Esto ha hecho que en otras partes del mundo estén intentando implantar el llamado "modelo español" de coordinación de la donación de órganos y tejidos9.
Sin embargo, la tasa de pulmones procedentes de cadáver válidos para TP es relativamente baja, inferior al 20%, tanto en España como en el resto de Europa y en Estados Unidos. Por este motivo aumentan progresivamente tanto el número de pacientes en lista de espera como el tiempo en espera del órgano6. Para intentar paliar este hecho, además de relajar progresivamente la exigencia respecto a los criterios de aceptación de pulmones para trasplante10, se han puesto en marcha una serie de medidas, entre las que destacan el reparto de cada uno de los pulmones procedentes de un solo donante a 2 receptores y la utilización de donantes en asistolia. Así, está perfectamente consolidado en España, con buenos resultados, el reparto de los pulmones de un donante para 2 receptores del mismo11 o diferentes centros12, en ausencia de un receptor adecuado para trasplante bipulmonar. En 2001 la Clínica Puerta de Hierro comenzó un programa pionero de TP con órganos procedentes de donantes en asistolia, el cual está ofreciendo resultados esperanzadores13. Por otra parte, el grupo del Hospital Reina Sofía ha puesto de manifiesto que la tasa de pulmones válidos para TP procedentes de donantes multiorgánicos no es homogénea en España, y que existe un potencial de crecimiento de órganos mediante la mejora de los cuidados del donante14.
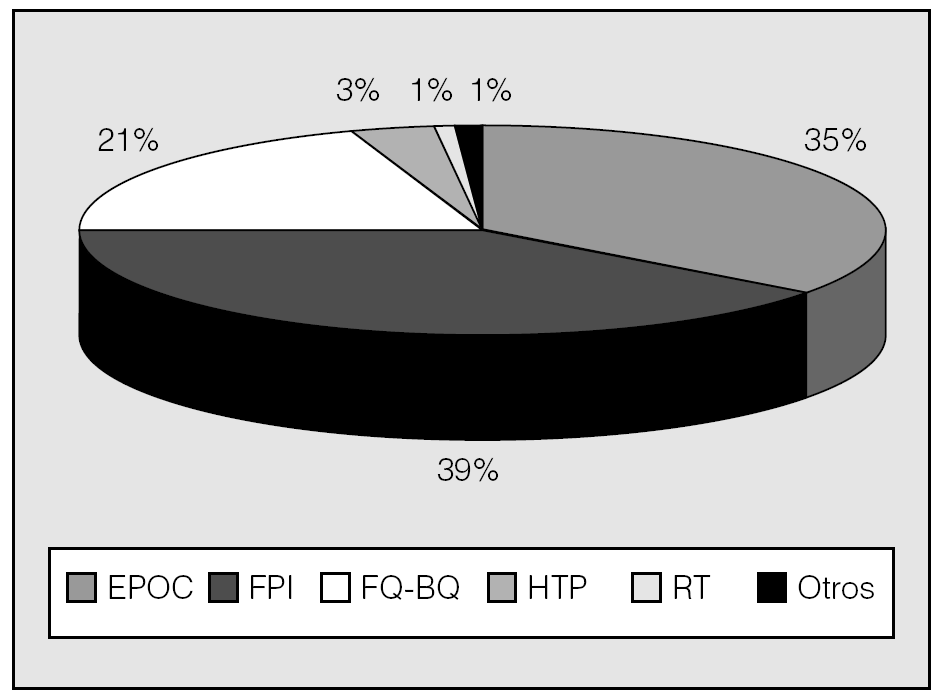
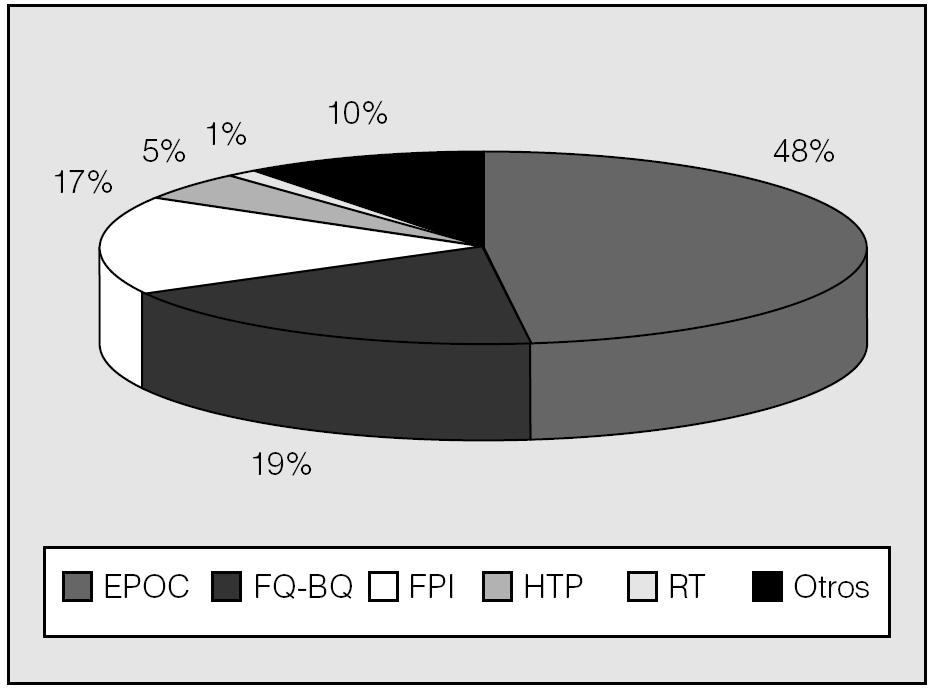
El tipo de trasplante --uni o bipulmonar-- depende, fundamental pero no exclusivamente, de la enfermedad a tratar. Así, mientras que los procesos sépticos --fibrosis quística y bronquiectasias-- requieren necesariamente el trasplante bipulmonar, y la fibrosis suele tratarse con trasplante unipulmonar, en el resto de las afecciones susceptibles de TP puede optarse por ambas opciones según el caso concreto, la disponibilidad de donantes y el criterio y la experiencia de los diferentes grupos de trasplante. En España, desde 1997 el trasplante bipulmonar representa aproximadamente las dos terceras partes del total de TP, sin grandes diferencias entre los distintos grupos (tabla I; fig. 1); por el contrario, en el RI ambos tipos de trasplante figuran con casi idéntico porcentaje. Esta diferencia tal vez se explique por el mayor porcentaje de enfisema tratado en Estados Unidos (el 48 frente al 34%)5,6 y por el mayor número relativo de donantes en España. Las indicaciones de TP en España y en el RI están representadas en las figuras 2 y 3, respectivamente.
Fig. 2. Indicaciones de trasplante pulmonar en España (datos de la Organización Nacional de Trasplantes, 2003). EPOC: enfermedad pulmonar obstructiva crónica; FPI: fibrosis pulmonar idiopática; FQ-BQ: fibrosis quística-bronquiectasias; HTP: hipertensión pulmonar; RT: retrasplante.
Fig. 3. Indicaciones de trasplante pulmonar en el Registro de la International Society for Heart and Lung Transplantation, año 2004. (Véanse abreviaturas en el pie de la fig. 2.)
La supervivencia de los TP en el RI es del 74, el 58, el 47 y el 24% a 1, 3, 5 y 10 años, respectivamente. En la actualidad se está diseñando un Registro Español de Trasplante Pulmonar, por lo que, desgraciadamente, no contamos aún con cifras globales de supervivencia del TP en España. Sin embargo, las publicadas por los diferentes grupos españoles no difieren de las del RI o incluso son mejores que éstas14-20.
El propósito fundamental de este trabajo es recoger las principales aportaciones realizadas por los grupos de TP españoles a la comunidad científica internacional.
Indicaciones de trasplante pulmonar. Estudio y selección de candidatos
El TP se ofrece a pacientes con neumopatía avanzada de carácter obstructivo, restrictivo, séptico o vascular, sin otra alternativa terapéutica, y que tengan una calidad de vida inaceptable y una esperanza de vida limitada, sin otras enfermedades extrapulmonares graves asociadas ni antecedente reciente de neoplasia. Con respecto a la pregunta de en qué momento debe incluirse a un paciente en lista de espera activa para TP, no debe darse una respuesta general, sino que se debe tener muy en cuenta el tiempo medio de espera del programa de TP concreto. Este tiempo, junto a la supervivencia esperable con y sin trasplante, es el que debería utilizarse para encontrar el momento óptimo de inclusión en lista de espera. Estrictamente, el momento óptimo para llevar a cabo un trasplante es aquel en el que la supervivencia esperada con el trasplante supera a la de la evolución natural de la enfermedad. Con el fin de adaptar las guías internacionales a la situación española, miembros de diferentes grupos de TP españoles Clínica Puerta de Hierro, Hospital Reina Sofía, Hospital Vall d'Hebron y Hospital Marqués de Valdecilla elaboraron para la Sociedad Española de Neumología y Cirugía Torácica una normativa en la que compendiaron todo el proceso del TP21.
El momento apropiado para introducir en lista de espera a pacientes con enfermedad pulmonar obstructiva crónica (EPOC) es particularmente difícil, ya que enfermos muy sintomáticos pueden tener una larga supervivencia. No contamos aún con parámetros predictores lo bastante exactos para poder desarrollar una ecuación de regresión con la que estimar la supervivencia de los pacientes con EPOC. En la actualidad el volumen espiratorio forzado en el primer segundo es, sin duda alguna, el parámetro fundamental para la toma de decisiones en la gran mayoría de los programas. Sin embargo, el grupo de la Clínica Puerta de Hierro ha aplicado retrospectivamente el índice BODE, descrito por Celli et al22, en 52 pacientes trasplantados por EPOC. La mayoría de los pacientes tenían una puntuación igual o mayor que 7 en la escala BODE y la supervivencia alcanzada tras el TP fue del 48% a los 5 años. Dado que la supervivencia de los pacientes con esta puntuación en la escala BODE en el estudio de Celli et al es de sólo el 20% a los 52 meses sin trasplante, es muy probable que el uso de este índice represente una mejora en los criterios de selección para el TP en los pacientes con EPOC23.
La fibrosis quística también plantea problemas, tanto respecto al momento de incluir a los pacientes en lista de espera como en la manera de tratar los frecuentes episodios de neumotórax y hemoptisis masiva que presentan en el curso de la enfermedad. En el año 2000 la Fundación Sira Carrasco promovió un documento de consenso sobre estos aspectos, redactado, entre otros, por miembros de los grupos de TP de los Hospitales Ramón y Cajal, Juan Canalejo, Vall d'Hebron, Reina Sofía y La Fe, que informa y ofrece pautas de actuación sobre estos aspectos de la enfermedad24.
La linfangioleiomiomatosis constituye una indicación controvertida para TP, debido a la poca experiencia acumulada y a la recurrencia de la enfermedad en el injerto que se ha descrito. Sin embargo, el grupo del hospital Vall d'Hebron25 publicó en el año 2000 una de las series más extensas de TP en esta enfermedad; incluía a 8 pacientes, con buena supervivencia en 6. Recientemente, este mismo grupo ha publicado una serie de 3 lactantes trasplantados por neumonía intersticial, una enfermedad rara, con mal pronóstico y sin tratamiento específico; se pudo dar de alta a los 3 en buen estado26.
Entre las indicaciones controvertidas para TP se encuentran el síndrome de distrés respiratorio agudo y los defectos congénitos del sistema inmunitario. No obstante, el grupo del Hospital La Fe ha demostrado buenos resultados, tanto en un paciente con síndrome de distrés respiratorio agudo y ventilación mecánica prolongada27 como en pacientes con hipogammaglobulinemia asociada al cromosoma X28.
La necesidad de ventilación mecánica previa al TP es un factor de riesgo de mortalidad temprana5 y, por tanto, se considera una contraindicación relativa. Sin embargo, y a pesar de la alta incidencia de complicaciones postoperatorias, los grupos de los hospitales La Fe20,29 y Reina Sofía30 han publicado supervivencias que permiten afirmar que el TP es una opción válida en casos bien seleccionados de pacientes sometidos a ventilación mecánica.
El grupo del Hospital Vall d'Hebron publicó, en 1996, uno de los pocos trabajos existentes en la bibliografía acerca de los resultados de la evaluación de candidatos a TP. Aproximadamente la mitad de los 208 pacientes, remitidos entre 1990 y 1994, cumplían criterios para ser evaluados intrahospitalariamente; de ellos, el 50% pasó a la lista de espera activa, y finalmente se trasplantó la mitad, es decir, 1 de cada 4 pacientes remitidos para evaluación31.
La indicación de coronariografía en candidatos a TP sin síntomas de cardiopatía isquémica es controvertida. El grupo del Hospital Vall d'Hebron realizó coronariografía a todos los pacientes mayores de 55 años y a los mayores de 50 años que tuvieran factores de riesgo para coronariopatía. Encontraron enfermedad coronaria significativa en el 16% de los pacientes, todos ellos fumadores. En ninguno de los pacientes trasplantados se diagnosticó cardiopatía isquémica en el postoperatorio. Concluyeron que la coronariografía es útil en los candidatos mayores de 50 años con factores de riesgo para enfermedad coronaria32.
Preservación pulmonar
La preservación del pulmón tiene como fin minimizar el efecto perjudicial de la necesaria isquemia y posterior reperfusión a la que se le somete. Una buena preservación es esencial para evitar el fallo primario del injerto, principal causa de mortalidad temprana, disminuir las posibilidades de infección, de rechazo y de problemas con la anastomosis bronquial, y en definitiva, para obtener buenos resultados con el TP. La preservación persigue un doble objetivo: por una parte, mantener íntegras la estructura y la función del injerto, y por otra, hacerlo durante el mayor tiempo posible.
Una de las aportaciones españolas que más repercusión han tenido, y que de hecho han adoptado la mayoría de los grupos de TP del mundo, ha sido la doble perfusión del injerto, por vía arterial y venosa. El grupo del Hospital Reina Sofía, a raíz de la publicación de Sarsam et al33 --en que se preconizaba la vía de perfusión venosa como preferible, al incluir también en la perfusión a la circulación bronquial--, la cual coincidió en el tiempo con el inicio de su programa en 1993, añadió sistemáticamente, desde el segundo paciente de su serie, la denominada perfusión retrógrada --perfusión del líquido de preservación a través de las venas pulmonares del injerto, una vez extraído-- a la perfusión anterógrada estándar --perfusión a través de la arteria pulmonar, en el cadáver34--. Poco tiempo después, el grupo de la Clínica Puerta de Hierro, que había demostrado previamente, tanto en animales35 como en clínica36, la eficacia de la perfusión retrógrada, añade también una segunda perfusión --en este caso anterógrada, en el injerto ya extraído-- a la perfusión retrógrada estándar en cadáver37. Aunque ninguno de los 2 estudios fue controlado, en ambos se observó una baja incidencia de disfunción primaria del injerto y de complicaciones anastomóticas bronquiales. Desde luego, lo que sin duda aporta la doble perfusión es una mejor limpieza del árbol vascular, pues no es infrecuente observar durante la segunda perfusión la salida de coágulos residuales34.
El grupo de la Clínica Puerta de Hierro puso de manifiesto, en un modelo canino de TP, que la pérdida de la capacidad de adsorción del surfactante tras el TP se correlaciona con la disminución de las concentraciones de la proteína A del surfactante y el aumento de la proteína C reactiva. Los autores concluyen que el hallazgo de concentraciones elevadas de proteína C en el lavado broncoalveolar puede ser un marcador muy sensible de daño pulmonar38.
También en un modelo canino, el grupo del Hospital Reina Sofía demostró que la administración del inhibidor C1 de la esterasa, el principal inhibidor del sistema de contacto de la coagulación y del complemento, evitaba la disfunción temprana del injerto tras TP. Los autores postulan que la activación del sistema de contacto de la coagulación y el sistema del complemento participan de forma importante en el daño de isquemia y reperfusión39. Strüber et al40 han utilizado posteriormente el inhibidor C1 de la esterasa en el fallo primario del injerto, con buenos resultados.
El grupo del Hospital Reina Sofía, en el mismo modelo animal de TP utilizado para el estudio del inhibidor C1 de la esterasa, demostró que la administración de antitrombina, un importante inhibidor de las serinproteasas, con efecto antiinflamatorio, evitaba el daño funcional, histológico y molecular secundario a la isquemia-reperfusión tras un TP, y que este efecto estaba condicionado por el incremento en la producción de prostaglandina I241.
La utilización del óxido nítrico inhalado tras la reperfusión pulmonar sigue siendo actualmente controvertida. Miembros del grupo de la Clínica Puerta de Hierro han participado en un estudio experimental que demuestra que la administración de óxido nítrico en el postrasplante inmediato perjudica al sistema surfactante, a la vez que empeora la oxigenación arterial42.
El líquido más utilizado para la perfusión del lecho vascular en preservación pulmonar ha sido, hasta hace poco tiempo, el Euro-Collins modificado, una solución intracelular, rica en potasio. Sin embargo, hoy día tiende a usarse más una solución de tipo extracelular, baja en potasio, que contiene dextrano y glucosa (Perfadex®), por sus teóricas ventajas. El grupo del Hospital Marqués de Valdecilla43 ha llevado a cabo un estudio clínico en el que compara ambas soluciones. Encuentra que el cociente presión arterial de oxígeno/fracción inspiratoria de oxígeno (PaO2/FiO2) en las primeras 24 h tras el trasplante es significativamente mejor, y que la duración de la ventilación mecánica y la estancia en la unidad de cuidados intensivos es más corta en el grupo prefundido con Perfadex®.
Asimismo, entre las publicaciones sobre preservación pulmonar, destaca una completa y reciente revisión escrita por miembros del grupo del Hospital La Fe44. En ella, además de tratar los fundamentos específicos de la preservación pulmonar, analizan los principios comunes de la preservación de órganos sólidos. De entre sus conclusiones, destaca la afirmación de que, a pesar de los múltiples trabajos experimentales llevados a cabo hasta la fecha en materia de preservación, su repercusión clínica sigue siendo excepcional.
Acto anestesicoquirúrgico
La anestesia en el TP ha ido perfeccionándose progresivamente. No obstante, sigue representando un importante reto, incluso para los anestesistas más experimentados. Paradójicamente, en la bibiliografía internacional no existen suficientes trabajos sobre anestesia en el TP, por lo que aún destacan más los publicados por el grupo del Hospital La Fe45-47. En 1996 describieron las complicaciones anestésicas observadas en los primeros pacientes sometidos a TP por fibrosis quística y destacaron los momentos críticos que suponen el clampaje de la arteria pulmonar y el período tras la reperfusión del primer pulmón45. En 1997 publicaron una revisión general de la anestesia en el TP46. En su trabajo más reciente analizan la morbimortalidad perioperatoria en el TP por fibrosis; destacan la amenaza vital que aún suponen las complicaciones intra y postoperatorias en este grupo de pacientes, fundamentalmente las infecciosas, a pesar de los progresos llevados a cabo en este campo47.
La técnica quirúrgica del TP también ha ido refinándose desde sus inicios hasta la actualidad. El doble TP "en bloque" dejó paso al trasplante bipulmonar secuencial, por su menor morbimortalidad. Para la realización del trasplante bipulmonar secuencial, se utiliza como vía de acceso la toracotomía anterolateral bilateral, con o sin sección del esternón según la exposición obtenida y la necesidad o no de utilizar circulación extracorpórea. El grupo de la Clínica Puerta de Hierro ha descrito la técnica de canulación transcutánea para circulación extracorpórea como alternativa a la ampliación de la vía de abordaje mediante sección esternal48.
Inmunodepresión
A pesar de los avances en los regímenes inmunodepresores en el TP, el rechazo agudo y, sobre todo, el crónico siguen siendo factores limitantes de la supervivencia y de la calidad de vida de los pacientes trasplantados. No existe todavía un consenso internacional acerca de la prescripción o no de tratamiento de inducción, y tampoco del perfil del tratamiento de mantenimiento5, si bien la mayoría de los pacientes trasplantados recibe como tratamiento de mantenimiento un inhibidor calcineurínico, un inhibidor del ciclo celular y corticoides.
Los grupos de los Hospitales La Fe, Puerta de Hierro, Vall d'Hebron y Reina Sofía participaron en el ensayo clínico internacional que comparaba el micofenolato mofetil frente a la azatioprina en el TP. En el análisis realizado al año del comienzo del ensayo, aunque la frecuencia de rechazo agudo y crónico no difería entre ambos grupos de pacientes, la incidencia de retirada temprana y de mortalidad global fue significativamente más alta en los pacientes tratados con azatioprina49.
El rechazo crónico, actual talón de Aquiles del TP, afecta al 50% de los pacientes que sobreviven a los 5 años del trasplante5. Una de las medidas que suelen tomarse ante su diagnóstico es la optimización del tratamiento inmunodepresor de base. La rapamicina, un inmunodepresor potente, que también ejerce una acción antifibrótica, ha formado parte del tratamiento inmunodepresor en varios pacientes con rechazo crónico o toxicidad derivada de los inhibidores calcineurínicos tras un trasplante de pulmón, o corazón-pulmón, en la Clínica Puerta de Hierro. Los resultados preliminares han sido favorables, con estabilización de la función pulmonar en la mayoría de los pacientes con rechazo crónico y mejoría de los efectos iatrogénicos en el resto50,51. Por otra parte, el grupo del Hospital Vall d´Hebron ha comunicado los resultados preliminares del tratamiento de rescate con tacrolimus y micofenolato mofetil, como sustitutos de la ciclosporina y la azatioprina, en pacientes con rechazo crónico. El número de episodios de rechazo agudo disminuyó drástica y significativamente tras el cambio de régimen, y la función pulmonar mejoró o se estabilizó en la mayoría de los pacientes. Los autores son partidarios de reservar el régimen basado en tracrolimus y micofenolato mofetil como tratamiento de rescate y no utilizarlo como tratamiento inicial52.
El grupo del Hospital Reina Sofía ha publicado una revisión sobre tacrolimus y micofenolato mofetil en el TP. Los autores concluyen que con el tacrolimus, usado para la inmunodepresión primaria en lugar de ciclosporina, asociado a azatioprina y corticoides, se producen menos episodios de rechazo agudo, sin que en los pacientes tratados se observen diferencias en el tiempo que permanecen libres de bronquiolitis obliterante, o en las tasas de infección o supervivencia. Como tratamiento de rescate, el tacrolimus puede estabilizar o enlentecer la pérdida de función pulmonar. Como inmunodepresión primaria, el micofenolato mofetil, en vez de azatioprina, es una alternativa fiable, sin diferencias respecto a la seguridad o la eficacia en la prevención de rechazo agudo o en las tasas de supervivencia a corto plazo; como tratamiento de rescate, aún está por determinar su eficacia. La asociación de tacrolimus y micofenolato mofetil, como alternativa a la ciclosporina y la azatioprina, es también una opción segura y eficaz, si bien los resultados en TP son aún contradictorios53.
La incidencia de infección y enfermedad por citomegalovirus en el TP es muy elevada, y se asocia a una mortalidad no desdeñable. El grupo del Hospital Vall d'Hebron ha encontrado que las concentraciones de ciclosporina, tanto predosis como a las 2 h de la dosis, son significativamente más altas en los pacientes con infección o enfermedad por citomegalovirus. Plantean que concentraciones de ciclosporina por debajo de 200-220 ng/ml en predosis, o de 1.000-1.200 ng/ml a las 2 h de la dosis, hacen improbable el desarrollo de infección por citomegalovirus54.
Profilaxis de la infección
La infección es, junto al fallo primario del injerto, la causa principal de mortalidad temprana en el TP y una de las complicaciones que más mortalidad ocasiona en todos los períodos postrasplante5. El grupo de la Clínica Puerta de Hierro, paralelamente al análisis de las infecciones acontecidas en 14 pacientes de su serie de TP, realizó una revisión del tema, en la que recalcó el enorme impacto de esta complicación en los resultados y la necesidad de conocer la cronología del desarrollo de los distintos tipos de infecciones, para así ajustar la profilaxis y detectarlas tempranamente55.
Las infecciones fúngicas son especialmente relevantes, tanto en el período inicial como en el tardío, en la evolución del TP, debido a que pueden acarrear una alta morbimortalidad. Por ello, es fundamental efectuar una profilaxis antifúngica adecuada a los pacientes trasplantados de pulmón. El grupo del Hospital La Fe administró fluconazol (400 mg/día) y anfotericina B inhalada (0,6 mg/kg/día) en el postoperatorio de 52 TP; ningún paciente desarrolló infección por hongos durante ese período, ni toxicidad atribuible a los fármacos56. El grupo del Hospital Vall d'Hebron realizó un estudio en 55 TP consecutivos para comprobar si la anfotericina B inhalada administrada al 80% de los pacientes de la serie analizada resultaba eficaz como profilaxis de la infección por Aspergillus. La tercera parte del total desarrolló la infección. En el análisis de los factores de riesgo demostraron que la anfotericina B inhalada puede prevenir la infección por Aspergillus, y que la enfermedad por citomegalovirus incrementa la probabilidad de desarrollar la infección fúngica57. Este mismo grupo estudió la concentración y la distribución de la anfotericina B inhalada en el tracto respiratorio de los pacientes trasplantados. Encontraron que las concentraciones del fármaco permanecían elevadas durante las primeras 24 h en el lavado broncoalveolar y durante menos tiempo en el broncoaspirado; asimismo, demostraron que la distribución de la anfotericina B fue uniforme en los pacientes que no habían desarrollado bronquiolitis obliterante58. El grupo de la Clínica Puerta de Hierro examinó la incidencia y gravedad de la infección por Aspergillus en 49 pacientes trasplantados. Casi la cuarta parte de la serie desarrolló infección; 4 pacientes presentaron aspergilosis invasiva --de éstos, 3 fallecieron, a pesar del tratamiento--, y el resto, traqueobronquitis aspergilar, todos ellos con buena respuesta a una combinación de itraconazol y anfotericina B (inhalada e intravenosa)59.
España es uno de los países europeos con mayor incidencia de tuberculosis. Es fundamental tener presente este hecho en la población de pacientes trasplantados de pulmón, por razones obvias. El grupo del Hospital Vall d'Hebron realizó un estudio prospectivo de profilaxis con isoniazida en su población de pacientes trasplantados. Prescribieron el fármaco a los pacientes infectados o anérgicos --no tratados anteriormente--, mientras estaban en lista de espera. Ningún paciente de los que finalizaron la profilaxis previamente al trasplante desarrolló la enfermedad, que, por otra parte, se diagnosticó en el 10% de la serie. No observaron diferencias en la incidencia de tuberculosis entre pacientes infectados o anérgicos y no infectados. Concluyeron que la profilaxis con isoniazida, en nuestro medio, es segura y eficaz en los pacientes infectados o anérgicos que están a la espera de un TP60.
El grupo del Hospital La Fe ha publicado los 2 primeros casos mundiales de leishmaniasis visceral en pacientes trasplantados de pulmón. Los autores, tras revisar la bibliografía, observan que todos los pacientes trasplantados de cualquier órgano que desarrollaron leishmaniasis visceral procedían del área mediterránea, por lo que aconsejan incluir pruebas serológicas de infección latente en el estudio pre-TP de los pacientes pertenecientes a esta zona geográfica61.
Complicaciones
La disfunción temprana del injerto, fundamentalmente como consecuencia del daño de isquemia y reperfusión, es la causa principal de muerte en el período post-TP5. La frecuencia de la disfunción temprana del injerto es difícil de precisar, ya que no existe una definición internacionalmente aceptada de esta entidad, por lo que dentro de este término se engloban desde disfunciones leves, que no representan incremento significativo de la morbimortalidad, hasta síndromes de distrés respiratorio agudo --que requieren ventilación mecánica prolongada e incluso el concurso de la oxigenación de membrana extracorpórea-- frecuentemente mortales. El grupo del Hospital Vall d'Hebron publicó una incidencia de esta complicación --definida por un cociente PaO2/FiO2 < 150-- cercana al 50% en 49 pacientes consecutivos, sin que estuviese relacionada con la enfermedad de base, el tipo de trasplante o el tiempo de isquemia, pero sí con un tiempo de cirugía largo62. El grupo del Hospital Marqués de Valdecilla refirió 2 casos graves intraoperatorios de edema de reperfusión, con exudado broncopulmonar rico en proteínas, que mejoraron con tratamiento posturogravitacional, apoyo inotrópico y diurético63. El grupo del Hospital La Fe revisó la incidencia de disfunción temprana del injerto --definida como un cociente PaO2/FiO2 < 200 en las primeras 72 h, o necesidad de ventilación mecánica durante más de 5 días por esta disfunción-- en 35 trasplantes unipulmonares. Cuatro pacientes (11,4%) desarrollaron la complicación, y 3 de ellos fallecieron. De entre las variables analizadas, sólo la causa de muerte del donante --accidente cerebrovascular-- se asociaba a la disfunción del injerto64.
Las complicaciones de la anastomosis de la vía aérea limitaron enormemente el desarrollo inicial del TP clínico. Sin embargo, el perfeccionamiento en la selección de candidatos, en el método de preservación, en la técnica quirúrgica, en los cuidados perioperatorios y en la profilaxis del rechazo e infección ha hecho que disminuyan enormemente la frecuencia y gravedad de esta complicación. El grupo del Hospital Reina Sofía analizó la incidencia, tratamiento y seguimiento de los problemas anastomóticos de la vía aérea en una serie de 151 anastomosis "a riesgo". Encontró que la incidencia fue especialmente baja (5,3%), que se daba exclusivamente en trasplantes bipulmonares y que se relacionaba de forma significativa con un tiempo prolongado de ventilación mecánica. Las complicaciones se resolvieron con dilataciones broncoscópicas e implantación de tutores endobronquiales, salvo en un caso que requirió cirugía exerética65.
Las complicaciones pleurales son frecuentes tras el TP. Sin embargo, pocos estudios las analizan específicamente. El grupo del Hospital Vall d'Hebron estudió las complicaciones pleurales agudas y crónicas en 100 pacientes trasplantados. Entre las complicaciones agudas destacaron el hemotórax y la fuga aérea persistente, ambos asociados con un incremento de la mortalidad postoperatoria. Al año del TP, la mayoría de los supervivientes presentaban alteraciones pleurales --fundamentalmente paquipleuritis-- en la tomografía axial computarizada66.
Tanto el grupo del Hospital Reina Sofía como el de la Clínica Puerta de Hierro han analizado los factores de riesgo de mortalidad en TP. Curiosamente, ambos estudios incluyen a 68 pacientes consecutivos, si bien el primero abarcó todo el período post-TP y el segundo se centró en el postoperatorio inmediato. La mortalidad a largo plazo en la serie del Hospital Reina Sofía se asoció al tipo de TP (unipulmonar), a la necesidad de ventilación mecánica pre-TP, al tiempo de isquemia y al tiempo de intubación post-TP, con una supervivencia a los 5 años del 57%19. La mortalidad a corto plazo en la serie de la Clínica Puerta de Hierro fue significativamente menor entre los pacientes con enfermedad pulmonar supurativa. Ninguna de las variables procedentes de los donantes se correlacionó con la mortalidad temprana, pero sí con un tiempo de isquemia prolongado, la necesidad de circulación extracorpórea, la presencia de fallo primario del injerto y la reoperación por hemorragia67.
Conclusiones
El TP está consolidado en España como alternativa terapéutica de la neumopatía avanzada. A la espera de obtener datos globales del Registro Español de Trasplante Pulmonar, en fase de diseño, los resultados parciales de supervivencia publicados por una buena parte de los grupos españoles son comparables con los reflejados en el registro voluntario RI. La tasa de indicación de TP es dispar entre las diferentes regiones españolas, y la de TP realizado es, en España, similar a la de Estados Unidos y Canadá, y superior a la de la mayoría de los países de nuestro entorno. La contribución científica internacional de los grupos de TP españoles es notable y abarca prácticamente todos los aspectos del procedimiento, tanto en su vertiente clínica como experimental.