Introducción
Desde la descripción del antígeno carcinoembrionario, en 1965, se han conocido y estudiado innumerables sustancias de potencial uso clínico como marcadores tumorales (MT). Con los avances en la biología del cáncer, la gran mayoría de las moléculas analizadas para este fin en el cáncer de pulmón (CP), como en otras neoplasias, son productos de la expresión de determinados oncogenes o genes supresores. La reciente aplicación de nuevas tecnologías de biología molecular, especialmente el uso de las micromatrices multigénicas (microarrays), nos ha permitido pasar en poco tiempo de analizar los patrones de expresión de 1 o 2 genes a detectar simultáneamente el grado de expresión de miles de genes a la vez. Al aplicar estos métodos al estudio del CP, se comprobó que el patrón de expresión de muchos de los genes relevantes en el desarrollo de la enfermedad es extraordinariamente complejo. No existe un patrón de expresión uniforme para una estirpe o subestirpe concreta de CP o, dicho de otro modo, no existe un único gen o una única combinación de genes que esté consistentemente sobreexpresado o subexpresado en un fenotipo particular de cáncer1. Sin embargo, el procesamiento de esa ingente información mediante procedimientos estadísticos sofisticados (clustering) permite establecer subgrupos, según el perfil de expresión genética, que se correlacionan significativamente con la supervivencia. La perfección y el refinamiento de estas técnicas podrían contribuir a establecer nuevas clasificaciones del CP con relevancia pronóstica y terapéutica2.
En el CP, a diferencia de otros tumores epiteliales, como el cáncer de mama, donde se aconseja el uso clínico de algunos MT (BRCA1, BRCA2, indicativos de predisposición a la enfermedad, u otros, como los receptores estrogénicos o el HER2/neu, de trascendencia pronóstica y terapéutica), ningún MT se ha mostrado lo suficientemente útil para que se emplee de modo sistemático y universal en la práctica cotidiana. Así, aunque en muchos hospitales se determinan habitualmente diversos MT séricos ante la sospecha de CP, las publicaciones que tratan sobre normas y recomendaciones relativas al manejo de esta enfermedad o no mencionan los MT o desaconsejan, por su escasa eficacia, su uso sistemático3-5. Por el contrario, en el ámbito de la investigación clínica y epidemiológica ha aumentado exponencialmente el número de trabajos sobre la posible utilidad de los MT.
Las aplicaciones más estudiadas de los MT durante estos últimos años, en relación con el CP, y que se analizarán en este artículo han sido: a) marcadores de susceptibilidad al CP, entre los que destaca el análisis de los polimorfismos de enzimas relacionadas con la activación o eliminación de carcinógenos; b) diagnóstico temprano, especialmente con el intento de detectar en el suero marcadores indicativos del proceso de carcinogénesis; c) pronóstico, a cuyo respecto hemos de recordar que, para que un marcador sea útil, debería añadir información a la que ya proporcionan otros parámetros que, como el grado TNM, el estado general del paciente u otras variables clínicas o analíticas, son imprescindibles para la toma de decisiones o bien son más sencillos o de menor coste. Por tanto, tal vez el valor pronóstico de un marcador o grupo de marcadores debería evaluarse en subgrupos muy concretos de pacientes en cuanto a estirpe y estadio (p. ej., adenocarcinomas con TNM grado I; epidermoides con TNM grado III, etc.), y d) predicción de la sensibilidad o resistencia del tumor frente a determinados fármacos, aspecto éste de evidente relevancia clínica y que está siendo objeto de intensa investigación en estos años.
Marcadores de susceptibilidad al cáncer de pulmón
Entre los fumadores activos un 10-15% acaba desarrollando un CP, como ocurre en una pequeña proporción de personas no fumadoras. Se ha comprobado también que los familiares directos de los enfermos diagnosticados de CP tienen un riesgo de presentar la enfermedad entre 2 y 6 veces mayor que quienes carecen del parentesco. Por ello, se piensa que existe una predisposición genética para el desarrollo del CP, que parece ser de carácter mendeliano codominante6. Podría estar implicado algún gen poco frecuente pero de alta penetrancia, aún no identificado, y probablemente otros de baja penetrancia pero más frecuentes. Se incluyen en este último grupo, sobre todo, los genes que modulan la respuesta del organismo frente a las sustancias cancerígenas (reparación de ADN, activación o inactivación de carcinógenos, fundamentalmente). Dichos genes presentan polimorfismos que dan lugar a alteraciones en la estructura, la función o las concentraciones de las diferentes enzimas que codifican. Así, ciertas variantes de las enzimas activadoras de carcinógenos (enzimas de fase I), la ausencia de algunas enzimas destoxificantes de carcinógenos (enzimas de fase II) y otros polimorfismos en genes reparadores de ADN se asociarían a un riesgo superior de presentar CP en las personas portadoras. Sin embargo, no siempre coinciden los resultados de los trabajos proyectados para evaluar esta relación debido, en buena medida, a la baja frecuencia de algunos polimorfismos en la población, su variación entre las distintas razas, las diferencias en el riesgo de CP asociadas al grado de exposición al tabaco, etc.6. En los últimos años se han publicado varios metaanálisis sobre estudios de casos y controles y grandes revisiones que, aun con ciertas limitaciones, nos dan una idea del peso que pueden tener estos factores genéticos.
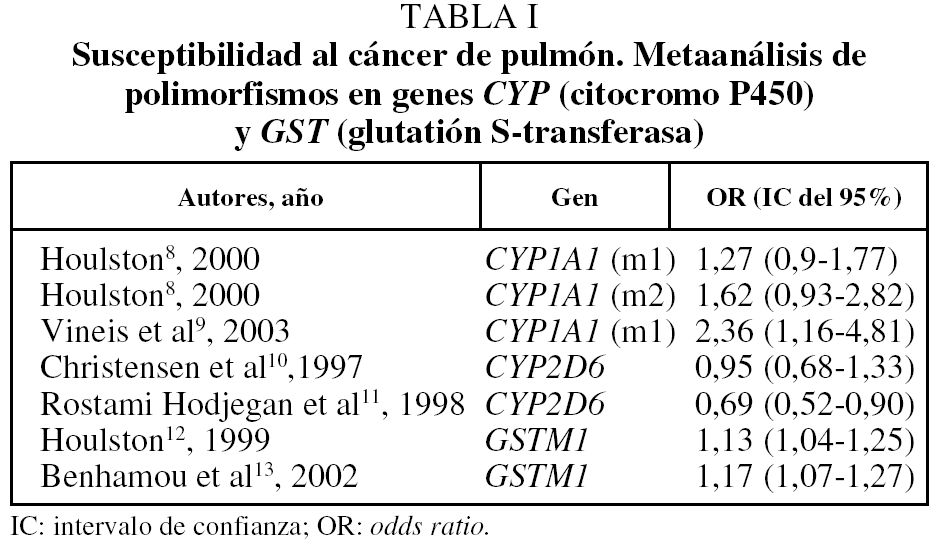
Entre las enzimas de fase I, las más significativas son las derivadas de polimorfismos de los genes CYP (citocromo P450) relacionados con la activación de importantes procarcinógenos del humo del tabaco (aminas aromáticas, hidrocarburos, etc.). Se han estudiado diversas variables alélicas del CYP7, entre las que destacan CYP1A1 y CYP2D6. Respecto a la primera se han publicado 2 metaanálisis: el de Houlston8, en el año 2000, donde se encuentran unas odds ratio de 1,27 y 1,62 para formas homocigotas de los polimorfismos CYP1A1 MspI (m1) y CYP1A1 Ile-Val (m2), respectivamente, pero sin alcanzar diferencia significativa (tabla I), y el publicado en 2003 por Vineis et al9 sobre el polimorfismo CYP1A1 MspI (m1), cuya odds ratio llega a 2,36 dentro de un intervalo de confianza significativo (entre 1,16 y 4,81), pero sólo evaluando estudios realizados sobre población de raza caucásica, ya que en la asiática no se ha comprobado que el riesgo sea significativamente mayor. Con respecto a CYP2D6 (metabolismo de debrisocina), los 2 metaanálisis disponibles10,11 no muestran un incremento del riesgo de CP para los portadores (tabla I).
La glutatión S-transferasa (GST) es la más representativa de las enzimas destoxificantes de cancerígenos (enzimas de fase II), y tiene más de 20 isoenzimas (GSTM1, GSTT1, GSTP1, etc.). Conocemos un metaanálisis de 1999 sobre el riesgo asociado a los polimorfismos del gen GSTM112 y otro de 2002, en el cual Benhamou et al13 confirman los resultados anteriores al comprobar un modesto aumento del riesgo de CP en las personas que carecen de la enzima GSTM1 (GSTM1 null), con una odds ratio de 1,17 y un intervalo de confianza de 1,07-1,27 (tabla I). Nuevos estudios publicados a partir de 2002 de distintas isoenzimas y polimorfismos se mantienen en una línea de resultados similares, aunque otros parecen contradictorios14. La combinación de 2 o más polimorfismos genéticos pertenecientes a la misma o distintas familias de enzimas (fases I y II) incrementa, según algunos autores, el riesgo de presentar CP7. Otros trabajos realizados sobre diferentes genes activadores, destoxificadores o reparadores de ADN no han mostrado, hasta ahora, un incremento apreciable de presentar CP entre sus portadores6.
Debido a la capacidad que tiene la GST para inactivar ciertas sustancias, podría reducir la eficacia de algunos quimioterápicos. Además, diversos estudios han asociado varios genotipos de GST con patrones somáticos tumorales más agresivos (mutaciones de p53, K-ras, etc.). Por estos motivos, se investigan actualmente las implicaciones que pueden tener sus distintos polimorfismos sobre la elección de quimioterápicos y evaluación pronóstica de los pacientes15.
En definitiva, algunos polimorfismos genéticos podrían incrementar, de manera discreta, la posibilidad de experimentar CP, pero éste es un tema que debe seguir estudiándose y validándose.
Marcadores tumorales para el diagnóstico temprano del cáncer de pulmón
Distintos avances (radiología, endoscopia) facilitan la detección de tumores de pequeño tamaño pero, aun en esta situación, la liberación y el establecimiento de metástasis pueden haberse producido. Resulta por tanto necesaria la identificación de MT que representen de forma específica, microscópicamente, pasos intermedios de la carcinogénesis. Con tal información podríamos obtener referencias útiles (puntos intermedios) para los ensayos sobre quimioprevención, identificar a los pacientes con altas posibilidades de desarrollar CP (población de riesgo) o apoyar la toma de decisiones ante nódulos hallados en la tomografía computarizada y llevar a cabo tratamientos en estadios realmente tempranos.
Diversas sustancias y modificaciones genéticas (tabla II) se están proponiendo como MT16-21, pero aún no parecen lo suficientemente sensibles y específicas para que se usen como método de diagnóstico temprano en el CP. Sabremos de su verdadero valor a medida que dispongamos de trabajos bien diseñados que logren validar resultados positivos a gran escala y avancemos en el conocimiento de la secuencia de cambios genéticos (mutaciones, deleciones, expresión de telomerasa, etc.) y epigenéticos que acaban desembocando en el CP16,17. Hoy se piensa que el desarrollo de las técnicas de estudio simultáneo de múltiples genes (biochips o micromatrices multigénicas) para identificar selectivamente los expresados en las células tumorales17, junto con las nuevas técnicas de proteómica que mejoran considerablemente la identificación y purificación de proteínas fundamentales en la carcinogéne- sis18-22, puede dar lugar a avances significativos en el diagnóstico temprano del CP.
Para llevar a cabo programas de detección entre la población de riesgo elevado necesitamos estudiar MT en muestras fáciles de obtener. En este sentido, el esputo (estudios de la ribonucleoproteína nuclear heterogénea, metilación, mutaciones, otros cambios genéticos) y, sobre todo, las muestras séricas son los más apropiados16. Se han identificado en suero de pacientes con cáncer de ovario algunos patrones proteicos (proteómica) con elevada sensibilidad y especificidad diagnósticas, incluidos los tumores iniciales. Sobre el CP hay trabajos en marcha actualmente. Otro campo de estudio de gran interés es la evaluación del ADN circulante en sangre periférica, y en menor medida del ARN, detectables en estadios tumorales tempranos. Los trabajos disponibles actualmente cuentan, por lo general, con un limitado número de casos y controles y se centran en 5 aspectos fundamentales: a) medida del ADN total; b) grado de expresión de distintos genes; c) metilación de promotores en uno o varios genes; d) alteración de microsatélites, y e) mutaciones específicas19. En conjunto se han hallado alteraciones en ADN o ARN circulante desde un 25 hasta un 78% de los casos de CP y sólo entre el 0 y el 12% de los controles. Aunque existe una clara necesidad de validar y estandarizar los métodos de estudio, disponemos ya de algunos resultados esperanzadores. Sozzi et al20, que determinaron la cantidad de ADN circulante en 100 pacientes con CP no microcítico y 100 controles, encontraron que la mediana de ADN era casi 8 veces mayor en los primeros que en los segundos. También observaron que con un valor de corte de 15 ng/ml la sensibilidad y especificidad del test eran del 78 y el 95%, respectivamente, y que valores superiores a 20 ng/ml se asociaban con un riesgo de presentar CP que era 85 veces superior al que tenían las personas con cifras menores o iguales a 4 ng/ml.
Marcadores tumorales en la evaluación
del pronóstico
Disponemos de un creciente número de estudios que evalúan la capacidad pronóstica de múltiples marcadores moleculares --genes K-ras, Bcl2, Her2/neu, gen del receptor del factor de crecimiento epidérmico (EGF-R), p53, Rb, p16, p27, ciclinas, catepsina B, inhibidores tisulares de metaloproteinasas, telomerasa, factor de crecimiento endotelial vascular (VEGF), detección sérica del fragmento 19 de citoqueratina (CYFRA 21-1), enolasa neuronal específica, etc.--. Desafortunadamente, las diferencias metodológicas entre dichos trabajos, la inclusión de un número relativamente bajo de enfermos, la insuficiente comparación de los factores recientemente descritos con los identificados en estudios previos y los resultados heterogéneos son la causa de que actualmente estos factores pronósticos sigan encuadrados en la categoría de "nuevos o prometedores"23 y apenas estén tomándose en consideración en la evaluación pronóstica del paciente individual.
De hecho, no resulta fácil conocer el valor de cada marcador en concreto. En una completa revisión realizada al efecto sobre CP no microcíticos (CPNM) por Brundage et al23, se indica que, a título ilustrativo y sin valor de "evidencia", excluyendo la extensión anatómica tumoral, los asociados significativamente con la supervivencia fueron, con mayor frecuencia: marcadores de angiogénesis, estado de p21, CYFRA 21-1, estado de los organizadores nucleolares (Ag-NOR), estado de p185, estado de Ki-67, estado del VEGF y estado de p53. Realizando una búsqueda en MEDLINE sobre metaanálisis recientes de estos factores, hemos encontrado un mayor riesgo de fallecimiento, moderado pero estadísticamente significativo, sólo en las siguientes situaciones: elevada cantidad de microvasos en pieza tumoral (tasa de riesgo [TR]: 1,80-1,99)24, VEGF positivo (TR: 1,48)25, CYFRA 21-1 elevada (TR: 1,88)26, sobreexpresión de C-erbB-2 (TR: 1,55)27, que conduce a la acumulación de p185, y p53 anormal (TR: 1,44)28. La mutación del oncogén K-ras, que da lugar al aumento de p21, se ha asociado también con una reducción de la supervivencia de los enfermos, pero los trabajos analizados resultaron excesivamente heterogéneos29. Hemos de señalar que las conclusiones de los anteriores metaanálisis se refieren exclusivamente a pacientes diagnosticados de CPNM. Tan sólo los relativos a VEGF, p53 y C-erbB-2 recogieron trabajos sobre enfermos con CP microcítico, y concluyeron que los datos disponibles eran insuficientes para determinar su valor pronóstico en este tipo de tumor, que, lógicamente, sigue siendo objeto de estudio21.
Como ocurre en el campo del diagnóstico temprano, las nuevas técnicas de proteómica y análisis de múltiples genes pueden resultar de gran ayuda en la evaluación pronóstica del paciente22. Con esta perspectiva Endoh et al30 han estudiado, en la pieza tumoral resecada de 85 enfermos de adenocarcinoma, el patrón de expresión de 44 genes, a partir de los cuales se identificó un grupo concreto de 8 genes asociados significativamente (estudio multivariante) con una menor supervivencia. Este hecho, que condicionaba un riesgo de fallecimiento más de 5 veces superior, se validó posteriormente al confirmarse el resultado en otro grupo independiente de 21 pacientes.
Marcadores predictores de respuesta al tratamiento
Una de las características del cáncer, especialmente aplicable al CPNM, que plantea difíciles retos a la hora de abordar su tratamiento es la gran heterogeneidad, no sólo en cuanto a la expresión clínica, la velocidad de crecimiento o el potencial metastásico, sino en cuanto a su resistencia o sensibilidad a la medicación aplicada. La heterogeneidad se da no sólo entre tumores de igual estirpe en distintos pacientes, sino incluso en un mismo tumor de un mismo paciente, de modo que cuando se diagnostica, aun en estadio temprano, existe una gran diversidad de poblaciones celulares con características diferentes31. En la práctica, la tasa de respuestas objetivas en el CPNM, la mayoría remisiones parciales, se puede alcanzar hoy en el 30-40% de los casos y, aunque circunstancias clínicas como el estado general del paciente, la comorbilidad, etc. nos ayudan a seleccionar a los candidatos a recibir tratamiento con quimioterapia o radioterapia, es claro que todavía desconocemos en gran medida qué rasgos del tumor nos pueden precisar qué pacientes serán beneficiarios de tal o cual tratamiento.
Desde hace años se conoce la existencia de mecanismos celulares causantes de la resistencia a citostáticos, como la glucoproteína P, dependiente de la familia de genes de MDR (resistencia a múltiples fármacos), que expulsa los fármacos fuera de la célula mediante un sistema transportador dependiente del adenosintrifosfato32. También se han intentado analizar otros rasgos geneticomoleculares que permitan predecir la sensibilidad o resistencia a determinados agentes quimioterápicos de uso común en el CP. Monzó et al33 secuenciaron el gen de la betatubulina, enzima que estimula la polimerización de microtúbulos y que sirve de blanco a la acción del paclitaxel, citostático de uso generalizado en el tratamiento del CPNM, y hallaron que la presencia de mutaciones en el gen se asociaba a falta de respuesta al fármaco, de modo que podría disponerse de un potente predictor de quimiorresistencia. Otros autores, sin embargo, no han podido detectar tales mutaciones en ninguno de los 83 CPNM resecados y concluyen que deben de existir otros mecanismos alternativos de resistencia al paclitaxel34 (tabla III).
Entre otros genes de probable importancia en la respuesta al tratamiento se encuentran los que controlan la capacidad de reparación del ADN. Así, la sobreexpresión del oncogén p53 se ha asociado a una pobre respuesta frente a la quimioterapia basada en cisplatino, en pacientes con enfermedad avanzada35. El mismo significado adverso de p53 se observó también en una serie de pacientes con estadio III tratados con navelbina y radioterapia36. En ambos estudios, el p53 mantuvo su asociación con mala respuesta en el contexto de análisis multivariante. Por otro lado, en trabajadores expuestos a cloruro de vinilo se ha observado que algunos polimorfismos comunes del gen ERCC1 (gen de reparación-escisión, o excision repair cross-complementing-1) son causantes de la susceptibilidad al daño genético inducido por sustancias químicas37. En el CPNM, la expresión del ERCC1 parece implicar, por un lado, un buen pronóstico y, por otro, una probable resistencia al tratamiento con cisplatino; a su vez, aquellos con baja expresión tendrían peor pronóstico, pero mayor sensibilidad a dicho fármaco, lo que podría ser útil para seleccionar a pacientes candidatos a obtener mayores beneficios con tratamiento adyuvante38,39.
Al igual que en el cáncer de mama, la amplificación o sobreexpresión del receptor de membrana HER-2/neu, o C-erb-2, se asocia en el CP a una conducta más agresiva y peor pronóstico: un estudio de pacientes sometidos a resección que analizaba factores predictores de supervivencia demostró que la sobreexpresión de este marcador mantenía un valor pronóstico independiente en un análisis multivariante que incluía el sexo, la estirpe, el estadio TNM y el tipo de cirugía40; además, como se comentó más arriba, en un metaanálisis publicado en 2003 se demuestra el significado adverso de HER-2/neu27. Frente a este receptor se ha elaborado un anticuerpo monoclonal humanizado, el trastuzumab, de eficacia probada en el cáncer de mama. Recientemente se ha estudiado su posible papel en el CPNM en 2 ensayos independientes, uno de ellos aleatorio41,42 (tabla III). Aunque ninguno observó ventaja en los tratados con la medicación de prueba, frente a controles históricos en uno y frente al grupo control en el estudio aleatorio, ambos realizaron a posteriori un análisis de subgrupos en función del grado de expresión de HER-2/neu y encontraron una tasa de respuestas mayor o una supervivencia más larga en los que presentaban el máximo nivel de sobreexpresión del marcador (HER-2/neu 3+). En un editorial de la revista en que se publicó uno de estos trabajos se hace hincapié en la necesidad de cuantificar de modo más preciso, mediante la técnica de reacción en cadena de la polimerasa previa transcriptasa inversa, y no simplemente mediante inmunohistoquímica de la pieza tumoral, el grado de expresión del receptor. Asimismo, se aconseja seleccionar, de cara a ensayos fase III, sólo a los pacientes que tengan el más alto grado de sobreexpresión de HER-2/neu e, incluso, limitar aún más el tipo de posible candidato mediante la determinación de otros factores, como el factor 1 de crecimiento insulinoide, que puede contrarrestar el efecto del trastuzumab43. Sin embargo, menos del 5% de los CPNM reunirían tales características, por lo que el papel de este fármaco inhibidor no parece claro por el momento41.
Predictores de la respuesta al gefitinib
Esta sustancia, pequeña molécula diseñada para inhibir al EGF-R, y recientemente aprobada en Estados Unidos para uso clínico de tercera línea en pacientes con CPNM, había suscitado grandes esperanzas por su comodidad (administración oral), buena tolerancia y algunas respuestas preliminares alentadoras observadas en los primeros estudios clínicos. Sin embargo, poco después se conocieron los resultados de 2 amplios ensayos aleatorios en los que dicho fármaco se asoció a pautas estándar de quimioterapia, sin que se obtuviera beneficio alguno44,45. En varios análisis efectuados en series amplias de pacientes tratados se intentó detectar qué características (del paciente o del tumor) podrían ayudar a predecir una mayor probabilidad de obtener una respuesta favorable. Así, se observó que el sexo femenino, la ausencia de tabaquismo, la estirpe del adenocarcinoma y la presencia de rasgos de diferenciación bronquioloalveolar se asociaron a un porcentaje más elevado de respuestas46. Por otro lado, ya en ensayos anteriores había sorprendido el hecho de que no hubiese una relación clara entre la sobreexpresión del EGF-R y una respuesta clínica favorable. Muy recientemente, en sendos trabajos publicados en Science47 y New England Journal of Medicine48 (tabla III) , ambos con comentario editorial, se han comunicado hallazgos que permiten explicar esta aparente contradicción y cuál es la alteración molecular concreta que puede predecir fiablemente la respuesta al mencionado fármaco inhibidor. Los autores seleccionaron, entre los pacientes tratados con gefitinib, a: a) un grupo en que se había obtenido una indudable respuesta objetiva favorable, con aumento del tiempo de supervivencia; b) otro grupo en que no hubo respuesta alguna, y c) un grupo de pacientes con CPNM aún no sometidos a tratamiento. Después procedieron a analizar en todos ellos, en el ADN extraído del tumor, la secuencia completa que codificaba la producción del EGF-R. De este modo encontraron, en 8 de los 9 pacientes que habían respondido al tratamiento, diversas mutaciones heterocigotas que se agrupaban justamente en la región que codifica para la zona del receptor catalíticamente activa, que es precisamente la zona donde se une el fármaco inhibidor. En los que no respondieron al tratamiento no encontraron tales mutaciones. Los autores postulan que esa mutación confiere una mayor estabilidad a la unión con el gefitinib, que tiene como consecuencia una ganancia de función, es decir, una sobreactivación de las cadenas metabólicas dependientes y, por tanto, una ventaja proliferativa con respecto a las células carentes de esa alteración. Aunque el número de pacientes examinados es pequeño, estos primeros datos hacen pensar en la alta probabilidad de conocer a priori, mediante la correspondiente determinación geneticomolecular, si un paciente concreto será sensible o no al tratamiento con el fármaco. Lamentablemente, el análisis del tercer grupo, es decir, de los pacientes con CPNM no tratados, encontró que es muy pequeña (inferior al 10%) la proporción de pacientes con posible respuesta, es decir, de portadores de esas mutaciones. Por tanto, si se administra el gefinitib de forma indiscriminada a todo paciente con CPNM, como se hizo en los grandes ensayos aleatorios antes mencionados, que además asociaban quimioterapia, es fácil entender que el efecto beneficioso, circunscrito a una exigua minoría, queda diluido y oculto por la gran mayoría de pacientes que no responden. Entre los diversos grupos de pacientes estudiados, hubo una proporción más elevada de mutaciones entre las mujeres japonesas que en las norteamericanas, lo que apunta a la existencia de influencias étnicas en la diversa patogenia molecular del CP.
Si los hallazgos de estos últimos trabajos se confirman en estudios prospectivos, éste sería sin duda un paso importante en el proceso de incorporación a la clínica del CP de la farmacogenómica y, por tanto, de la aplicación de tratamientos adaptados a las circunstancias geneticomoleculares de cada tumor o tratamientos "a la medida".