Tradicionalmente la interpretación del asma se ha fundamentado en relaciones deterministas directas del tipo estímulo-inflamación-hiperrespuesta bronquial-obstrucción-síntomas, olvidando, sin embargo, que en esta enfermedad no es infrecuente detectar circunstancias que no guardan linealidad. Por tal motivo algunos autores postulan que el abordaje de su patogenia debería comenzar a realizarse desde la óptica de los sistemas complejos que adoptan una topología libre de escala. La teoría de los impactos inflamatorios múltiples, propuesta por el grupo de Pavord, representa, en su sentido más amplio, una aportación adicional a esta línea de pensamiento. De acuerdo con ella, en el asma la coexistencia de estímulos inflamatorios adicionales, de localización pulmonar o extrapulmonar, agravan la evolución del proceso respiratorio. Los efectos de esos estímulos pueden ser aditivos o actuar de manera sinérgica con la propia inflamación asmática. Más allá de su interés práctico, la hipótesis viene a recordarnos que el organismo es un constructo conformado a partir de conjuntos interconectados, y que el asma incluye en su patogenia elementos de naturaleza diversa entrelazados. Si esto es así, el planteamiento futuro tendría que comenzar a centrarse en la búsqueda de los hubs de esa red llamada asma integrando la información aportada por la genómica, la proteómica y la metabolómica.
Our understanding of asthma has traditionally been based on linear deterministic relationships of the type stimulus-bronchial hyperresponsiveness-obstruction-symptoms. This notion however neglects the fact that nonlinear relationships may be present. To better define the disease, some authors therefore suggest that we should think in terms of complex systems with a scale-free topology. The idea of multiple inflammatory hits proposed by the group of Pavord is in its broadest sense a further contribution to this line of thought. According to this theory, the coexistence of additional inflammatory stimuli, which may or may not be localized to the lungs, are responsible for deteriorating lung function. The effects of these stimuli may be additive or act in synergy with the underlying inflammation of asthma itself. In addition to the practical implications, this hypothesis serves as a reminder that the body is made up of interconnected parts and that the pathogenesis of asthma includes distinct elements linked together. If this hypothesis proves valid, future approaches should start to look for the hubs in this network that constitutes asthma, and attempt to integrate information from genomics, proteomics, and metabolomics.
El modelo de ciencia moderna surge del principio newtoniano reduccionista-mecanicista, que consiste en dividir el objeto de estudio en partes más simples con la esperanza de que, a partir de esos elementos, sea posible dilucidar el funcionamiento del conjunto, aceptando que la suma de las soluciones de un problema es también una solución1,2. Sin duda esta manera de intentar aprehender la naturaleza ha resultado extraordinariamente satisfactoria. Sin embargo, el modelo reduccionista no siempre funciona bien cuando lo que se pretende investigar: a) interactúa con el medio fuera de equilibrio termodinámico; b) trabaja bajo una dinámica no lineal (rara vez los efectos son proporcionales a las causas), y c) la totalidad no puede ser representada como la suma de sus componentes, al surgir propiedades nuevas no explicables por la simple agregación de las partes individuales que lo conforman1,2. Un ser vivo es más que la suma de sus átomos, y el cerebro humano es más que la suma de sus neuronas. En el primer supuesto, la propiedad emergente es la vida misma, y en el segundo, la inteligencia y la conciencia. Para abordar ese paradigma holístico nace, a mediados del siglo pasado, la ciencia no lineal o ciencia de la complejidad, que abarca, entre otras nociones, la teoría del caos, la geometría fractal, los autómatas celulares, la computación emergente o el análisis de redes2.
A nuestro entender, la aplicación de algunos de los principios fundamentales de la ciencia no lineal puede ayudarnos a entender mejor una situación compleja como es el asma, donde estamos lejos de tener todas las respuestas.
Barreras actuales en el manejo del asmaAunque durante las últimas décadas hemos asistido a avances sustanciales en el conocimiento de la patogenia de esta enfermedad y se han producido mejoras significativas respecto al tratamiento, la curación continúa siendo una quimera, y conseguir su control adecuado no siempre resulta fácil para un porcentaje notorio de pacientes. El asma refractaria o de manejo difícil ejemplifica muy bien esa limitación3. Existen diversas razones potenciales que pueden explicar el fracaso terapéutico frente a cualquier enfermedad (efectos indeseables y restricciones farmacogéneticas o farmacodinámicas de los medicamentos usados, redundancia patológica, diana terapéutica equivocada, etc.)4 y, en lo que nos ocupa, el asma, se han llegado a identificar determinantes concretos de evolución tórpida: polimorfismos, exposición mantenida a alérgenos, agentes ocupacionales o contaminantes ambientales, rinosinusopatía, incumplimiento terapéutico, factores psicosociales, falta de observancia de las normativas, hipopercepción de síntomas, etc. (tabla 1)3,5–11. Aun así, la realidad es que el modo actual de afrontar el tema sigue dejando abiertos muchos interrogantes. Prueba de ello son los comentarios publicados hace no mucho por Bjermer12 planteando la necesidad de cambiar aquí la estrategia del tratamiento al estimar, como sucedió con la enfermedad pulmonar obstructiva crónica (EPOC), que hablar de asma es hablar de inflamación (enfermedad) sistémica. Sólo de ese modo cabría explicar las asociaciones detectadas entre asma y rinitis, dermatitis atópica, enfermedad inflamatoria intestinal, trastornos del sueño o enfermedad cardiovascular12. Los estudios HUNT y Young-HUNT, llevados a cabo en Noruega, parecen sustentar dicha alternativa patogénica al identificar hasta qué punto la alergia guarda relación con manifestaciones clínicas de entrada poco ligadas con el fenómeno atópico13,14. Abundando en este planteamiento general, en fecha también reciente Pavord et al15 han propuesto además un nuevo postulado, la llamada “teoría de los impactos inflamatorios múltiples”.
Determinantes del asma refractaria
| Polimorfismos |
| Receptor adrenérgico β2 |
| CRHR1 |
| Interleucina-4 |
| Factores medioambientales |
| Exposición a alérgenos |
| Exposición a agentes ocupacionales |
| Exposición a agentes químicos/contaminantes |
| Comorbilidades y cofactores |
| Tabaquismo |
| Rinosinusopatía |
| Uso de antiinflamatorios no esteroideos, bloqueadores beta, inhibidores de la enzima conversiva de la angiotensina |
| Síndrome de apnea obstructiva del sueño |
| Menstruación, embarazo |
| Incumplimiento terapéutico |
| Enfermedades psiquiátricas |
| Circunstancias psicosociales |
| Alteraciones en la percepción de la disnea |
| Impactos inflamatorios múltiples |
CRHR1: receptor 1 de la hormona liberadora de corticotropina.
La teoría establece que, en el asma (y también en la EPOC), la coexistencia de estímulos inflamatorios adicionales, localizados en el territorio pulmonar o en otros lugares del organismo, agrava y/o entorpece la evolución de la enfermedad respiratoria15. Los efectos de esos estímulos pueden ser sólo aditivos o actuar de manera sinérgica con la propia inflamación asmática. En el primer caso, el resultado final dependerá de las variaciones en la respuesta del huésped frente a tales estímulos, del lugar donde predomine la respuesta inflamatoria inducida por ellos (vías aéreas de pequeño o de gran calibre) y del tipo de células implicadas (neutrófilos o eosinófilos)15. Si esta suposición fuera correcta, la hipótesis sostiene la posibilidad de que la identificación y modulación de esos estímulos inflamatorios añadidos deberían reducir la progresión del proceso asmático, que, en caso contrario, evolucionará a formas resistentes al tratamiento habitual15.
Desde nuestro punto de vista, los planteamientos de Bjermer y Pavord et al son un intento inteligente de abarcar una cuestión difícil (el asma) cuya interpretación, hasta ahora, se ha fundamentado en relaciones deterministas directas (estímulo-inflamación-hiperrespuesta bronquial-obstrucción-síntomas), olvidando la no linealidad de ciertos hechos. ¿Por qué la hiperrespuesta de la vía aérea llega a persistir durante meses tras una única exposición a alérgenos?16 ¿Por qué los pacientes con asma ocupacional expresan síntomas persistentes una vez que ha cesado el contacto con el agente medioambiental?17 ¿Por qué, en ocasiones, hay una relación débil entre la intensidad del estímulo desencadenante y la magnitud de la agudización?18 Estas y otras circunstancias similares han llevado a pensar que durante el curso de tal enfermedad, y quizá también en situaciones normales, el aparato respiratorio, constituido por múltiples componentes e interacciones, adopta un comportamiento estocástico y con propiedades dinámicas similares a las de otros sistemas complejos existentes19–21. De ser eso verdad, y antes de completar la exposición de la teoría de los impactos inflamatorios múltiples, parece necesario recordar de manera sucinta qué son y cómo se comportan los sistemas complejos.
Sistemas complejos y redes libres de escalaUn sistema complejo es, por definición, un conjunto de elementos conectados para formar un todo con peculiaridades sustantivas no existentes en sus elementos aislados, de tal manera que el resultado final de la interrelación origina cualidades nuevas (emergentes) no atribuibles a las partes consideradas separadamente22,23. Cuanto mayor número de elementos integre el conjunto, mayor será su complejidad. Todo sistema se encuentra inmerso en un medio ambiente que puede afectar su modo de funcionar y el rendimiento final. Los sistemas que no intercambian o intercambian poca materia, energía o información con el entorno se conocen con el nombre de sistemas cerrados, mientras que los que presentan alguna o mucha interacción se denominan sistemas parcialmente abiertos o abiertos22,24,25. Asimismo, dentro de la categoría de sistemas abiertos, algunos se ven influidos pasivamente por el medio (sistemas no adaptativos), y otros poseen la capacidad de reaccionar y adaptarse al mismo (sistemas adaptativos)22,24,25. Los sistemas también pueden dividirse en dinámicos y estáticos según modifiquen o no su estado interno a medida que transcurre el tiempo. Un sistema que, a pesar de estar en contacto con un entorno cambiante, mantiene su estado interno se llama homeostático. Los sistemas altamente homeostáticos siguen las transformaciones del contexto a través de autoajustes; si no logran acomodarse modificando su estructura o su función, llegarán a transformarse o a deteriorarse en mayor o menor medida y de forma temporal o permanente22,24,25.
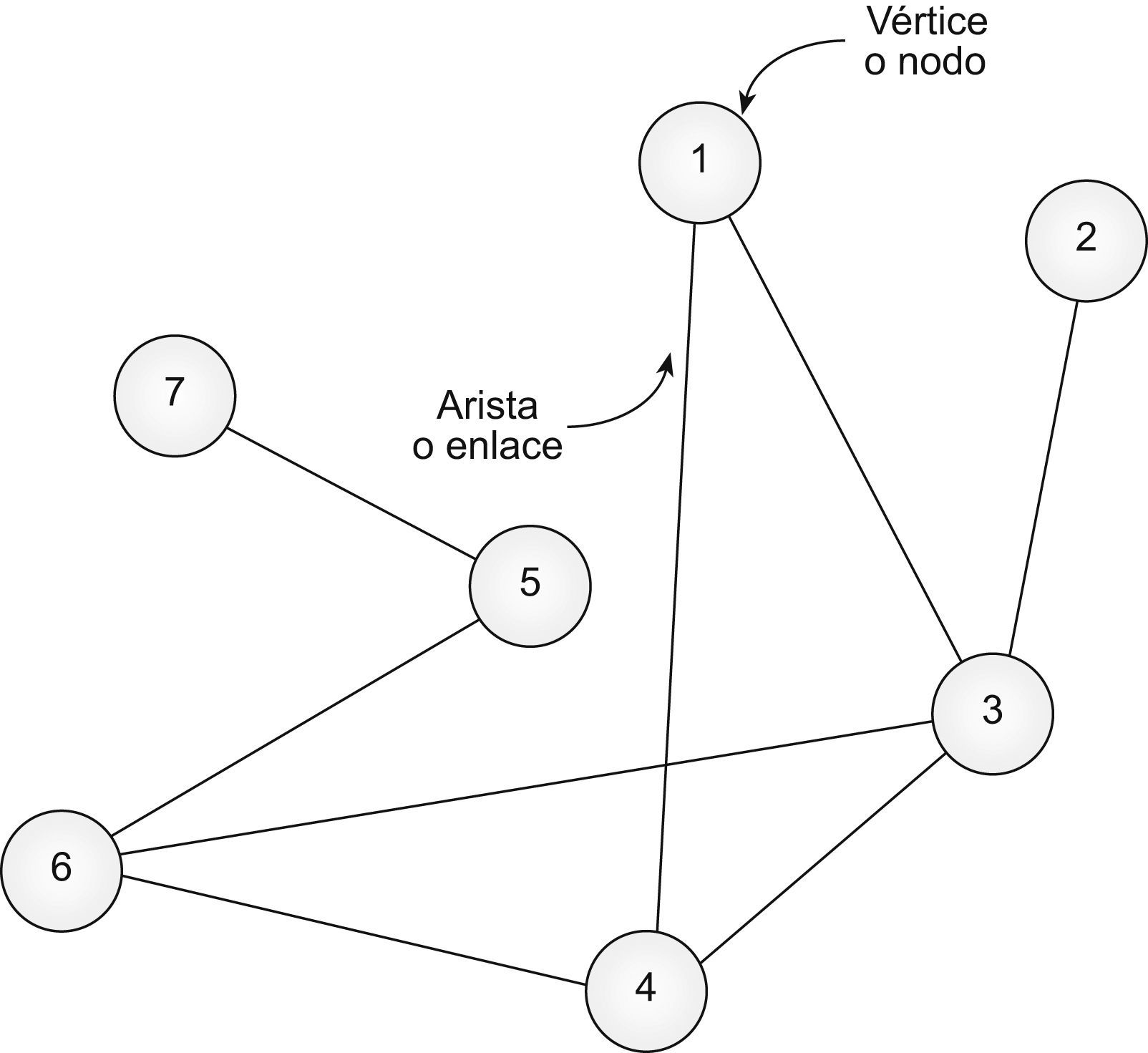
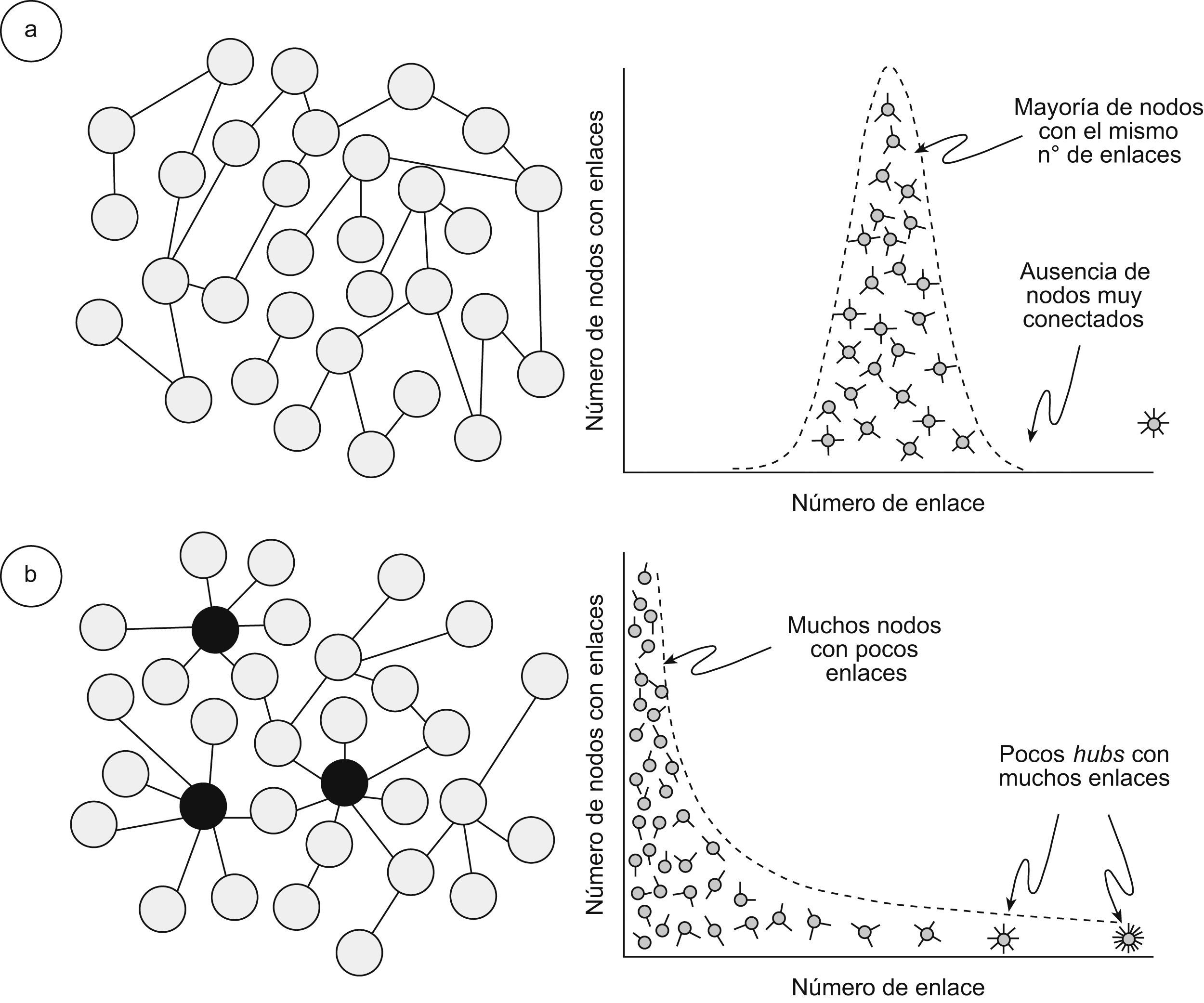
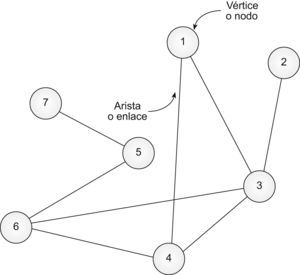
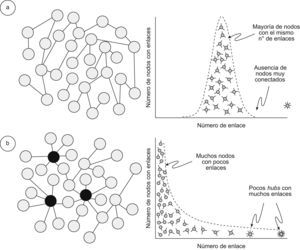
El estudio de los sistemas complejos se ha llevado a cabo tradicionalmente recurriendo a la teoría matemática de grafos, donde cada elemento constituyente de la red recibe el nombre de vértice o nodo, y las conexiones entre ellos se denominan aristas o enlaces22 (fig. 1). Los nodos se representan por los símbolos v1, v2…vN, donde N es el número total de nodos. Cuando un nodo vi está ligado con otro nodo vj, esa conexión se representa por una pareja ordenada (vi, vj). Si para cada pareja (vi, vj) existe la pareja (vj, vi), la red se llama “no dirigida”; en el caso contrario, la red se etiqueta como “dirigida”22. El análisis de las propiedades estructurales o topológicas del sistema nos informa acerca de cómo están conectados los nodos unos con otros. De entre esas propiedades destacan particularmente: a) la distribución de conexiones o vecinos P(k) (probabilidad de que un nodo escogido al azar tenga k conexiones o vecinos); b) el coeficiente de agregación C (probabilidad de que 2 nodos conectados directamente a un tercer nodo estén conectados entre sí); c) la longitud mínima Lij entre 2 nodos vi y vj (número mínimo de “saltos” que se tienen que dar para llegar a un nodo vi de la red a otro nodo vj de la red), y d) la longitud promedio de la red L —promedio de las longitudes mínimas Lij entre todas las posibles parejas de nodos (vi vj) de la red—22,24. La primera de las citadas —la distribución de vecinos P(k)— es quizá una de las que mejor caracterizan la arquitectura de cualquier red22,24. De acuerdo con ella, hay básicamente 2 grandes tipos de redes complejas: las que poseen una topología de Poisson, y las que presentan una topología libre de escala22,24,26. Las primeras, descritas por los matemáticos húngaros Paul Erdös y Alfréd Rényi, se caracterizan porque las conexiones están distribuidas homogéneamente entre sus nodos y, aunque algunos poseen mayor número de conexiones que otros, en promedio todos tienen la misma conectividad22,24,26. Por el contrario, la singularidad de las redes libres de escala es su alta heterogeneidad, con nodos de pocas conexiones, nodos medianamente conectados y nodos muy conectados, denominados hubs, núcleos o centros de la red. Dicho de otro modo: en las redes libres de escala el valor medio de la distribución de conexiones de los vértices no traduce la conectividad real de la red (fig. 2)22,24,26.
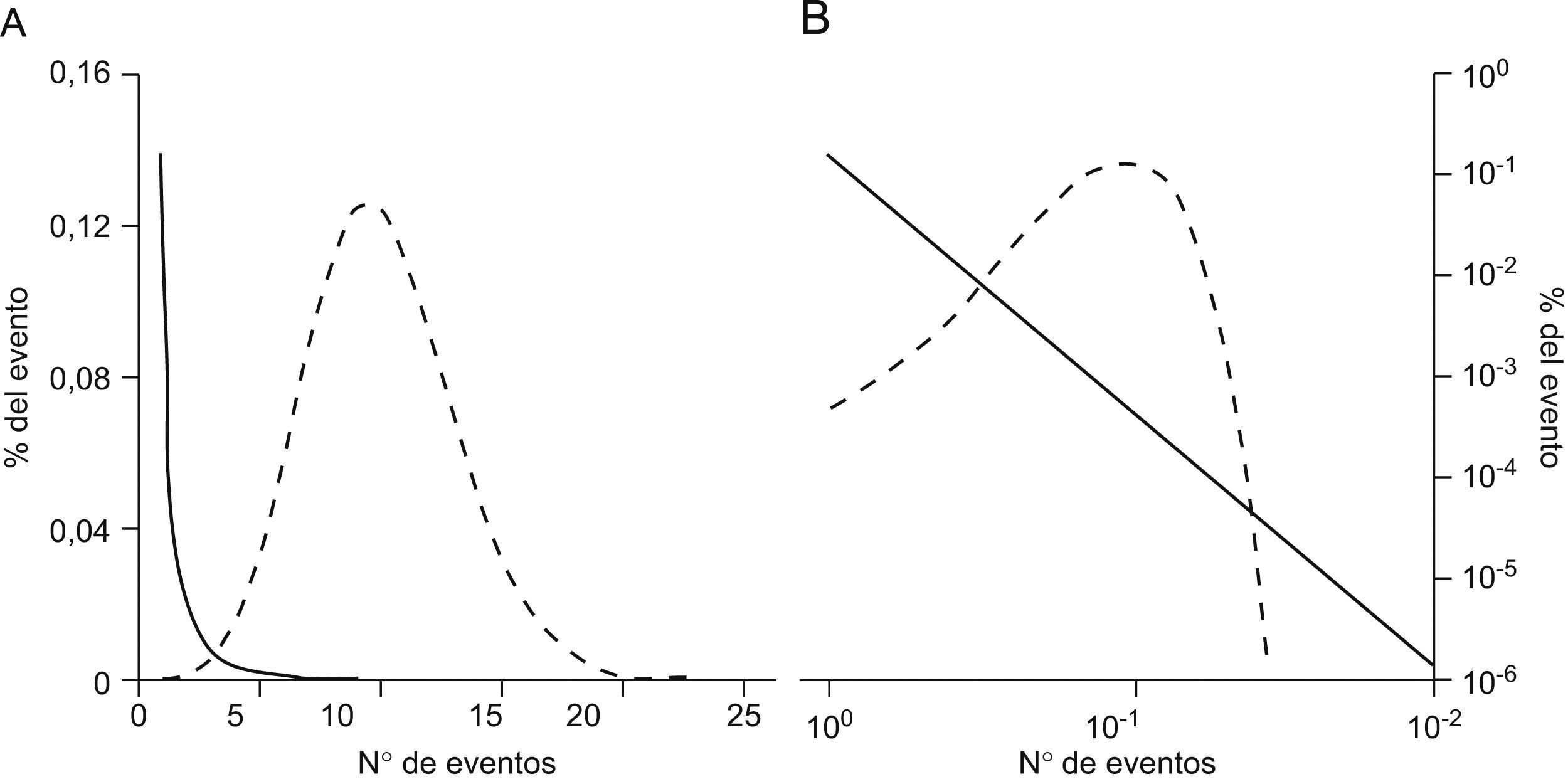
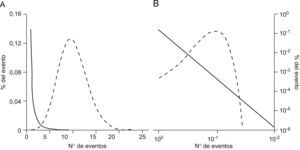
Las redes libres de escala cumplen, además, la ley de potencia22,26. Una relación en forma de ley de potencia entre 2 variables cuantitativas denota que la frecuencia de lo que se mide es una función exponencial negativa constante de la magnitud de lo que se está midiendo. En otras palabras, el número de eventos de una magnitud dada N(s) está en función de s–γ, donde s es la magnitud del evento y γ la constante exponencial. A la relación N(s)=s–γ se la conoce como ley de potencia porque el número de eventos es una potencia de la magnitud del evento. El exponente negativo implica que habrá un número relativamente grande de eventos de pequeña magnitud y un número relativamente pequeño de eventos de gran magnitud. Las distribuciones estadísticas de la ley de potencia no cumplen los patrones de la distribución normal (gaussiana), ya que carecen de un valor “típico” alrededor del cual las medidas individuales quedan centradas. Un modo conveniente de investigar una posible relación de ley de potencia es trazar el logaritmo del número de eventos [log N(s)] frente el logaritmo de la magnitud de eventos (log s) y comprobar si se genera una línea recta. Si eso ocurre, la pendiente de la línea será igual al exponente de ley de potencia γ, es decir: log N(s)=–γ log s (fig. 3)27.
Debido a esa especial estructura que acabamos de describir, una propiedad notable de las redes libre de escala es la robustez de sus conexiones frente a la supresión aleatoria de nodos22,24. En este tipo de redes resulta más factible la eliminación de un nodo poco conectado que la de uno muy conectado, si bien la supresión de un hub puede provocar un cambio en el sistema que cause su fragmentación22,24. Al mismo tiempo, la existencia de esos hubs posibilita que la información de una parte a otra de la red pueda llegar más pronto y fácilmente (con menos “saltos”), siempre que escojamos la vía mejor interconectada. Esa circunstancia (fenómeno small world, o mundo pequeño) indica que la distancia media entre cualquier par de nodos no conectados directamente resulta pequeña22,24.
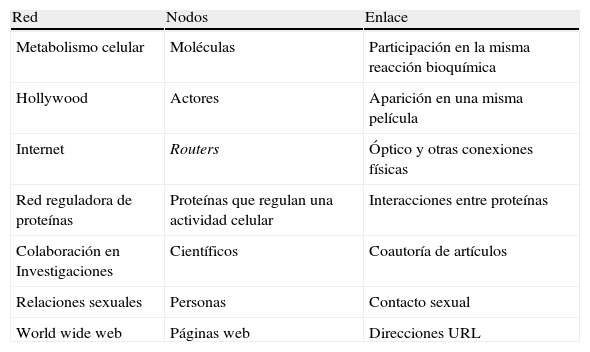
Dejando aparte los aspectos estructurales y de diseño, con toda probabilidad el detalle de mayor relevancia que los expertos en redes han puesto de manifiesto en sus trabajos comparativos es el comprobar que un buen número de los sistemas complejos conocidos adoptan una topología libre de escala. Y aquí se incluyen las redes de regulación genética, las redes de proteínas, las redes metabólicas, las redes neuronales, las redes de comunicación e informáticas (internet, redes telefónicas, etc.), las redes sociales (amistades, contactos sexuales, colaboradores científicos y autores de publicaciones, propagación de enfermedades, etc.), las redes ecológicas (interacciones tróficas en un ecosistema), etc. (tabla 2)22.
Algunos ejemplos de redes libres de escala
| Red | Nodos | Enlace |
| Metabolismo celular | Moléculas | Participación en la misma reacción bioquímica |
| Hollywood | Actores | Aparición en una misma película |
| Internet | Routers | Óptico y otras conexiones físicas |
| Red reguladora de proteínas | Proteínas que regulan una actividad celular | Interacciones entre proteínas |
| Colaboración en Investigaciones | Científicos | Coautoría de artículos |
| Relaciones sexuales | Personas | Contacto sexual |
| World wide web | Páginas web | Direcciones URL |
El hecho de que redes tan diferentes compartan, en los principios básicos, una misma arquitectura formal ha llevado a conjeturar que existe una ley fundamental hoy por hoy desconocida y que el diseño confiere per se ventaja evolutiva28. Lo que sí parece cierto es que la adopción de redes libres de escala por los sistemas biológicos comporta consecuencias beneficiosas (facilitar la diversidad química con coste de energía mínimo, reducir el tiempo de transición entre estados metabólicos, disminuir las consecuencias de errores bioquímicos o genéticos, entre otras)29.
Cabría pensar que lo comentado hasta ahora pertenece únicamente al terreno de la disquisición académica. Nada más lejos de la realidad. Los procedimientos estadísticos multivariados y los modelos computacionales han permitido, aplicando los principios de la ciencia no lineal, describir con detalle mapas concretos de regulación transcripcional30, descubrir que entre las enfermedades humanas hay sorprendentes interconexiones, comenzándose ya a construir lo que se ha dado en llamar diseasome29,31,32, identificar nuevas dianas terapéuticas que influyen en la propensión y letalidad del adenocarcinoma de próstata33, diseñar estrategias para el control de epidemias34 o estudiar la propagación de la obesidad en grupos poblacionales35, por poner sólo algunos ejemplos.
Así pues, el análisis de redes y sistemas complejos reconoce enlaces (links), ayuda a ilustrar la estructura del conjunto o de los subconjuntos y, paralelamente, profundiza en la naturaleza de las relaciones, aclara las reglas que las gobiernan y permite establecer nuevos marcos de trabajo aportando soluciones abarcadoras frente a problemas multideterminados36.
Por lo que hace referencia al asma, la literatura médica es de momento aún escasa y se centra en la descripción de las interacciones entre proteínas y genes candidatos implicados en su patogenia37,38, o en modelo predictivos de la aparición de agudizaciones que toman como punto de partida la premisa de que la vía aérea es un fractal39. En nuestra opinión, la teoría de los impactos inflamatorios múltiples, juzgada en su sentido más amplio, representa una aportación adicional en este campo.
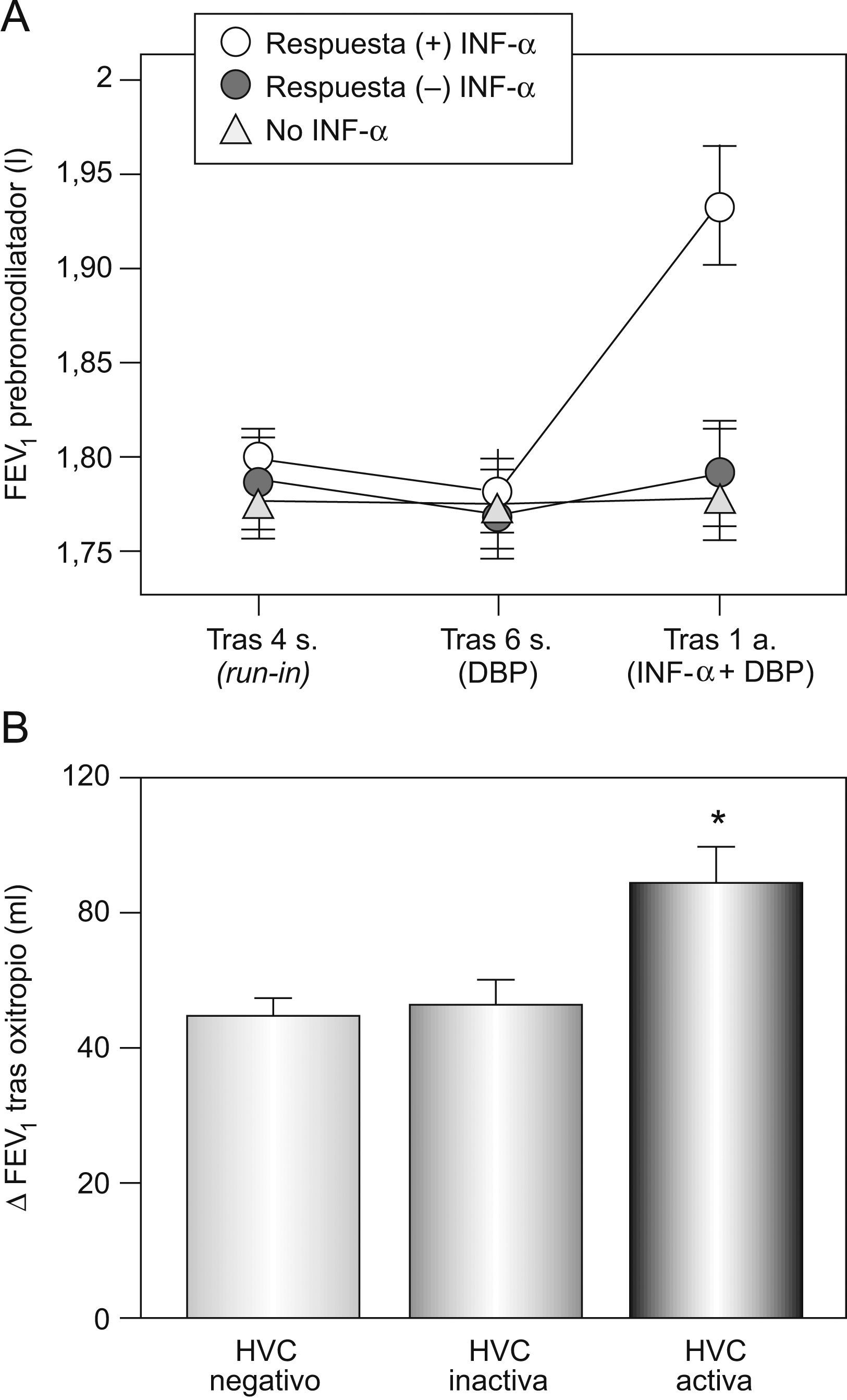
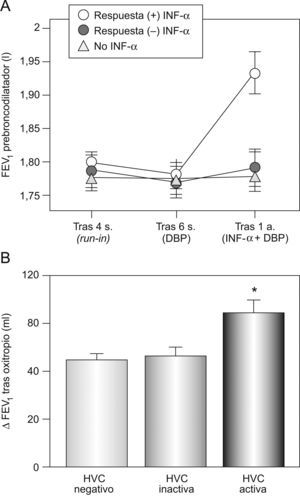
Asma e impactos inflamatorios múltiples: desarrollo y mecanismos patogénicosPara el grupo de Pavord —dejando aparte los ejemplos del tabaquismo40 y el papel que en el asma desempeñan las infecciones crónicas o latentes de las vías respiratorias por virus41,42, Mycoplasma pneumoniae y Chlamydia pneumoniae43—, las asociaciones que vendrían a avalar su propuesta se observan con procesos inflamatorios crónicos que afectan a órganos relacionados embriológicamente con los pulmones, como es el caso de la enfermedad inflamatoria intestinal, la hepatitis crónica por virus C, la tiroidopatía autoinmunitaria y la gastritis inducida por Helicobacter pylori15. No obstante, quizá la situación que mejor refleja la idea de los impactos inflamatorios múltiples es la asociación asma/hepatitis por virus C. El virus de la hepatitis C es un virus ARN, clasificado en la familia Flaviviridae, que posee una gran capacidad para eludir el sistema inmunitario del huésped y que causa infección persistente en la mayoría de los infectados de manera aguda. La persistencia de la infección es responsable de las acciones directas e indirectas del virus sobre el tejido hepático provocando la inflamación crónica que progresará a cirrosis y carcinoma hepatocelular. La infección crónica se asocia con múltiples manifestaciones extrahepáticas, entre las que se encuentran las pulmonares44. Diversos estudios realizados en Japón han venido a constatar que, en los asmáticos portadores de infección por virus C, hay un deterioro acelerado de la función pulmonar y una menor respuesta a los agonistas adrenérgicos β2 y a los corticoides inhalados, pero no a los anticolinérgicos como el oxitropio45–47. Los efectos sobre la función pulmonar también parecen detectarse si el sujeto presenta EPOC48. Sin embargo, cuando los asmáticos infectados por el virus son tratados con interferón y reducen la carga vírica, el comportamiento del simpaticomimético y el esteroide tiende a ser similar al detectado en pacientes no portadores, y el flujo espiratorio máximo durante el primer segundo reduce su caída (fig. 4)45,46. Para los autores de estos estudios, los hechos que acabamos de enumerar guardarían relación con un incremento, inducido por el virus, de las poblaciones de linfocitos T CD8+ presentes en el aparato respiratorio del asmático49, lo que avalaría los hallazgos llevados a cabo por otros grupos50,51.
Infección por el virus de la hepatitis C (VHC) y asma: efectos sobre la respuesta a esteroides y oxitropio. A) Evolución del volumen espiratorio forzado en el primer segundo (FEV1) tras la administración de broncodilatador en 48 asmáticos con infección por el VHC tratados con beclometasona (DPB), de los que 30 recibieron además interferón (IFN); sólo en 11 de ellos el tratamiento con IFN redujo de manera significativa la carga vírica. Al cabo del año, el FEV1 de estos últimos fue claramente mayor. B) Cambios en el FEV1 tras la administración de oxitropio en asmáticos estables no infectados por el VHC y en asmáticos con hepatitis por virus C (HVC) activa o inactiva. (Modificada de Kanazawa et al45,47.)
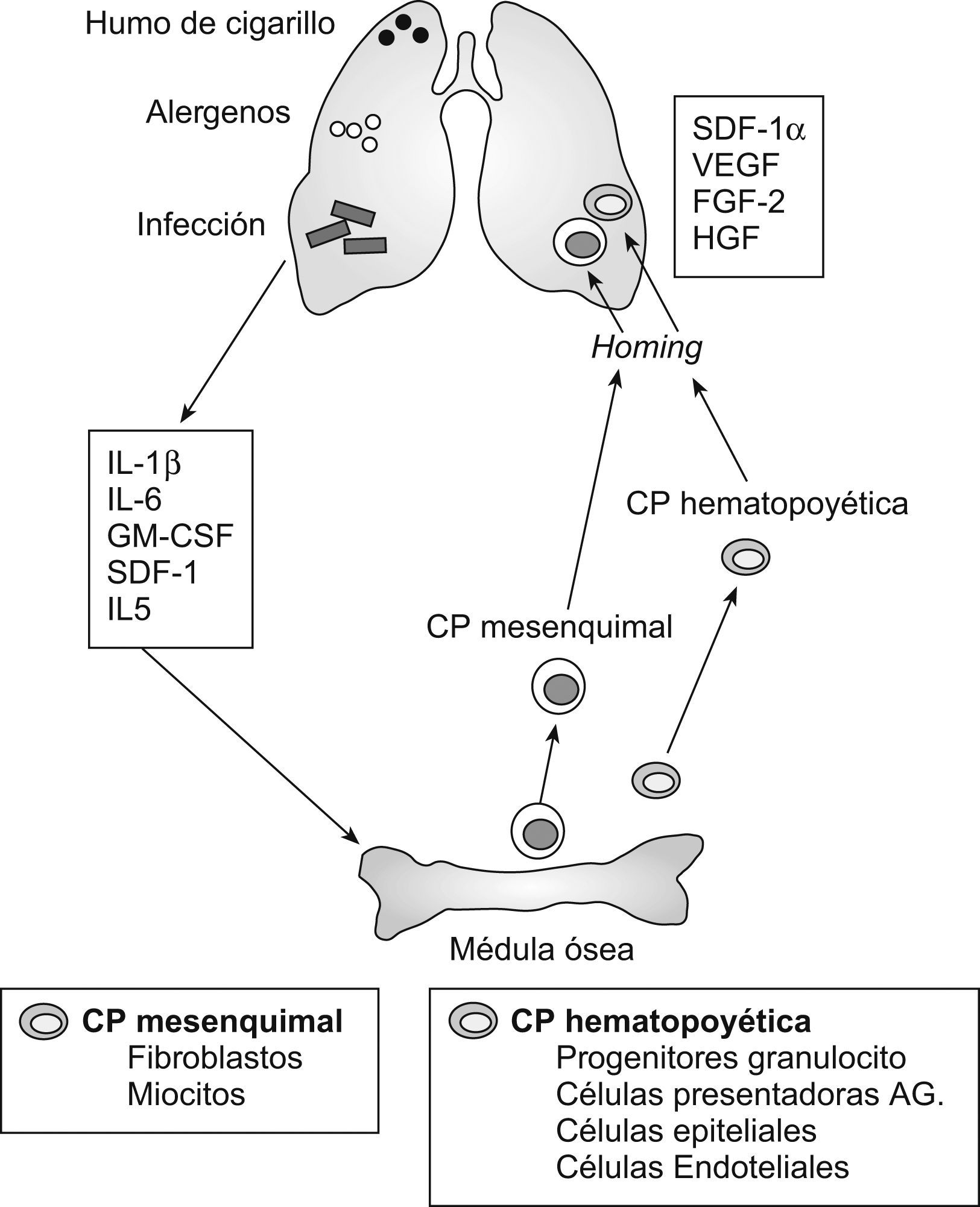
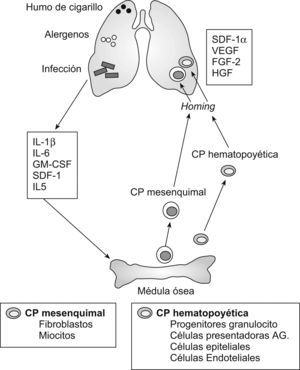
Sea como fuere, en opinión de Pavord et al, su teoría podría explicarse considerando que muchos de los estímulos inflamatorios arriba enumerados se han asociado con la puesta en marcha de la respuesta inmunitaria natural, una regulación al alza de las vías homing y la activación de células inflamatorias (neutrófilos y monocitos/macrófagos). Esto tendría repercusiones en las respuestas inmunitarias agudas y crónicas ya existentes en el territorio pulmonar, dando lugar a su amplificación y extensión15. Téngase en cuenta que el diálogo inmunidad natural-inmunidad adquirida es continuo y bidireccional, de modo que presenta tal número de interacciones que Sabroe et al52 han propuesto la idea de “inmunidad contigua” a fin de subrayar los fenómenos de cooperación existentes entre ambas formas de inmunidad. Asimismo, hay que recordar que en el asma (y en la EPOC, la fibrosis pulmonar y las neumonías) tiene lugar un fenómeno de reclutamiento y diferenciación de células progenitoras hematopoyéticas y mesenquimales, derivadas de la médula ósea, con potencialidad de diferenciarse en diversos tipos celulares (células presentadoras de antígenos, progenitores de granulocitos, células endoteliales, fibroblastos, miocitos, etc.) capaces de “percibir” tejido dañado, migrar a su localización y contribuir a la reparación y remodelación que surgen tras la agresión del pulmón (fig. 5)53. Cabe plantear si el fenómeno opuesto puede ocurrir igualmente ante inflamaciones extrapulmonares, de modo que las células progenitoras inducidas alcancen no sólo el territorio que las ha originado, sino también la vía aérea, que, en el supuesto planteado, está ya experimentando su propia inflamación (aquí de naturaleza “asmática”).
Diagrama que resume cómo la inflamación pulmonar inducida por estímulos de muy diversa naturaleza genera mediadores que provocan en la médula ósea la producción de células progenitoras (CP) hematopoyéticas y mesenquimales implicadas en la regulación de la respuesta inflamatoria. FGF: factor de crecimiento de los fibroblastos; GM-CSF: factor estimulante de las colonias de granulocitos y macrófagos; HGF: factor de crecimiento de los hepatocitos; IL: interleucina; SDF: factor derivado de la estroma; VEGF: factor de crecimiento del endotelio vascular. (Modificada de Denburg y Van Eeden53.)
Más allá de su indudable interés práctico (llamar la atención al clínico sobre la necesidad de descartar determinadas comorbilidades en el asma), la mayor virtud de la hipótesis de los impactos inflamatorios consiste en poner en valor no ya que el pulmón no es un órgano aislado o que el organismo es un constructo conformado a partir de conjuntos interconectados, sino que además el asma, como entidad compleja, incluye en su patogenia elementos de naturaleza diversa y, aparentemente, poco relacionados con la propia enfermedad pulmonar. La afirmación puede parecer de entrada una obviedad, y así lo sería salvo que profundicemos en el concepto de sistemas complejos cuyas estructuras adoptan topologías de red libre de escala. Dar ese salto cualitativo supone plantearse dónde se encuentran realmente los hubs de esta red llamada asma, asumiendo: a) que un componente que actúa como hub en un proceso puede desempeñar un papel distinto en otro, y b) que la importancia de los hubs puede variar a lo largo de la enfermedad y de situaciones agudas a crónicas. Esta estrategia, todavía en sus principios, ha comenzado a ser explorada en la EPOC por el grupo de Sabroe con la esperanza de que, de ese modo, se facilite la búsqueda y el aislamiento de dianas terapéuticas definitivas4,54.
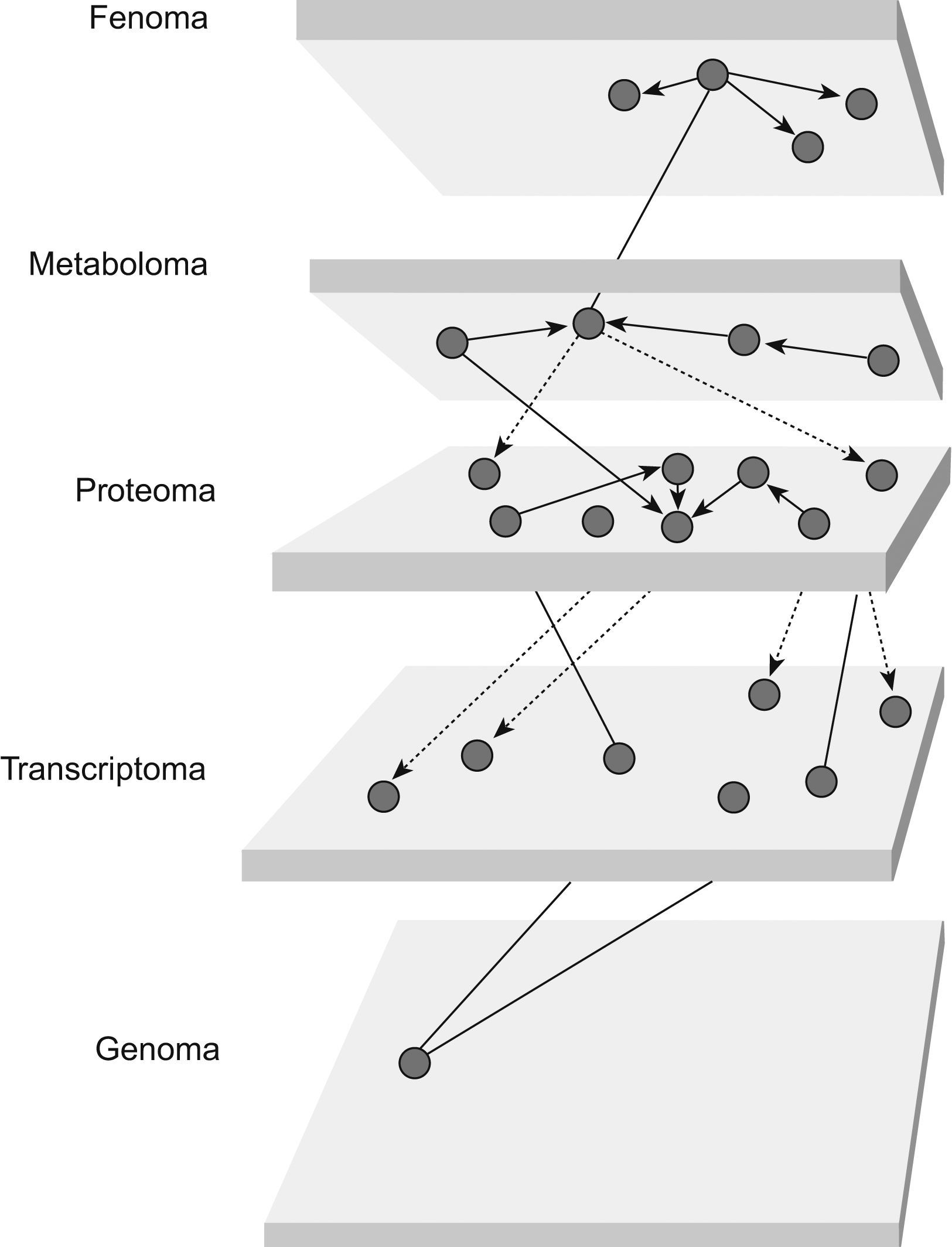
Con toda seguridad, en los próximos años asistiremos a enormes cambios en la metodología de estudio de las enfermedades. Combinar la enorme información aportada por la genómica, la proteómica, la metabolómica, etc., será el gran reto, y la ciencia de sistemas complejos, la biología de sistemas55, el cuerpo de doctrina que lo hará posible (fig. 6)56. Parafraseando a Solé57, lo complejo tiene mucho más que ver con la naturaleza de las interacciones que con la naturaleza de los objetos que interaccionan, aunque estos últimos imponen algunas limitaciones sobre lo que puede ocurrir en el siguiente nivel. Comprender la complejidad requiere sustituir el enfoque analítico por una forma de mirar la realidad en la que añadimos un elemento esencial: el mapa de conexiones entre elementos. Necesitamos este mapa para dar contenido a la interpretación integral de los hechos que nos rodean.
Integración e interrelaciones entre datos relativos a la expresión génica (genoma, transcriptoma, proteoma), metaboloma (conjunto de determinados metabolitos) y fenoma (conjunto de parámetros fisiológicos o patológicos de interés). La biología de sistemas busca identificar la intersección y las relaciones de todos estos datos ubicados en diversos planos para aportar una visión integradora del problema objeto de estudio. (Modificada de Lusis56.)
El contenido del presente artículo está basado en la conferencia “Impactos inflamatorios múltiples en asma. Redes libres de escala”, pronunciada por el autor durante el XXXIV Simposio de Neumología, celebrado en Burgos (octubre de 2008).