El síndrome de Kartagener (SK) se caracteriza por bronquiectasias, sinusitis paranasal y situs inversus total (SIT). La asociación de la bronquiolitis difusa (BD) con el SK se ha documentado únicamente en Japón. En una unidad se identificaron 14 pacientes con SIT durante un periodo de 7 años. Todos los pacientes fueron objeto de un estudio diagnóstico similar que incluyó una tomografía computarizada (TC) de alta resolución (TCAR) del tórax y TC de senos paranasales. Se realizó un análisis de semen en 2/3 de los varones adultos. Once pacientes (6 varones y 5 mujeres) tenían un SK, mientras que en 3 mujeres adultas había tan solo un SIT. La TCAR de tórax detectó bronquiectasias en 10/11 pacientes con SK. La TCAR de tórax confirmó la BD en 6/11 pacientes con SK. Un varón adulto presentó un recuento espermático total de 2,5millones/ml, sin motilidad espermática, mientras que en los otros no hubo espermatozoides.
Esta serie documenta el mayor número de pacientes con SIT/SK descrito en la India y resalta por primera vez la asociación de BD con SK en este país.
Kartagener's syndrome (KS) is characterised by bronchiectasis, paranasal sinusitis and situs inversus totalis (SIT). Association of diffuse bronchiolitis (DB) with KS has been documented from Japan only. Fourteen patients with SIT were seen in one unit over 7 years. All patients underwent a similar work up which included high resolution computed-tomography (HRCT) of thorax and CT-paranasal sinuses. Semen analysis was done in 2/3 adult males. Eleven patients (6 males and 5 females) had KS while 3 adult females had SIT alone. HRCT-thorax detected bronchiectasis in 10/11 patients with KS. HRCT-thorax confirmed DB in 6/11 patients with KS. One adult male had total sperm count of 2.5million/ml without sperm motility while the other had no sperms.
This series documents the largest number of patients with SIT/KS from India and highlights for the first time, the association of DB with KS from India
El situs inversus total (SIT) consiste en una inversión especular de todas las estructuras asimétricas del cuerpo y se estima que se produce en 1/8.000-1/25.000 nacidos vivos1. La mayor parte de los pacientes con SIT llevan una vida completamente normal, pero en aproximadamente el 20-25% de los pacientes puede observarse también una discinesia ciliar primaria (DCP) asociada1. La DCP, a la que anteriormente se denominaba «síndrome de inmovilidad ciliar», es una enfermedad genética causada por defectos de la estructura y la función de los cilios que conducen a una limpieza mucociliar anormal y que se manifiesta como una enfermedad clínica de la región sinusal-pulmonar. El síndrome de Kartagener2 (SK), que actualmente se clasifica como un subgrupo de la DCP, se caracteriza por la tríada de bronquiectasias, sinusitis paranasal y SIT.
Presentamos una revisión de 14 pacientes con SIT, 11 de los cuales tenían un SK. En 6 de estos pacientes había signos de bronquiolitis difusa (BD) en la TC de tórax. Esta manifestación asociada al SK se describió por primera vez en Japón3, y aún no ha sido ampliamente reconocida. Se observó la presencia de una oligo/azoospermia en dos de nuestros pacientes con SK. Que nosotros sepamos, esta es la serie más amplia de casos de SIT de la India.
Descripción de los casosA lo largo de un periodo de 7 años, entre abril de 2003 y marzo de 2010, aproximadamente 11.361 nuevos pacientes (1.944 de ellos del grupo de edad pediátrico) con síntomas respiratorios fueron remitidos a una unidad del Instituto. A 14 de ellos (6 varones y 8 mujeres; 6 adultos y 8 pacientes pediátricos) se les diagnosticó un SIT. De estos 14 pacientes, 11 presentaban un SIT con SK, mientras que en 3 había solamente un SIT (todos ellos mujeres adultas). El diagnóstico de SK se basó en la demostración de la tríada clásica del síndrome, consistente en bronquiectasias, sinusitis paranasal y SIT. En todos los pacientes se realizó un estudio diagnóstico similar, que incluyó cultivo de esputo para microorganismos aerobios, incluido Mycobacterium tuberculosis, electrocardiograma, espirometría completa, ecografía abdominal, tomografía computarizada (TC) con contraste, así como TC de alta resolución (TCAR) del tórax y TC de senos paranasales (SPN). Se valoró en la TC, con métodos ya descritos, la gravedad de las bronquiectasias4 y la sinusitis5. Se realizó un análisis de semen en 2/3 de los varones adultos que dieron su consentimiento.
Las características clínicas de estos 14 pacientes se indican, por orden de presentación, en la tabla 1.
Características demográficas y perfil clínico
| Paciente número | Edad, (años)/Sexo | Casados/Infertilidad/Análisis de semen (recuento total [millones/ml] y motilidad [%]) | Síntomas respiratoriosa | Síntomas nasalesb | Cantidad de esputo (ml/día) | Cultivo de esputo para microorganismos aerobios |
| 1 | 6/M | N | 1,2 | 1,2 | Ninguno | Falta de esputo |
| 2 | 17/F | N | 1,2,3,4 | 1,2 | 20 | Haemophilus influenzae |
| 3 | 16/F | N | 1,2,6 | 1,2,5,6 | 100 | Streptococcus pneumoniae |
| 4 | 22/M | N/2,5y0 | 1,2 | 1,5,6 | 100 | NOP |
| 5 | 28/M | S/S/0y0 | 1,2,6 | 1,2 | 100 | NOP |
| 6 | 16/M | N | 1,2 | 1,2 | 100 | NOP |
| 7 | 10/M | N | 1,2 | 1,2,6 | 10 | Pseudomonas aeruginosa |
| 8 | 50/M | S/S/No realizado | 1,2,3,6 | 1,5,6 | 100 | Pseudomonas aeruginosa |
| 9 | 54/F | S/N | 1,2,3,4 | 1,2,4 | 10 | NOP |
| 10 | 13/F | N | 1,2 | 1,2,6 | 10 | NOP |
| 11 | 77/F | S/N | 1,2 | N | 5 | Falta de esputo |
| 12 | 15/F | N | 1,2,3 | 1,2 | 100 | NOP |
| 13 | 17/F | N | 1,2 | 1,2 | 100 | NOP |
| 14 | 35/F | S/N | 1,2,3,4 | N | 5 | NOP |
M: varones; F: mujeres, N: no; S: sí, NOP: ningún organismo patológico
La TCAR de tórax permitió detectar bronquiectasias en 10/11 pacientes con SK. Se observaron en un mínimo de 2 lóbulos y en un máximo de 5, pero en la mayoría de los pacientes había 4 lóbulos afectados. El lóbulo inferior izquierdo fue el más afectado, con signos en 8/11 pacientes. Le seguían en frecuencia los lóbulos inferior derecho, medio y de la língula (7/11 pacientes cada uno). Se observaron bronquiectasias de lóbulos superiores en 3/11 pacientes. La puntuación global de gravedad de las bronquiectasias4 osciló entre 0 y 13 en una puntuación total máxima de 18, con una media de 5,81±2,75 (tablas 1 y 2). En 6 pacientes con SK se observaron nódulos centrolobulillares difusos pequeños (2mm de diámetro) con un aspecto de «árbol en brote» predominantemente en los lóbulos medio, de la língula e inferior, que sugerían una bronquiolitis difusa. En 3/6 se observó también un atrapamiento de aire, líneas en raíles de tranvía y bronquiolectasias. En 4/6 había espacios quísticos de paredes gruesas (bronquios) agrupados, principalmente en los lóbulos medio y de la língula, que sugerían atelectasias o consolidación (tabla 2). En los 3 pacientes sin SK, la TCAR de tórax mostró un parénquima pulmonar normal y la TC de SPN estuvo también dentro de los límites de la normalidad. En la tabla 2 se detallan las manifestaciones radiológicas de los pacientes con SK.
Exploraciones radiológicas
| Características estructurales TCAR: tórax | Pacientes con SK (n=11) |
| Bronquiectasias(cualquier lóbulo) | 10 |
| Puntuación de gravedad global de las bronquiectasias18 | 5,81±2,75 |
| Lóbulo afectado | |
| Lóbulo superior izquierdo | 3 (pacientes 1, 3, 4) |
| Lóbulo medio izquierdo | 7 (pacientes 2, 5, 6, 8, 10, 12, 13) |
| Lóbulo inferior izquierdo | 8 (pacientes 2, 4, 5, 6, 8, 10, 12, 13) |
| Lóbulo superior derecho | 3 (pacientes 4, 5, 8) |
| Lóbulo de la língula derecho | 7 (pacientes 3, 5, 6, 8, 10, 12, 13) |
| Lóbulo inferior derecho | 7 (pacientes 1, 4, 5, 6, 8, 12, 13) |
| Número de lóbulos afectados | |
| Ninguno | 1 (paciente 7) |
| Uno | 0 |
| Dos | 3 (pacientes 1, 2, 3) |
| Tres | 1 (paciente 10) |
| Cuatro | 4 (pacientes 4, 6, 12, 13) |
| Cinco | 1 (paciente 5, 8) |
| Seis | 0 |
| TCAR de tórax: otros signos | |
| Nódulos centrolobulillares pequeñoscon aspecto de árbol en brote | 6 (pacientes 2, 5, 6, 7, 8, 10) |
| Hiperinsuflación (atrapamiento de aire) | 3 (pacientes 5, 8, 10) |
| Consolidación/Colapso del lóbulo medio y/o de la língula | 4 (pacientes 2, 6, 7, 10) |
| Pecho en quilla | 1 (paciente 6) |
| Características estructurales TC de SPN | Pacientes con SK (n=7/11) |
| Sinusitis (cualquiera) | 7 |
| Puntuación de gravedad global19 | 15,37±1,99 |
| Hipoplasia/agenesia del seno frontal | 6 (pacientes 1, 6, 7, 8, 12, 13) |
TC: tomografía computarizada; TCAR: tomografía computarizada de alta resolución; SPN: senos paranasales.
Dos de los 3 adultos varones aceptaron que se realizara un análisis de semen. Los dos pacientes estaban casados pero no tenían hijos. En un paciente se determinó un recuento espermático total de 2,5millones/ml con movilidad espermática nula, y en el otro no se observaron espermatozoides (tabla 1). En este último caso, el nivel de fructosa en el semen fue superior a 100mg/dl.
DiscusiónDesde el mismo momento en que fuera descrito por primera vez en 4 pacientes por Manes Kartagener2, el síndrome que lleva su nombre ha venido fascinando a los clínicos durante la mayor parte del pasado siglo. Los investigadores han descubierto muchas anomalías asociadas, como la panbronquiolitis difusa (PBD) en el SK, que se describió por primera vez en Japón hace casi dos décadas3. Desde entonces solo ha habido otras 2 descripciones de esta anomalía6,7, ambas originadas también en Japón. Esta asociación no se ha descrito en ninguna otra parte del mundo.
La PBD es una forma muy infrecuente de bronquiolitis, caracterizada por una inflamación sinusal-bronquial. Se ha observado predominantemente en Japón, en donde fue descrita por primera vez en 19698. Posteriormente se han publicado casos esporádicos documentados en otros países asiáticos y también de otros continentes9. En la TCAR, la PBD se caracteriza en los estadios tempranos por numerosos nódulos pequeños (<5mm) y mal definidos, de distribución centrolobulillar. En el estadio 2, algunos nódulos se extienden formando pequeñas áreas lineales ramificadas de atenuación (aspecto en «árbol en brote». En las fases más avanzadas hay una dilatación quística de los nódulos que corresponde a la bronquiolectasia. Las zonas periféricas son menos densas, y la presencia de una película espiratoria sugeriría un atrapamiento de aire10. El hecho de que las exploraciones de imagen desempeñan un papel clave en el diagnóstico de la PBD fue resaltado de modo vehemente por Hansell11 en la siguiente afirmación: «Los signos de panbronquiolitis difusa en la TCAR, en un contexto clínico apropiado, son prácticamente patognomónicos».
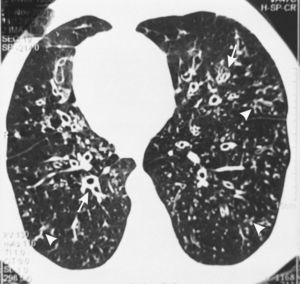
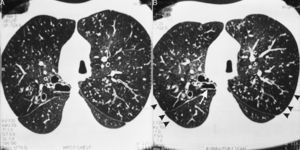
En 6 de nuestros pacientes con SK, la TCAR mostró nódulos pequeños centrolobulillares difusos con aspecto de «árbol en brote», bronquiolectasias/bronquiectasias con líneas en raíles de tranvía indicativas de un engrosamiento difuso de la pared bronquial, que eran «prácticamente patognomónicas»11 de la PBD (fig. 1). Se observaron áreas de reducción de la atenuación, que se acentuaban en las imágenes obtenidas en espiración, en la periferia pulmonar, indicativas de un atrapamiento de aire (fig. 2A-B). Estos signos, que sugieren una PBD en el SK/DCP, fueron descritos inicialmente en dos pacientes por Amitani et al.3 en 1990 y posteriormente en 6 de 8 pacientes con SK por Homma et al.6 en 1999, y en un paciente con SK y una enfermedad maligna7 al que se había diagnosticado una PBD 11 años antes de la presentación.
En la tomografía computarizada de alta resolución (TCAR) del paciente número 8 se observa dextrocardia, nódulos centrolobulillares difusos con aspecto de «árbol en brote» (puntas de flecha) en la periferia pulmonar con bronquiolectasias/bronquiectasias y engrosamiento difuso de la pared bronquial (flecha).
En la tomografía computarizada de alta resolución (TCAR) inspiratoria (A) y espiratoria (B) del mismo paciente de la figura 1 se aprecia una disminución de la atenuación del parénquima pulmonar en la periferia (puntas de flecha), que se acentúa en la imagen espiratoria (B) y sugiere un atrapamiento de aire. Se observa asimismo el cayado aórtico en el lado derecho y bronquiectasias quísticas en el segmento posterior del lóbulo superior derecho, que presenta una reducción de su dimensión en la imagen obtenida en espiración (flecha). Se observan también nódulos centrolobulillares difusos con aspecto de «árbol en brote» y bronquios ectásicos difusos con paredes engrosadas.
Homma et al.6 resaltaron las notables semejanzas existentes entre el SK y la PBD en cuanto a las manifestaciones clínicas, radiológicas y espirométricas. Histológicamente, las lesiones inflamatorias presentes en el SK se encontraban en los bronquiolos membranosos, mientras que en la PBD estaban en los bronquiolos respiratorios. Los autores propusieron que la asociación de la BD podía ser una «manifestación característica» Homma et al.6. Aunque la causa de la PBD continúa siendo desconocida, se ha propuesto, que en la DCP, los movimientos discinéticos de los cilios podrían causar la aparición de la PBD3,12.
La mayor parte de los pacientes con SK tienen un pronóstico favorable y llevan una vida bastante normal13. Se ha propuesto que la disfunción ciliar conduce a un deterioro de la limpieza ciliar y a la formación de tapones de moco inicialmente en las vías aéreas pequeñas y luego en las grandes, con lo que se crea una propensión a las infecciones recurrentes que causan la bronquiolitis. Esto da lugar a un atrapamiento de aire, aumento de la resistencia de las vías aéreas, reducción de la elasticidad, hipoxemia, hipertensión pulmonar y cor pulmonale. Se documentó una obstrucción notable de las vías aéreas en 5/6 pacientes descritos por Homma et al.6 y en 4/6 en nuestros pacientes. En ambas series, la mitad de los 6 pacientes con BD presentaron un atrapamiento de aire en la TC de tórax. La aparición de una BD en el SK podría aumentar la morbilidad y afectar a la calidad de vida.
Los pacientes varones con SK son invariablemente infértiles, mientras que las mujeres presentan una reducción de la fertilidad14. La mayor parte de pacientes infértiles con SK tienen un recuento de espermatozoides normal, pero con un defecto estructural y una falta completa de motilidad14. La oligospermia y la azoospermia se observan con muy poca frecuencia en el SK. Sin embargo, en nuestro estudio el análisis del semen de los 2 pacientes adultos mostró una reducción del recuento espermático y de la motilidad (oligoastenozoospermia) en un caso y una azoospermia en el otro. Este último paciente presentaba una fructosa normal, lo cual sugiere la presencia de un conducto deferente permeable. La presencia de azoospermia en el SK ha sido descrita ya con anterioridad15-17. Parece que la oligospermia o la azoospermia, cuya fisiopatología continúa pendiente de definir, puede ser una variante asociada a este síndrome. Además, se han publicado algunas descripciones de casos de azoospermia obstructiva asociada al SIT, a los que a menudo se etiqueta como una variante muy poco común del síndrome de Young18,19.
No pudimos determinar anomalías del brazo de dineína en nuestros pacientes, ni efectuamos pruebas de NO nasal inhalado. Que nosotros sepamos, este es el estudio que documenta un mayor número de casos de SIT/SK de la India y resalta por primera vez la asociación de la BD con el SK en este país.
Conflicto de interesesLos autores no tienen conflictos de intereses que declarar.