Diversos datos epidemiológicos muestran que el síndrome de apneas-hipopneas del sueño (SAHS) se relaciona independientemente con el desarrollo de resistencia a la insulina e intolerancia a la glucosa. Además, y pese a la existencia de notables limitaciones metodológicas, algunos estudios refieren una elevada prevalencia de SAHS en pacientes con diabetes tipo 2 (DM2). Un reciente metaanálisis muestra que el SAHS moderado-grave se asocia a un mayor riesgo de DM2 (riesgo relativo=1,63 [1,09-2,45]), en relación con la ausencia de apneas-hipopneas.
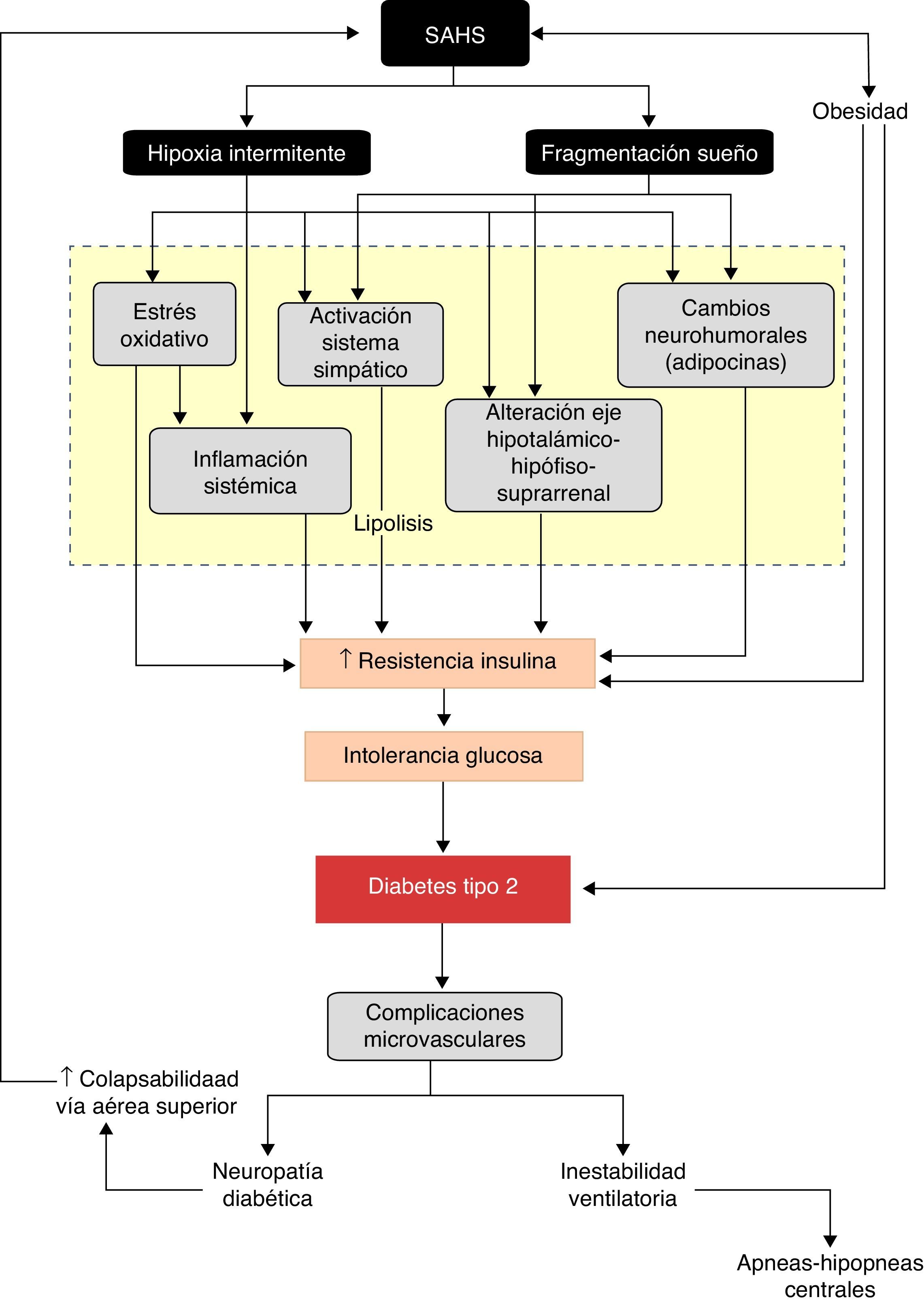
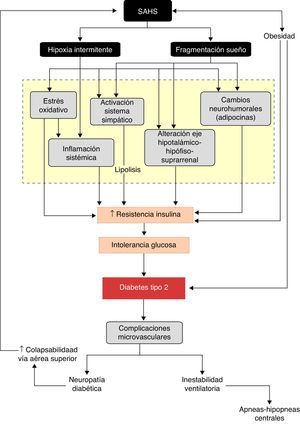
La existencia de alteraciones comunes de diversas vías patogénicas le proporciona plausibilidad biológica a esta relación. La hipoxia intermitente y la fragmentación del sueño, originadas por la sucesión de episodios de apneas-hipopneas, inducen diversos trastornos intermedios, como la activación del sistema nervioso simpático, el estrés oxidativo, la inflamación sistémica, alteraciones en las hormonas reguladoras del apetito y activación del eje hipotálamo-hipófiso-suprarrenal, que favorecen el desarrollo de resistencia a la insulina, así como su progresión a intolerancia a la glucosa y, en última instancia, a DM2.
La coexistencia del SAHS parece agravar la evolución de la DM2, al empeorar el control glucémico y potenciar el efecto de la aterosclerosis en el desarrollo de complicaciones macrovasculares. Además, el SAHS podría asociarse al desarrollo de complicaciones microvasculares, particularmente la retinopatía, nefropatía o neuropatía diabéticas. Aunque todavía escasos, algunos datos sugieren que la DM2 también podría empeorar la evolución del SAHS, al favorecer la colapsabilidad de la vía aérea superior y potenciar la aparición de apneas-hipopneas centrales.
Epidemiological data suggest that sleep apnea-hypopnea syndrome (SAHS) is independently associated with the development of insulin resistance and glucose intolerance. Moreover, despite significant methodological limitations, some studies report a high prevalence of SAHS in patients with type 2 diabetes mellitus (DM2). A recent meta-analysis shows that moderate-severe SAHS is associated with an increased risk of DM2 (relative risk=1.63 [1.09 to 2.45]), compared to the absence of apneas and hypopneas.
Common alterations in various pathogenic pathways add biological plausibility to this relationship. Intermittent hypoxia and sleep fragmentation, caused by successive apnea-hypopnea episodes, induce several intermediate disorders, such as activation of the sympathetic nervous system, oxidative stress, systemic inflammation, alterations in appetite-regulating hormones and activation of the hypothalamic-pituitary-adrenal axis which, in turn, favor the development of insulin resistance, its progression to glucose intolerance and, ultimately, to DM2.
Concomitant SAHS seems to increase DM2 severity, since it worsens glycemic control and enhances the effects of atherosclerosis on the development of macrovascular complications. Furthermore, SAHS may be associated with the development of microvascular complications: retinopathy, nephropathy or diabetic neuropathy in particular. Data are still scant, but it seems that DM2 may also worsen SAHS progression, by increasing the collapsibility of the upper airway and the development of central apneas and hypopneas.
El síndrome de apneas-hipopneas del sueño (SAHS) es un problema de salud pública de primera magnitud1, por su elevada prevalencia2,3 y notable morbimortalidad4–6, destacando particularmente la accidentabilidad7,8, las complicaciones cardiovasculares9–25 y, más recientemente, las enfermedades neoplásicas26. Un aspecto de creciente interés es su relación con alteraciones metabólicas, en concreto con la diabetes tipo 2 (DM2).
La diabetes mellitus constituye una epidemia global27. Actualmente, en el mundo existen 382 millones de diabéticos, y se estima que en 2035 el número de enfermos alcanzará los 592 millones28. La DM2, que supone el 90-95% de todos los casos de diabetes29, es un complejo trastorno metabólico, en el que la interacción de factores genéticos y ambientales produce un déficit tanto en la secreción de insulina como en la sensibilidad a la misma.
En sujetos sanos, la homeostasis de la glucosa se alcanza controlando su producción por el hígado (neoglucogénesis) y su uso por tejidos insulinodependientes, como el músculo o la grasa, y por tejidos no insulinodependientes, como el cerebro30. La disponibilidad de glucosa por los tejidos periféricos se regula mediante la insulina, que es producida por las células β de los islotes pancreáticos, tanto constitucionalmente como en respuesta a un incremento de la glucemia. Además, la insulina suprime la neoglucogénesis hepática y la lipólisis del tejido adiposo. La respuesta biológica de los tejidos diana a la insulina (sensibilidad a la insulina) tiene diversos determinantes fisiológicos, entre los que destaca la cantidad de tejido graso. Una disminución de la respuesta periférica a la insulina (resistencia a la insulina) disminuye la disponibilidad tisular de glucosa y favorece la intolerancia a la misma31. Cuando las células β son incapaces de secretar suficiente insulina para superar la resistencia insulínica, surge la DM232.
La presencia de factores de riesgo comunes, así como la implicación de algunas vías patogénicas compartidas, justifican una potencial relación entre ambas entidades. Por tanto, los objetivos de esta revisión son analizar los datos clínico-epidemiológicos que avalan la existencia de una posible relación entre el SAHS y la DM2, evaluar los mecanismos patogénicos potencialmente implicados y valorar el impacto pronóstico de dicha relación.
Evidencia clínica y epidemiológicaLa información disponible sugiere que el SAHS puede alterar el metabolismo de la glucosa, progresando desde un aumento de la resistencia insulínica a intolerancia a la glucosa, peor control metabólico de la glucemia y, finalmente, DM2.
Aunque algún estudio preliminar es más controvertido33, parece que el SAHS induce un incremento de la resistencia a la insulina independiente de la obesidad. Ip et al.34 analizaron la relación entre el SAHS y la resistencia a la insulina, evaluada por el índice «homeostatic model assessment» (HOMA), en 270 sujetos no diabéticos. Comprobaron que los pacientes con SAHS tenían un índice HOMA superior, es decir, presentaban más resistencia insulínica, que los enfermos sin SAHS. Además, tanto la obesidad como el índice de apneas-hipopneas (IAH) y la saturación de oxihemoglobina (SaO2) mínima fueron determinantes independientes de la resistencia a la insulina.
El efecto del SAHS sobre la resistencia a la insulina parece no ser solo independiente de la obesidad, sino también de la distribución de la grasa corporal y del sexo. En 194 pacientes no diabéticos con SAHS, el índice HOMA fue mayor en los enfermos con SAHS grave y se relacionó de forma independiente con el índice de masa corporal (IMC), el IAH y la concentración plasmática de adiponectina35. A su vez, en una muestra poblacional de 400 mujeres de 20-70 años, Theorell-Haglöw et al.36 comprobaron que la sensibilidad a la insulina fue menor en pacientes con SAHS grave, relacionándose con la SaO2 mínima, una vez controlada la edad, relación cintura-cadera, actividad física, tabaquismo y consumo de alcohol36.
La influencia del SAHS en el desarrollo de resistencia a la insulina también viene confirmada por algún estudio longitudinal, como el realizado por Lindberg et al.37, en el que analizaron su influencia sobre el metabolismo hidrocarbonado en una muestra poblacional de hombres adultos sin diabetes, comprobando que el índice de desaturación, el IAH y la SaO2 mínima se relacionan de forma independiente con la evolución del índice HOMA durante el seguimiento de los pacientes. También se ha tratado de controlar la posible influencia de la obesidad sobre la asociación SAHS-resistencia a la insulina, evaluándola en individuos delgados. Pamidi et al.38 han descrito que hombres delgados con SAHS tienen una sensibilidad a la insulina un 27% menor y una secreción de insulina un 37% mayor que controles pareados por edad, IMC, historia familiar y niveles de ejercicio. Resultados similares fueron hallados en otro estudio de hombres delgados realizado en China39. En definitiva, la evidencia disponible parece demostrar que el SAHS se relaciona independientemente con el desarrollo de resistencia insulínica y, por tanto, aumentaría el riesgo de presentar diabetes.
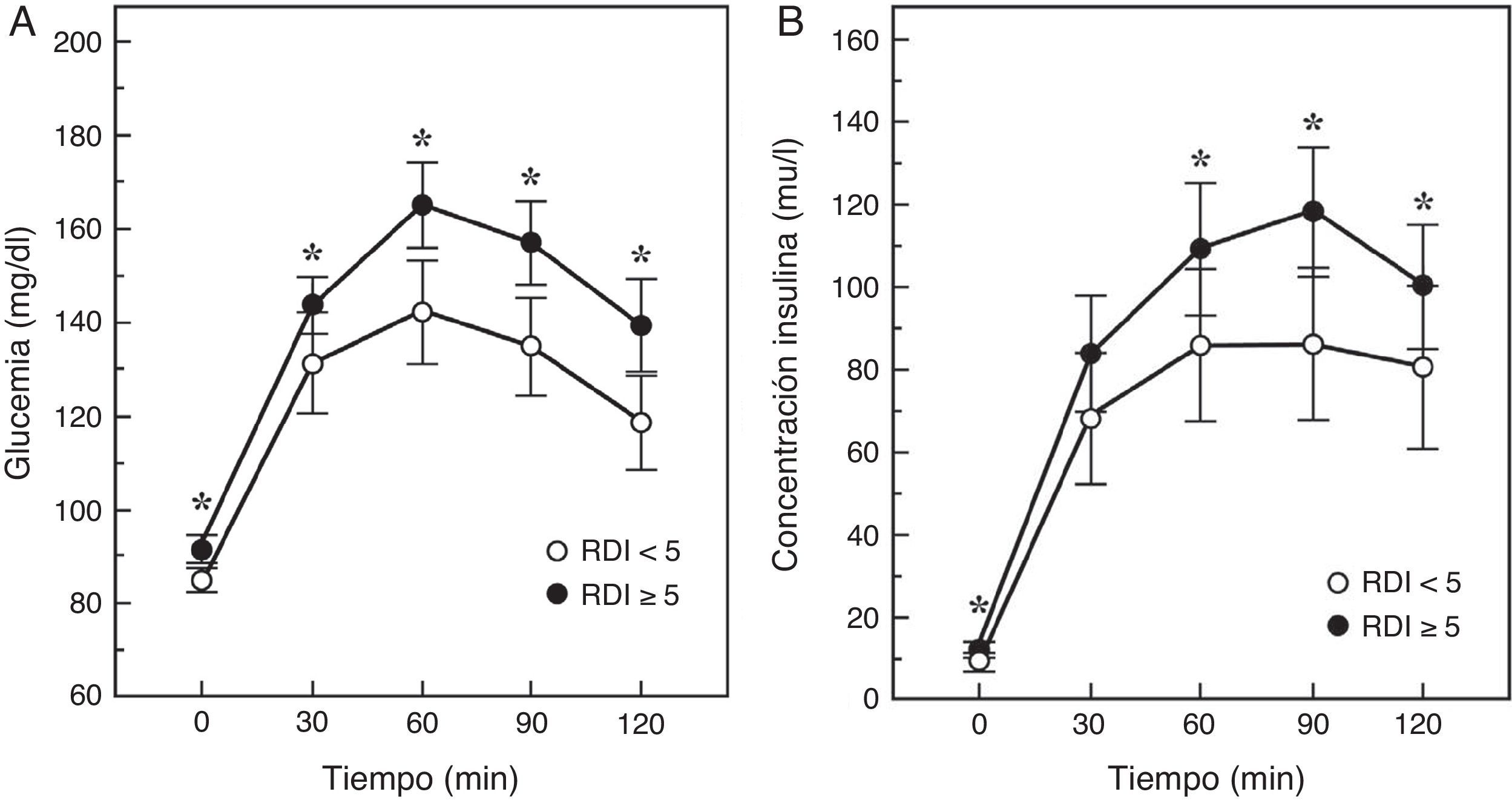
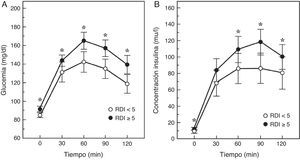
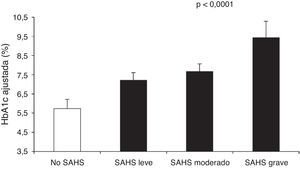
Un paso intermedio en la historia natural de la relación SAHS-diabetes es la disminución de la tolerancia a la glucosa. De hecho, en 150 hombres sanos, sin diabetes ni enfermedad cardiopulmonar, se comprobó que un IAH≥5 duplicaba el riesgo de intolerancia a la glucosa, dependiendo fundamentalmente de la gravedad de la desaturación nocturna40. De igual modo, en el Cleveland Family Study, se identificó que el principal determinante de la intolerancia a la glucosa, que estaba presente en un 32% de los sujetos con SAHS, era el tiempo con una SaO2<90% (CT90). Los individuos con un CT90≥2% tenían 2,33 (IC95%: 1,38-3,94) veces más riesgo de presentar intolerancia a la glucosa41. En el Sleep Hearth Health Study, el mayor estudio epidemiológico realizado hasta la fecha que valoró la presencia de SAHS por polisomnografía y midió niveles basales de glucosa e insulina y tras una sobrecarga oral de glucosa, se comprobó que una vez ajustados por edad, IMC, perímetro de la cintura, raza, sexo y tabaquismo, los sujetos que tenían un IAH≥15 alcanzaban odds ratios de 1,46 y 1,44 para tener niveles elevados de glucemia basal o tras la sobrecarga oral42. Más recientemente, Cizza et al.43 describieron que el 44% de los obesos con somnolencia presentaba intolerancia a la glucosa y que la mayor gravedad del SAHS se relacionaba con superiores glucemias e insulinemias basales, así como con una peor respuesta a la sobrecarga oral de glucosa (fig. 1).
Respuesta de la glucemia y la insulinemia a una sobrecarga oral de glucosa en pacientes con SAHS (RDI o índice de eventos respiratorios≥5) o sin SAHS. Modificada de Cizza et al.43.
Por último, también existen algunas evidencias que relacionan directamente al SAHS con un peor control metabólico de la glucosa36,44–50. En pacientes sin diabetes conocida, se evidenció la existencia de una relación dosis-respuesta entre el IAH y el porcentaje de mal control glucémico, definido por una hemoglobina glucosilada (HbA1c)>6%, que alcanzaba el 34,2% cuando el IAH era superior a 5051. Con respecto a los sujetos con un IAH<5, la presencia de un IAH de 15-30 o ≥50 tenía una odds ratio ajustada para mal control glucémico de 1,80 (1,19-2,72) y 2,96 (1,58-5,54), respectivamente. Además, la hipoxemia durante el sueño también se relacionó con una HbA1c>6%51.
En definitiva, los datos aportados por diversos estudios clínicos o epidemiológicos soportan una asociación entre el SAHS y un deterioro de la homeostasis de la glucosa, que expone a estos pacientes a un mayor riesgo de desarrollar diabetes.
Prevalencia del síndrome de apneas-hipopneas del sueño en pacientes con diabetes tipo 2Pese a la existencia de notables limitaciones metodológicas, diversos estudios proporcionan cifras de prevalencia del SAHS en pacientes con DM2 superiores a las de la población general52–57. Desafortunadamente, todavía pocos estudios han utilizado métodos diagnósticos universalmente aceptados como la poligrafía o la polisomnografía. Las principales evidencias disponibles proceden de distintos subanálisis de la cohorte multiétnica de sujetos mayores de 40 años sin enfermedad cardiovascular conocida reclutados en el Sleep Heart Health Study. En una muestra de 4.991 participantes, se comprobó que el índice de eventos respiratorios se asociaba con la presencia de diabetes, además de la edad, IMC, índice cintura-cadera, hipertensión y perfil lipídico58. En otra muestra de 5.874 participantes, se apreciaron diferencias en el índice de eventos respiratorios y el CT90 entre pacientes diabéticos y no diabéticos59. Cuando en la misma cohorte se evaluó la presencia de SAHS mediante polisomnografía, se comprobó que alcanzaba un 58% en el grupo de enfermos con DM260. Dos estudios posteriores también han identificado altas tasas de prevalencia de SAHS en pacientes con DM2. En uno se halló que hasta un 62% de enfermos hospitalizados por DM2 pobremente controlada tenía un SAHS (un 34% leve, un 19% moderado y un 10% grave)55. El otro describe una prevalencia de SAHS del 86% en diabéticos obesos56.
Prevalencia de diabetes tipo 2 en pacientes con síndrome de apneas-hipopneas del sueñoLa prevalencia de DM2 en pacientes con SAHS oscila del 15 al 30%, dependiendo de la población del estudio, la definición de gravedad del SAHS y los métodos diagnósticos utilizados61,62. El estudio de la Wisconsin Sleep Cohort detectó una mayor prevalencia de DM2 en pacientes con SAHS (14,7 vs. 2,8%), con una odds ratio ajustada de 2,3 (1,28-4,11) para un IAH≥15 con respecto a un IAH<548. Por el contrario, una muestra multiétnica de 1.008 pacientes con DM2, de predominio hispano y afroamericano, proporcionó resultados negativos. Aunque la prevalencia de DM2 también fue mayor en los sujetos con SAHS que en los no apneicos (30,1 vs. 18,6%), obteniendo una odds ratio de 1,8 (1,3-2,6), esta asociación no resultó significativa cuando se controlaron diversos factores de confusión63. No obstante, otro análisis transversal realizado sobre una muestra mucho mayor (14.440 sujetos del Hispanic Community Health Study/Study of Latinos) confirma que el SAHS moderado se asocia tanto a intolerancia a la glucosa (odds ratio=1,7; IC95%:1,3-2,1) como a diabetes (2,3; 1,8–2,9)64.
Además de la relación entre el SAHS y la DM2 mostrada en estos estudios transversales, algunos estudios longitudinales señalan que la existencia de apneas-hipopneas puede favorecer el desarrollo de diabetes. Marshall et al.61 proporcionaron la primera evidencia de que el SAHS moderado-grave es un factor de riesgo para el desarrollo de diabetes. Después de 4 años de seguimiento de una cohorte poblacional australiana, hallaron que el 20% de los pacientes con SAHS moderado-grave había sido diagnosticado de DM2, demostrando que el SAHS es un factor de riesgo independiente para la diabetes incidente (hazard ratio ajustada=13,45; IC95%:1,59-114,11). Lindberg et al.37 refirieron que este efecto no es exclusivo de las formas moderadas-graves. Durante 11 años, siguieron la evolución de una muestra poblacional de varones adultos no diabéticos y comprobaron que, una vez ajustado por los factores de confusión, un índice de desaturación>5 fue predictor del desarrollo de diabetes (4,4; 1,1-18,1). Otro estudio observacional de una cohorte de 1.233 pacientes del Veteran Affairs Connecticut Health Care System confirma el papel del SAHS como factor de riesgo para el desarrollo de DM265. Tras ajustar por edad, sexo, raza, glucemia basal, IMC y cambio de peso, se detectó una asociación independiente entre SAHS y diabetes incidente (1,43; 1,10-1,86). En una pequeña cohorte de mujeres de edad media remitidas a una clínica de sueño seguidas durante 16 años, también se comprobó que el SAHS predice la aparición de diabetes de reciente comienzo en el sexo femenino62.
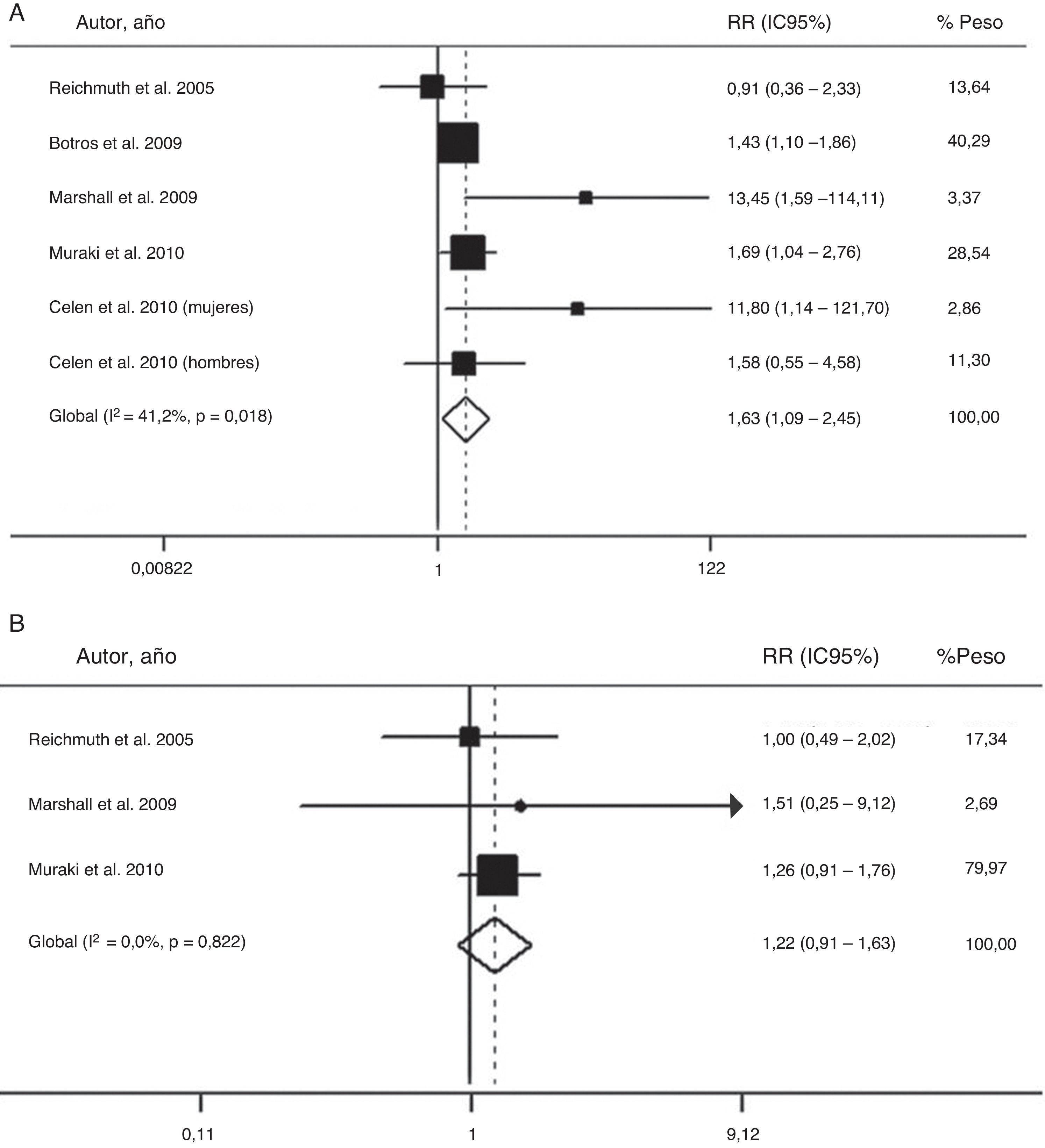
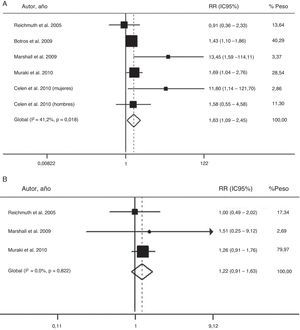
El valor global de las evidencias disponibles ha sido recientemente evaluado en un metaanálisis de 6 estudios prospectivos de cohortes, que incluían un total de 5.953 participantes, con un periodo de seguimiento de 2,7–16 años66. Dicho análisis confirmó que el SAHS moderado-grave se asocia a un mayor riesgo de diabetes (riesgo relativo=1,63; IC95%:1,09-2,45), cuando se compara con la ausencia de SAHS (fig. 2). Sin embargo, los pacientes con SAHS leve no mostraron un riesgo superior a los no apneicos (1,22; 0,91–1,63)66.
Riesgo de la asociación entre SAHS moderado-grave (A) y SAHS leve (B) con diabetes tipo 2. IC: intervalo de confianza; RR: riesgo relativo. Modificada con permiso de la Asian Pacific Society of Respirology. Copyright© 2012 Asian Pacific Society of Respirology. Wang et al.66.
El mejor conocimiento de la repercusión de los trastornos fisiopatológicos originados por las apneas-hipopneas sobre el metabolismo de la glucosa proporciona un sustrato de plausibilidad biológica a la relación SAHS-DM2. De forma esquemática, se puede considerar que el SAHS activa 2 mecanismos desencadenantes, la hipoxia intermitente y la fragmentación del sueño, que inducen diversos trastornos intermedios, como la activación del sistema nervioso simpático, el estrés oxidativo, la inflamación sistémica, alteraciones en las hormonas reguladoras del apetito y activación del eje hipotálamo-hipófiso-suprarrenal, que favorecen el desarrollo de resistencia a la insulina y su progresión a intolerancia a la glucosa y, en última instancia, a DM2 (fig. 3).
Además de la hipoxia continua67–70, estudios con modelos animales han demostrado que la hipoxia intermitente puede causar resistencia a la insulina. En ratones sin sobrepeso, la exposición a ciclos sucesivos de hipoxia intermitente disminuye la sensibilidad a la insulina, en comparación con la exposición a aire sintético, fundamentalmente por una menor utilización de glucosa por las fibras musculares oxidativas71. Parece que la hipoxia intermitente solo empeora la homeostasis de la glucosa durante los periodos de exposición hipóxica e induce la replicación de células β pancreáticas, probablemente para compensar la disminución de la sensibilidad a la insulina72. Sin embargo, la presencia de hiperglucemia aumenta la apoptosis de las células β e inhibe su replicación, perdiendo esta respuesta compensadora72.
Los efectos de la hipoxia intermitente sobre el metabolismo de la glucosa en humanos son peor conocidos. Sin embargo, Louis y Punjabi73 demostraron, en voluntarios sanos sometidos a ciclos de hipoxia intermitente o normoxia, que la primera se asociaba con una disminución de la sensibilidad a la insulina y de la efectividad de la glucosa73. Además, se acepta que la hipoxemia intermitente constituye uno de los principales determinantes de la HbA1c en pacientes con SAHS. Un reciente estudio evaluó los factores relacionados con los niveles de HbA1c en 164 pacientes con SAHS y tolerantes a la glucosa, 111 con intolerancia y 55 con diabetes74. Comprobaron que la HbA1c se relacionó con la saturación mínima en todos los pacientes, mientras que no mostraba relación con el IAH en aquellos que tenían DM2 o normoglucenia. Por tanto, se sugiere que la relación entre SAHS y HbA1c en pacientes con DM2 resulta más dependiente de la SaO2 mínima que del IAH74. En la misma línea, otros autores refieren que el IAH se relaciona con la HbA1c solo durante la fase de sueño REM75, lo que podría explicar parte de la variabilidad individual. Otra posible justificación de la variación intersujeto radica en alteraciones del factor inducido por la hipoxia-1, que desencadena la expresión de genes específicos en presencia de una baja concentración de oxígeno76. En ratas diabéticas, se ha comunicado que existe un incremento en la expresión del factor inducido por la hipoxia -1 por las células β pancreáticas, lo que inhibe el transporte de glucosa y perpetúa un estado de resistencia a la insulina77.
Fragmentación del sueñoEn condiciones de laboratorio, se ha comprobado que la deprivación total de sueño disminuye la tolerancia a la glucosa46,78–80. Diversos estudios observacionales en población general también muestran una relación entre deprivación de sueño y alteraciones del metabolismo de la glucosa. El Sleep Heart Health Study confirmó que menos de 6h de sueño se asocia a una mayor prevalencia de diabetes o intolerancia a la glucosa que dormir 7-8h60. Además, un considerable número de estudios longitudinales señalan que la restricción de sueño aumenta el riesgo de desarrollar diabetes. Un análisis del First National Health and Nutrition Examination Survey demostró que menos de 5h de sueño aumentaba 1,47 veces el riesgo de desarrollar diabetes durante un seguimiento de 8-10 años49. En más de 1.000 hombres reclutados en el Massachusetts Male Aging Study también se comprobó que aquellos que referían un menor tiempo medio de sueño tenían el doble de riesgo de desarrollar diabetes que aquellos que dormían 7-8h81. Aunque la información sobre este aspecto todavía resulta limitada, el efecto de la restricción de sueño sobre el riesgo de desarrollar diabetes parece ser dependiente del sexo82,83. En más de 70.000 mujeres adultas no diabéticas incluidas en el Nurses Health study se comprobó que dormir menos de 5h incrementaba 1,57 veces el riesgo de desarrollar diabetes en 10 años, aunque este efecto perdió significación al ajustarlo por el IMC y otros factores de confusión47. Por tanto, la restricción de sueño parece ser un factor de riesgo independiente para desarrollar diabetes, fundamentalmente en hombres.
Además de los estudios sobre población general, varios autores han evaluado la duración y calidad del sueño en pacientes con diabetes84,85. La mayoría hallaron que una pobre calidad de sueño era más prevalente en los enfermos con diabetes85 y que esto afectaba negativamente al control glucémico84,85. La influencia de la calidad del sueño sobre la tolerancia a la glucosa también ha sido investigada en diversas cohortes longitudinales49,82,83,86,87. Salvo un estudio83, todos refieren un incremento del riesgo de diabetes en relación con trastornos del sueño. La potencial contribución de la fragmentación del sueño a la relación SAHS-diabetes se pone de manifiesto por la importancia de la somnolencia, como demostraron Barceló et al.88. Estos autores comprobaron que los pacientes con SAHS y somnolencia diurna excesiva tienen un mayor índice HOMA que los enfermos con SAHS no somnolientos o los controles sanos88. La pérdida de sueño REM, por la fragmentación del mismo, también podría contribuir al desarrollo de diabetes89. El sueño REM tiene elevados requerimientos energéticos debido a la actividad neuronal sostenida y se acompaña por un incremento en la utilización cerebral de glucosa así como por una disminución en las concentraciones de insulina y glucagón90. Por ello, la mayor prevalencia de diabetes en pacientes con SAHS que tienen más concentración de eventos respiratorios durante el sueño REM91 podría estar relacionada con la fragmentación de esta fase del sueño92.
Activación del sistema nervioso simpáticoEl sistema nervioso simpático tiene un papel central en la regulación metabólica de la glucosa y la grasa93,94. Es conocido que las catecolaminas disminuyen la sensibilidad a la insulina, reducen el consumo de glucosa mediado por la insulina95, promueven la apoptosis de células β pancreáticas y reducen la secreción de insulina96,97. También pueden inhibir la glucogénesis mediada por la insulina e incrementar la glucólisis95,96,98. El aumento de la actividad simpática tiene efectos lipolíticos, liberando ácidos grasos circulantes, que disminuyen la sensibilidad a la insulina93. Por otra parte, la vasoconstricción simpática puede reducir el aporte de glucosa e insulina a los músculos esqueléticos, derivando el flujo sanguíneo hacia áreas metabólicamente menos activas, lo que disminuye el consumo neto de glucosa99.
Resulta conocido que la sucesión de periodos de hipoxemia-reoxigenación que acompañan a las apneas-hipopneas modifica la sensibilidad de los quimiorreceptores periféricos en pacientes con SAHS10,100 y que la estimulación de estos receptores incrementa la actividad del sistema nervioso simpático10,101. Dado que la activación del sistema nervioso simpático parece tener un impacto sobre la sensibilidad a la insulina, se ha propuesto que esta vía contribuya particularmente al desarrollo de resistencia a la insulina en pacientes con SAHS102.
Diversas evidencias experimentales apoyan que el incremento del tono simpático basal desempeña un papel esencial en la relación SAHS-DM2. La intolerancia a la glucosa originada en voluntarios sanos por exposición a periodos de hipoxia aguda se asocia a un incremento de catecolaminas plasmáticas70. También en voluntarios sanos sometidos a hipoxia intermitente, se ha comprobado que la disminución de la sensibilidad a la insulina y de la efectividad de la glucosa se relaciona con un desplazamiento del equilibrio simpático-vagal, con predominio de la actividad simpática73. Sin embargo, el bloqueo de la actividad simpática en un modelo animal no mitiga los efectos negativos a corto plazo de la hipoxia intermitente sobre la sensibilidad a la insulina, sugiriendo la implicación de otras vías alternativas71. En cualquier caso, este hallazgo no excluye que la activación hipóxica del sistema simpático contribuya a la progresión a largo plazo de la resistencia insulínica, que puede ocurrir durante décadas en pacientes con SAHS.
Estrés oxidativoUn exceso de especies reactivas de oxígeno (ERO) puede inhibir el consumo de sustratos energéticos inducido por la insulina en tejido muscular y adiposo, así como dañar las células β pancreáticas debido a su relativamente baja concentración de enzimas antioxidantes93,103. Además, la formación de ERO puede suprimir la secreción de insulina y empeorar la sensibilidad insulínica104,105. De hecho, estudios a nivel celular muestran que la hipoxia intermitente tiene un efecto negativo sobre la proliferación y muerte de las células β, que parece atribuible a un mayor estrés oxidativo celular106.
En modelos animales, se ha comprobado que la hipoxia intermitente favorece la liberación de ERO, promoviendo un estado proinflamatorio107. Como consecuencia, se incrementan los niveles plasmáticos de colesterol, al inhibir su consumo hepático108, y se favorece el desarrollo de resistencia a la insulina, aumentando los niveles de insulina y disminuyendo la tolerancia a la glucosa109. En voluntarios sanos, también se ha confirmado que la hipoxia intermitente produce un incremento de ERO110, asociado a una disminución de la sensibilidad a la insulina73. Por tanto, el incremento del estrés oxidativo evidenciado en pacientes con SAHS111,112 podría contribuir al desarrollo de resistencia a la insulina.
Inflamación sistémicaDiversas líneas de evidencia convergen para implicar a la inflamación subclínica en la patogénesis de la resistencia a la insulina y la diabetes93. Los pacientes diabéticos presentan un estado proinflamatorio basal, caracterizado por elevados niveles circulantes de citocinas inflamatorias como interleucina-6, factor de necrosis tumoral-α, proteína C reactiva e interleucina -18113,114. De forma especial, la interleucina -6 y el factor de necrosis tumoral -α han sido implicados en la patogénesis de la resistencia a la insulina y la DM2115–117. En paralelo, otros estudios han documentado la existencia un estado proinflamatorio en los pacientes con SAHS84,118.
Aunque todavía no se dispone de información precisa sobre cómo la inflamación sistémica contribuye al desarrollo de resistencia a la insulina en el SAHS, el reclutamiento de macrófagos y la vía lipotóxica parecen especialmente relevantes. La inflamación crónica produce una activación y acumulación de macrófagos en los islotes pancreáticos de pacientes con DM2, lo que podría favorecer su destrucción tisular y reparación anómala119,120. Los efectos lipotóxicos de la obesidad también pueden desempeñar un importante papel en la patogénesis de la resistencia insulínica activando la vía proinflamatoria. Ello es debido a que los adipocitos son una fuente principal de citocinas, que son secretadas a la circulación en función del tamaño del adipocito, por lo que existe una relación directamente proporcional entre masa grasa y citocinas circulantes121,122.
Alteración de las hormonas reguladoras del apetitoLas principales hormonas implicadas en esta función son la leptina, la adiponectina y la resistina123. La leptina regula a nivel central el hambre y la ganancia de peso, incrementando la expresión hipotalámica de péptidos anorexígenos y disminuyendo la de péptidos orexígenos124, mientras que a nivel periférico parece estar implicada en la homeostasis de la glucosa125. La adiponectina es sintetizada por los adipocitos y regula su sensibilidad a la insulina126. Bajos niveles circulantes de adiponectina constituyen un factor de riesgo para la incidencia de diabetes, aterosclerosis y dislipidemia127. Por el contrario, concentraciones elevadas de adiponectina tienen propiedades protectoras frente a la diabetes93. Aunque el papel de la resistina resulta más dudoso, se considera que incrementa la resistencia hepática a la insulina y reduce la tolerancia a la glucosa128.
Algunos autores han descrito que los pacientes con SAHS tienen menos leptina plasmática que sujetos sanos80, aunque no siempre se controla adecuadamente el papel de la obesidad como factor de confusión129. Esta hormona parece contribuir de forma importante al desarrollo de resistencia a la insulina en el SAHS. En ratones obesos deficientes en leptina, la hipoxia intermitente induce una disminución de la glucemia y un incremento de la insulina sérica, tanto a corto como a largo plazo, compatibles con una mayor resistencia insulínica109. Estas respuestas se bloquean cuando se realiza infusión previa de leptina109, por lo que el incremento de la resistencia a la insulina originado por la hipoxia intermitente parece ser dependiente de la disrupción de la vía de la leptina.
La resistina es otra adipocina que puede contribuir al desarrollo de obesidad130, resistencia insulínica131 y síndrome metabólico132. Algunos autores133 no hallan una asociación entre los niveles plasmáticos de resistina en enfermos con SAHS y la resistencia a la insulina, determinada por el índice HOMA. Sin embargo, otros estudios muestran que la concentración plasmática de resistina es mayor en los pacientes con SAHS que tienen DM2, en comparación con los que presentan intolerancia a la glucosa o un metabolismo de la glucosa normal134.
Activación del eje hipotálamo-hipófiso-suprarrenalEl cortisol y otros glucocorticosteroides interfieren con el metabolismo de los hidratos de carbono aumentando la producción de glucosa, disminuyendo su consumo en tejidos periféricos e inhibiendo la liberación de insulina desde las células β pancreáticas93,99.
La activación del sistema nervioso simpático podría incrementar la actividad del eje hipotálamo-hipófiso-suprarrenal, aumentando la síntesis de cortisol, que promueve el desarrollo de resistencia a la insulina y favorece la hiperglucemia135. De hecho, estudios en altitud o bajo condiciones hipobáricas confirman que la hipoxia modifica la función del eje hipotálamo-hipófiso-suprarrenal y aumenta los niveles de cortisol circulante135. Además, alteraciones en la secreción de las hormonas reguladoras del apetito también pueden afectar a la homeostasis de la glucosa, aumentando los niveles nocturnos de hormona de crecimiento y vespertinos de cortisol46. Todavía existen pocos estudios en humanos que hayan examinado los cambios en la secreción de cortisol inducidos por el SAHS. Aunque algún estudio señala que el SAHS no afecta a los niveles de cortisol136, en otros casos se ha descrito una concentración de cortisol superior a la de controles pareados por peso, que se reduce después del tratamiento con CPAP137.
En definitiva, la información disponible actualmente permite establecer una conexión entre la hipoxia intermitente y la fragmentación del sueño ocasionados por el SAHS y el desarrollo de resistencia a la insulina, a través de diversas vías patogénicas. No obstante, los mecanismos moleculares de señalización celular que conducen al incremento de la resistencia a la insulina en estos pacientes todavía no son suficientemente conocidos.
Relevancia clínica y pronóstica de la asociación síndrome de apneas-hipopneas del sueño-diabetesEn los últimos años se han acumulado algunas evidencias que sugieren que la coexistencia de un SAHS podría agravar la evolución de la DM2138–140, pero también plantean la interesante posibilidad de una relación bidireccional.
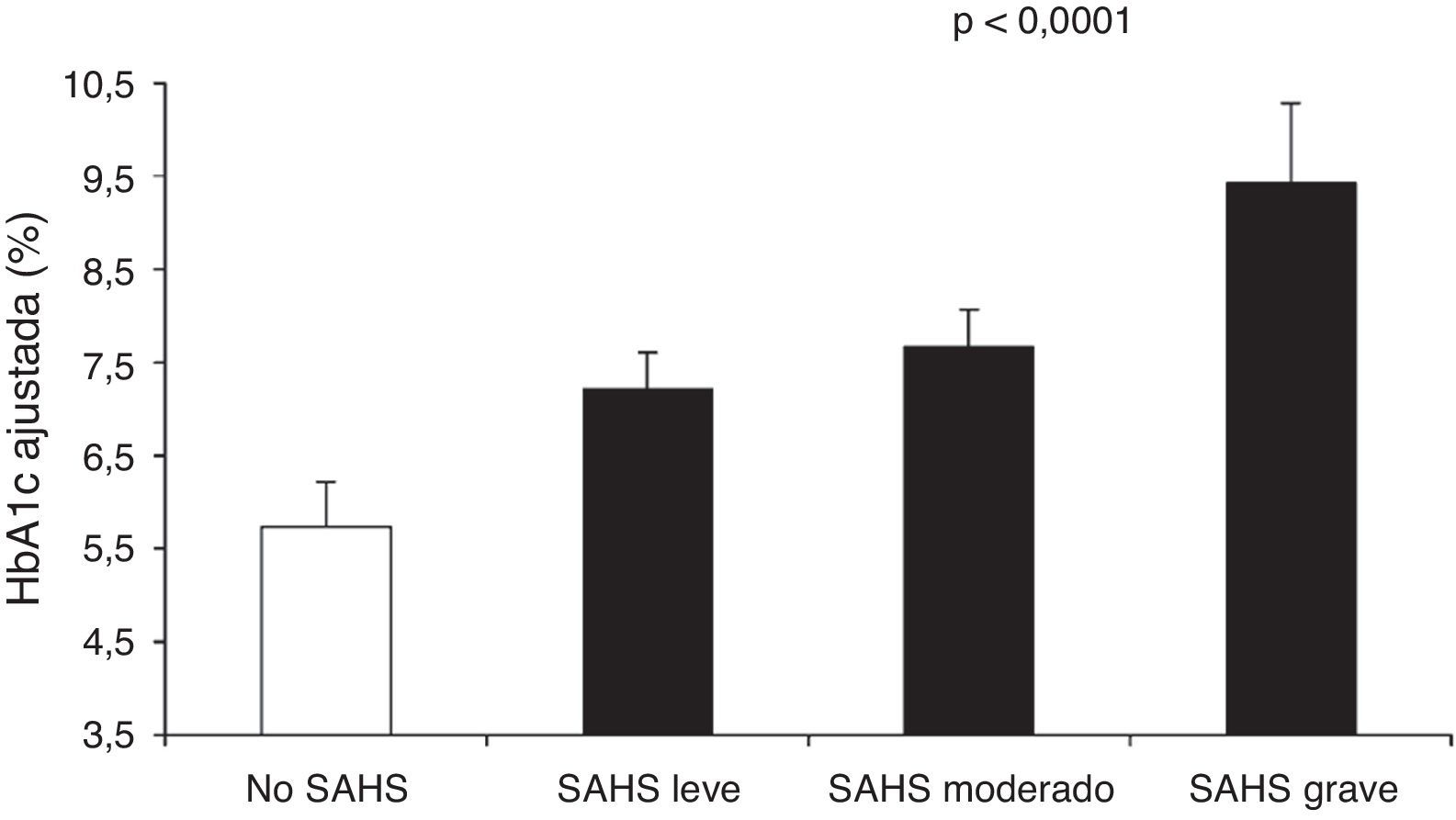
Aronsohn et al.141 han demostrado que el SAHS empeora el control glucémico de la DM2. En comparación con sujetos control, la HbA1c media ajustada aumentaba un 1,49% en pacientes con SAHS leve, un 1,93% en SAHS moderado y un 3,69% en SAHS grave (fig. 4). Además, otras medidas de gravedad del SAHS, como los IAH y de desaturación durante la fase REM, también se relacionaban con la concentración de HbA1c.
Concentración de hemoglobina glucosilada (HbA1c) en pacientes control y distintos niveles de gravedad del SAHS. Los valores están ajustados para edad, sexo, raza, índice de masa corporal, medicación antidiabética, nivel de ejercicio, años de evolución de la diabetes y tiempo total de sueño. Las barras representan el error estándar de la media. Reproducida con permiso de la American Thoracic Society. Copyright© 2014 American Thoracic Society. Aronsohn et al.141.
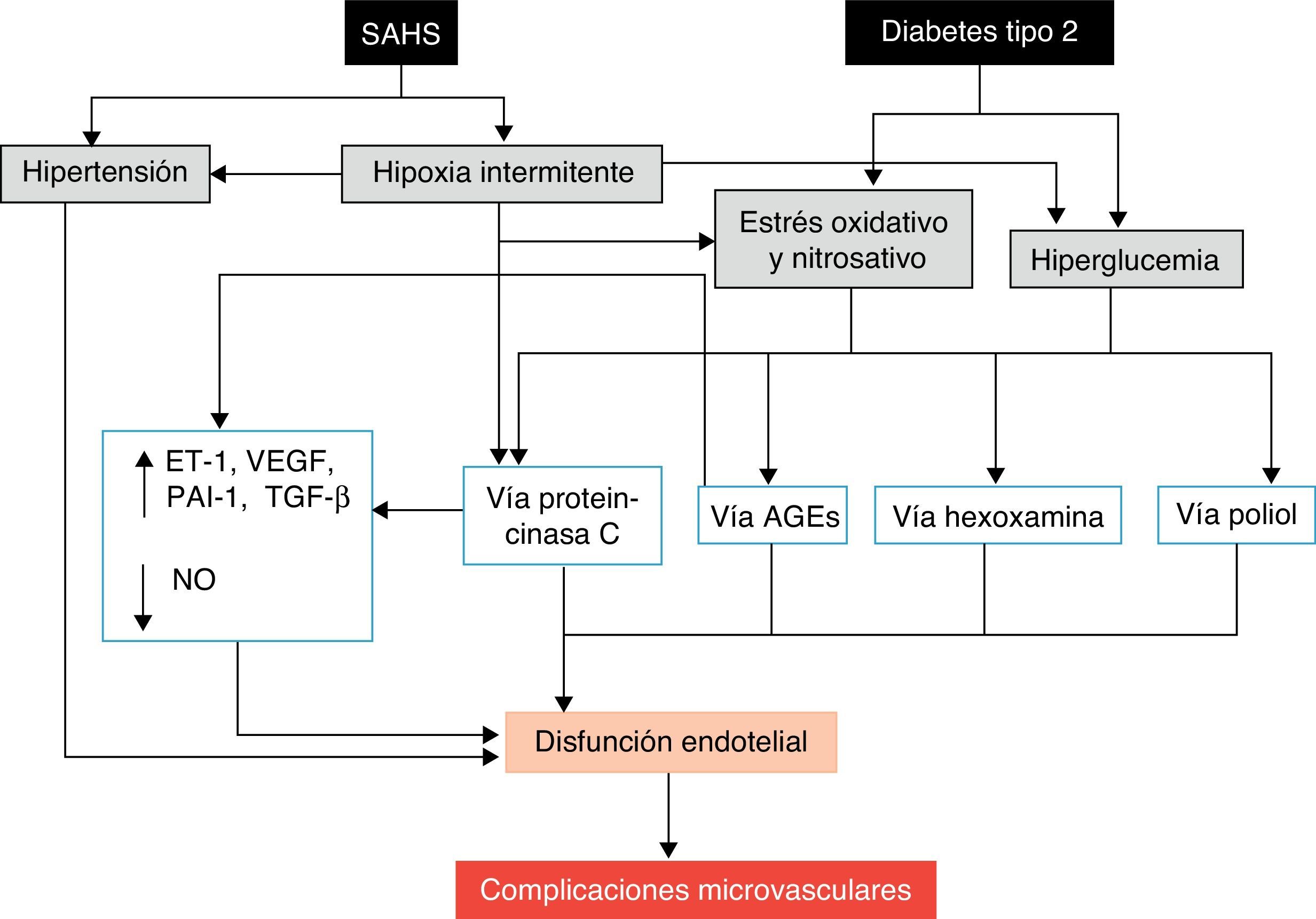
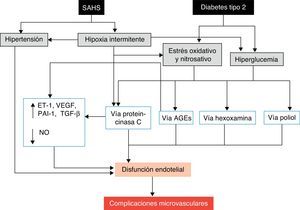
La principal causa de morbimortalidad de los pacientes con DM2 es el desarrollo de complicaciones micro o macrovasculares, sobre las que también podría incidir el SAHS. Las complicaciones macrovasculares, que incluyen cardiopatía isquémica, enfermedad arterial periférica y enfermedad cerebrovascular, son debidas a los efectos nocivos de la hiperglucemia142,143, además del proceso de aterosclerosis. Además, el SAHS puede empeorar ciertas complicaciones microvasculares típicas, como la retinopatía, nefropatía y neuropatía138,144. Los mecanismos potencialmente implicados en el desarrollo de las complicaciones microvasculares son diversos145. El SAHS aumenta la producción de productos finales o desechos de la glucación avanzada146 y ha sido asociado con una alteración de la señalización de la proteincinasa C, que desempeña un importante papel en la respuesta celular a la hipoxia145. Además, el SAHS se asocia con una disminución de la óxido-nítrico sintetasa endotelial y un incremento de los niveles de endotelina-1147, con hipercoagulabilidad21 e inflamación118. A su vez, los episodios repetitivos de hipoxemia-reoxigenación inducen la producción de ERO112. El resultado final de este proceso, potenciado por el efecto de la hiperglucemia y la hipertensión, es el desarrollo de disfunción endotelial y afectación microvascular (fig. 5).
Mecanismos propuestos por los que el SAHS puede favorecer el desarrollo de complicaciones microvasculares de la diabetes. AGE: productos finales o residuos de la glucación avanzada; ET-1: endotelina-1; NO: óxido nítrico; PAI-1: inhibidor del activador del plasminógeno-1; TGF-β: factor de crecimiento tisular β; VEGF: factor de crecimiento endotelial vascular.
Aunque existe algún estudio negativo148, la mayoría muestran una asociación entre SAHS y gravedad de la retinopatía, así como un mayor riesgo de progresión. En un estudio transversal de casos-control que incluía a 68 pacientes con retinopatía diabética no proliferativa y 151 enfermos con retinopatía diabética proliferativa, la gravedad de las desaturaciones nocturnas, evaluada mediante el índice de desaturaciones y la SaO2 mínima, resultó ser un factor de riesgo para retinopatía diabética proliferativa, sugiriendo que la reoxigenación causada por el SAHS puede incidir en la progresión de la retinopatía149. En otro estudio realizado en hombres con DM2, el SAHS se asoció independientemente con retinopatía y maculopatía diabética139. Un estudio longitudinal también ha demostrado que los pacientes con SAHS tienen más riesgo de desarrollar una retinopatía diabética avanzada150. En un reciente estudio transversal de varones obesos con DM2, Rudrappa et al.151 describen un empeoramiento de la retinopatía pero no de la maculopatía y una mayor proporción de pacientes con retinopatía diabética proliferativa en el grupo SAHS. Además, el SAHS resultó el único predictor independiente de retinopatía después del ajuste para nuevos biomarcadores séricos de retinopatía e inflamación151.
Síndrome de apneas-hipopneas del sueño y nefropatía diabéticaExisten datos contradictorios sobre esta otra complicación mayor de la diabetes. Schober et al.152 hallaron una mayor prevalencia de nefropatía en diabéticos adultos con un IAH≥15 que en los no apneicos. Aunque otros autores no identificaron una relación entre la presencia de SAHS en pacientes con DM2 y la existencia de microalbuminuria140, en un grupo de pacientes con insuficiencia renal secundaria a diabetes se ha descrito que el SAHS se asocia a un mayor riesgo de hemodiálisis e hipertensión153.
En general, se considera que la isquemia y la hipoxia renal son factores clave para el desarrollo de insuficiencia renal. Diversas evidencias sugieren que un incremento de la gravedad del SAHS se relaciona con un deterioro de la función renal independiente de los factores de riesgo establecidos para progresión de la nefropatía144. Para explicar este hecho se proponen diversos mecanismos. Resulta conocido que la hipoxia intermitente y la fragmentación del sueño originadas por el SAHS activan el sistema nervioso simpático y el sistema renina-angiotensina-aldosterona, aumentan los niveles de citocinas y favorecen el estrés oxidativo. El aumento de la generación de radicales libres da lugar a un conjunto de procesos deletéreos como la disfunción endotelial, inflamación, agregación plaquetaria, aterosclerosis y fibrosis, que podrían aumentar el riesgo de daño renal de los enfermos con SAHS. Además, también debe considerarse que el SAHS es un factor de riesgo independiente de hipertensión e hiperfiltración glomerular, y que podría resultar un predictor independiente de proteinuria –una manifestación de enfermedad renal y un factor de riesgo para progresión de una nefropatía crónica a enfermedad renal en estado final144.
Síndrome de apneas-hipopneas del sueño y neuropatía diabéticaLas neuropatías diabéticas representan un grupo heterogéneo de trastornos que afectan a diferentes partes del sistema nervioso, incluyendo polineuropatías simétricas generalizadas, neuropatías multifocales y focales, y neuropática autonómica. Mayer et al.154 demostraron que los pacientes con SAHS grave tienen disfunción de nervios periféricos, originada por lesiones de la mielina axonal, cuya gravedad está parcialmente relacionada con la hipoxemia nocturna. Posteriormente, Raman et al.155 evaluaron el riesgo de neuropatía en 1.414 pacientes con DM2 y comprobaron que el grupo de mujeres diabéticas con alteración del patrón de sueño tenía más riesgo para desarrollar neuropatía. Sin embargo, en otro estudio que solo incluyó a 40 pacientes, no se identificó una asociación ente IAH y neuropatía diabética156.
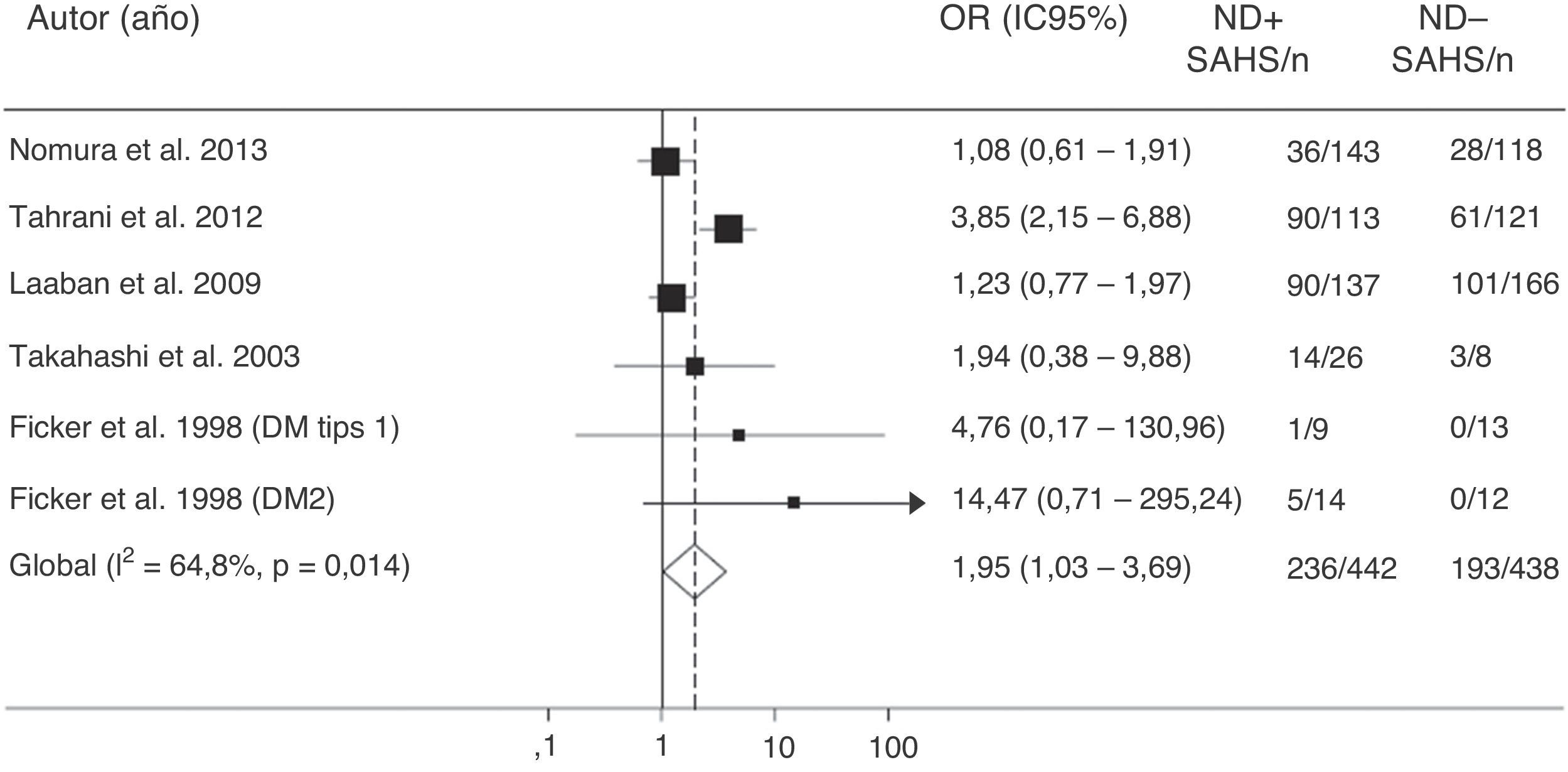
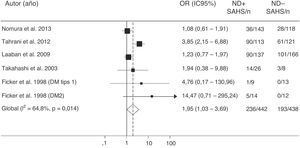
Más recientemente, Tahrani et al.145 demuestran que el SAHS se asocia independientemente con la neuropatía diabética (odds ratio ajustada=2,82; IC95%:1,44-5,52). Comprueban que la gravedad de la neuropatía diabética se relaciona con la del SAHS y de la hipoxemia nocturna e identifican potenciales mecanismos patogénicos, entre los que destaca un incremento del estrés nitrosativo145. Por último, un metaanálisis confirma la relación entre SAHS y neuropatía diabética. La presencia de SAHS resulta más frecuente en los pacientes con DM2 que tienen neuropatía (odds ratio=1,95; IC95%: 1,03-3,70) (fig. 6)157.
Valores de odds ratio (OR) con intervalo de confianza al 95% (IC95%) para la existencia de un SAHS de pacientes con neuropatía diabética (ND) comparados con sujetos sin ND. El área de cada cuadro negro es proporcional al peso estadístico de cada estudio. El rombo blanco representa la OR global. La línea vertical discontinua indica el IC95% de cada OR. La línea vertical continua representa el valor de equivalencia entre los 2 grupos comparados. Modificada de Fujihara et al.157.
Aunque todavía escasos, algunos datos sugieren que la DM2 podría empeorar la evolución del SAHS (fig. 3). En modelos animales, se ha demostrado que la resistencia a la insulina se asocia con una menor respuesta ventilatoria158. Además, la presencia de neuropatía diabética podría incrementar la colapsabilidad de la vía aérea superior, por afectación de los músculos dilatadores de la laringe, y agravar las apneas-hipopneas obstructivas. De hecho, se ha comprobado que los pacientes con neuropática autonómica tienen un SAHS más grave, con una mayor duración de los eventos respiratorios y más desaturación que los diabéticos sin neuropatía autonómica159.
Además, la diabetes también puede favorecer la aparición de apneas centrales. Así, los pacientes del Sleep Hearth Health Study que son diabéticos presentan más respiración periódica y apneas centrales que los sujetos sin diabetes59. Se especula que la neuropatía autonómica asociada a la diabetes podría alterar las respuestas reflejas de la vía aérea superior, el control periférico de los músculos de las vías aéreas superiores, los umbrales de activación de los mecanorreceptores, la estabilidad y el control ventilatorio central, así como las respuestas periféricas a la hipercapnia y a la hipoxia93,160. Además, la hiperglucemia crónica induce estrés oxidativo, que ocasiona disfunción y daño estructural de los nervios161, lo que podría empeorar la disfunción autonómica y agravar los trastornos respiratorios del sueño, creando un círculo vicioso. Precisamente esta relación permite justificar el efecto de algunas intervenciones generales que resultan beneficiosas en el SAHS. Así, por ejemplo, el ejercicio y el incremento de la actividad física, que favorecen un mejor control de la glucemia, también tienen un efecto beneficioso sobre la gravedad del SAHS, que no resulta completamente explicado por la pérdida de peso asociada93,162. Por otra parte, algunos estudios muestran que la pérdida de peso se asocia a mejorías sustanciales en la gravedad del SAHS, debidas a cambios en la estructura y función de las vías aéreas superiores163,164.
En conclusión, existen crecientes evidencias que permiten relacionar al SAHS con el desarrollo de DM2. Esta asociación se soporta por la existencia de vías patogénicas comunes y podría tener importantes implicaciones pronósticas, no solo por la progresión de las complicaciones de la diabetes sino también por un efecto sinérgico sobre el propio SAHS.
FinanciaciónParcialmente financiado por la Sociedad Española de Neumología y Cirugía Torácica (034/2013), el Fondo de Investigación Sanitaria (PI10/00642 y PI13/01512), el Ministerio de Educación y Ciencia (SAF2007-62270) y el Programa de I+D en Biomedicina de la Comunidad de Madrid (S2010/BMD-2542).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.