Las escalas predictivas de recurrencias de ETV son útiles para decidir la duración del tratamiento anticoagulante. Aunque hay varias escalas, desconocemos la aplicabilidad de las mismas en nuestro medio. Por ello nos planteamos validar el modelo predictivo DASH y el nomograma de Viena a 12 meses.
MétodosEstudio retrospectivo de pacientes consecutivos no seleccionados con ETV no provocada desde 2006 hasta 2014. Comparamos la capacidad de predecir recurrencias de ETV de la escala DASH y el nomograma de Viena. La validación se realizó estratificando a los pacientes como de bajo o alto riesgo, según cada escala (discriminación) y comparando las recurrencias observadas frente a las esperadas (calibración).
ResultadosDe 353 pacientes evaluados, se analizaron 195, con una edad media de 53,5+/-19 años. Hubo 21 recurrencias a 1 año (10,8%, IC95%: 6,8-16%). Según la escala DASH, fueron catalogados de bajo riesgo el 42%, observando ETV recurrente en el grupo de bajo fue del 4,9% (IC95%: 1,3-12%) vs. el grupo de alto riesgo en que fue del 15% (IC95%: 9-23%) (p<0,05). Según el nomograma de Viena, fueron catalogados de bajo riesgo el 30%, observando ETV recurrente en el grupo de bajo vs. alto riesgo en el 4,2% (IC95%: 0,5-14%) vs. 16,2% (IC95%: 9,9-24,4%) (p<0,05).
ConclusionesNuestro estudio valida la escala DASH y el nomograma de Viena en nuestra población. El modelo predictivo DASH sería el más aconsejable, tanto por su sencillez como por la capacidad de identificar a más pacientes de bajo riesgo frente al nomograma de Viena (42% vs. 30%).
Scales for predicting venous thromboembolism (VTE) recurrence are useful for deciding the duration of the anticoagulant treatment. Although there are several scales, the most appropriate for our setting has not been identified. For this reason, we aimed to validate the DASH prediction score and the Vienna nomogram at 12 months.
MethodsThis was a retrospective study of unselected consecutive VTE patients seen between 2006 and 2014. We compared the ability of the DASH score and the Vienna nomogram to predict recurrences of VTE. The validation was performed by stratifying patients as low-risk or high-risk, according to each scale (discrimination) and comparing the observed recurrence with the expected rate (calibration).
ResultsOf 353 patients evaluated, 195 were analyzed, with an average age of 53.5 ± 19 years. There were 21 recurrences in 1 year (10.8%, 95% CI: 6.8%-16%). According to the DASH score, 42% were classified as low risk, and the rate of VTE recurrence in this group was 4.9% (95% CI: 1.3%-12%) vs. the high-risk group that was 15% (95% CI: 9%-23%) (p <.05). According to the Vienna nomogram, 30% were classified as low risk, and the rate of VTE recurrence in the low risk group vs. the high risk group was 4.2% (95% CI:0.5%-14%) vs. 16.2% (95% CI: 9.9%-24.4%) (p <.05).
ConclusionsOur study validates the DASH score and the Vienna nomogram in our population. The DASH prediction score may be the most advisable, both because of its simplicity and its ability to identify more low-risk patients than the Vienna nomogram (42% vs. 30%).
La enfermedad tromboembólica venosa (ETV) engloba tanto la trombosis venosa profunda (TVP) como la embolia de pulmón (EP). La ETV tiene una incidencia de 1 por 1000 personas/año, y es la tercera enfermedad cardiovascular, después del síndrome coronario agudo y del ictus1.
La ETV puede tener diferentes etiologías, y en su mecanismo fisiopatológico intervienen una serie de factores de riesgo unidos a la predisposición individual de cada sujeto, bien sea esta genética o adquirida. Cuando estos factores de riesgo y factores predisponentes son conocidos, se habla de ETV provocada (p. ej. cirugía, la inmovilización, el tratamiento hormonal, el embarazo, puerperio y cáncer). Aún así, aproximadamente un 50% de los casos ocurre en ausencia de un factor precipitante claro y es entonces cuando se habla de ETV no provocada o idiopática2–4.
Actualmente desconocemos cuál es la duración óptima del tratamiento anticoagulante en pacientes con ETV no provocado, ya que en los pacientes que se suspende la anticoagulación, el riesgo acumulado de ETV recurrente a 5 años es del 25-30%4–6. Por este motivo se sugiere continuar con tratamiento anticoagulante en caso de que el riesgo de hemorragia no sea elevado4–7. Sin embargo, basado en las evidencias actuales conocemos factores de riesgo que pueden modular el riesgo de recurrencia, como el sexo y el dímero D tras la retirada de la anticoagulación5,6,8. Desde un punto de vista práctico debemos analizar la tasa de letalidad (case fatality rate) de las hemorragias mayores, que es 2-3 veces superior que la tasa de letalidad de la ETV recurrente9,10, y por este motivo se recomienda suspender el tratamiento anticoagulante extendido cuando el riesgo de recurrencia durante el primer año es inferior al 5-8%11–13.
Para poder evaluar de forma individualizada el riesgo de ETV recurrente en los pacientes con ETV no provocado en los que suspende el tratamiento anticoagulante se han desarrollado y validado varios modelos de predicción clínica3,14, aunque ninguno de ellos se ha validado en España. Dos de las escalas más conocidas y validadas son la escala DASH13,15 y el nomograma de Viena16,17. El objetivo de nuestro estudio es realizar una validación externa en nuestro medio de la escala DASH y el nomograma de Viena reevaluando la calibración de las predicciones (p. ej. la precisión de la probabilidad de ETV recurrente que predicen los modelos comparados con los observados en la nueva cohorte).
MétodosDiseño del estudio y selección de pacientesEstudio retrospectivo de pacientes consecutivos no seleccionados con ETV no provocada valorados en una consulta monográfica, en el periodo comprendido de 2006 hasta 2014.
Criterios de inclusión: pacientes con ETV no provocada que realizaron tratamiento anticoagulante al menos durante 3 meses. Pacientes con ETV no provocada a los que se les suspendió la anticoagulación y se les determinó dímero D 21 días tras la retirada del tratamiento anticoagulante.
Criterios de exclusión: pacientes con ETV provocado atendiendo a criterios ISTH2 (cáncer activo, cirugía, inmovilización, traumatismo, hospitalización previa, embarazo o puerperio; anticuerpos anticardiolipina o anticoagulante lúpico positivo).
El diagnóstico definitivo de TVP se estableció mediante venografía o ecografía doppler o compresiva18. Para la confirmación del diagnóstico de EP, se requirió uno de los siguientes: 1) un defecto de llenado intraluminal en el protocolo de tomografía computarizada de tórax helicoidal con contraste; 2) gammagrafía pulmonar de ventilación-perfusión de alta probabilidad de acuerdo a los criterios PIOPED; o 3) gammagrafía pulmonar ventilación/perfusión no diagnóstica con TVP de miembro inferior confirmada mediante ecografía doppler o compresiva19–21.
Recogida de datos y seguimientoEn todos los pacientes recogimos una serie de variables clínicas entre las que se incluyeron como relevantes, al menos, aquellas para poder validar las dos escalas. Entre ellas se encuentran edad, sexo, comorbilidades (entre las que se encuentra hipertensión arterial, diabetes, dislipemia, cardiopatía isquémica), localización del evento trombótico, fecha del evento trombótico y de la retirada de la anticoagulación).
Previo a la suspensión, todos los pacientes recibieron tratamiento anticoagulante, al menos durante 3 meses tal y como indican las guías de práctica clínica6,22,23. Tras la retirada del tratamiento anticoagulante se realizó una determinación del dímero D a los 21+/-5 días y se realizó un seguimiento mínimo de 12 meses tras la retirada del tratamiento, bien en consulta o telefónicamente. En el caso de que el paciente no acudiese a la consulta se contactaba por teléfono, y en caso de ser necesario utilizamos datos administrativos para poder constatar la muerte del paciente, y que no hubiese presentado ETV (se consultó el programa de historia digital hospitalario y el de atención primaria). La sangre periférica se obtuvo mediante venopunción antecubital, a los 21 días de la retirada del tratamiento anticoagulante. El dímero D se realizó mediante el kit Acute Care™ D-dimer test pack de Siemens Healthcare Diagnostics (Newark, DE, EE. UU.), cuyo rango de normalidad es < 500μg / L.
Los pacientes con sospecha clínica de ETV recurrente se evaluaron usando el mismo método que para el diagnóstico inicial. Los pacientes con sospecha clínica de ETV recurrente se evaluaron usando el mismo método que para el diagnóstico inicial. Los pacientes con sospecha clínica de EP recurrente fueron documentados por gammagrafía de ventilación-perfusión, tomografía computarizada con contraste o angiografía pulmonar. Se consideró diagnóstico de EP recurrente si una gammagrafía pulmonar de alta probabilidad reveló una nueva área de defecto de perfusión segmentaria con alteración de la ventilación o mediante nuevos defectos de repleción en la tomografía axial computarizada helicoidal. Los pacientes con sospecha clínica de TVP recurrente fueron evaluados por ecografía compresiva o doppler, y el diagnóstico de una recurrencia de la TVP requería una clara evidencia de trombosis en, al menos, un segmento de vena proximal previamente no afecto. Esto requería evidenciar falta de compresibilidad en US de un trayecto de las venas proximales previamente compresible. Todas las exploraciones fueron realizadas por expertos en la técnica empleada. Un comité de adjudicación (LJP y SMR) revisó y estableció todas y cada una de las recurrencias.
El objetivo primario del estudio fue la validación externa a 12 meses de las escalas de ETV recurrente DASH y el nomograma de Viena. La validación se realizó tanto en términos de calibración como de discriminación24–26. Como objetivos secundarios se plantearon: 1) análisis comparativo de la discriminación de las dos escalas; 2) validación externa de las dos escalas a largo plazo. El estudio siguió los principios éticos de acuerdo con la Declaración de Helsinki y contó con la aprobación del comité ético del centro.
La escala DASH valora el D-Dímero elevado tras la suspensión del tratamiento anticoagulante (+2 puntos), la edad ≤ 50años (+1 punto), el sexo masculino (+1 punto) y el tratamiento hormonal (-2 puntos). La escala considera a los pacientes con bajo o alto riesgo de ETV recurrente si presentaban una puntuación ≤ 1 o ≥ 2, respectivamente15. Esta escala se derivó de una cohorte de 1818 pacientes15 y se validó posteriormente en una cohorte retrospectiva de 827 pacientes13. El nomograma de Viena utiliza como variables el sexo, localización de la ETV (EP, TVP proximal o distal), y dímero D tras la retirada del tratamiento anticoagulante. Esta escala se derivó de una cohorte de 925 pacientes16 y se validó posteriormente en un trabajo con 904 pacientes provenientes de datos de siete estudios17. En el nomograma de Vienna se debe realizar el cálculo de dicha escala para cada uno de los pacientes y posteriormente dividir la muestra en cuatro cuartiles (Q), definiendo como de bajo y alto riesgo a los pacientes en Q1 y Q2-4, respectivamente16.
Análisis estadísticoLas variables continuas se expresan como media y desviación estándar (DE) y las variables categóricas por frecuencia y porcentaje. La validación externa de los dos modelos se realizó en términos de calibración y discriminación24–26. La calibración la realizamos mediante la comparación de eventos observados vs. esperados. Los datos esperados los obtuvimos de las publicaciones previas de la derivación de la escala DASH15 y Viena16. La discriminación de los modelos la evaluamos por el grado en el que el modelo distingue entre los individuos que tienen ETV recurrente frente a los que no. Para ello analizamos el porcentaje de pacientes identificados como de bajo riesgo y utilizamos el área bajo la curva (ROC). Analizamos los intervalos de confianza mediante el método exacto de Clopper-Pearson. Analizamos el tiempo hasta la recurrencia mediante el método de Kaplan-Meier (prueba de Mantel-Cox Log Rank). Consideramos significación estadística para una p < 0,05. Los análisis estadísticos se llevaron a cabo mediante el paquete IBM SPSS Statistics v20 software.
Cálculo del tamaño de la muestraTal y como sugiere el panel de expertos, calculamos un tamaño de la muestra suficiente para que el riesgo de ETV recurrente en el grupo de bajo riesgo fuese < 5% al año para poder demostrar que en los pacientes con ETV no provocada se podía suspender el tratamiento anticoagulante de forma segura12. Para identificar diferencias significativas asumimos una tasa de ETV recurrente al año del 5% en el grupo de bajo riesgo y del 14% en el grupo de alto riesgo. Para un nivel de seguridad del 95% (1-α), con un poder estadístico del 80%, el tamaño de la muestra mínimo calculado fue de 165 pacientes.
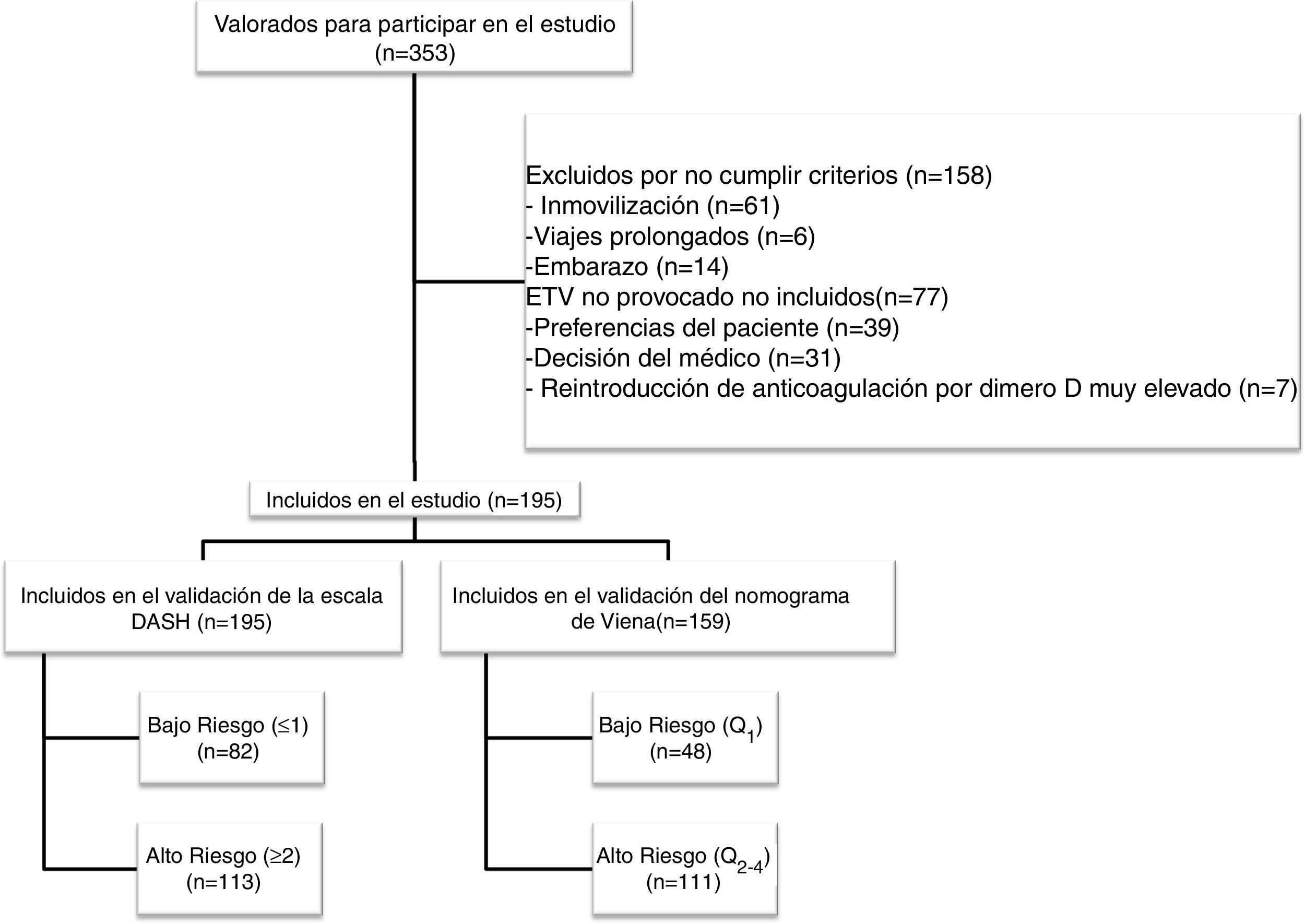
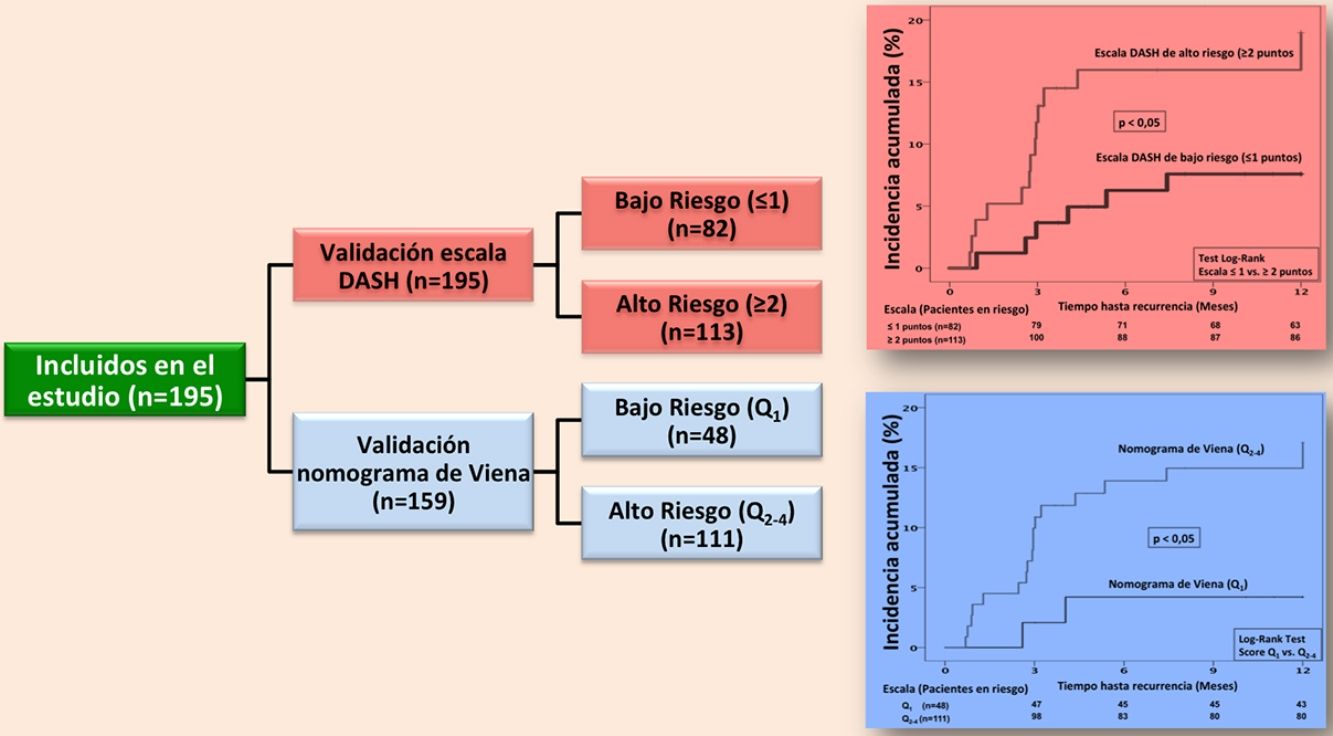
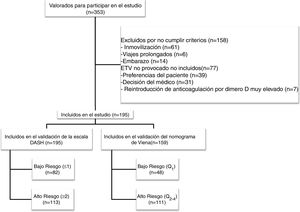
ResultadosDurante el periodo de estudio evaluamos a 353 pacientes, de los cuales 195 cumplieron los criterios de inclusión (diagrama de flujo, figura 1). Todos los pacientes eran caucásicos, con una edad media (+/- desviación estándar [DE]) de 53,5 (+/- 19) años y un predominio de mujeres (57%). La forma de presentación de la ETV fue: TVP (75,4%), EP (14,9%), y TVP con EP (9,7%). El 7,2% (n=14) de los pacientes tenían antecedentes familiares de ETV y el 7% (n=11) tuvieron ETV previo. Entre los pacientes con antecedente personal de ETV (n=11), en el 80% de los casos (n=9) la ETV fue secundaria, y el 20% (n=2) tuvieron una ETV no provocada pero con alto riesgo de sangrado en los que se planificó retirada de tratamiento anticoagulante. La tabla 1 muestra las características principales de los pacientes incluidos.
Características de los pacientes incluidos en el estudio
| Variables | Pacientes (n=195) |
|---|---|
| Edad, media (DE) | 53,5 (19,2) |
| Sexo femenino, n (%) | 112 (57,4) |
| Antecedentes personales, n (%) | 11 (7,0) |
| Antecedentes familiares de ETV, n (%) | 14 (7,2) |
| Hipertensión arterial, n (%) | 57 (29,2) |
| Diabetes, n (%) | 18 (9,2) |
| Dislipemia, n (%) | 37 (19,0) |
| Cardiopatía isquémica, n (%) | 5 (2,6) |
| Ictus, n (%) | 1 (0,5) |
| Insuficiencia cardiaca congestiva, n (%) | 3 (1,5) |
| Enfermedad pulmonar crónica, n (%) | 14 (7,2) |
| Síndrome de apneas hipopneas durante el sueño | 4 (2,1) |
| Enfermedad neurológica degenerativa, n (%) | 2 (1) |
| Demencia, n (%) | 4 (2,1) |
| Conectivopatías, n (%) | 10 (5,1) |
| Enfermedad inflamatoria intestinal | 4 (2,1) |
| Hepatopatía, n (%) | 3 (1,5) |
| Patología articular, n (%) | 31 (15,9) |
| Tratamiento hormonal, n (%) | 36 (18) |
| Síndrome varicoso, n (%) | 35 (17,9) |
| Tipo de ETV | |
| TVP, n (%) | 147 (75,4) |
| EP, n (%) | 29 (14,9) |
| TVP y EP, n (%) | 19 (9,7) |
| Localización TVP | |
| Proximal, n (%) | 135 (91,2) |
| Distal, n (%) | 13 (8,8) |
| Trombofilia conocida | |
| Factor V Leiden, n (%) | 17 (8,7) |
| Gen de protrombina, n (%) | 15 (7,7) |
| Trombosis residual, n (%) | 46 (23,6) |
| Síndrome postrombótico, n (%) | 45 (23,1) |
| Hemorragia durante el tratamiento anticoagulante, n (%) | 10 (5,2) |
| Duración del tratamiento anticoagulante (meses), media (DE) | 14,1 (11,9) |
| Seguimiento (meses) desde la retirada de la anticoagulación, media (DE) | 48,3 (35,4) |
DE: desviación estándar; EP: embolia de pulmón; ETV: enfermedad tromboembólica venosa; TVP: trombosis venosa profunda.
La hemorragia fue el motivo para plantear la suspensión del tratamiento anticoagulante en un 5,2%. El tiempo medio (+/- DE) de anticoagulación y el tiempo medio de seguimiento tras suspender el tratamiento anticoagulante fue de 14,1 (+/- 11,9) y 48,3 (+/- 35,4) meses, respectivamente.
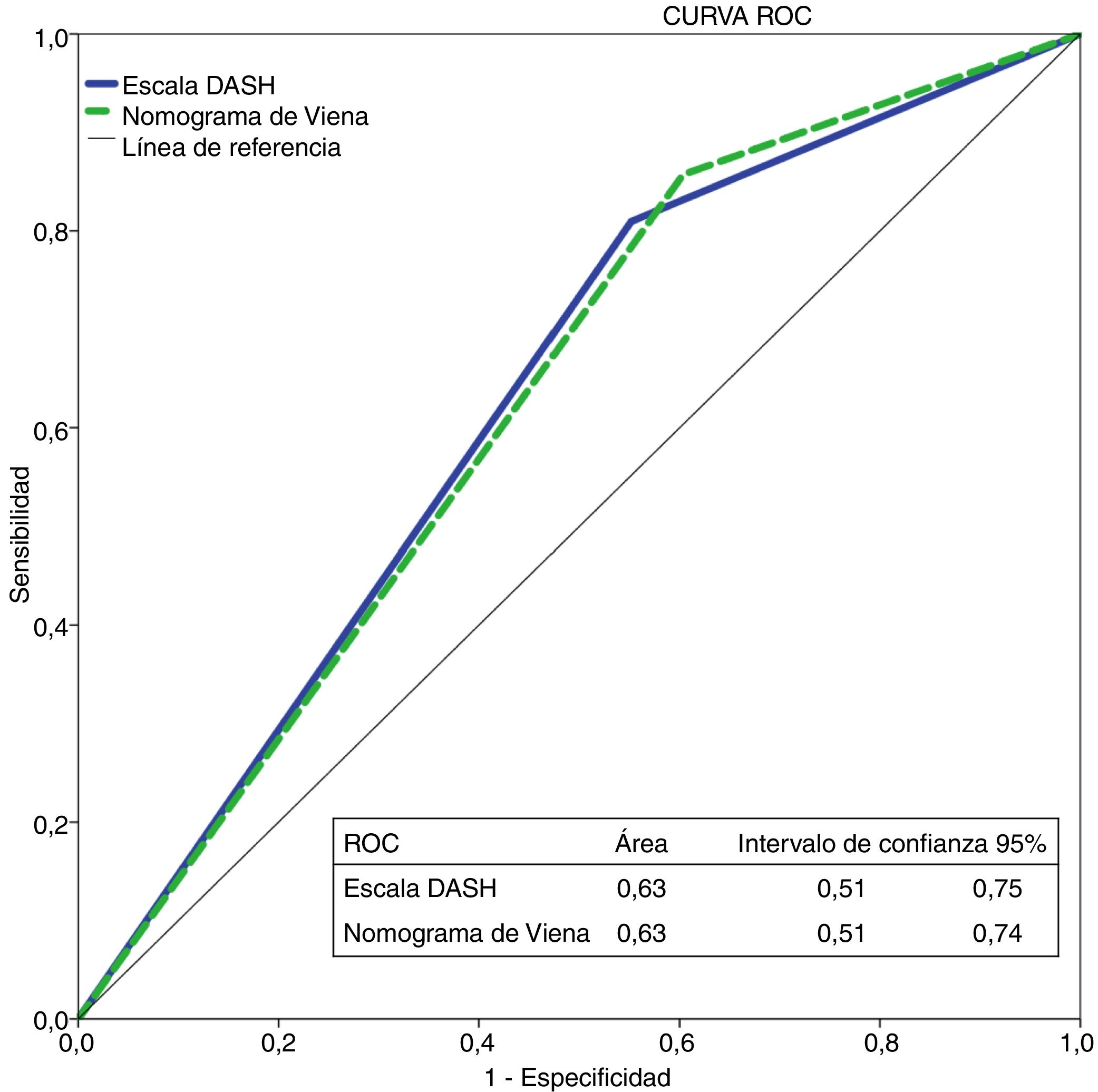
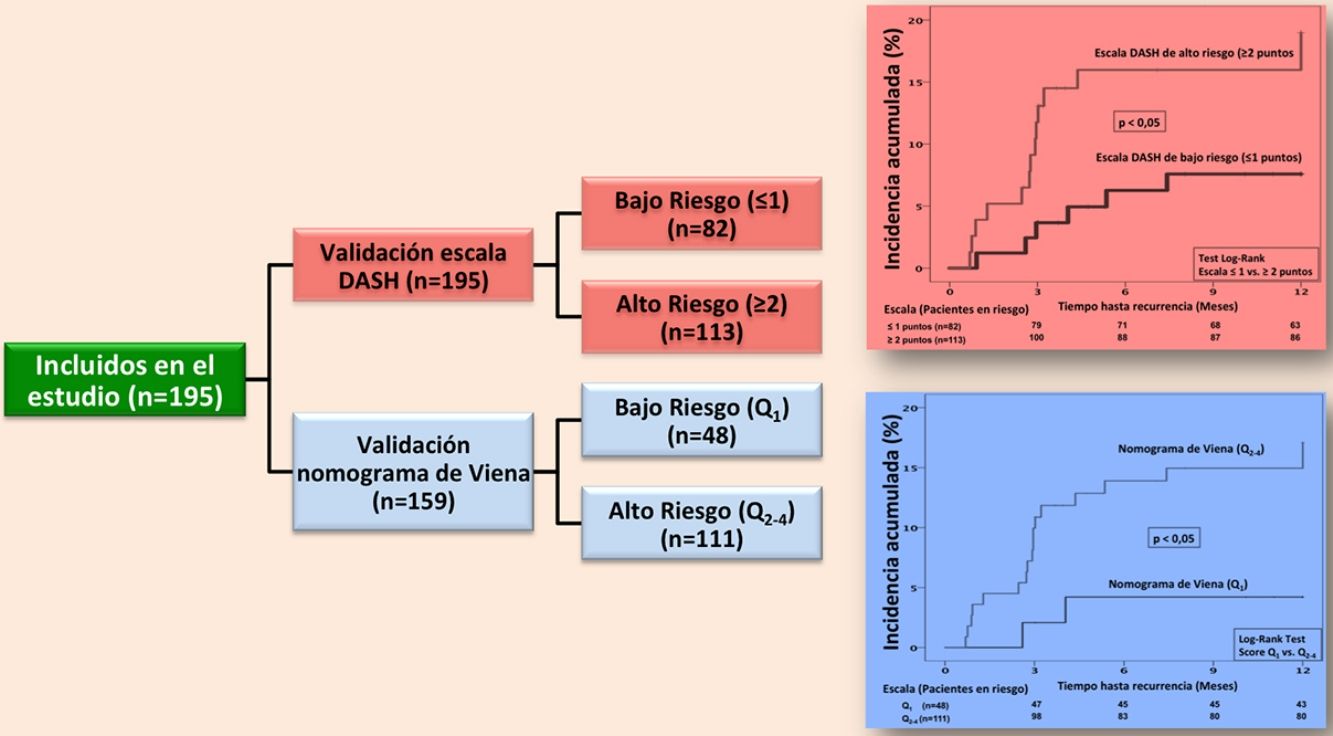
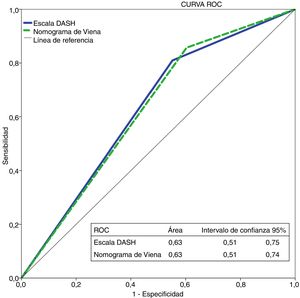
Con la escala DASH evaluamos los 195 pacientes, y el porcentaje de pacientes catalogados como de bajo y alto riesgo fue del 42% y del 58%, respectivamente. Para aplicar el nomograma de Viena excluimos a los pacientes que realizaban tratamiento hormonal (n=36) analizando una muestra final de 159 pacientes, clasificando como de bajo vs. alto riesgo al 30% y 70%, respectivamente. La figura 2 muestra la curva ROC evaluando la probabilidad de cada una de las escalas de predecir ETV recurrente a 12 meses.
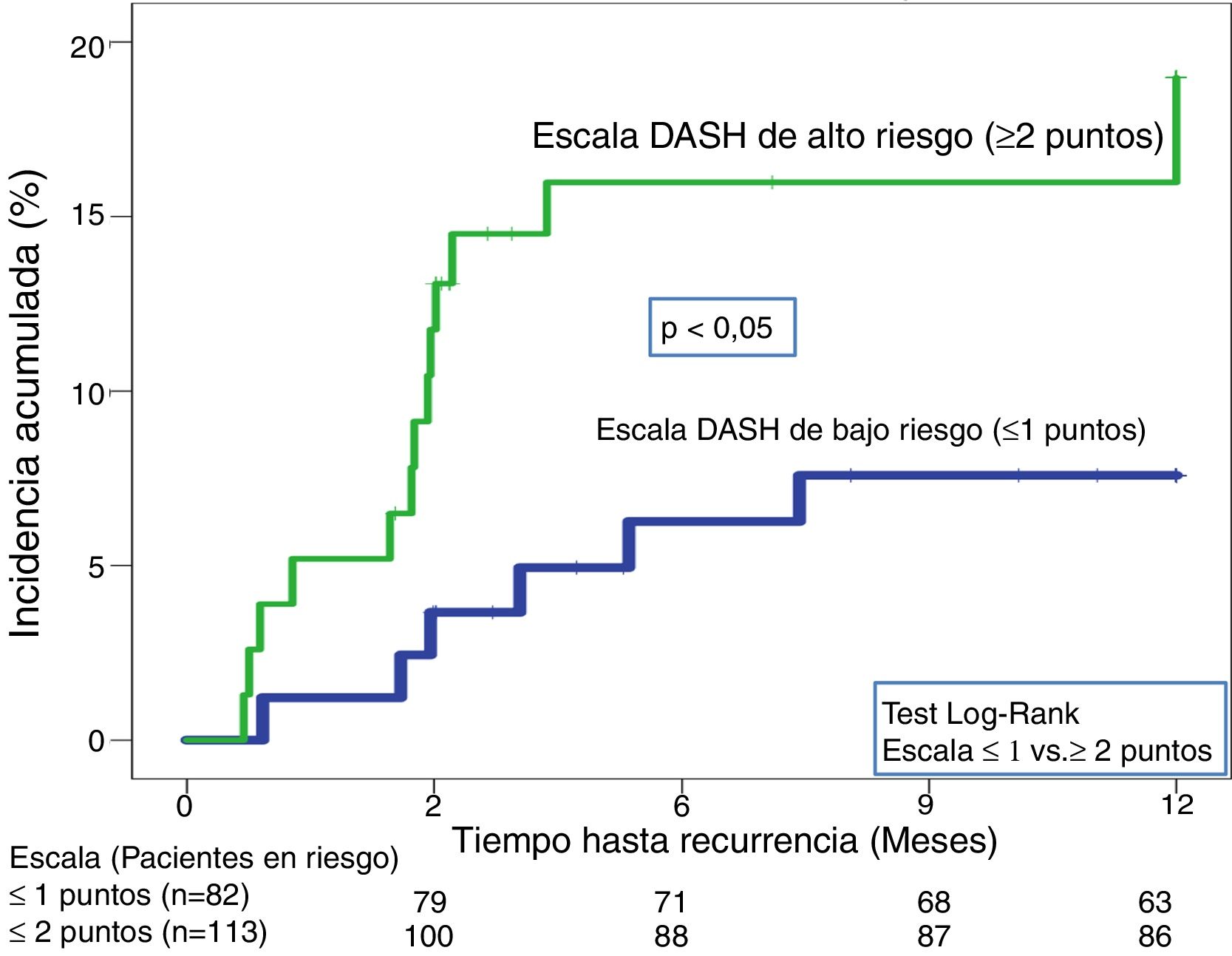
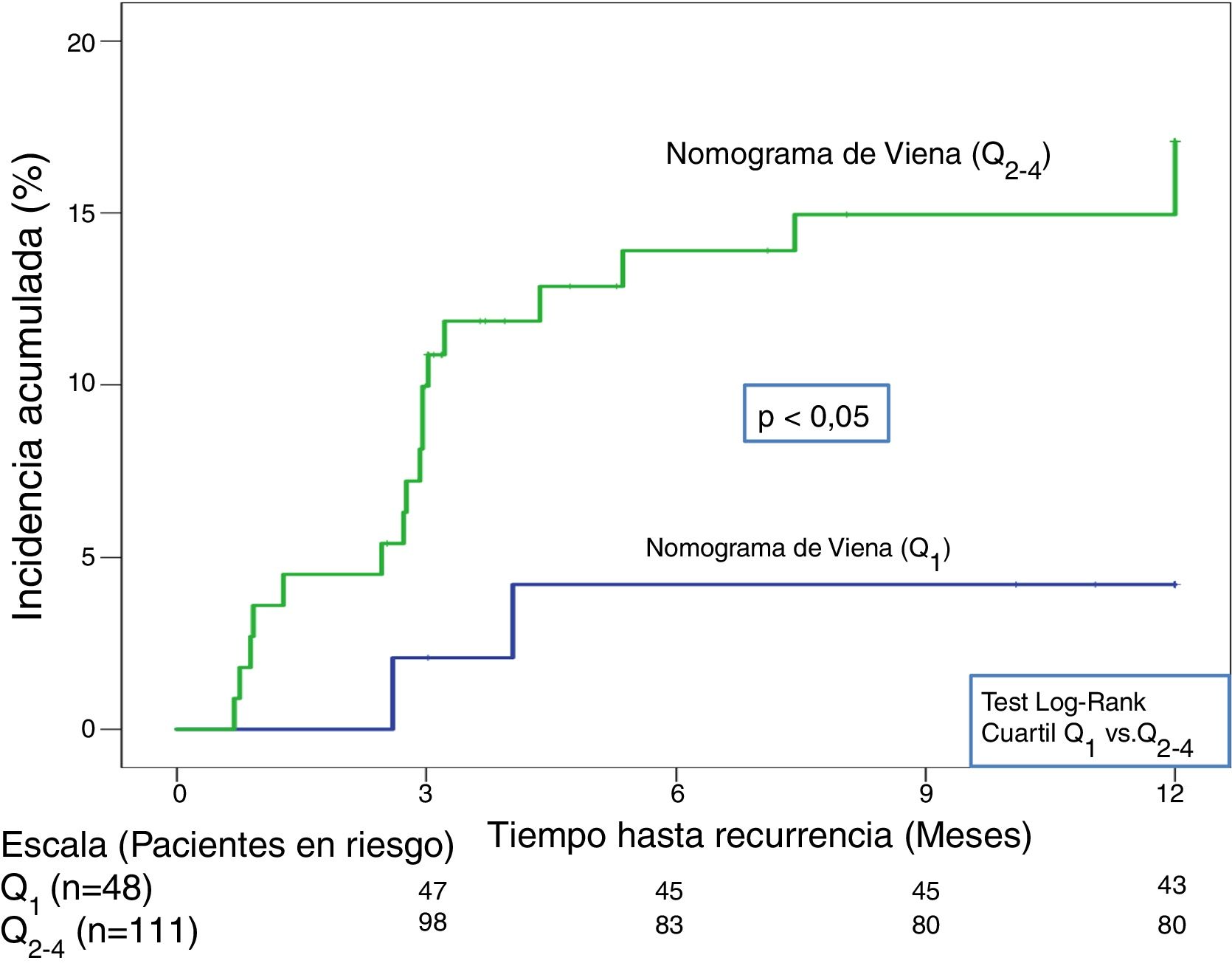
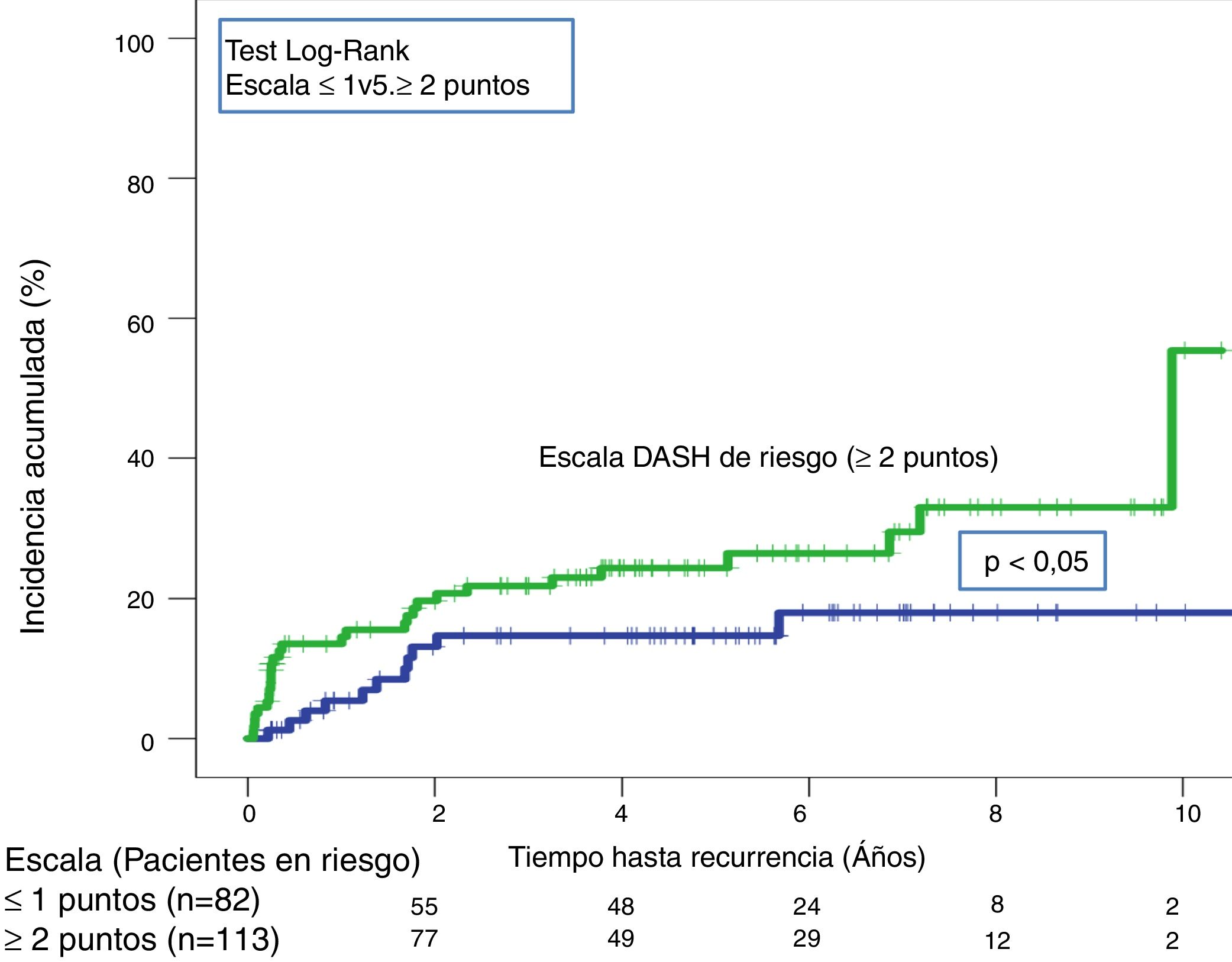
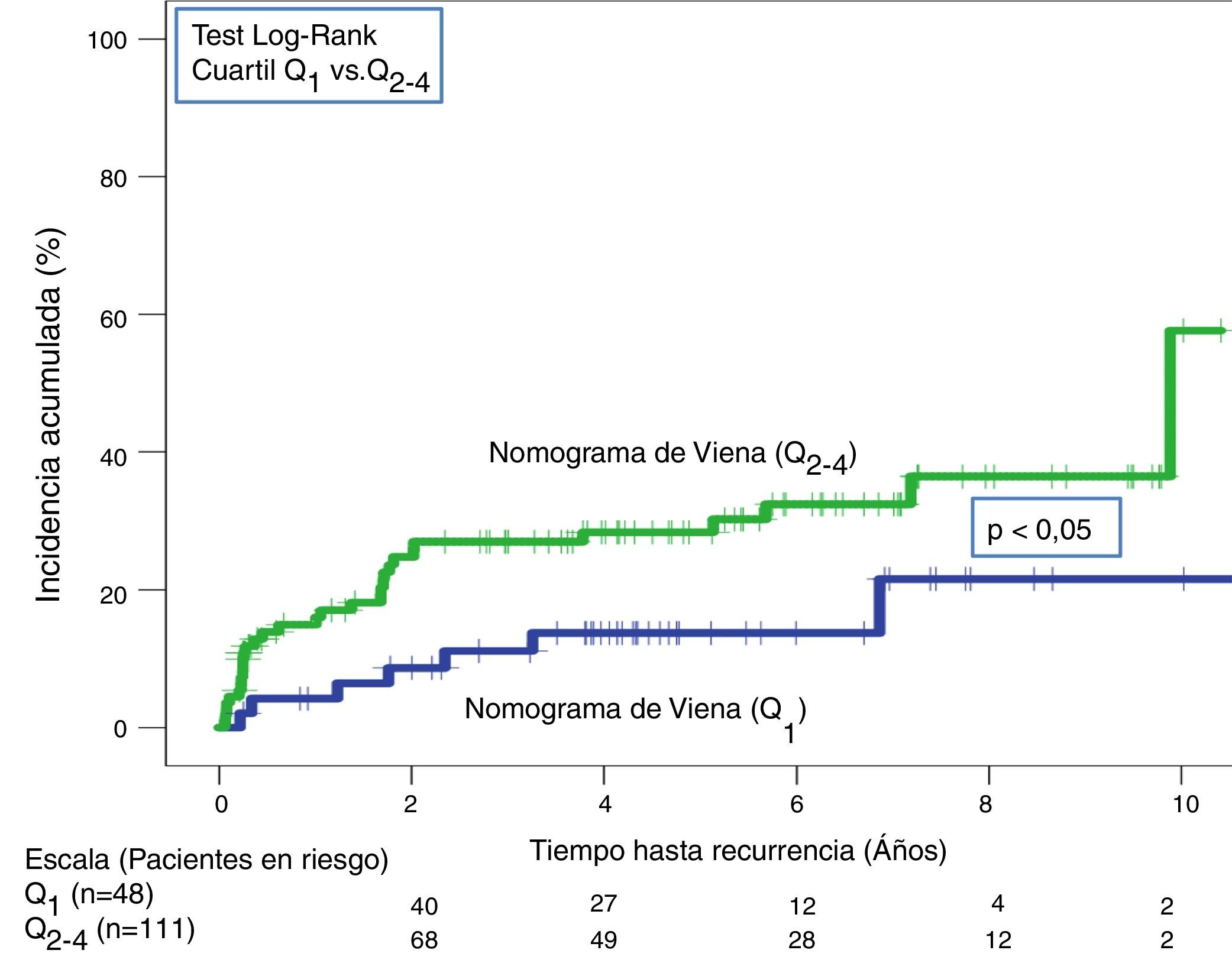
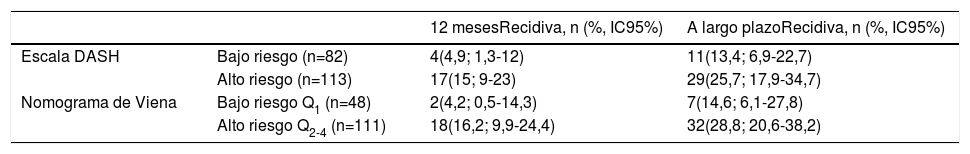
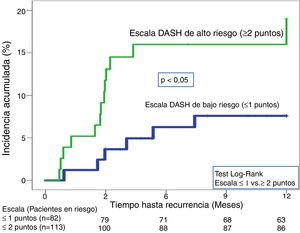
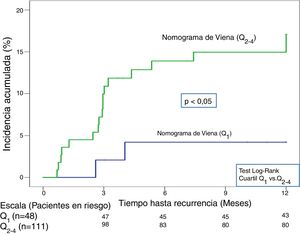
En la validación de la escala DASH (n=195), hubo 21 recurrencias (10,8%, IC95%: 6,8-16%) durante los 12 primeros meses tras la retirada del tratamiento anticoagulante. En el 95% de los casos (n=20) las recurrencias fueron en forma de TVP. La incidencia acumulada en los pacientes de bajo y alto riesgo fue del 4,9% (IC95%: 1,3-12%) y del 15% (IC95%: 9-23%), respectivamente (p <0,05) (fig. 3). En la validación del nomograma de Viena (n=159), hubo 20 recurrencias (12,6%, IC95%: 7,9-18,8%) en los 12 meses tras la retirada del tratamiento anticoagulante. Una vez realizado el nomograma de Viena dividimos la muestra por cuartiles (Q), observando una incidencia acumulada del 4,2% (IC95%: 0,5-14%) de recurrencias en Q1 vs. 16,2% (IC95%: 9,9-24,4%) en Q2-4 (p < 0,05) (fig. 4). Realizamos la calibración de ambos modelos comparando la incidencia de ETV recurrente observada y la incidencia predicha en las cohortes de validación (tabla 2).
Calibración de la validación. Características basales en comparación con la cohorte de derivación
| Incidencia acumulada observada a 12 mesesRecidiva, n (%, IC95%) | Incidencia acumulada esperada a 12 meses *Recidiva, n (%, IC95%) | ||
|---|---|---|---|
| Escala DASH | Bajo riesgo (≤1) (n=82) | 4(4,9; 1,3-12) | 20(3,6; 2,2-5,6) |
| Alto riesgo (≥2) (n=113) | 17(15; 9-23) | 20(7,2; 4,4-10,9) | |
| Nomograma de Viena | Bajo riesgo (Q1) (n=48) | 2(4,2; 0,5-14,3) | 13(5,1; 2,7-9,9) |
| Alto riesgo (Q2-4) (n=111) | 18(16,2; 9,9-24,4) | 110(15,2; 12,7-18) |
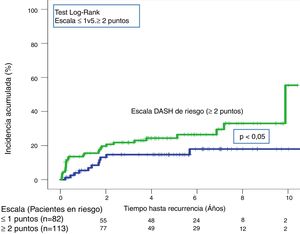
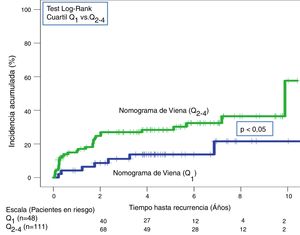
A lo largo de todo el seguimiento (mediana de 3,9 años; rango intercuartílico: 1,1-6,3 años) hubo 40 recurrencias (20,5%; IC 95%: 15,1-26,9). Tras aplicar la escala DASH, las recurrencias en los pacientes de bajo y alto riesgo fueron del 13,4% (IC95%; 6,9-22,7%) y del 25,7% (IC95%: 17,9-34,7%), respectivamente (p < 0,05) (tabla 3, fig. 5). Tras aplicar el nomograma de Viena las recurrencias en los pacientes de bajo y alto riesgo fue del 14,6% (IC95%: 6,1-27,8%) y del 28,8% (IC95%: 20,6-38,2%), respectivamente (p < 0,05) (fig. 6).
Recidiva en pacientes estratificados según Escala DASH y nomograma de Viena
| 12 mesesRecidiva, n (%, IC95%) | A largo plazoRecidiva, n (%, IC95%) | ||
|---|---|---|---|
| Escala DASH | Bajo riesgo (n=82) | 4(4,9; 1,3-12) | 11(13,4; 6,9-22,7) |
| Alto riesgo (n=113) | 17(15; 9-23) | 29(25,7; 17,9-34,7) | |
| Nomograma de Viena | Bajo riesgo Q1 (n=48) | 2(4,2; 0,5-14,3) | 7(14,6; 6,1-27,8) |
| Alto riesgo Q2-4 (n=111) | 18(16,2; 9,9-24,4) | 32(28,8; 20,6-38,2) |
Hemos validado retrospectivamente, en nuestro medio, la escala DASH y el nomograma de Viena. Estas escalas nos permiten identificar a los pacientes con ETV no provocado con bajo riesgo de ETV recurrente para poder suspenderles el tratamiento anticoagulante de forma segura tras realizar al menos 3 meses de tratamiento anticoagulante. Las implicaciones de estos resultados, permiten optimizar el tiempo de tratamiento anticoagulante, pudiendo ser suspendido con seguridad en aquellos pacientes clasificados como de bajo riesgo de recidiva tal y como demuestran estudios previos11–13.
El planteamiento de la suspensión del tratamiento anticoagulante en los pacientes con ETV no provocado es un tema muy debatido y controvertido12,27–29. En los pacientes con ETV no provocado las guías recomiendan tratamiento anticoagulante indefinido si el riesgo de sangrado no es alto6,30. La sociedad internacional de trombosis y hemostasia (ISTH) sugiere que es apropiado parar el tratamiento anticoagulante en subgrupos de pacientes en los que el riesgo de ETV recurrente a un año sea menor al 5%12. Nuestro trabajo ha validado las dos escalas en nuestra población, con una incidencia en el grupo de bajo riesgo por debajo del 5%. Dado que la escala DASH identifica a más pacientes como de bajo riesgo que el nomograma de Viena (42% vs. 30%) y que la escala es más fácil de emplear, sería la más recomendable de utilizar.
El estudio tiene varias fortalezas. Primero, analiza en la misma cohorte de pacientes las dos escalas, permitiendo no solo validarlas, sino permitiendo identificar cuál de ellas incluye a más pacientes en el grupo de bajo riesgo, que será el grupo que se beneficie de suspender el tratamiento anticoagulante de forma segura. Desde nuestro conocimiento, este es el único estudio que valida estas escalas en España, lo que le da validez externa a las mismas y facilita su aplicabilidad en nuestro medio (término conocido como transportabilidad). Segundo, las características clínicas de nuestros pacientes son similares a las publicadas previamente en otras series. En nuestra población la edad media fue de 54+/-19 años y el los trabajos previos la edad oscilaba entre 54-68 años, dependiendo del estudio13,15–17. Tercero, todas las recurrencias estuvieron documentadas de forma objetiva y fueron revisadas por un comité independiente (SMR y LJP).
El estudio tiene varias limitaciones. Primera, es un estudio retrospectivo con las limitaciones que ello conlleva, pero sin embargo, analiza a pacientes consecutivos no seleccionados con ETV. Además, la validación previa de la escala DASH y la de Viena fueron también en series retrospectivas de pacientes13,17. Hay que tener en cuenta que en algunos casos ha podido haber un sesgo de selección, dado que en aquellos pacientes con alto riesgo de ETV recurrente el clínico no suspendió el tratamiento anticoagulante, aunque esta limitación la comparten este trabajo y los publicados previamente por su carácter retrospectivo13,17. En nuestro trabajo documentamos el número de pacientes que prefirieron continuar con el tratamiento anticoagulante (14%), aquellos casos en los que el clínico decidió mantener tratamiento (11%) y pacientes en los que se decidió reintroducir tratamiento tras apreciar dímeros D muy elevados (3%). De forma similar, en el trabajo de validación de la escala de Viena, de una base de datos de 1818, solo 904 (50%) pudieron formar parte de la validación externa de la escala17. En la validación externa de la escala DASH ni siquiera se comenta o se aporta información de los pacientes no analizados o excluidos13. Es cierto que metodológicamente es mejor que la validación externa se realice de forma prospectiva, pero desde el punto de vista práctico pretendíamos conocer la aplicabilidad y validez de ambas escalas en nuestro medio. Segunda, no hemos analizado otras escala como la Men-HERDOO231, que evalúa el sexo (todos los hombres continúan con la anticoagulación), hiperpigmentación, edema o enrojecimiento en la pierna afecta, el dímero D durante el tratamiento anticoagulante y la edad. Aunque está validada de forma prospectiva tiene como limitaciones la subjetividad de los signos en el miembro afecto y que todos los hombres deben continuar el tratamiento anticoagulante de forma indefinida, característica que no ocurre con las otras dos escalas. Nosotros no pudimos validar esta escala en nuestro medio por no disponer de los datos de hiperpigmentación, edema o enrojecimiento en la pierna afecta. Tercera, todos eran de raza caucásica, lo que limita potencialmente la generalización a otras razas. Cuarto, desconocemos el papel que pueden tener los anticoagulantes orales de acción directa a la hora de plantear la suspensión del tratamiento anticoagulante, ya que estos fármacos han demostrado un mejor perfil de seguridad, por lo que algunos expertos plantean que si el riesgo de sangrado es mayor del 3%-año se debe suspender el tratamiento, y si es menor del 3%-año se debería plantear la suspensión si el paciente es de bajo riesgo de ETV recurrente tras evaluar la escala28. Aun así este planteamiento debería ser evaluado en un ensayo clínico. Quinto, habría sido interesante realizar un análisis por subgrupos en función del sexo o de la localización de la ETV. Lamentablemente, la muestra se calculó para poder validar ambas escalas, y nuestro trabajo no tiene suficiente potencia para poder realizar subanálisis.
ConclusiónNuestro estudio valida la escala DASH y el nomograma de Viena en nuestra población. El modelo predictivo DASH sería el más aconsejable tanto por su sencillez como por la capacidad de identificar a más pacientes de bajo riesgo frente al nomograma de Viena (42% vs. 30%).
Conflicto de interesesLuis Jara Palomares ha recibido honorarios como ponente o en concepto de traslado y alojamiento por parte de Rovi, PFIZER, Menarini, Leo-Pharma y GSK, independientemente del manuscrito publicado. María Isabel Asensio Cruz ha recibido honorarios en concepto de traslado y alojamiento por parte de Rovi, Novartis y Teva, independientemente del manuscrito publicado. Raquel Morillo Guerrero ha recibido honorarios como ponente o en concepto de traslado y alojamiento por parte de PFIZER, Menarini y GSK, independientemente del manuscrito publicado. El resto de los autores no declaran ningún conflicto de intereses.