Existen algunas referencias en la literatura sobre la posible relación entre la infección por virus SARS-CoV-2 e infección fúngica1–3. Presentamos dos pacientes con COVID-19 y aspergilosis pulmonar asociada.
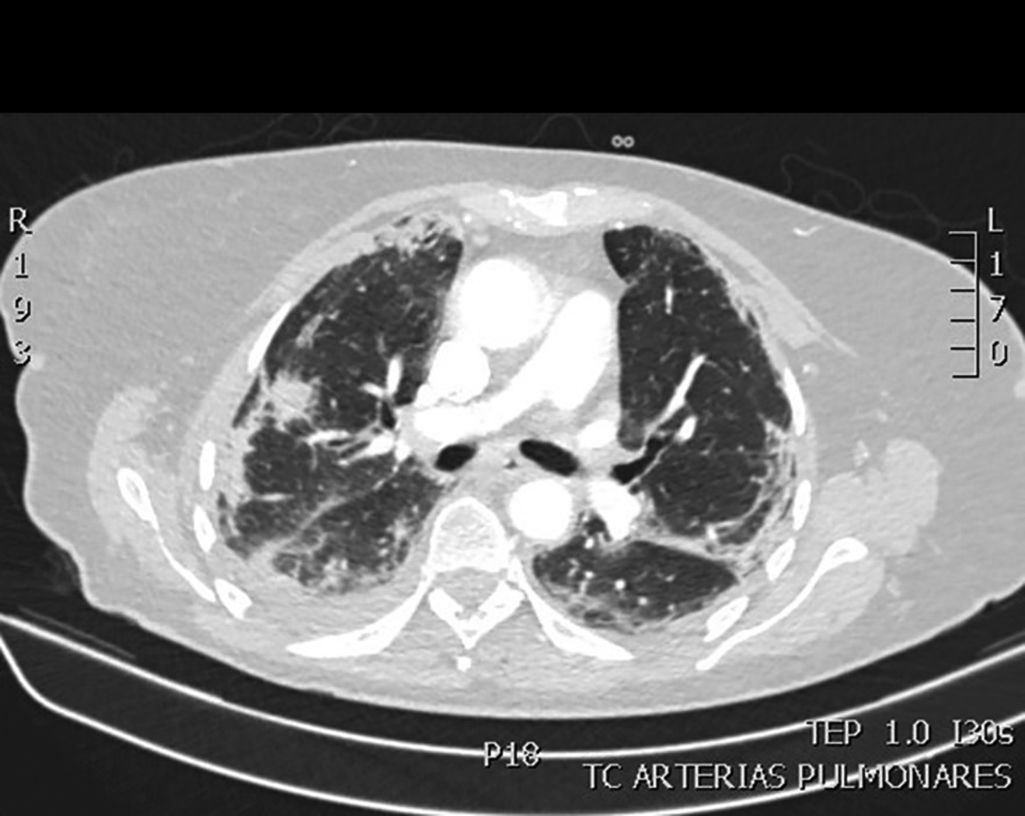
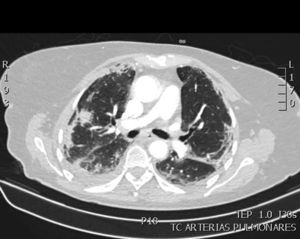
Mujer de 78 años con hiperparatiroidismo que ingresa por fiebre, mialgias y tos irritativa con imágenes radiológicas periféricas en vidrio deslutrado bilaterales que se confirman en TAC de tórax (fig. 1). La reacción en cadena de la polimerasa en exudado nasofaríngeo fue positiva para SARS-CoV-2 con 9.684.116 copias iniciándose tratamiento con hidroxicloroquina, ceftriaxona, azitromicina y lopinavir/ritonavir. En las siguientes 48 h presentó deterioro gasométrico y progresión de las lesiones radiológicas e ingresó en la Unidad de Cuidados intensivos (UCI). Precisó ventilación mecánica invasiva y tratamiento con tocilizumab, sin cambios en la pauta antibiótica. En el cuarto día de ingreso en UCI se realizó broncoscopia con aislamiento en aspirado bronquial (BAS) y lavado broncoalveolar (LBA) (cultivo en agar sabouraud) de múltiples colonias de Aspergillus fumigatus(A. fumigatus) y Aspergillus nidulans con galactomanano en LBA positivo. Se realizó la prueba de Aspergillus-LFD (lateral flow device) que fue positiva. De forma precoz se inició tratamiento con anfotericina B, evolucionando de forma favorable siendo posible la extubación a los 8 días. Pasó a planta de hospitalización donde continuó tratamiento con voriconazol con buena evolución clínica.
Paciente varón de 83 años con HTA, cardiopatía isquémica y enfermedad renal crónica que ingresa por fiebre y disnea con infiltrados radiológicos en bases. En la analítica se objetivó leucopenia con linfopenia y dímero-D de 1259 ng/mL y en TAC de tórax opacidades bilaterales en vidrio deslustrado. La reacción en cadena de la polimerasa en exudado nasofaríngeo fue positiva con 399.623 copias de SARS-CoV-2. Se inició tratamiento con hidroxicloroquina, ceftriaxona, azitromicina y lopinavir/ritonavir. En las siguientes 48 h el paciente sufrió empeoramiento clínico con progresión radiológica y deterioro del intercambio gaseoso iniciándose tratamiento con soporte ventilatorio (CPAP). En el cultivo de esputo micológico se aislaron múltiples colonias de A. fumigatus confirmándose dicho aislamiento en BAS en el que el galactomanano y la prueba Aspergillus-LFD fueron positivas. Se inició tratamiento con anfotericina B y posteriormente voriconazol con buena evolución clínica del paciente.
El síndrome respiratorio agudo severo secundario a coronavirus (SARS-CoV-2) es una enfermedad con mortalidad y morbilidad elevada. Las complicaciones más frecuentemente descritas son el distrés respiratorio agudo grave y posibles complicaciones trombóticas. Se desconoce la frecuencia e importancia de las coinfecciones. En algunas publicaciones se observan al menos un 10% de coinfecciones en pacientes hospitalizados por COVID-19 con distrés respiratorio agudo y se han descrito aislamientos de Aspergillus4,5. Recientemente se ha descrito un caso de un paciente que falleció con COVID-19 y aspergilosis pulmonar invasora (API)2. Nosotros hemos observado aislamiento de Aspergillus con galactomanano positivo en LBA y/o BAS con prueba de Aspergillus-LFD positiva en los dos pacientes descritos, a los pocos días de ingreso por COVID-19, lo que permitió iniciar el tratamiento antifúngico de forma precoz.
Se ha descrito una incidencia de API en el 19% de pacientes con influenza A y B graves ingresados en la UCI, frente a un 5% de pacientes con neumonía severa de otra naturaleza6. Es posible que por un mecanismo similar al que ocurre en la infección por influenza, la COVID-19 pueda representar un factor de riesgo de infección fúngica. El virus SARS-CoV-2 produce un daño severo a nivel del tejido pulmonar con importantes lesiones alvéolo-intersticiales que hacen que sea más probable la aparición de coinfecciones que se adquieren por vía inhalatoria como la enfermedad fúngica y la infección por Pneumocystis jirovecii7. A esto hay que añadir la leucopenia severa causada por el virus con un descenso importante en el número de linfocitos CD4 y CD8 y elevación de interleucinas (IL-2R, IL-6, IL-10, TNF-alpha) y otros marcadores inflamatorios8 y el tratamiento en algunos casos con corticoides a dosis elevadas e inmunosupresores. En el estudio publicado por Yang et al.9, se hace referencia a la coinfección de COVID-19 con otros patógenos entre los que destacan Aspergillus flavus(A. flavus) y A. fumigatus en uno de los pacientes descritos. En el trabajo de Lescure et al. describen un paciente con aislamiento de A. flavus10. Nuestro primer paciente cumple criterios de API siendo el galactomanano y la prueba Aspergillus-LFD en LBA positivas. El segundo paciente puede plantear dudas sobre el diagnóstico de API ya que tanto el cultivo como el galactomanano y Aspergillus-LFD han sido realizados en BAS, si bien la positividad del Aspergillus-LFD indicaría infección activa por el hongo, lo que apoyaría más la probabilidad de API. En ninguno de los pacientes se realizó la determinación de galactomanano en sangre.
En relación con la patogénesis, el virus produciría rotura de la mucosa respiratoria y secundariamente alteración del aclaramiento mucociliar11,12. Esto permitiría a las conidias de Aspergillus infectar el tracto respiratorio evitando la acción de los macrófagos alveolares. Se añade además una alteración importante en los niveles pulmonares y sistémicos de citoquinas dando lugar a un estado de deficiencia inmune13,14. En relación con el uso de esteroides, este se ha relacionado con la aparición de API en pacientes con gripe15, sin embargo los pacientes descritos en este trabajo no han recibido esteroides sistémicos en ningún momento de la evolución clínica. Tampoco observamos un claro factor de riesgo en relación con alteración estructural pulmonar, apareciendo en muchos casos la COVID-19 en pacientes que no presentan un daño pulmonar previo y por tanto tampoco tendrían este factor de riesgo para presentar enfermedad por Aspergillus.
En los hallazgos observados en la TAC de tórax, ambos pacientes presentan hallazgos típicos de neumonía por SARS-CoV-2 objetivándose alteraciones en el parénquima pulmonar con patrón en vidrio deslustrado bilateral (fig. 1), siendo difícil diferenciar el patrón visible en relación con el virus, del que podría ocurrir en relación con la infección por Aspergillus.
El interés de esta carta científica es llamar la atención sobre la infección vírica por SARS-CoV-2 y su posible coinfección pulmonar por Aspergillus. En los pacientes graves ingresados por neumonía producida por este virus, es importante realizar cultivos micológicos de muestras respiratorias con el fin de identificar coinfecciones y valorar la existencia de API de forma precoz e iniciar tratamiento. Por otra parte son pacientes que pueden beneficiarse de tratamiento con esteroides sistémicos a dosis elevadas y con inhibidores de la IL-6 (tocilizumab) y por tanto será importante identificar aquellos pacientes con aspergilosis pulmonar para evitar complicaciones derivadas de estos tratamientos. En estos pacientes debe de realizarse un diagnóstico precoz y estrategias de tratamiento y deberían realizarse estudios multicéntricos para definir mejor la incidencia y evolución.