Este artículo está subvencionado con las ayudas de Red Gira-ISCIII-03/063 y Red Respira-ISCIII-RTIC-03/11.
Introducción
Los conceptos de neumonía que no responde y neumonía progresiva son términos de difícil definición y han dado lugar a diferentes enunciados que se han ido modificando con el tiempo. En ambos casos, estos conceptos hacen referencia a una mala respuesta terapéutica de la neumonía y que, en el caso de la neumonía progresiva, da lugar a una emergencia médica con implicaciones vitales para el paciente que obliga a un cambio muy rápido en la actitud diagnóstica y terapéutica.
La dificultad inicial para el clínico es decidir cuándo es el momento exacto en el que se enfrenta a una neumonía no resuelta o una neumonía progresiva, ya que el tiempo para definirlo ha sido utilizado de forma arbitraria por los diversos autores1. El conocimiento de la clínica natural de la neumonía adquirida en la comunidad (NAC), de la evolución de sus síntomas y la velocidad de su resolución radiológica ha servido de base para poder definir estos términos. Así, Fein et al, en 1987, definían la neumonía no resuelta mediante criterios clínicos como un síndrome clínico en el que los infiltrados focales se asocian con signos de infección pulmonar aguda y no se resuelve en el período esperado. En 1991, Kirtland y Winterbauer2 añadieron criterios radiográficos; de esta forma, se definió la neumonía de lenta resolución como una mejoría de la imagen radiológica menor del 50% en 2 semanas o incompleta a las 4 semanas. Fein y Feinsilver, con ambos criterios, realizaron una nueva definición que incluía un mínimo de 10 días de tratamiento antibiótico y una falta de resolución de los infiltrados radiográficos en este período a pesar del tratamiento antibiótico administrado.
Para el concepto de neumonía progresiva hay menos definiciones. En las últimas recomendaciones de la ATS (2001) para el manejo de la neumonía adquirida en la comunidad3 se emplean como criterios clínicos para identificarla el deterioro clínico tras 24 h de tratamiento con un incremento en las imágenes radiográficas del 50%, y como fracaso terapéutico del tratamiento o falta de respuesta la ausencia de estabilidad clínica al tercer día sin coexistir factores conocidos de respuesta lenta, o respuesta en el día 7. Örtqvist et al4 establecieron una neumonía que no responde en un 6,5% de los pacientes, lo que se evidencia como un fracaso del tratamiento antibiótico intrahospitalario en las primeras 48-72 h. Para Arancibia et al5, la neumonía progresiva se define como el deterioro clínico con insuficiencia respiratoria que requiere ventilación mecánica o el shock séptico tras 72 h de tratamiento, y la neumonía que no responde cuando persiste la fiebre (> 38 ºC) con síntomas clínicos después de las primeras 72 h de tratamiento.
La incidencia de neumonía no está completamente establecida. Aproximadamente un 10% de pacientes hospitalizados no responde de forma adecuada al tratamiento empírico y otro 6% puede evolucionar como neumonía progresiva4,6. Arancibia et al5, en el conjunto de neumonías que no responden encuentran un 39% que evoluciona como neumonías progresivas. La incidencia de neumonía nosocomial no es mayor. Álvarez Lerma et al7 constatan un 36% de pacientes con carencia de respuesta clínica, y Crouch et al8 hasta un 60% en la neumonía asociada al ventilador (NAV).
La mortalidad en pacientes con NAC y neumonía que no responde alcanzó el 43%5, cifra 3 veces superior a la mortalidad global en pacientes hospitalizados (5-15%). Además, cuando la causa del fracaso terapéutico era consecuencia de una infección nosocomial, la mortalidad fue del 88%. De hecho, esta causa fue un factor predictor de la mortalidad, de forma independiente (riesgo relativo [RR] = 16,7; intervalo de confianza [IC] del 95%, 1,4-194), lo que no sucedía si la causa de fracaso era una infección primaria, una infección persistente u otros motivos. Pereira et al9, en otro grupo de neumonía nosocomial que no responde en pacientes ingresados en una unidad de cuidades intensivos (UCI) médica, encuentran una mortalidad global similar (43,4%), aunque en este estudio no se ajusta por otras variables de riesgo. En un trabajo finalizado recientemente, la mortalidad fue 5 veces superior en un grupo de pacientes con neumonía nosocomial (M. Loanas y A. Torres, comunicación personal).
Factores asociados a la resolución de la neumonía
En la desaparición de los síntomas y en la resolución radiográfica de la neumonía están implicados diversos factores relacionados con el huésped y el microorganismo causal.
Factores del huésped
La respuesta terapéutica esperable en una neumonía sería la desaparición de la fiebre entre 3 y 5 días y la mejoría de la leucocitosis al cuarto día, mientras que los crepitantes en la auscultación pulmonar persisten más de 7 días y, en último lugar, se constata la resolución de la condensación en la radiografía, ya que a las 4 semanas hasta un 40% de los pacientes presenta aún imágenes asociadas con esta afección3. A partir de los estudios clásicos, la mayoría realizados sobre sujetos hospitalizados, sabemos que la edad avanzada, el alcoholismo y la comorbilidad, como la diabetes mellitus, las cardiopatías y otras afecciones, retrasan la resolución de la NAC1,2,10,11.
La gravedad inicial de la presentación de la neumonía influye en su evolución posterior y en el pronóstico. Así, la gravedad inicial, medida como PSI o la escala de riesgo de Fine, graduada en 5 clases (I-V)12, que incluye 20 variables pronósticas combinadas (p. ej., edad, comorbilidad, alteraciones analíticas y radiológicas), se ha correlacionado con la rapidez de la resolución de los síntomas y signos. Halm et al13 encuentran que el número de días hasta la desaparición de la fiebre, la insuficiencia respiratoria y la normalización de las constantes vitales (frecuencia cardíaca, respiratoria y presión arterial) depende de la clase de riesgo inicial. Así, a mayor gravedad mayor es el número de días que se requiere hasta alcanzar la estabilidad clínica, que oscila entre 5 y 7 según los puntos de corte más o menos conservadores elegidos, y viceversa.
En las últimas normativas de la ATS3 se proponen 3 períodos para la aparición de la respuesta clínica, que pueden orientar al clínico en su evaluación de la respuesta terapéutica: el primero al inicio del tratamiento, el segundo comienza el tercer día, en el que se espera que el paciente alcance la estabilidad clínica, y el tercer período corresponde a la recuperación y la resolución de las alteraciones previas.
En una cohorte de individuos no inmunodeprimidos, que incluye pacientes hospitalizados y ambulatorios, se comprobó que la resolución radiográfica se obtiene en el 67% de los casos en 4 semanas, y el 73% en 6 semanas14. La resolución fue rápida en sujetos no fumadores y con NAC ambulatorias1,10,11; por el contrario, se encontró una correlación inversa con el número de lóbulos afectados en la radiografía y con la edad14. Algunos estudios previos ya habían demostrado la influencia de ciertos factores en la resolución de la clínica, como las NAC bacteriémicas, con afección multilobar. El uso de tratamiento esteroideo, incluso en tratamientos con pautas cortas, puede afectar negativamente la morbilidad y la mortalidad15.
La respuesta inflamatoria del huésped frente a la infección con producción local y sistémica de citocinas proinflamatorias se ha correlacionado con la gravedad inicial de la neumonía y su mortalidad. Las citocinas participan en la respuesta a la infección con una activación de células inmunes y el reclutamiento de monocitos y neutrófilos. Aunque estos mediadores tienen un efecto beneficioso en la respuesta del huésped, una producción excesiva puede ejercer un efecto deletéreo16-18. Así, los valores plasmáticos elevados de la interleucina (IL) 6 y el factor de necrosis tumoral (TNF) alfa se han correlacionado con una mayor mortalidad en la NAC y el síndrome de distress respiratorio agudo19. Algunos estudios recientes, realizados en pacientes con sepsis, sugieren que el equilibrio entre citocinas proinflamatorias y antiinflamatorias tienen su papel en el resultado18. Hasta la actualidad no se conoce la implicación de la respuesta local y sistémica de las citocinas en la neumonía que no responde o en la neumonía progresiva. Estudios preliminares realizados en pacientes tratados empíricamente por la neumonía adquirida en la UCI han encontrado que los valores séricos elevados de IL-6 el primer día constituyen un factor de riesgo independiente y predictor de la neumonía que no responde (A. Torres, comunicación personal). Es posible que una adecuada y equilibrada respuesta de las citocinas sea un factor clave que contribuya a la falta de respuesta, a pesar de un adecuado tratamiento antibiótico inicial. En un estudio piloto, Montón et al20 encontraron que el empleo de glucocorticoides en el tratamiento de la neumonía grave fue capaz de reducir la respuesta inflamatoria con una disminución de la IL-6 y el TNF, así como una menor mortalidad asociada.
Factores relacionados con el microorganismo causal
En la historia natural evolutiva de la NAC los microorganismos causales desempeñan un papel importante; los más frecuentes son Streptococcus pneumoniae, Mycoplasma pneumoniae, L. pneumophila, C. pneumoniae y bacilos gramnegativos, y la relación que establecen con el huésped determinan ciertas peculiaridades en la resolución de los síntomas y los signos radiográficos. El S. pneumoniae es el microorganismo causal mas frecuente y el que aún provoca más muertes por NAC. Su evolución depende en gran medida de la interrelación con las características del huésped. Así, en pacientes ancianos debilitados, con comorbilidad e inmunodeprimidos tiene un peor pronóstico y una resolución más lenta. A partir de los estudios clásicos conocemos que entre 8 y 10 semanas la desaparición de la imagen es completa en el 90% de los pacientes. Sin embargo, esta resolución también está retrasada en las NAC con bacteriemia y afección de varios lóbulos. Los factores de riesgo asociados al retraso en la resolución son la edad avanzada, la enfermedad pulmonar obstructiva crónica (EPOC), el alcoholismo y la neumonía multilobar. Por el contrario, en los individuos menores de 50 años la resolución de los infiltrados tiene lugar a las 12 semanas en el 94% de los casos.
La Legionella sp. es causa del 1-8% de NAC y algo superior entre los pacientes que precisan ingreso en la UCI. La evolución de los síntomas en la NAC por Legionella sp. es más lenta o tórpida que con otros microorganismos típicos, incluso puede cursar como una neumonía progresiva y desencadenar una insuficiencia respiratoria grave y una progresión radiográfica21. La evolución radiográfica de este microorganismo puede mostrar un empeoramiento de la condensación y la diseminación al pulmón contralateral en un tercio de los pacientes22, sobre todo en las infecciones mixtas por más de una especie de Legionella; la normalización de las imágenes en 4 semanas sólo se consigue en el 12% de los casos, y a los 3 meses hasta un 40% de los pacientes pueden presentar lesiones residuales. En estudios previos se ha comprobado que el porcentaje de pacientes que presentan una resolución en las primeras 4 semanas (29-52%) es inferior que para el S. pneumoniae. En pacientes inmunodeprimidos, durante su evolución puede aparecer cavitación.
M. pneumoniae es el microorganismo causal de NAC más frecuente en los jóvenes, aunque puede afectar a todas las edades. Aunque en algunos casos puede evolucionar con progresión de la imagen radiológica, su evolución muestra una resolución de la imagen en el 98% de los casos en 8 semanas1,23. No obstante, si la NAC causada por este microorganismo tiene lugar sobre pacientes con alteración de las defensas, ésta puede cursar con una forma clínica más grave y de peor pronóstico.
Hay menos estudios realizados en pacientes con NAC por C. pneumoniae, pero su curso es más benigno que la NAC por S. pneumoniae y Legionella, y se ha constatado que el aclaramiento de la imagen radiográfica es completo a las 4-6 semanas. Kauppinen24, en un estudio que compara diversos parámetros evolutivos de NAC por Chlamydia sola o asociada a S. pneumoniae, demuestra un peor pronóstico, un mayor número de días de estancia y una resolución radiológica más lenta cuando la NAC es mixta. La información disponible sobre la evolución natural y la tasa de resolución radiológica para otros microorganismos menos frecuentes de NAC es menor.
La interacción entre el microorganismo causal, la carga bacteriana y el huésped puede desencadenar una determinada respuesta inflamatoria, con un papel primordial en la respuesta clínica y la resolución. Algunos autores han demostrado diferencias en la producción de citocinas según el microorganismo causal. Lieberman et al25 encuentran una mayor concentración sérica de IL-1 beta y IL-6 en la NAC causada por S. pneumoniae que respecto a la causada por Mycoplasma. Desde otra perspectiva, algunas hipótesis señalan la posibilidad de que los valores persistentes de citocinas pueden favorecer el crecimiento de bacterias nosocomiales. Así, Meduri et al26, en estudios realizados in vitro con diferentes concentraciones de citocinas, encontraron un mayor crecimiento en función de la concentración de Staphylococcus aureus, Acinetobacter spp. y Pseudomonas aeruginosa.
Causas de neumonía no resuelta y neumonía progresiva
Se clasifican en 2 grupos: de origen infeccioso y no infeccioso3.
Causas infecciosas
Si la evolución clínica o radiográfica del paciente no sigue los parámetros habituales antes comentados, ésta puede deberse a una etiología de la NAC por microorganismos resistentes a los antibióticos, por patógenos inusuales o a una evolución complicada de la propia neumonía3,5. Las normativas habituales de tratamiento de la NAC tienen una cobertura adecuada para S. pneumoniae resistente y sólo un escaso porcentaje de pacientes presenta resistencia a las cefalosporinas de tercera generación. No obstante, también se ha detectado un fracaso terapéutico por resistencia a las nuevas fluoroquinolonas, en concreto levofloxacino27, por lo que debe considerarse el control de este aspecto ya que la resistencia puede desarrollarse incluso durante el tratamiento.
El tratamiento empírico inicial puede fracasar cuando la etiología se relaciona con microorganismos poco frecuentes o inusuales de NAC. S. aureus y P. aeruginosa son microorganismos que no quedan adecuadamente cubiertos con las pautas terapéuticas empíricas aconsejadas en la NAC. Aunque su frecuencia es baja, su mortalidad, sobre todo para P. aeruginosa, es elevada y, por ello, en las últimas normativas de la ATS se detallan los factores de riesgo de este microorganismo con objeto de seleccionar el tratamiento inicial idóneo3. Arancibia et al5 encuentran 5 casos de Pseudomona en 49 (10,2%) neumonías que no respondían al tratamiento antibiótico, en 3 pacientes debido a infecciones persistentes, y en 2 a la aparición de infecciones nosocomiales posteriores. En la NAV que no responde, la resistencia múltiple de los microorganismos a los tratamientos antibióticos usuales es la responsable de la falta de resolución en el 50% de los episodios, y los microorganismos más frecuentes son resistentes a la meticilina S. aureus (MRSA), P. aeruginosa y Acinetobacter spp.28.
Dentro del grupo de microorganismos poco usuales se incluyen las siguientes: micobacterias, Nocardia spp., P. carinii, anaerobios, leptospiras, hongos endémicos y otros microorganismos que requieren un tratamiento antibiótico específico diferente al recomendado en las normativas de tratamiento empírico inicial de la NAC. La tuberculosis puede sospecharse en ambientes epidemiológicos concretos o en sujetos con procedencia de grupos de factores de riesgo o de países con una alta incidencia. Las micobacterias ambientales, aunque de menor frecuencia y con un curso clínico subagudo, pueden dar lugar a cuadros tipo síndrome del lóbulo medio o lesiones en el ápex pulmonar con cavitación. La Nocardia spp. es un microorganismo que puede aparecer como etiología en pacientes con tratamiento esteroideo, EPOC, colagenosis, inmunodeprimidos u otros29. El contacto con animales en exposiciones por trabajo, ocio o mascotas domésticas puede dar lugar a infección por leptospiras, psitacosis, ántrax, tularemia y hantavirus.
Las complicaciones pueden producir una resolución más lenta o una progresión de la NAC. La NAC progresiva puede cursar con aparición de shock, distrés respiratorio o fallo multiorgánico. El derrame pleural es causa frecuente de ausencia de respuesta, por lo que hay que solicitar una radiografía o una tomografía computarizada (TC) para descartarlo, ya que obliga a realizar una toracocentesis y un análisis del líquido pleural. Las infecciones metastásicas, como la endocarditis, la artritis y la peritonitis, tienen mayor incidencia en las NAC bacteriémicas.
Causas no infecciosas
Otras enfermedades con afección aguda del parénquima pulmonar pueden simular una NAC y aparentar un fracaso terapéutico. Este grupo incluye las neoplasias, las hemorragias pulmonares y las enfermedades de origen inflamatorio, como bronquiolitis obliterante con neumonía organizativa (BONO), eosinofilias pulmonares, neumonitis por hipersensibilidad y otras. La frecuencia de etiologías no infecciosas no está bien establecida. Respecto a la prevalencia, la neoplasia es la de mayor frecuencia; así, Feinsilver et al30 hallan un 10% de carcinomas pulmonares en adultos con neumonías no resueltas. Sin embargo, Örtqvist et al y Arancibia et al refieren un porcentaje inferior de neoplasias, cercano al 1%4,5.
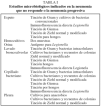
Evaluación de la neumonía no resuelta y de la neumonía progresiva (tablas I, II, III)
Ante un paciente con falta de respuesta o con neumonía progresiva es preciso una revaluación completa de la anamnesis y la exploración. En esta valoración de posibles causas hay factores epidemiológicos clave que pueden orientarnos hacia microorganismos poco usuales, factores de riesgo de microorganismos resistentes o de infección por el virus de la inmunodeficiencia humana (tabla IV).
La investigación microbiológica puede iniciarse con estudios de muestras no invasivas, como el esputo (con tinciones especiales para Ziehl convencional y modificado para Nocardia, plata metenamina para P. carinii), la orina con detección de antígenos, la obtención de sangre para hemocultivos y la detección de anticuerpos por serología. Técnicas más recientemente introducidas, como la reacción en cadena de la polimerasa (PCR) en sangre y orina permiten identificar S. pneumoniae, Legionella, C. pneumoniae y M. pneumoniae en frotis faríngeo31; sin embargo, su uso no está totalmente sistematizado y son técnicas aún en proceso de desarrollo.
La fibrobroncoscopia permite obtener muestras respiratorias y examinar la permeabilidad de la vía respiratoria en la misma zona donde tiene lugar la neumonía. La rentabilidad diagnóstica para algunos microorganismos bacterianos puede estar reducida por la toma previa de antibióticos, lo que reduce su utilidad que, no obstante, en el contexto de la neumonía que no responde se sitúa entre el 41%4 y el 42%5, y el 72%9 en la neumonía nosocomial en UCI.
La recomendación es realizar el lavado broncoalveolar (LBA) y el cepillado protegido antes de los cambios terapéuticos para no enmascarar la presencia de microorganismos inusuales, resistentes o persistentes. El LBA puede dar falsos negativos en bacterias como S. pneumoniae, Haemophilus influenza o anaerobios, si bien estos microorganismos no son los más probables en la neumonía que no responde. Si es posible, deben obtenerse muestras respiratorias por ambas técnicas, que son complementarias. No obstante, el LBA es una muestra más completa, ya que analiza una porción anatómica pulmonar correspondiente a unos 106 alvéolos, a diferencia del cepillado bacteriológico, que recupera secreciones de la vía respiratoria en los bronquios subsegmentarios. Por ello, el LBA proporciona una valiosa información para el diagnóstico diferencial y una cantidad de muestra respiratoria suficiente para estudiar el componente celular y el líquido32.
El recuento celular diferencial del LBA ofrece datos con información diagnóstica útil: el predominio de neutrófilos es sugestivo de una enfermedad infecciosa; la presencia de eosinófilos > 20% de eosinofilias pulmonares; la infección por hongos, el uso de fármacos u otras sustancias, la presencia de sangre o macrófagos cargados de hemosiderina (> 20%) es sugestiva de hemorragia pulmonar33, y el aumento de linfocitos indica la presencia de neumonitis por hipersensibilidad, sarcoidosis o fibrosis pulmonar (tabla V). En pacientes con neumonía de lenta resolución, después de 2 semanas de tratamiento, se ha demostrado una persistencia del patrón inflamatorio celular en el LBA, con un elevado porcentaje de linfocitos, polimorfonucleares y eosinófilos con una resolución completa34.
Jacobs et al35, en un grupo de neumonías aparecidas en la UCI con mala respuesta terapéutica, mediante el estudio del citocentrifugado del fluido del LBA fueron capaces de orientar el diagnóstico hacia una etiología no infecciosa en el 19% de los casos. Este diagnóstico de sospecha se alcanzó con una tinción de May-Grünwald Giemsa para la identificación de las células y la tinción de Perls's para la visualización de hemosiderina, y se confirmó por otros métodos diagnósticos en el 77% de los casos.
La tinción de Gram del líquido recuperado del LBA también es útil en la identificación del microorganismo y tiene un valor predictivo del crecimiento bacteriano. Los organismos intracelulares en los leucocitos polimorfonucleares, las tinciones de Gram en el citocentrifugado del LBA para la observación de los microorganismos intracelulares, son unos marcadores muy específicos para el cambio de la terapia antimicrobiana o en el diagnóstico diferencial de otras enfermedades no infecciosas. El procesado para el estudio microbiológico debe incluir bacterias convencionales, tinciones de Ziehl normal y modificado para Nocardia, hongos e infecciones oportunistas32. La investigación de Legionella se realiza con inmunofluorescencia directa y cultivo posterior. Recientemente, las técnicas de PCR, que poseen una mayor sensibilidad para la detección de microorganismos, pueden incrementar la rentabilidad diagnóstica, aunque su interpretación debe ser cuidadosa, precisamente por su capacidad para detectar componentes moleculares o microorganismos incompletos. Para la identificación de bacterias convencionales, con objeto de distinguir entre colonización e infección, se utilizan los recuentos de colonias, que deben interpretarse en el conjunto de pruebas del paciente, ya que los antibióticos previos pueden reducir su recuento por debajo de los puntos de corte establecidos: 103 para el cepillado y 104 para el LBA.
Orqvist et al4 señalan que la obtención de LBA y el cepillado bacteriológico proporcionó información en el 79% de los pacientes, en el 50% por hallazgos positivos y en el 29% por hallazgos negativos, que incluyen otro diagnóstico o tratamiento adecuado a falta de una demostración de la presencia del microorganismo. Arancibia et al5 aíslan microorganismos en el 40% de los LBA practicados en pacientes con fracaso terapéutico previo y en el 42% de los cepillados bacteriológicos. En este mismo estudio se determinó que las causas más frecuentes de fracaso terapéutico corresponden a infecciones primarias, persistentes o infecciones nosocomiales, y un 22,4% a etiologías no infecciosas.
Pereira et al9 investigan el impacto del LBA en la neumonía nosocomial con fracaso terapéutico previo en una UCI médica, con una rentabilidad diagnóstica del 75% (> 103 UFC/ml si está bajo tratamiento o > 104), con el hallazgo de microorganismos nosocomiales resistente a pesar del tratamiento previo con antibióticos. Estos hallazgos permitieron modificar el tratamiento antibiótico previo en más de la mitad de los pacientes (54,8%); sin embargo, esto no se acompañó de una reducción de la mortalidad.
En la neumonía nosocomial no resuelta el LBA ha permitido identificar la persistencia de microorganismos resistentes o su aparición, generalmente P. aeruginosa. La confirmación de altas concentraciones de estos microorganismos con valores de > 104 UFC/ml es útil para predecir un mal pronóstico; sin embargo, los cambios terapéuticos con la información obtenida no han podido reducir la probabilidad de muerte. Luna et al36, en esta misma línea de investigación, encuentran que el resultado del LBA permite confirmar si el tratamiento inicial fue adecuado y comprobar la diferencia de mortalidad en estos 2 grupos (el 35 frente al 91%). Por ello, Niederman37, en una revisión sobre el papel de la broncoscopia, seriada o no, en la neumonía nosocomial que no responde concluye que, aunque esta prueba proporcione información útil en cuanto a la etiología, no está demostrada su posible eficacia para reducir la mortalidad.
La rentabilidad diagnóstica de la biopsia bronquial y transbronquial en la neumonía que no responde o en la neumonía progresiva no está establecida, y depende de la probabilidad de otras etiologías sospechadas. Arancibia et al5 encuentran hasta un 57% de diagnósticos al realizar una biopsia transbronquial en la neumonía que no responde, aunque sólo obtienen esta muestra en el 25% de los casos. En este estudio, en el que el 18% de las causas del fracaso terapéutico eran de origen no infeccioso, los autores concluyen que es particularmente útil para el diagnóstico de este grupo, que incluía neoplasias, BONO e histiocitosis X.
La biopsia a cielo abierto estaría indicada cuando se han agotado otros métodos diagnósticos sin resultados. No obstante, en pacientes inmunocompetentes, Dunn et al38 señalan que pocas veces proporciona información relevante para mejorar el pronóstico.
Estudios de imagen
El estudio de seguimiento de la evolución radiográfica en las neumonías, cuando la evolución clínica es adecuada, no es obligado para indicar un tratamiento secuencial o para el alta hospitalaria, y es suficiente con un control a las 4 semanas del alta3. En una neumonía progresiva el deterioro clínico y la extensión de la imagen radiográfica puede aparecer incluso antes de las 72 h del inicio del tratamiento. En la neumonía que no responde, la radiografía simple de tórax puede mostrar un derrame pleural, la aparición de la cavitación o nuevos infiltrados. Estos hallazgos son más evidentes en la TC y, además, permite un estudio detallado del parénquima, el intersticio, la pleura y el mediastino.
Los hallazgos de la TC pulmonar pueden ser característicos de algunos microorganismos, aunque no sean patognomónicos39. La aparición de imágenes nodulares con el signo del halo, una zona de hipoatenuación alrededor del nódulo con afección cercana a la pleura, es sugestivo de aspergilosis pulmonar o mucor. También se han descrito imágenes nodulares de apariencia similar en Candida, citomegalovirus, granulomatosis de Wegener, sarcoma de Kaposi y metástasis hemorrágicas. Las imágenes de neumonía por P. carinii muestran como hallazgo característico la opacidad del vidrio esmerilado o imágenes de neumonía intersticial. Las infecciones bacterianas con imágenes de nódulos o masas múltiples con o sin cavitación pueden estar causadas por Nocardia spp., Mycobacterium tuberculosis o fiebre Q. Los infiltrados difusos intersticiales o mixtos pueden deberse a virus o M. pneumoniae.
La TC de alta resolución es útil en el diagnóstico diferencial para diferenciar entre la etiología infecciosa y no infecciosa, aunque no identifica la enfermedad de forma específica. Recientemente, Tomiyama et al40, en un estudio sobre la utilidad de la TC de alta resolución en la enfermedad aguda parenquimatosa pulmonar, encuentran que mediante esta técnica se clasifica de forma correcta (etiología infecciosa o no) en el 90% de los sujetos. En este estudio, realizado sobre pacientes no inmunodeprimidos y sin la ayuda de los datos clínicos, se comprobó además que la identificación del diagnóstico fue correcta en el 90% de la neumonía intersticial aguda, en el 72% de las neumonitis por hipersensibilidad y, en menor grado, en las hemorragias pulmonares y la neumonía eosinofílica. Aunque el estudio no se realizó en unas condiciones similares a la práctica real, el hallazgo clave de identificar una imagen como infecciosa o no, es interesante y esperanzador.
Otros estudios de imagen se realizan según la sospecha inicial, como la gammagrafía de ventilación por perfusión, para descartar el embolismo pulmonar que debe sospecharse en ausencia de hallazgos de microorganismos y pacientes con factores de riesgo, como las complicaciones posquirúrgicas, la inmovilización prolongada o los signos de trombosis venosa profunda, acompañados de insuficiencia respiratoria, inestabilidad hemodinámica y dilatación o sobrecarga de ventrículo derecho. La TC helicoidal y la arteriografia pulmonar complementan este diagnóstico.
Cambios terapéuticos empíricos en la neumonía que no responde
Las causas infecciosas son las más frecuentes de la neumonía que no responde y los resultados de los estudios microbiológicos pueden demorarse hasta 48 h. Por ello, tras la obtención de muestras está indicado proceder a un cambio terapéutico empírico. Para realizar este cambio deben revisarse todos los resultados micobiológicos iniciales y, si hay hallazgos microbiológicos positivos, ajustar el tratamiento. Sin embargo, es más probable que los resultados iniciales sean poco informativos. En estas circunstancias el cambio terapéutico empírico debe dirigirse a ampliar el espectro bacteriológico, incluida la posibilidad de microorganismos resistentes o poco usuales. Los microorganismos más frecuentemente encontrados en la neumonía que no responde en el estudio de Arancibia fueron S. pneumoniae y P. aeruginosa. El tratamiento para los pacientes con falta de respuesta en NAC debe realizarse con terapia combinada, y la cobertura debe ampliarse para cubrir anaerobios, P. aeruginosa y S. aureus, y mantener la de los microorganismos habituales, como S. pneumoniae y Legionella con betalactámicos antiseudomonas (cefepime, imipenem, meropenem, piperacilina/tazobactam) y fluoroquinolonas intravenosa, y valorar la asociación de un macrólido intravenoso (azitromicina o claritromicina).
En la neumonía nosocomial que no responde se requiere asociaciones, en ocasiones, de hasta 3 antibióticos, con cobertura para P. aeruginosa, MRSA y, según la flora local de cada hospital, Acinetobacter spp. u otros. Las causas más frecuentes de fracaso son un inapropiado tratamiento inicial con microorganismos resistentes y superinfecciones por la flora de cada hospital (M. Loanas y A. Torres, comunicación personal), por lo que en la valoración del cambio terapéutico empírico hay que conocer los patrones de resistencia propios. Las asociaciones en estos casos deben incluir betalactámicos antiseudomonas (piperacilina-tazobactam, imipenem, meropenem) o quinolonas antiseudomonas, aminoglucósidos y vancomicina hasta descartar con seguridad la presencia de MRSA.