El déficit de proteína C del surfactante ocasiona una enfermedad pulmonar intersticial (EPI) de gravedad variable. En los niños, debido a su infrecuencia y gran variabilidad clínica, su diagnóstico es complejo1,2. Presentamos un caso con esta enfermedad, pero con diagnóstico inicial incorrecto.
Varón a término, sin antecedentes de interés. Con 14-15 meses sufre 2 ingresos, por bronquiolitis VRS+ y bronquitis por adenovirus. Tras el segundo, se observó taquipnea persistente, insuficiencia respiratoria e infiltrados bilaterales en la radiografía de tórax. Se amplió el estudio descartando malformaciones, inmunodeficiencias, hipertensión pulmonar y otras infecciones. Se realizó un lavado broncoalveolar con recuento celular normal, sin eosinofilia y con tinción de Gram y cultivos microbiológicos negativos. La TC pulmonar mostró patrón en vidrio esmerilado difuso con adenopatías hiliares. Se practicó una biopsia pulmonar por toracoscopia, remitiendo la muestra a un centro de referencia, siendo informada como «cambios asociados a bronquiolitis obliterante». Con 16 meses fue dado de alta con el diagnóstico de bronquiolitis obliterante postinfecciosa.
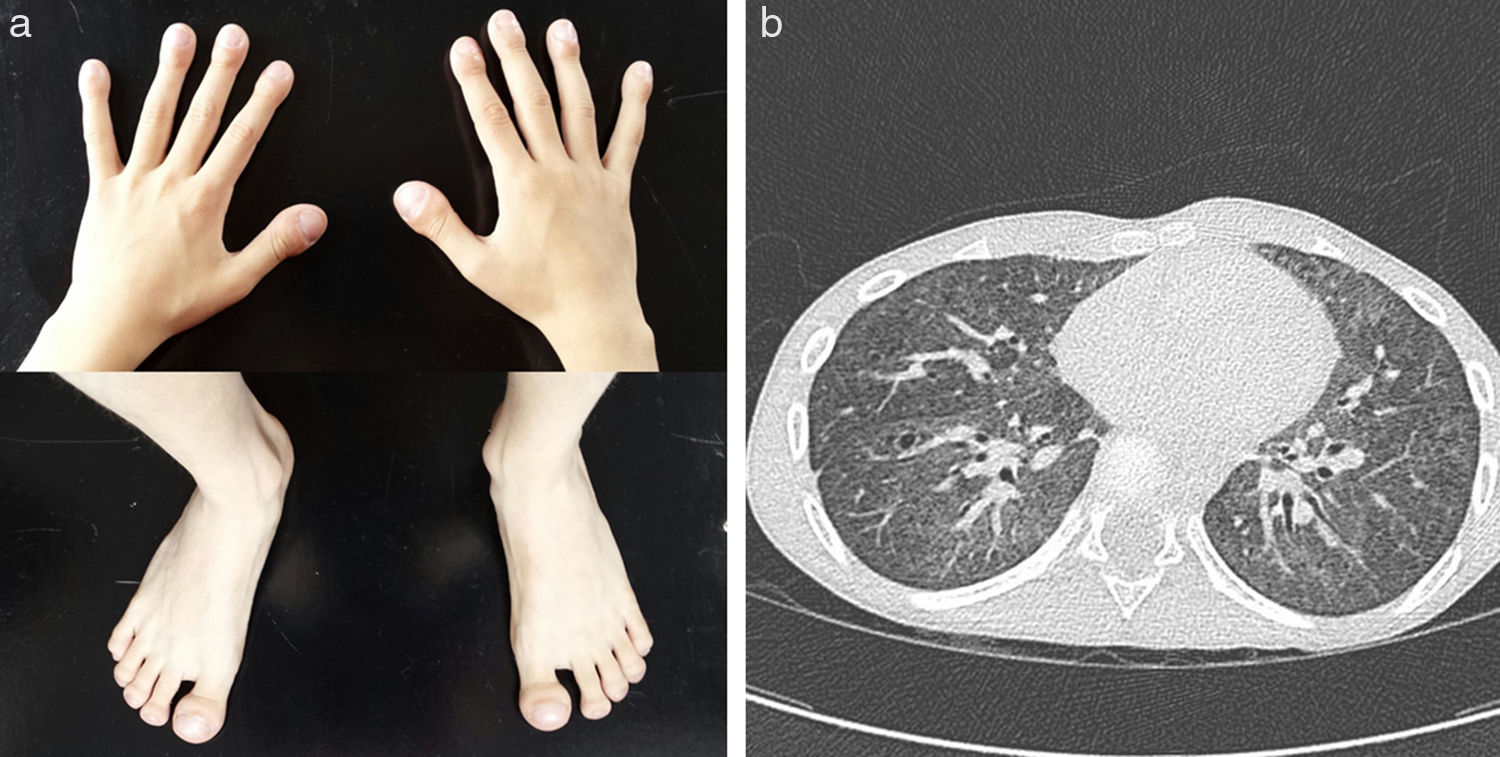
La evolución clínica inicial parecía compatible con este diagnóstico, precisando oxigenoterapia domiciliaria hasta los 24 meses, con reagudizaciones respiratorias por infecciones virales y múltiples ingresos, pero con progresiva mejoría e intervalos asintomáticos entre episodios. Sin embargo, a los 6 años, pese a mantener saturaciones diurnas y nocturnas normales, presenta disnea progresiva ante mínimos esfuerzos, mala ganancia ponderal, aspecto distrófico, acropaquias en pies y manos (fig. 1a), espirometría basal forzada con patrón restrictivo (FVC 0,49L [43%], FEV1 0,48L [51%] con relación FEV1/ FVC de 89%) y test de la marcha patológico (SaO2 inicial: 95%; SaO2 final: 89% y 402m recorridos). Se replantea el diagnóstico inicial y se repite la TC pulmonar que muestra progresión del patrón en vidrio deslustrado y múltiples lesiones quísticas intraparenquimatosas de nueva aparición (fig. 1b).
Se remite de nuevo al mismo centro la biopsia pulmonar realizada de lactante, para una nueva valoración, siendo informada ahora como «neumonitis crónica con fibrosis incipiente, alteración del desarrollo pulmonar, hipoalveolización con muscularización septal y glucogenosis intersticial». Dada la evolución y aspecto de la TC, se sospecha EPI por déficit de proteínas del surfactante. Se realiza estudio genético que detecta la mutación I73T en heterocigosis, en el gen SFTPC, diagnosticándose finalmente de déficit de proteína C del surfactante. Se inicia tratamiento con hidroxicloroquina oral (6,5mg/kg/día), que mantiene 10 meses después, con discreta mejoría clínica.
Cuando la evolución de una enfermedad no sigue el curso clínico habitual debemos replantear el diagnóstico inicial y realizar nuevos estudios, donde las EPI deben formar parte del diagnóstico diferencial3. Las enfermedades que pueden inducir una EPI comparten características clínicas, radiológicas e histológicas similares, pero su etiología es muy diversa. Las producidas por déficit de proteínas del surfactante son raras y heterogéneas y requieren un alto índice de sospecha para su correcto diagnóstico1,2.
El surfactante pulmonar es una mezcla de lípidos y proteínas producidos por los neumocitos-ii. Existen 6 proteínas fundamentales: A, B, C, D, ABCA3 y NKX2, siendo la C una proteína hidrofóbica, fundamental en el funcionamiento del surfactante. Los déficits de proteína-B y ABCA3 son entidades graves que comienzan en el periodo neonatal, aunque este último se puede presentar más tardíamente con una evolución menos grave. El déficit de proteína-C es una entidad autosómica dominante cuya mutación más frecuente es la I73T en el gen SFTPC1; se puede presentar a cualquier edad y suele progresar de forma más insidiosa1,2.
Hay más de 50 mutaciones descritas, sin una relación clara entre genotipo y fenotipo2 y, aunque se desconoce su fisiopatología, se postula que puede deberse a una acumulación intracelular de proproteína-C defectuosa, que resulta tóxica para la célula2. No existe tratamiento específico para el déficit de proteína-C, pero se ha descrito que la hidroxicloroquina puede ser eficaz, sola o asociada a corticoides2,4, por sus propiedades antiinflamatorias ligadas a la inhibición de la acumulación intracelular de proproteína-C 4.
Las EPI continúan siendo una entidad de difícil diagnóstico, especialmente en la edad pediátrica. Los hallazgos clínicos, radiológicos e histológicos pueden ser muy similares entre las diferentes entidades. La sospecha clínica y el estudio genético de las proteínas del surfactante son importantes herramientas diagnósticas2,5.