Introducción
La hiperrespuesta bronquial (HB) consiste en el estrechamiento excesivo de la luz aérea producido por la contracción del músculo liso presente en la pared del bronquio ante estímulos que habitualmente sólo provocan una respuesta escasa o incluso nula1,2. Este comportamiento anómalo constituye una de las peculiaridades más significativas del asma, aunque no una característica exclusiva de ésta2. La HB también puede detectarse en situaciones tales como bronquitis crónica, fibrosis quística, rinitis, sarcoidosis, estenosis mitral, etc., o incluso en sujetos sanos tras una infección viral del tracto respiratorio o la exposición a contaminantes atmosféricos2. Sin embargo, a pesar de esa falta de especificidad, es en el asma donde su análisis ha alcanzado sin duda un mayor desarrollo, de tal manera que el estudio de la HB en el laboratorio de función pulmonar representa, cara a la práctica diaria, una herramienta de gran ayuda para establecer (y, sobre todo, excluir) el diagnóstico de dicha enfermedad, evaluar indirectamente la magnitud de la inflamación y monitorizar la respuesta terapéutica y el grado de control conseguido3-5.
Dos son los aspectos clave que merecen tenerse en cuenta a la hora de escribir respecto a la HB en el asma: los mecanismos patogénicos y los métodos de registro y cuantificación.
Mecanismos patogénicos de la hiperreactividad bronquial en el asma
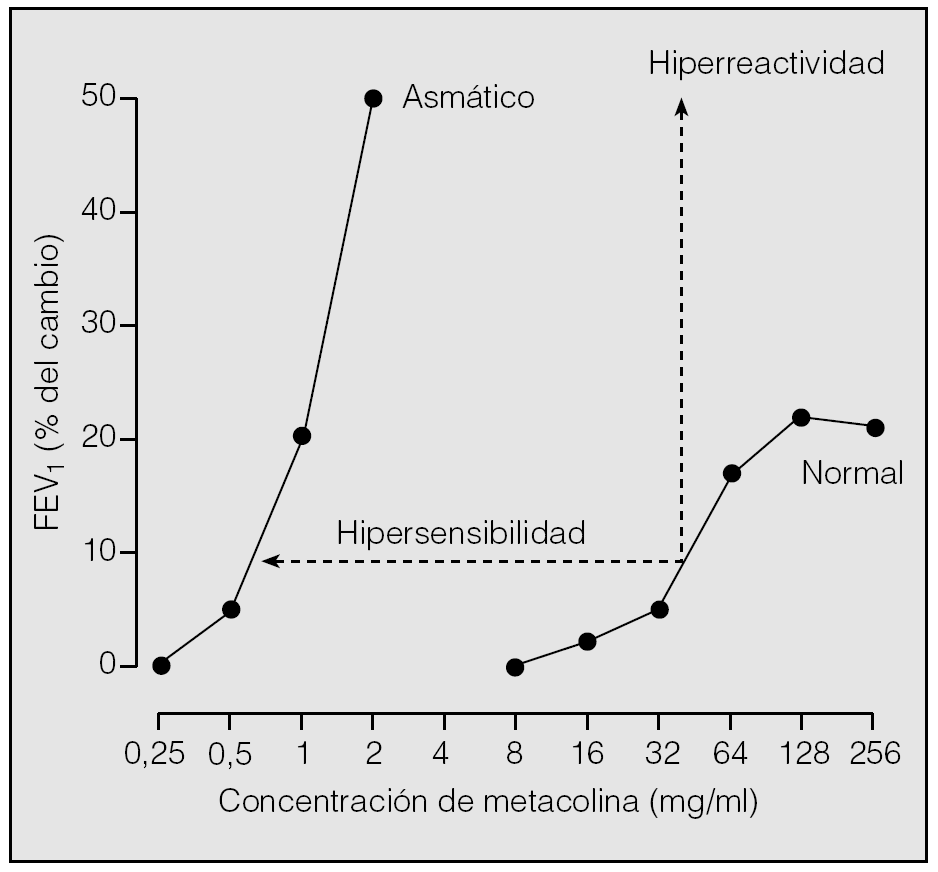
La HB es el resultado de 2 hechos particulares y bien definidos: la hipersensibilidad y la hiperreactividad1,3,4,6. De acuerdo con los modelos in vitro de interacción fármaco-receptor y su interpretación más clásica del fenómeno, el aumento de la sensibilidad (existencia de contracción ante concentraciones de estímulo más bajas que en condiciones de normalidad) implica: a) modificaciones en el número y/o afinidad de los receptores a contracturantes; b) cambios en la absorción o metabolismo de ellos, o c) factores locales que favorecen la accesibilidad del ligando a sus lugares de actuación. Por su parte, la hiperreactividad (el desarrollo de una mayor respuesta contráctil) está ocasionada por modificaciones en las propiedades y el comportamiento del propio tejido excitable (más cantidad de músculo, presencia de factores locales que facilitan su acortamiento y disfunciones en la maquinaria contráctil). La hipersensibilidad y la hiperreactividad pueden detectarse en el laboratorio de exploración funcional cuando se construyen curvas de dosis-respuesta "completas" a un agonista broncoconstrictor en el sujeto normal y en el asmático y se comparan su posición en el eje de ordenadas y sus morfologías (fig. 1).
Fig. 1. Cambios en el volumen espiratorio forzado en el primer segundo (FEV1) producidos tras la inhalación de concentraciones crecientes de metacolina en el sujeto sano y asmático. El desplazamiento hacia la izquierda de la curva obtenida en el asmático refleja la hipersensibilidad, y su mayor pendiente, la hiperreactividad.
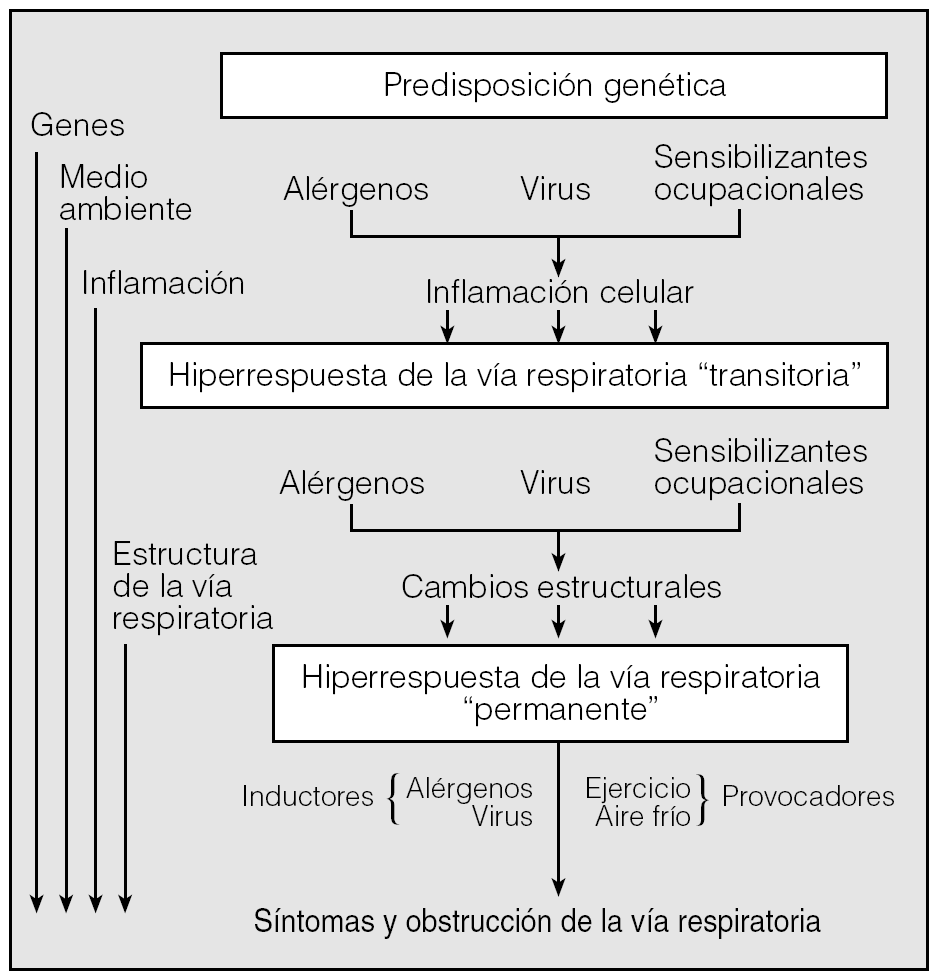
En el caso del asma, la génesis de la HB viene determinada por el proceso inflamatorio que caracteriza a la enfermedad2. No obstante, algunas observaciones publicadas durante los últimos años han venido a cuestionar, al menos parcialmente, la unívoca asociación inflamación-hiperrespuesta7-9. Para Brusasco et al4,7, que han discutido con profundidad sobre este punto, la conclusión de estos estudios parece bastante clara: en el asma, la inflamación y la hiperrespuesta mantienen una relación bastante imperfecta, de manera que la presencia de la primera no resulta ni necesaria ni suficiente para el desarrollo de la segunda. No obstante, no todos los investigadores comparten el enfoque de Brusasco et al. Halley y Drazen10, por ejemplo, recuerdan al respecto que el grado de HB detectado in vivo mediante los tests de provocación no es el resultado de un solo mediador ni la consecuencia de un mecanismo único, y cualquier intento de integrar en una sola dimensión ambas facetas puede conducir a deducciones demasiado simplistas que olvidan el conjunto real del problema. A nuestro entender, esta posición más conservadora parece adecuada, sobre todo si tenemos en cuenta que en la patogenia de la HB están también implicados factores genéticos y medioambientales, y, algo importante, que los mecanismos responsables del origen de la HB en el asma y de su evolución a lo largo del tiempo posiblemente sean diferentes (fig. 2)2.
Fig. 2. Interacción de factores genéticos y medioambientales en la patogenia de la inflamación e hiperrespuesta bronquiales que caracterizan al asma. (Modificada de O'Byrne e Inman2.)
En cualquier caso, la pregunta todavía pendiente de respuesta definitiva es por qué el músculo liso de la vía respiratoria (MLVR) del paciente asmático desarrolla al mismo tiempo hipersensibilidad e hiperreactividad. Se ha descrito una serie de modelos mecanicistas que pretenden explicar la aparición de la HB en el asma a partir de los cambios estructurales que experimenta el tracto respiratorio como consecuencia del ciclo inflamación-remodelado11-15. Quizá lo más interesante de estos modelos es que el aumento de la capa muscular o el engrosamiento de los compartimientos de la vía respiratoria --interno (epitelio, membrana basal, lámina reticular y tejido conjuntivo laxo) y externo (tejido conjuntivo laxo entre capa muscular y parénquima circundante)-- facilitan el mantenimiento de la hiperrespuesta a estímulos broncoconstrictores, incluso en ausencia de una inflamación aguda12,15 (tabla I). Sin embargo, y a juicio de diversos autores, esas interpretaciones explican bien la hiperreactividad pero no la hipersensibilidad16. Asimismo, olvidan que el MLVR no es sólo una diana pasiva sobre la que actúan mediadores inflamatorios, sino también una fuente de sustancias moduladoras de la inflamación, y que además expresa una heterogeneidad fenotípica variable con la evolución del asma (músculo liso "contráctil", "sintetizador" e "hipercontráctil")17.
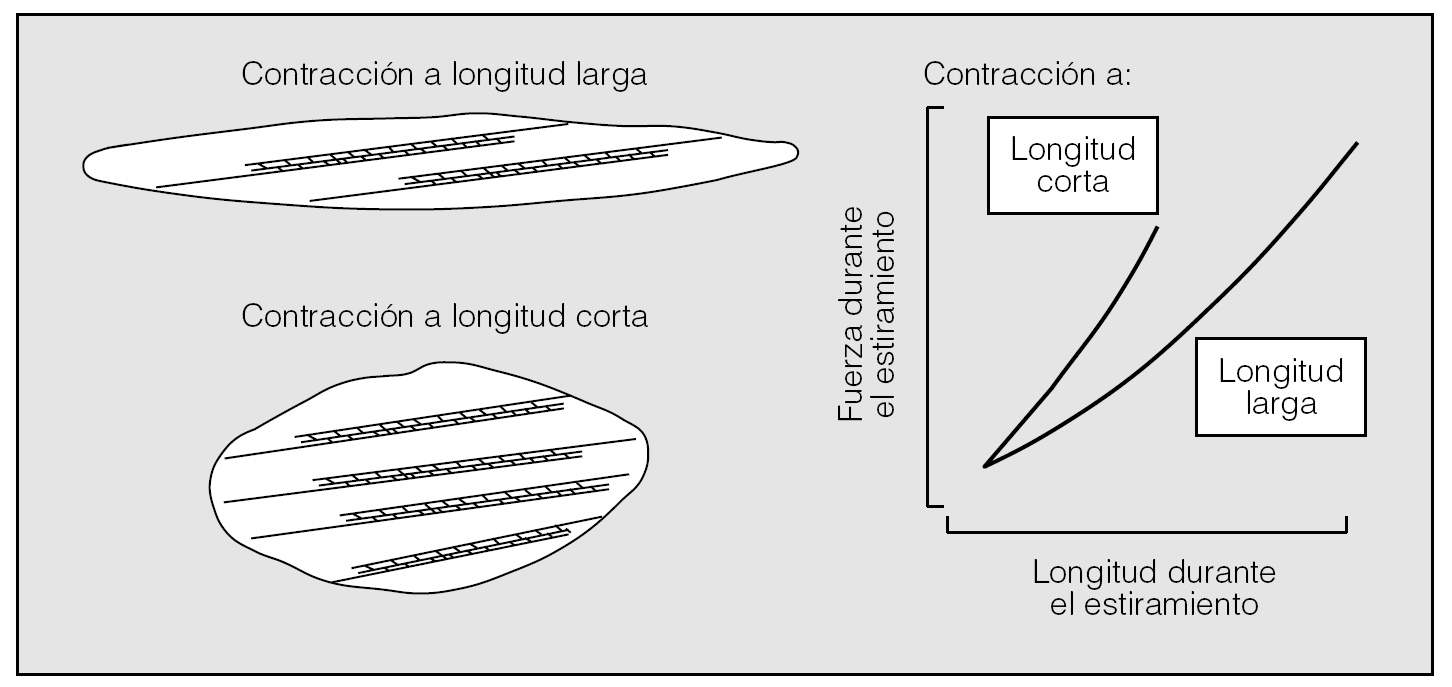
Fig. 4. Efectos de la organización de los filamentos contráctiles sobre la rigidez del músculo durante el estiramiento. Cuando el músculo se mantiene con una longitud pequeña durante la contracción, la organización de los filamentos del citosqueleto tiende a adaptarse a la morfología más corta y gruesa de la célula muscular, lo que determina la disposición en paralelo de los filamentos. El mantenimiento del músculo a longitudes mayores durante su activación da lugar a que los filamentos se adapten a una morfología más adelgazada de la célula. Tras la activación contráctil, el músculo será más rígido a longitudes cortas que a longitudes largas. (Modificada de Gunst y Wu38.)
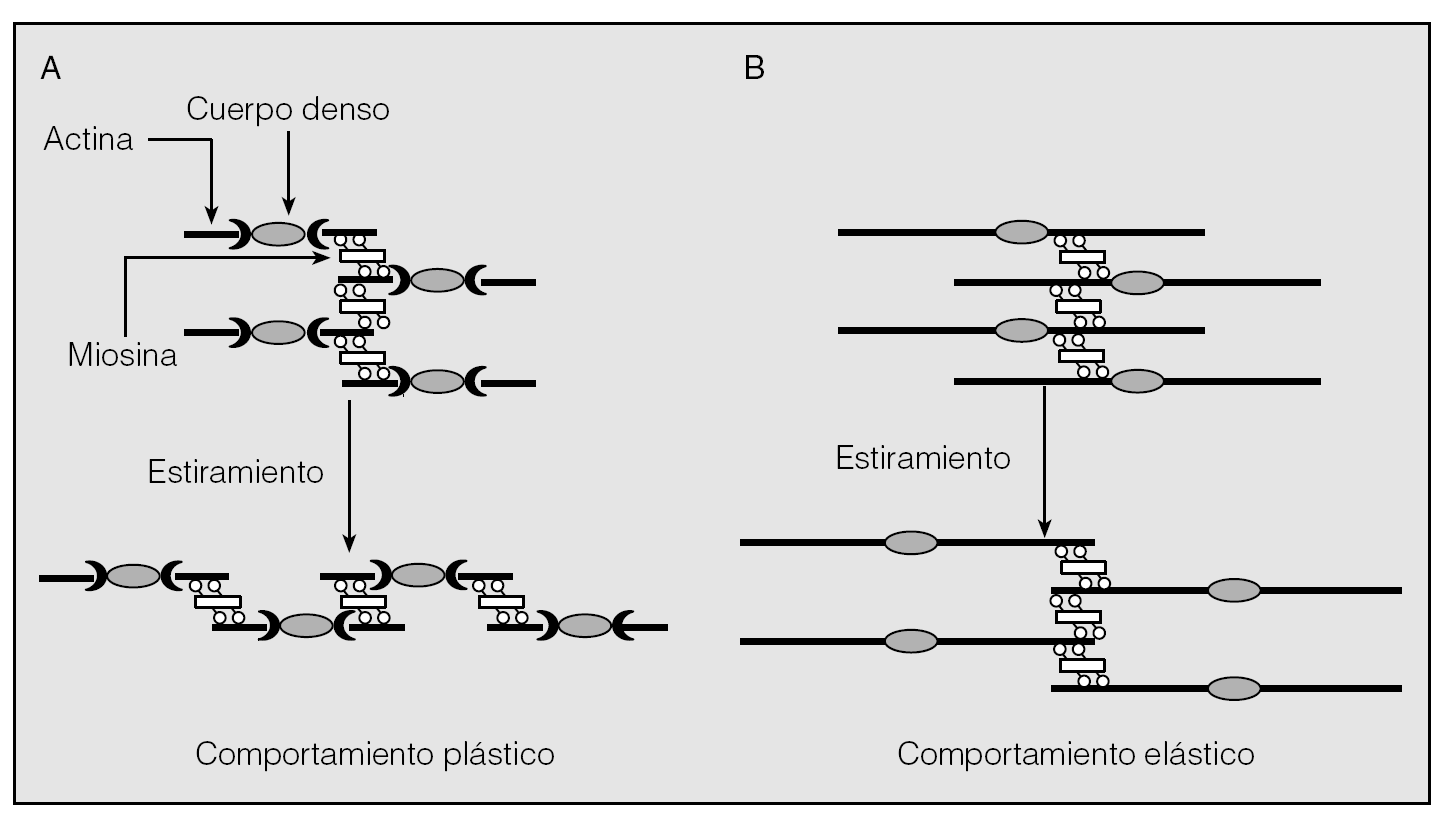
Fig. 5. Modelo propuesto por Solway et al35 para describir las consecuencias a que da lugar el aumento de la longitud de los filamentos de actina, cuando el músculo liso se ve sometido a un determinado estiramiento. En A, los filamentos de actina son cortos y la contracción que sigue a un estiramiento exige una reorganización de tales filamentos (pasan de estar en paralelo, a estar en serie), con lo cual disminuye la fuerza y el comportamiento es plástico. Sin embargo, en presencia de filamentos de actina con mayor longitud (B), la contracción tras el estiramiento no requiere el cambio de una posición en paralelo a otra en serie, de tal manera que puede mantenerse una fuerza mayor y el músculo se comporta más elásticamente.
Una alternativa que en principio sí podría explicar las 2 cualidades (hipersensibilidad e hiperreactividad) viene a centrar la cuestión en la existencia de defectos en el sistema regulador de la contractilidad del miocito y el acoplamiento excitación-respuesta16. Ese desarreglo debe de guardar relación con los mecanismos implicados en el manejo y la disponibilidad del mensajero intracelular que modula el tono de cualquier músculo liso: el Ca2+ intracitoplásmico18,19. Las posibilidades propuestas al respecto son básicamente 4: a) alteraciones en la permeabilidad de la célula muscular20; b) inhibición de los canales maxi-K+ por proteínas catiónicas21,22; c) cambios en la disponibilidad del inositol 1,3,5 trifosfato23,24, y d) aumento del Ca2+ en el compartimiento citosólico central, con modificaciones en las ondas de Ca2+ libre citoplásmico16. Esta última, todavía en fase de elaboración, propone que en el MLVR del paciente asmático existiría una mayor cantidad de Ca2+ en la porción del citoplasma cercana a los filamentos de actina-miosina y ello conduciría a su hipercontractilidad ante una amplia variedad de estímulos (hiperreactividad). El cambio de las concentraciones de Ca2+ en ese compartimiento vendría determinado por el proceso inflamatorio. Al mismo tiempo, el músculo bronquial experimentaría aumentos en la frecuencia y/o amplitud de las ondas de Ca2+ liberado desde el retículo sarcoplásmico por la activación de los receptores del inositol 1,3,5 trifosfato y de los receptores sensibles a la rianodina, y de este modo se modificaría el umbral de la contracción inducida por el agonista (hiperexcitabilidad), de la misma manera que las propiedades espaciotemporales de las oscilaciones del Ca2+ pueden modular la arritmogenicidad del músculo cardíaco16.
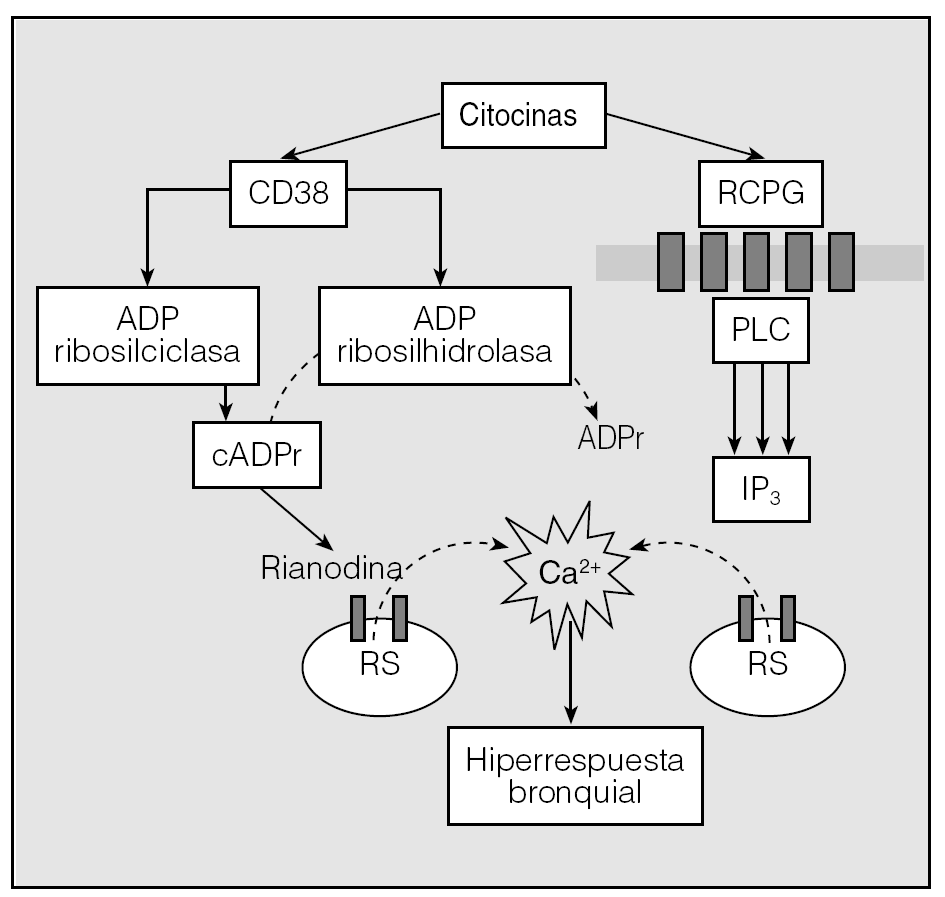
A fecha de hoy, ninguno de los planteamientos enumerados en el párrafo anterior se encuentra completamente confirmado, pero todos tienen la virtud de haber aportado parcelas de información que demuestran la complejidad de las interrelaciones inflamación-MLVR. Amrani et al25, que han revisado muy recientemente el tema que aquí nos ocupa, han enumerado diversas posibilidades mediante las cuales los mediadores inflamatorios (factor de necrosis tumoral alfa, interleucinas 1β y 13, etc.) podrían regular al alza del Ca2+ libre citoplásmico del MLVR y determinar así su hiperrespuesta ante agentes broncocontracturantes. El aumento de la expresión de CD38/adenosindifosfato ciclicorribosa (cADPr) sería una de ellas. El CD38 es una glucoproteína transmembrana de unos 45 kDa que cataliza la síntesis y degradación del cADPr a través de ADP ribosilciclasa y ADP ribosilhidrolasa, respectivamente25. Diversos trabajos experimentales han demostrado que el ADP ciclicorribosa incrementa la sensibilidad al Ca2+ de los receptores a la rianodina del retículo sarcoplásmico, regulando su liberación25 --liberación de Ca2+ inducida por Ca2+ (fig. 3).
Fig. 3. Producción y función del adenosindifosfato ciclicorribosa (cADPr) en el músculo liso de la vía respiratoria. CD38 cataliza la síntesis y degradación del cADPr, vía adenosindifosfato (ADP) ribosilciclasa y ADP ribosilhidrolasa, respectivamente. La expresión de CD38 se vería aumentada por la acción de determinadas citocinas, con el incremento subsiguiente de cADPr. El cADPr facilitaría, a través de los receptores a rianodina, la liberación de Ca2+ desde el retículo sarcoplásmico (RS). Por otro lado, las citocinas también "sensibilizarían" a los receptores a contracturantes acoplados a la proteína G (RCPG) para dar lugar, vía fosfolipasa C (PLC), a una mayor producción de la señal intracelular inositol 1,3,5 trifosfato (IP3) que, a su vez, facilitaría igualmente la salida de Ca2+ desde el RS actuando sobre sus receptores específicos presentes en esta organela citoplásmica.
Queda por comentar en este apartado una hipótesis final, barajada desde hace ya tiempo por diferentes grupos de trabajo, que focaliza el origen de la HB asmática en la pérdida de algún factor, operativo para el sujeto sano, y con la función de modular y limitar la contractilidad "normal" del MLVR. Ese dilatador endógeno sería la propia respiración y el estiramiento cíclico que experimenta el músculo de la pared bronquial durante los cambios de volumen pulmonar26-30. Para algunos, la tracción radial de la vía respiratoria que acompaña a la inspiración activaría mecanismos que, vía neural, inhiben la actividad tónica colinérgica31, favorecen la broncodilatación no adrenérgica y no colinérgica32 o incluso provocan, a partir de fuentes no neurales, la liberación de sustancias broncodilatadoras tipo óxido nítrico33. Para otros, el fenómeno es el resultado de un efecto directo sobre el MLVR provocado por el propio estiramiento30,34,35. Los defensores de esta variante plantean 2 posibilidades no necesariamente excluyentes.
La primera de ellas, ideada por Fredberg30,36,37, considera que con cada inspiración, y aún más con las inspiraciones profundas (suspiros) que a una frecuencia de unas 10 veces por hora ocurren normalmente, tiene lugar un pequeño estiramiento del músculo liso. Esos estiramientos mecánicos y cíclicos se transmiten a las cabezas de miosina y provocan su separación de los filamentos de actina mucho más pronto de lo que ocurriría en condiciones isométricas. Al haber menos puentes de actina-miosina, el músculo tenderá a estirarse algo más con la siguiente inspiración, y así sucesivamente hasta llegado un momento en el que sólo una pequeña fracción de los puentes de actino-miosina que podrían establecerse lo hacen ("equilibrio perturbado" de la unión de la miosina)36. La separación prematura de las uniones entre actina y miosina provocada por el estiramiento cíclico reduce el ciclo de trabajo de la miosina y la fuerza activa en una magnitud similar. Como resultado de todo ello, el músculo permanecerá alargado incluso cuando el estímulo que sobre él se aplique sea supramáximo. Este estado perturbado se caracteriza paralelamente por un ciclado de puentes rápido y una mayor tasa de utilización de adenosintrifosfato por puente establecido o por unidad de fuerza desarrollada36,37.
Siguiendo el esquema defendido por Fredberg, cualquier circunstancia que reduzca la tensión peribronquial (engrosamiento inflamatorio de la lámina reticular, engrosamiento de la adventicia peribronquial, pérdida del retroceso elástico, etc.) afectará a los efectos que el estiramiento cíclico debido a la inspiración produce en el músculo y no habrá nada que impida la formación de puentes de actina-miosina. El MLVR tendrá más rigidez y desarrollará más fuerza cuando se le estimule30,36,37.
La segunda posibilidad, defendida sobre todo por Gunst y Wu38, parte de la idea de que el MLVR posee una plasticidad intrínseca en virtud de la cual la organización de su maquinaria contráctil tiende a acomodarse a los cambios de morfología y longitud que el miocito experimenta durante el ciclo respiratorio. Esta plasticidad influye de manera sustancial en su capacidad de generar fuerza, ya que el músculo optimiza su contractilidad a la longitud a la cual se ve activado. A longitudes cortas, el músculo es menos extensible y rígido que a longitudes largas (fig. 4). Dicho en otros términos, la rigidez del MLVR está inversamente relacionada con el volumen corriente end-tidel. A medida que éste aumenta, la rigidez disminuye y viceversa. De ese modo la oscilación dinámica mecánica del músculo reduce per se su rigidez, fuerza y capacidad de respuesta. De ser así las cosas, el fracaso de esta propiedad, quizá relacionado en el asma con un aumento de la longitud de los filamentos de actina y un comportamiento del MLVR más elástico que plástico, determinaría una mayor capacidad de contracción y una mayor velocidad de acortamiento (fig. 5)38. Los cambios de longitud vendrían ocasionados por alguno de los productos de la inflamación que asientan en la vía respiratoria del asmático y con capacidad para alterar el equilibrio síntesis/degradación (polimerización/despolimerización) de la actina35.
Fig. 4. Efectos de la organización de los filamentos contráctiles sobre la rigidez del músculo durante el estiramiento. Cuando el músculo se mantiene con una longitud pequeña durante la contracción, la organización de los filamentos del citosqueleto tiende a adaptarse a la morfología más corta y gruesa de la célula muscular, lo que determina la disposición en paralelo de los filamentos. El mantenimiento del músculo a longitudes mayores durante su activación da lugar a que los filamentos se adapten a una morfología más adelgazada de la célula. Tras la activación contráctil, el músculo será más rígido a longitudes cortas que a longitudes largas. (Modificada de Gunst y Wu38.)
Fig. 5. Modelo propuesto por Solway et al35 para describir las consecuencias a que da lugar el aumento de la longitud de los filamentos de actina, cuando el músculo liso se ve sometido a un determinado estiramiento. En A, los filamentos de actina son cortos y la contracción que sigue a un estiramiento exige una reorganización de tales filamentos (pasan de estar en paralelo, a estar en serie), con lo cual disminuye la fuerza y el comportamiento es plástico. Sin embargo, en presencia de filamentos de actina con mayor longitud (B), la contracción tras el estiramiento no requiere el cambio de una posición en paralelo a otra en serie, de tal manera que puede mantenerse una fuerza mayor y el músculo se comporta más elásticamente.A la vista de toda la información que acabamos de exponer, resulta evidente que estamos todavía lejos de poder definir con precisión el mecanismo o, mejor, el conjunto de mecanismos implicados en el origen de la HB característica del asma. Lo que sí está bastante claro es que las evidencias actuales abren nuevos caminos para que en un futuro esta situación cambie. Seguramente, cuando esto ocurra estaremos más cerca de conocer de verdad la fisiopatología de la enfermedad asmática.
Estudio de la hiperreactividad bronquial
El análisis de la HB se realiza en el laboratorio de exploración funcional utilizando, por lo general, sustancias que, como la histamina o la metacolina, causan broncoconstricción al actuar "directamente" en las células implicadas en la génesis de la limitación al flujo (MLVR, endotelio vascular bronquial, células productoras de moco, etc.)5. Sin embargo, la existencia de hiperrespuesta también puede ponerse de manifiesto mediante agentes que ocasionan la reducción del calibre de la vía respiratoria de manera "indirecta", estimulando inicialmente células inflamatorias o neuronales que, una vez activadas, generan los mediadores adecuados para provocar la disminución de la luz bronquial (tablas II y III)5,39. Esta diferencia tan destacada explica por qué el grado de correlación entre estímulos "directos" e "indirectos" resulta poco significativa y, aún más, que la información de cada uno de ellos aporta una visión parcelada, no intercambiable y sí complementaria de las alteraciones presentes en el tracto respiratorio del enfermo con asma5.
El número de estímulos "indirectos" es amplio e incluye, entre otros, estímulos farmacológicos, estímulos físicos y agentes selectivos40. De todos ellos, quizá el que más interés ha despertado en los últimos años es la adenosina o, para hablar con mayor propiedad, su precursor de mayor hidrosolubilidad: la adenosina 5'-monofosfato (AMP)40,41.
La adenosina es un nucleósido endógeno implicado en la modulación de no pocos procesos fisiológicos (control del tono vascular, modulación de la neurotransmisión y neurosecreción, regulación del tono intestinal, contractilidad de los miocitos, etc.), que, además, interviene en las respuestas inflamatorias40,41. Su síntesis tiene lugar en el interior de las células, a partir de la hidrólisis del AMP por la 5'-nucleotidasa o por el catabolismo de la s-adenosilhomocisteína. Cuando la concentración intracelular se incrementa por la hipoxia o por la activación celular, la adenosina se libera al exterior, donde puede desaminarse a inosina, recaptada por la propia célula, o unirse a receptores específicos ubicados en las membranas citoplásmicas de otras células, determinando así sus efectos biológicos41. Se han clonado 4 tipos de receptores para la adenosina: A1, A2A, A2B y A340, todos ellos con representación en el pulmón40.
Por vía inhalada, el AMP desencadena una broncoconstricción en los sujetos con asma y no modifica el tono de la vía respiratoria de la población sana. Esta respuesta es consecuencia de la liberación de histamina a partir de los mastocitos una vez activados los receptores A2B ubicados en su superficie, aunque también se encuentran implicados otros mediadores40,41. Como broncoconstrictor, el AMP es un tercio menos potente que la histamina y un sexto menos potente que la metacolina. La HB frente al AMP guarda una relación mucho más estrecha con la inflamación asmática que la HB detectada con estímulos "directos". La exposición repetida al AMP lleva al desarrollo de taquifilaxia5,39,40.
En la actualidad hay ya publicado un buen número de recomendaciones y normativas para llevar a cabo las pruebas de provocación, tanto con estímulos "directos" como "indirectos"39,40,42-44. Las más habituales en la práctica diaria son aquellas que utilizan la histamina o la metacolina como agentes broncoconstrictores, administradas por vía inhalada (respiración espontánea del aerosol durante 2 min o empleo de dosímetro de 5 respiraciones máximas de aerosol)44. El parámetro de función pulmonar a emplear, a fin de medir los cambios producidos en el calibre de la vía respiratoria, se debe escoger considerando lo que uno intenta buscar. Si el objetivo es tener sensibilidad, utilizaremos medidas que no requieran respiraciones profundas (p. ej., sGaw o conductancia específica). Si lo que se pretende es ganar especificidad recurriremos a pruebas --volumen espiratorio forzado en el primer segundo (FEV1)-- que exijan lo contrario2-4,44.
Existen varios modos de expresar los resultados obtenidos. Cuando empleamos el FEV1, la forma más habitual es la PC20-FEV1, es decir, la concentración teórica de histamina o metacolina que produce una caída del FEV1 de exactamente el 20% en relación con su valor inicial3,44. Este valor se obtiene considerando los valores de la concentración anterior y posterior a la teórica que produce el descenso del FEV1 en un 20%, mediante fórmulas de interpolación42,44. Si se utilizan dosis acumulativas, lo que se calcula entonces es la PD20-FEV144. La mayoría de los sujetos no asmáticos tienen unas cifras de PC20 superiores a los 16 mg/ml3,44.
El valor diagnóstico máximo para asma de un test positivo con metacolina o histamina ocurre cuando las probabilidades previas de asma oscilan entre el 30 y el 70%44. De todas maneras, como ya se señaló al principio de esta revisión, la mayor utilidad de la prueba radica en su alto valor predictivo negativo4.