Introducción
El término "parasitismo" indica un tipo de asociación entre 2 seres vivos que tiene consecuencias nocivas para uno de ellos (hospedador) y aporta beneficios al otro (parásito). Aunque que el término "parásito" incluye conceptualmente a todos los seres vivos capaces de causar perjuicio a otros, tradicionalmente en medicina este nombre se aplica de forma exclusiva a los protozoos, helmintos y artrópodos que viven temporal o permanentemente en el ser humano1. Desde un punto de vista práctico, el parasitismo puede ocasionar manifestaciones clínicas (enfermedades parasitarias) o cursar como una infección asintomática1. Con algunas excepciones (principalmente la amebosis y el paludismo grave2), la mayor parte de parásitos que afectan al pulmón son helmintos, es decir, animales invertebrados que tienen aspecto de gusano (vermes).
En este trabajo revisaremos de forma conjunta las enfermedades del aparato respiratorio producidas por estos seres vivos en humanos, actualizando varios aspectos ya considerados en Archivos de Bronconeumología por Cremades3 en 1998. Inicialmente se indicará de forma breve cuáles son los principales géneros y especies implicadas, así como el momento del ciclo biológico en que tiene lugar el contacto con las estructuras respiratorias. En un segundo apartado se revisarán las principales características epidemiológicas, haciendo hincapié en la distribución geográfica de estas enfermedades. A continuación se indicarán los mecanismos de lesión pulmonar (agresión por el parásito y defensa del hospedador) para señalar posteriormente las manifestaciones clínicas. Los 2 últimos bloques se dedicarán a los métodos diagnósticos y a las posibilidades terapéuticas.
Agentes causales
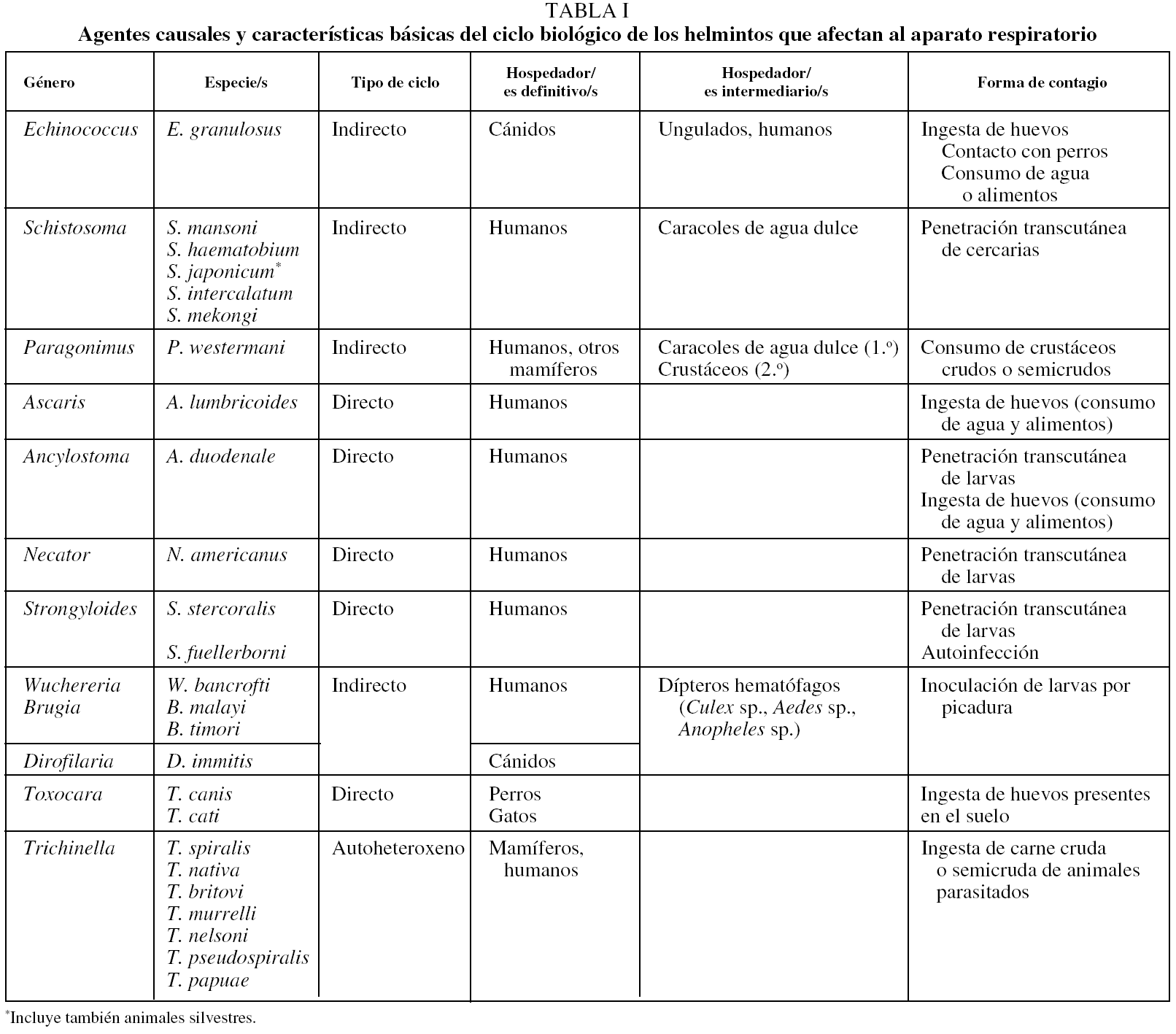
Las principales helmintosis humanas están producidas por diversas especies de cestodos, trematodos y nematodos. Las cestodosis que afectan al pulmón únicamente son las producidas por formas larvarias, nunca las producidas por vermes adultos (p. ej., Taenia saginata, Taenia solium, Diphyllobothrium latum, Hymenolepis sp. o Dipylidium caninum). Por otro lado, la principal cestodosis en la que se afecta el pulmón es la hidatidosis o equinococosis (producida por Echinococcus granulosus)4, mientras que es excepcional la afectación pulmonar por cisticercos (forma larvaria de T. solium)5-7 y por otras especies de Echinococcus (E. multilocularis, E. vogeli y E. oligarthrus)4. Dentro de las trematodosis, los 2 géneros que pueden cursar con lesión pulmonar son Schistosoma y Paragonimus. Las esquistosomosis están producidas por varias especies de Schistosoma; las más importantes por su frecuencia son las ocasionadas por S. mansoni, S. haematobium y S. japonicum8. En el caso de las esquistosomosis, la afectación pulmonar adopta 2 formas diferentes: durante la fase aguda, en el contexto de un síndrome de Katayama, y en la fase crónica, por embolia de huevos en las ramas de la arteria pulmonar8. La paragonimosis se debe a la infección por varias especies de Paragonimus, de las cuales el agente causal más importante es P. westermani9,10. Finalmente, varios tipos de nematodosis pueden afectar al pulmón: a) algunas helmintosis intestinales, que incluyen en su ciclo vital el paso transpulmonar --Ascaris sp., uncinarias (Ancylostoma duodenale, Necator americanus) y Strongyloides sp.--11,12; b) algunos tipos de filariosis linfáticas (producidas por Wuchereria bancrofti, Brugia malayi o Brugia timori)13 y dirofilariosis (ocasionada por Dirofilaria immitis)14, y c) nematodosis tisulares como la toxocariosis (producida por Toxocara canis o Toxocara cati)15 o la triquinelosis (producida por varias especies de Trichinella)16.
Aspectos biológicos básicos
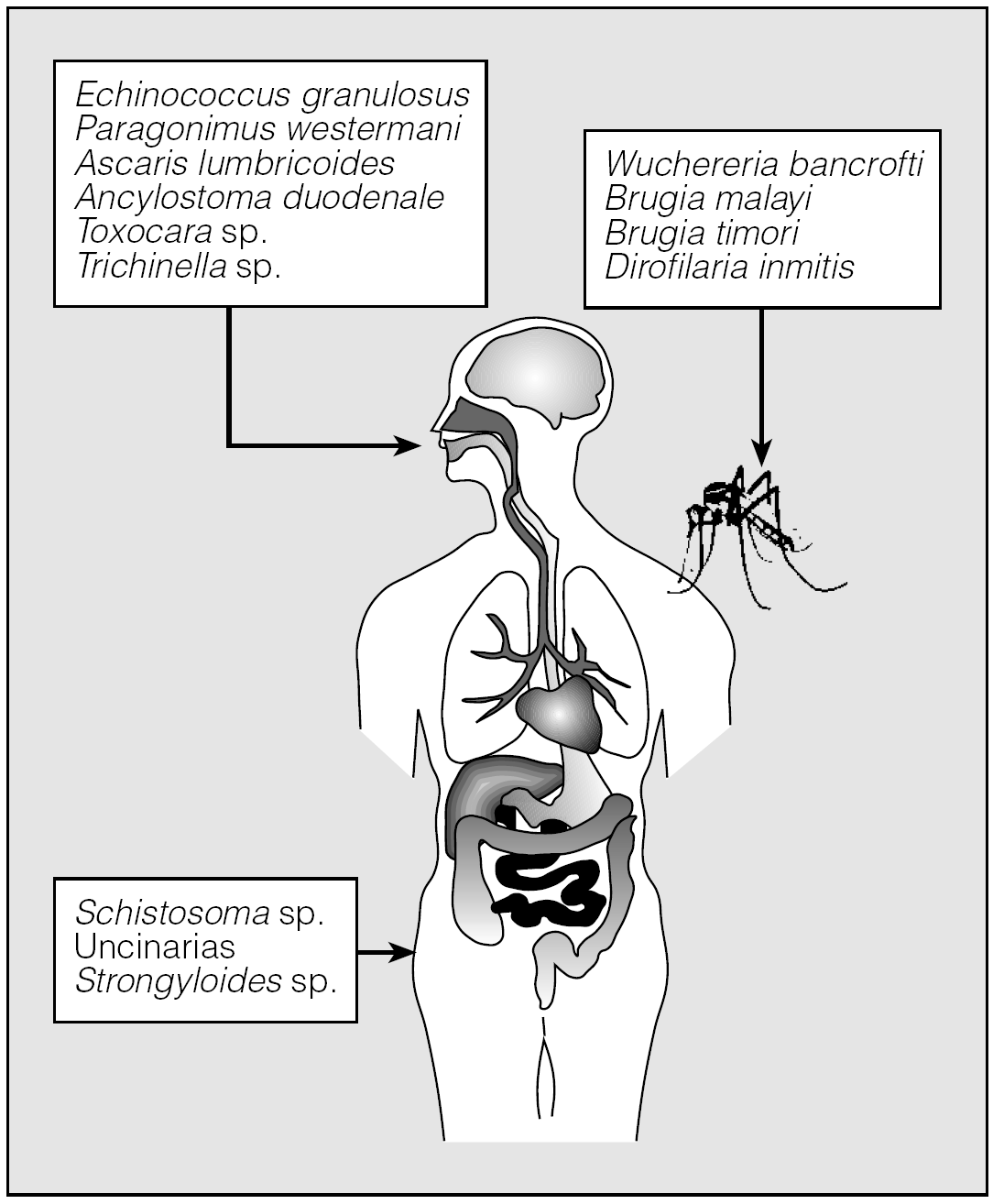
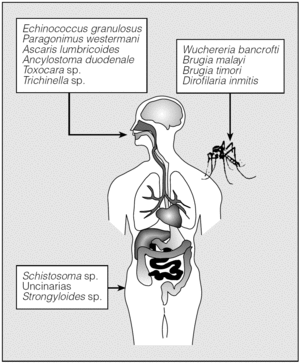
Los helmintos mencionados acceden al organismo desde el exterior empleando 3 vías diferentes (fig. 1). Así, E. granulosus, P. westermani, Ascaris lumbricoides, Ancylostoma duodenale, Toxocara sp. y Trichinella sp. penetran en el organismo por el consumo de formas infectivas del parásito presentes en el agua o en alimentos. Por otro lado, la infección por Schistosoma sp., uncinarias y Strongyloides stercoralis tiene lugar por vía transcutánea. Finalmente, las filariosis se transmiten por diferentes vectores artrópodos.
Fig. 1. Vías de entrada de los helmintos.
E. granulosus tiene un ciclo de vida indirecto. Los cánidos y algunos félidos los albergan en la fase adulta, mientras que la fase larvaria (metacestodos) se encuentra en numerosos hospedadores intermediarios, generalmente ungulados y roedores4,17. El ser humano se convierte en un hospedador intermediario accidental al ingerir huevos del helminto, bien directamente del hospedador definitivo o por el consumo de agua o verduras contaminadas con deposiciones de los hospedadores definitivos. Tras la ingestión, los huevos eclosionan en el intestino delgado y se liberan oncosferas que penetran en la pared intestinal. Estas oncosferas se dirigen por vía circulatoria hasta el hígado, donde se retiene la mayoría, y el resto accede por la circulación venosa al pulmón e incluso supera el filtro pulmonar y llega a través de la circulación sistémica a otros órganos. Ocasionalmente se ha descrito la llegada de oncosferas desde el intestino por vía linfática (evitando el filtro pulmonar) y por vía bronquial17. En los órganos diana, las oncosferas que el sistema inmunitario no ha destruido dan lugar progresivamente a quistes (hidátides) que aumentan de tamaño de forma paulatina, hasta que se generan protoescólices y vesículas hijas que ocupan el interior17.
Las diferentes especies de Schistosoma siguen también un ciclo indirecto, que requiere, como hospedadores intermediarios específicos, diversas especies de caracoles de agua dulce (Biomphalaria sp., Bulinus sp. o Onchomelania sp.). En estos hospedadores tienen lugar varias fases del ciclo biológico y se liberan cercarias al medio acuoso8. Las cercarias son capaces de atravesar la piel intacta y se transforman en esquistosómulas al perder la cola. Las esquistosómulas penetran en el sistema venoso y desde ahí a la circulación pulmonar, atravesándola; inicialmente acceden a las cavidades cardíacas izquierdas y con posterioridad a los vasos mesentéricos (p. ej., S. mansoni) o vesicales (p. ej., S. haematobium). En el interior de los vasos tiene lugar la diferenciación sexual; las parejas (macho y hembra) se mantienen acopladas y, tras la fecundación, se liberan huevos que se dirigen tanto en dirección anterógrada como retrógrada, lo que ocasiona las lesiones características de la enfermedad (granulomas). En esta fase "crónica" la lesión pulmonar se produce por la embolización de huevos en las ramas de las arterias pulmonares.
Los trematodos del género Paragonimus también tienen un ciclo indirecto --más complejo que el de Schistosoma--, que incluye 2 tipos de hospedadores intermediarios: caracoles de agua (como Aroapyrgus, en el que tiene lugar un ciclo similar a Schistosoma) y crustáceos (en los que penetran las cercarias y se enquistan en forma de metacercarias)9. La infección en humanos tiene lugar por la ingesta de crustáceos crudos o insuficientemente cocinados (sobre todo cangrejos) portadores de metacercarias. En el intestino se produce la exquistación de las metacercarias; las larvas atraviesan la pared intestinal, acceden al peritoneo y emigran a través del diafragma hasta el espacio pleural. Posteriormente se produce el desarrollo de la forma adulta en el tejido pulmonar, donde se forman quistes con una cápsula fibrosa y un contenido hemopurulento y se liberan huevos que finalmente se eliminan por vía bronquial9.
Los helmintos intestinales mencionados (Ascaris sp., A. duodenale, N. americanus y Strongyloides sp.) ocasionan afectación pulmonar durante su desplazamiento por el árbol bronquial. La infección por Ascaris sp.18, y ocasionalmente por A. duodenale, tiene lugar por la ingesta de alimentos contaminados con huevos embrionados de ambos nematodos. En el intestino delgado se liberan larvas (L2) que penetran en la pared intestinal y por vía venosa alcanzan el hígado (en el que no ocasionan lesiones), tras lo cual continúan su recorrido hasta las cavidades cardíacas derechas y desde ellas hasta el lecho capilar pulmonar. Posteriormente atraviesan la barrera alveolocapilar y siguen un recorrido ascendente por los bronquiolos, los bronquios y la tráquea hasta llegar a la faringe, donde son deglutidos, por lo que llegan de nuevo al intestino delgado, donde se encuentra la forma adulta del parásito. La infección por uncinarias19 y por S. stercoralis20 habitualmente sigue una vía diferente. Las larvas filariformes (L3) penetran a través de la piel, por contacto de los pies descalzos con la tierra. Por vía venosa acceden hasta las ramas de la arteria pulmonar, y el proceso se completa de forma similar a los otros helmintos intestinales. Una diferencia importante entre S. stercoralis y el resto de helmintos es su capacidad de reinfección desde el intestino.
Las filariosis constituyen la forma más frecuente de nematodosis sanguínea. La afectación pulmonar adopta 2 patrones diferentes: por un lado, las filariosis linfáticas (producidas por W. bancrofti y Brugia sp.), transmitidas por diversos dípteros hematófagos, ocasionan lesiones pulmonares por la liberación de microfilarias que son secuestradas en el lecho vascular pulmonar13; por otro, la infección por D. immitis ocasiona lesión pulmonar por embolización pulmonar de larvas14,21.
La toxocariosis se produce por la ingesta de huevos embrionados presentes en suelos contaminados por heces de perros o gatos infectados. Por razones lógicas, esta enfermedad es más frecuente en los primeros años de la vida. En el intestino delgado se produce la eclosión de los huevos y la liberación de las larvas (L2), que penetran a través de la pared intestinal y, por vía venosa, acceden a diversos órganos como el hígado, pulmón, sistema nervioso central y globo ocular22.
La infección por diferentes especies de Trichinella se produce por el consumo de carne cruda o semicruda de cerdos o jabalíes parasitados16. En el intestino tienen lugar la exquistación y el desarrollo sexual, tras lo cual se producen la fecundación de las hembras y la liberación de larvas L1. Éstas penetran en vasos y tejido linfático y acceden a la musculatura estriada esquelética, incluyendo diafragma y otros músculos respiratorios. En estos músculos, las larvas L1 invaden las células musculares, en las que crecen y se enquistan.
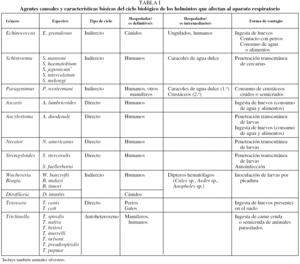
En la tabla I se indican de forma resumida las diferencias principales entre los helmintos que ocasionan afectación del aparato respiratorio.
Características epidemiológicas
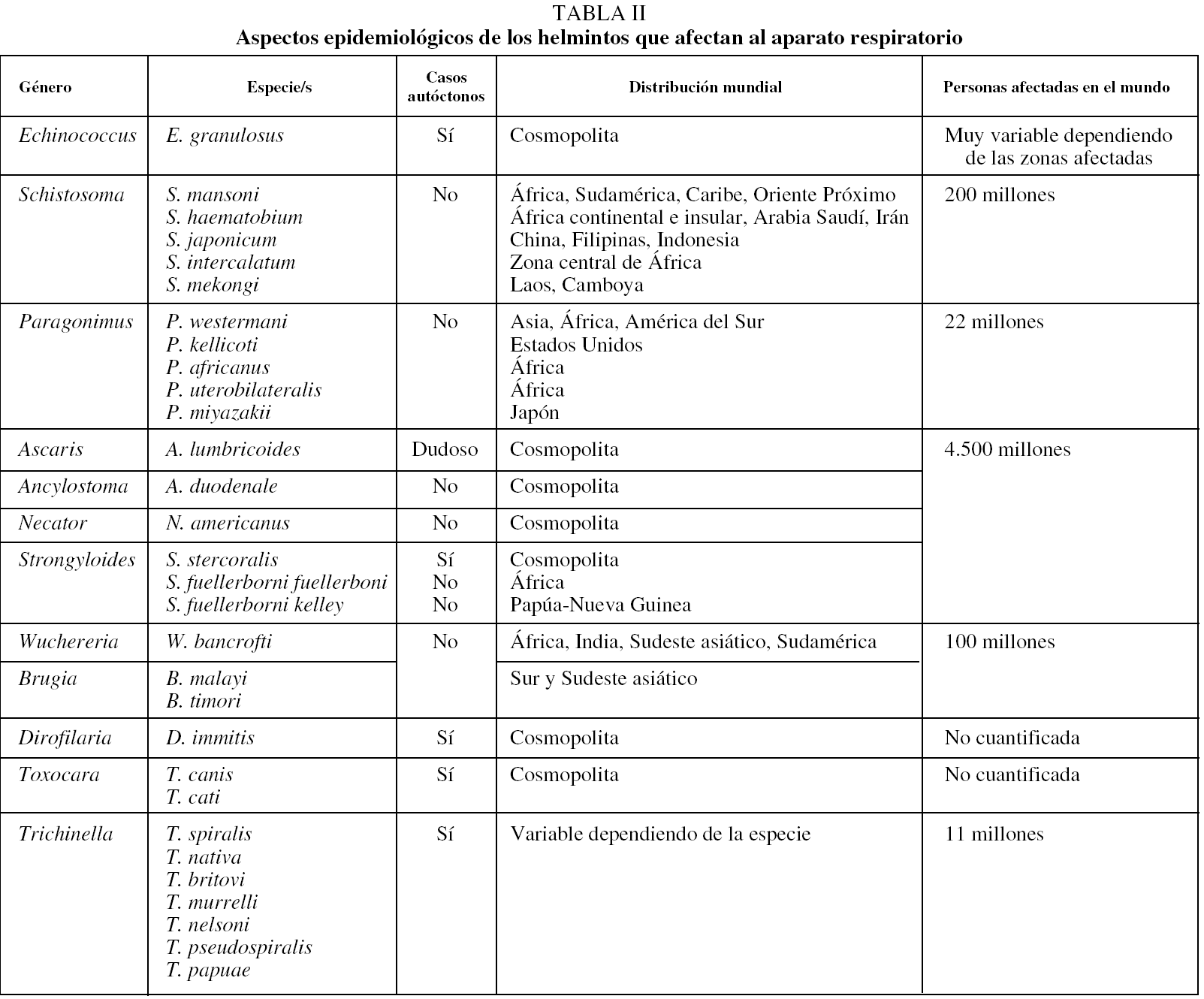
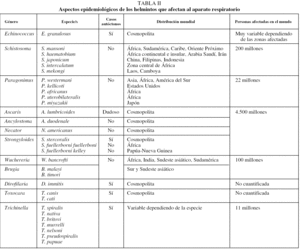
La infección por E. granulosus tiene una distribución cosmopolita y su prevalencia es muy variable dependiendo de los países e incluso dentro de cada país23,24. Las zonas hiperendémicas más importantes son la cuenca mediterránea (Marruecos, Túnez, Libia, Israel, Líbano, sur de Italia, Cerdeña y España), los países de la antigua Unión Soviética, el este de África (Somalia, Etiopía, Kenia), América del Sur (Perú, Chile, Argentina y Uruguay), zonas de China, Malasia, Sri Lanka e India. En estas zonas la prevalencia es muy variable: entre 1/1.000 habitantes en el lago Turkana (Kenia) y 0,7-0,9 por 100.000 habitantes en Israel. La tasa de mortalidad global se cifra en 0,2 por 100.000 habitantes4.
En España la hidatidosis ha sido y es una enfermedad endémica, presente en muchas regiones (especialmente en Castilla y León, Aragón, Navarra, La Rioja, Madrid, Castilla-La Mancha), que hasta hace unos años alcanzaba cifras considerables25. Sin embargo, últimamente se ha observado un descenso de los casos autóctonos (tabla II), aunque está aumentado el número de casos importados26.
La esquistosomosis humana es endémica en 76 países y constituye uno de los mayores problemas de salud pública en países tropicales y subtropicales. Se estima que existen unos 200 millones de personas afectadas y que causa de 300.000 a 500.000 muertes por año27. La infección producida por las diferentes especies de Schistosoma afecta en mayor grado y con más prevalecía a individuos jóvenes; a medida que avanza la edad, disminuye la carga parasitaria individual y aumenta la resistencia a la reinfección27. La distribución de la infección por diferentes especies es cambiante, dependiendo de las estrategias de control y de la aparición de nuevos focos28. De forma general, la infección por S. mansoni tiene lugar en muchos países de África, Sudamérica (Brasil, Surinam y Venezuela), varias islas del Caribe (entre ellas Puerto Rico, Santa Lucía, Guadalupe, Martinica, República Dominicana, Antigua y Montserrat) y en algunas zonas de Oriente Próximo. Entre las áreas de infección por S. haematobium figuran una gran parte de África continental e insular (Madagascar e islas Mauricio), Arabia Saudí y la provincia del Khuzestán en Irán. La distribución de la infección por S. japonicum es más limitada y comprende varias zonas de China (regiones próximas al río Yangtzé, las zonas lacustres de la región central y áreas montañosas de Sichuan y Yunnan), Filipinas e Indonesia (zona central de Sulawesi). Las otras 2 formas de infección por Schistosoma son de distribución muy limitada: S. intercalatum en la zona central de África (principalmente Gabón, Camerún y Zaire, con focos más aislados en Nigeria, República Central Africana, Chad y Burkina Faso) y S. mekongi en Laos y Camboya. En España no existe esquistosomosis como enfermedad autóctona debido, entre otros factores, a la ausencia de hospedadores intermediarios adecuados29. Sin embargo, cada vez se describen más casos importados, tanto en inmigrantes como en viajeros. Aunque el número de casos declarados al Sistema de Información Microbiológica es escaso (2 o 3 anuales), la revisión de los casos publicados o comunicados en congresos indica que la incidencia de esta enfermedad es mucho mayor30-32.
La infección por trematodos del género Paragonimus afecta a unos 22 millones de personas en el mundo, con focos endémicos en varios países de Asia, África y América33. Los países asiáticos más afectados son Corea, Japón, Taiwan, región central de China y Filipinas, aunque también se ha descrito en Vietnam, Sri Lanka, Indonesia, Malasia, Laos y Tailandia. En África se distribuye en el centro-oeste, principalmente en Camerún, Nigeria, Guinea, Gambia y Liberia. En América se han descrito casos en muchos países, sobre todo en Ecuador, Perú, Colombia, Venezuela y parte de Brasil. La especie más importante, de forma global, es P. westermani, aunque dependiendo de las zonas geográficas se encuentran otras especies (p. ej., P. kellicotti en EE.UU.34, P. africanus y P. uterobilateralis en África35 o P. miyazakii en Japón36). Por las características del ciclo biológico, la mayor parte de las infecciones se deben al consumo de crustáceos crudos o escasamente cocinados, aunque en menor medida pueden producirse por la ingesta de carne de hospedadores paraténicos (p. ej., cerdo, oso o rata). Un aspecto de interés es la posibilidad de casos adquiridos en países occidentales al consumir crustáceos encurtidos (en vino o vinagre) exportados de zonas endémicas. En España no se han descrito casos autóctonos de paragonimosis y los importados son excepcionales37.
Las geohelmintosis son las parasitosis más frecuentes en el mundo: se calcula que aproximadamente 4.500 millones de personas están afectadas38. Los 3 tipos de geohelmintos con potencial afectación de estructuras respiratorias son A. lumbricoides, uncinarias y Strongyloides sp. La infección por A. lumbricoides es cosmopolita, pero con una prevalencia más elevada en los países en vías de desarrollo del área tropical y subtropical39. De cualquier forma, la prevalencia de esta infección es muy variable dependiendo de la edad (predominio en niños) y de las diferentes regiones del país. Los casos declarados en España al Sistema de Información Microbiológica han sido escasos hasta el año 1999 (de 10 a 20 casos anuales), fecha a partir de la cual se han incrementado de forma notable, probablemente por la influencia de la inmigración40. No existen datos concluyentes sobre la presencia actual de casos autóctonos en España, que, de cualquier forma, son excepcionales41,42. Las uncinariosis (ocasionadas por A. duodenale y N. americanus) son las helmintosis cuya prevalencia mundial es mayor19. Su distribución es cosmopolita, aunque predominan en Asia (especialmente en China) y en el África subsahariana. N. americanus tiene una distribución más cosmopolita, mientras que A. duodenale está restringido a áreas más concretas. La infección por uncinarias presenta, a diferencia de la ascariosis, un predominio en la edad adulta. En nuestro país prácticamente sólo se ha descrito como enfermedad importada39,43. La infección producida por nematodos del género Strongyloides es prevalente en extensas áreas de clima tropical de Asia, África y América, disminuyendo a medida que las zonas geográficas se alejan del trópico. Las 2 principales especies que parasitan a humanos son S. stercoralis y S. fulleborni. Se estima que entre 80 y 100 millones de personas que habitan zonas templadas del planeta se encuentran infectadas por S. stercoralis44, mientras que la infección por S. fulleborni se limita a zonas de África y Papúa-Nueva Guinea45. En España, es común tanto la descripción de estrongiloidosis autóctonas (particularmente en la Comunidad Valenciana)20,46-48 como de formas importadas39,49.
Existen 2 tipos de infección por filarias capaces de ocasionar lesiones respiratorias: las filariosis linfáticas y la dirofilariosis. Las primeras están producidas por 3 especies (W. bancrofti, B. timori y B. malayi), con una distribución geográfica diferente. Se ha descrito la infección por W. bancrofti en aproximadamente 80 países; aproximadamente un tercio de los casos corresponde a África, otro tercio a la India y el resto al sur de Asia, el Pacífico y zonas de Centro y Sudamérica. Los países con mayor prevalencia son: India, Nigeria, Bangladesh, Indonesia, República Democrática del Congo, Filipinas y Madagascar50. La infección por Brugia sp. se limita al sur y sudeste asiático, en concreto a China, India, Indonesia, Malasia, Timor, Sri Lanka, Tailandia y Vietnam. Globalmente la filariosis linfática afecta a unos 120 millones de personas38. En España todos los casos de filariosis linfática descritos son importados51. La infección por D. immitis es cosmopolita. Afecta principalmente a perros y gatos en zonas con un clima cálido y templado, aunque se extiende de forma progresiva a otras regiones del planeta. Habitualmente afecta a cánidos y específicamente a perros, y es infrecuente el diagnóstico en humanos14. Los hospedadores intermediarios son aproximadamente 70 especies de mosquitos pertenecientes a varios géneros (Culex, Aedes, Anopheles y Mansonia). En España la dirofilariosis pulmonar se ha descrito como enfermedad autóctona en la provincia de Salamanca52,53, aunque la elevada seroprevalencia en perros en otras zonas de España, como Canarias54, hace suponer que esta entidad está infradiagnosticada.
La triquinelosis es una enfermedad de distribución mundial y en la actualidad se estima que en el mundo hay más de 11 millones de enfermos55. Por las características del ciclo biológico, esta enfermedad aparece habitualmente en forma de brotes en zonas muy diversas del mundo, como el este de Europa (Rusia, Rumania, Polonia, Bulgaria, antigua Yugoslavia, repúblicas bálticas), zonas rurales de Asia (sobre todo China) y algunos países de Sudamérica (Argentina, Uruguay, Chile y México). Las distintas especies de Trichinella ocupan diferentes nichos ecológicos. Las especies más cosmopolitas son T. spiralis y T. pseudospiralis, mientras que otras presentan una distribución más restringida (p. ej., T. nativa, que puede sobrevivir a temperaturas de congelación, tiene distribución subártica, y T. nelsoni, capaz de soportar elevadas temperaturas, se encuentra en regiones tropicales)56. En España, la triquinelosis es principalmente una enfermedad autóctona y se han descrito brotes en diferentes regiones57.
La prevalencia de toxocariosis en cualquier región o país es difícil de establecer, ya que: a) el cuadro clínico no es patognomónico; b) no existe un diagnóstico parasitológico directo, y c) las técnicas serológicas presentan una amplia reactividad cruzada. Por ello, el diagnóstico de casos clínicos de toxocariosis ("larva visceral emigrante") en España es anecdótico, ya sean casos autóctonos o importados. Sin embargo, la elevada seroprevalencia en humanos en varias zonas de España (un 32,8% en niños de Galicia58, un 3,4% en población general en Canarias59, un 14,1% en personas con eosinofilia en Barcelona60, un 8,5% en niños de áreas urbanas en Salamanca61 y un 1% en niños en Madrid62) debe hacer pensar en la existencia de formas asintomáticas o en un infradiagnóstico de formas clínicas.
Mecanismos de enfermedad y manifestaciones clínicas
En el aparato respiratorio, los helmintos mencionados dan lugar a manifestaciones clínicas por 2 mecanismos principales: a) la lesión mecánica debida a la presencia del parásito o a la obstrucción de estructuras (vasculares o bronquiales), y b) la respuesta inmunológica al parásito o a elementos de éste. En ocasiones las manifestaciones clínicas son escasas, siendo la alteración de las pruebas complementarias (p. ej., radiografía de tórax y/o hemograma) los datos que indican la presencia de helmintosis.
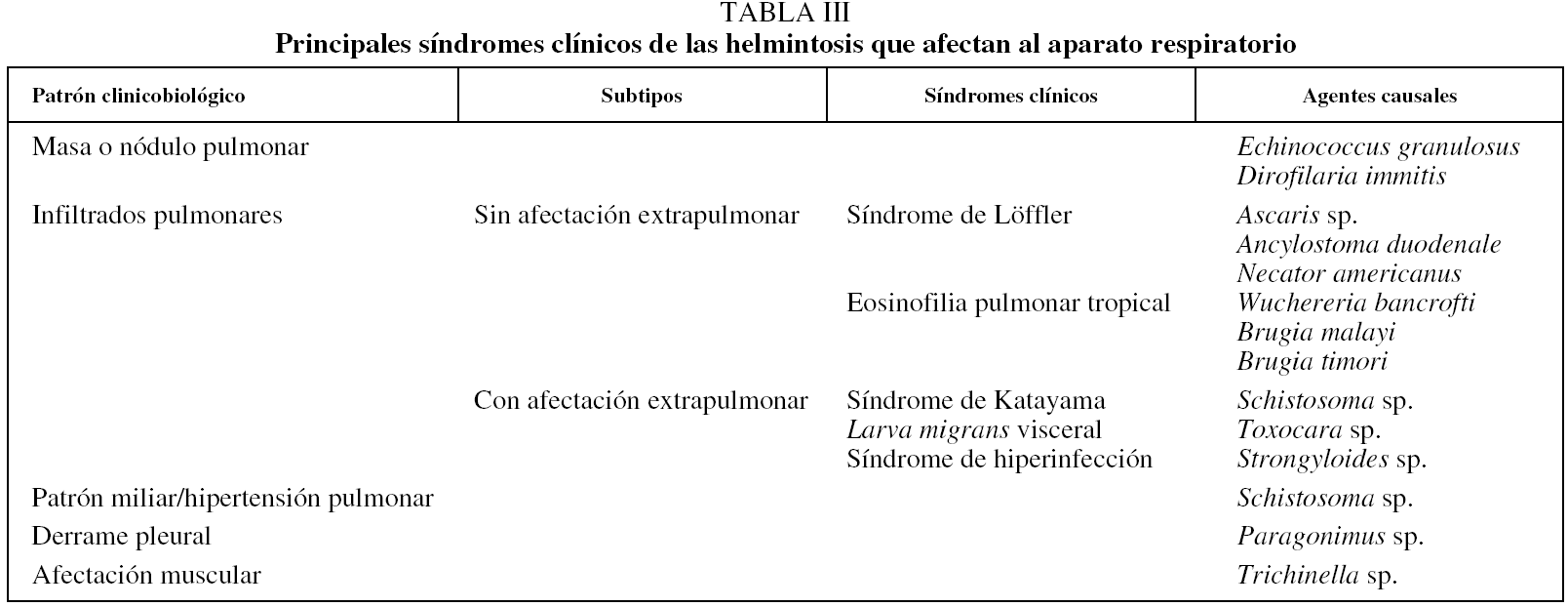
Los principales patrones clínicos y biológicos de afectación pulmonar y los helmintos responsables se indican en la tabla III.
Masa o nódulo pulmonar
Las 2 helmintosis que se expresan por este patrón son la hidatidosis (masa pulmonar única o múltiple) y la dirofilariosis (nódulos pulmonares).
La hidatidosis es la helmintosis pulmonar más frecuente. Sus manifestaciones clínicas y biológicas varían dependiendo del número de quistes y del estado de éstos. El período de incubación entre el contagio y las manifestaciones es muy variable, desde meses hasta, más frecuentemente, años. Aunque se han descrito casos en pacientes desde uno hasta 75 años, la edad más frecuente en el área mediterránea son los 20-40 años, sin predominio en función del sexo4,17,63. En general la aparición de hidatidosis pulmonar se asocia a edades más tempranas que la forma hepática pura, lo que se ha atribuido a la mayor distensibilidad del parénquima pulmonar64. La asociación con lesiones hepáticas es menos frecuente de lo que parecería lógico desde el punto de vista patogénico (20-40%) y puede estar relacionada con la infección con diferentes cepas de E. granulosus65. Globalmente, se considera que un 70-80% corresponde a quistes únicos y un 20-30% a formas múltiples64,66. El tamaño oscila entre 1 y 20 cm y la localización principal son los lóbulos inferiores, sobre todo la región inferior, con una distribución similar en ambos pulmones64,66. Las manifestaciones clínicas dependen de la integridad o rotura del quiste, así como de las complicaciones asociadas a la rotura67. Así, en la hidatidosis pulmonar no complicada, lo más frecuente es la ausencia de síntomas; durante la rotura el dato más característico es la presencia de vómica, mientras que las formas complicadas (p. ej., infección bacteriana secundaria, rotura a pleura) se expresan por múltiples síntomas y signos67. En series amplias, los datos más frecuentes son: tos (62%), dolor torácico (56%), expectoración (42%) y fiebre (32%)17. Hasta un 10% de los casos pueden desarrollar un cuadro sistémico de anafilaxia durante la rotura17. Los estudios de imagen aportan, dependiendo del estado del quiste, una rica semiología, revisada en profundidad por Pedrosa et al64 y Ramos et al67.
La dirofilariosis pulmonar humana se expresa habitualmente por la detección de alteraciones radiológicas en pacientes asintomáticos o con síntomas respiratorios inespecíficos13. Las formas más frecuentes son la presencia de nódulos pulmonares (persistentes o transitorios) o la detección de "granulomas"13,52,53.
Infiltrados pulmonares
La aparición de síntomas respiratorios (tos, expectoración, disnea, ocasionalmente hemoptisis y dolor torácico) asociados a infiltrados alveolares en la radiografía simple de tórax es otra forma de manifestación de infección pulmonar por helmintos. La afectación concomitante extrapulmonar ayuda en la orientación diagnóstica.
Sin afectación extrapulmonar. Los 2 cuadros característicos son el síndrome de Löffler y la eosinofilia tropical pulmonar. El síndrome de Löffler es una de las denominaciones más confusas de la medicina. Además de los problemas lingüísticos68, en la bibliografía médica se emplea en 2 contextos diferentes: los infiltrados transitorios pulmonares asociados a eosinofilia69 y la afectación endomiocárdica en el paciente con eosinofilia70. Específicamente, en el primer caso, la descripción original del síndrome de Löffler correspondía a la emigración transpulmonar de un helminto (probablemente Ascaris sp.)71, aunque posteriormente se ha aplicado a casos de afectación pulmonar y eosinofilia "asociados" a parasitosis sin paso transbronquial72 e incluso a infiltrados pulmonares transitorios de causa farmacológica73. En su sentido más estricto se caracteriza por la aparición de infliltrados pulmonares, eosinofilia en sangre periférica por el paso transbronquial de Ascaris sp.74. Aunque en textos clásicos es frecuente indicar que uncinarias e incluso Strongyloides sp. pueden asociarse a este síndrome, es excepcional encontrar casos bien documentados.
Por el contrario, la eosinofilia pulmonar tropical es un síndrome bien definido75, cuya patogenia es una reacción de hipersensibilidad a antígenos de filarias linfáticas (Wuchereria sp. y Brugia sp.). Clínicamente aparece principalmente en varones, con edad media entre 20 y 30 años, y existen diferencias raciales importantes (predomina en habitantes de la India). Habitualmente el cuadro clínico es el característico de un asma grave, con mala respuesta al tratamiento convencional. En la radiografía simple de tórax un 20% de los pacientes no muestran alteraciones; en el resto, el dato habitual es la presencia de infiltrados reticulonodulares, con un predominio en campos medios e inferiores.
Con afectación extrapulmonar. En este contexto, las principales posibilidades diagnósticas son el síndrome de Katayama, la toxocariosis (larva migrans visceral) y el síndrome de hiperinfección por estrongiloides.
El síndrome de Katayama es característico de la esquistosomosis aguda y por ello aparece más frecuentemente en viajeros que en inmigrantes8,76. Es habitual comprobar en la historia clínica el contacto con agua dulce potencialmente infectada entre 15 días y 3 meses antes de la aparición de las manifestaciones. En su forma completa, los pacientes presentan fiebre, cefalea, mialgias generalizadas, dolor en hipocondrio derecho y manifestaciones respiratorias inespecíficas (tos, disnea); estas últimas son más frecuentes en la infección por S. mansoni que en la producida por S. haematobium. En la exploración física es frecuente detectar hepatomegalia dolorosa y ocasionalmente esplenomegalia. Los principales datos complementarios alterados son la eosinofilia (prácticamente constante) y la presencia de anomalías en la radiografía torácica, principalmente infiltrados micronodulares, condensación alveolar y engrosamiento de la pared bronquial77. Este cuadro clínico corresponde a una reacción de hipersensibilidad al helminto, en una fase del ciclo biológico en que no ha comenzado la oviposición, por lo que es característico que los estudios parasitológicos directos (coproparasitario, detección de huevos en orina) sean negativos.
La toxocariosis visceral (larva visceral emigrante) es un cuadro característico de la infancia, principalmente en niños con geofagia y/o onicofagia15,78. Las manifestaciones clínicas habituales son las hepáticas (hepatomegalia dolorosa) y las pulmonares (broncospasmo). Pueden aparecer además lesiones cutáneas (prurigo y urticaria), articulares (artritis), miocarditis, glomerulonefritis y alteraciones neurológicas (p. ej., crisis epilépticas). En los exámenes complementarios es muy característica la presencia de eosinofilia, hipertransaminasemia e hipergammaglobulinemia.
La infección por Strongyloides sp. en el paciente inmunocompetente habitualmente no ocasiona manifestaciones respiratorias, aunque en algunos casos se ha atribuido a este helminto la presencia de asma. Una situación diferente tiene lugar durante la estrongiloidosis diseminada, habitualmente por hiperinfección79. Aunque existen casos de estrongiloidosis diseminada en personas inmunocompetentes, la mayor parte de los casos aparecen en presencia de 2 factores de riesgo: el empleo de glucocorticoides y la infección por HTLV-1 (virus linfotrópico humano de células T tipo 1)79,80. En estas circunstancias, las larvas rabditiformes se transforman en filariformes que penetran en la circulación. Las manifestaciones pulmonares son muy variadas y corresponden a 2 patrones lesionales aislados o asociados: a) infección bacteriana (por bacterias transportadas desde el intestino), y b) hemorragia alveolar difusa79-83. El cuadro clínico es muy variable, desde formas paucisintomáticas hasta formas graves con disnea, tos de características variables, hemoptisis y opresión precordial. Es muy frecuente la asociación con manifestaciones digestivas (dolor abdominal, náuseas, vómitos, diarrea o estreñimiento). En la radiografía de tórax habitualmente aparecen infiltrados pulmonares intersticiales bilaterales o focales. A diferencia de los otros cuadros mencionados, la eosinofilia no es un dato frecuente, lo que dificulta la sospecha diagnóstica. En el esputo o en otras muestras respiratorias es posible la visualización de larvas filariformes o rabditiformes, e incluso huevos del parásito.
Patrón miliar e hipertensión pulmonar
La asociación entre un patrón miliar y la detección de hipertensión pulmonar (e incluso datos de cor pulmonale) es el patrón característico de la esquistosomosis crónica77,84. Esta forma de enfermedad representa la consecuencia de la embolización de huevos de Schistosoma que ocasionan una respuesta inflamatoria granulomatosa, siendo la hipertensión secundaria a estas lesiones. Las manifestaciones clínicas corresponden a la hipertensión pulmonar, con disnea y dolor torácico sordo, a los que pueden añadirse datos de insuficiencia cardíaca derecha. En la radiografía de tórax el patrón más característico es el miliar (simulando una tuberculosis) y los datos habituales de hipertensión pulmonar.
Derrame pleural
Aunque en varias de las helmintosis mencionadas puede aparecer derrame pleural, esta manifestación respiratoria es especialmente relevante en la paragonimosis85. Su frecuencia oscila entre el 40 y el 70% de los pacientes y se asocia a lesiones en el parénquima pulmonar subyacente en forma de lesiones quísticas o nódulos. Aproximadamente el 20% de los pacientes con afectación respiratoria detectada por estudios de imagen están asintomáticos, mientras que el resto presenta algún síntoma como tos o dolor torácico. La asociación con eosinofilia periférica es un dato constante, sobre todo cuando hay afectación pleural.
Afectación muscular
La infección por las diferentes especies de Trichinella afecta de forma predominante al tejido muscular estriado (esquelético o cardíaco)86. Por ello, la afectación pulmonar durante esta helmintosis deriva de la afectación de la musculatura respiratoria (principalmente del diafragma, músculo afectado con mayor intensidad87) y, menos frecuentemente, de la aparición de miocarditis e insuficiencia cardíaca87.
Diagnóstico
El diagnóstico de las helmintosis pulmonares depende inicialmente de la sospecha clínica basada en los patrones antes señalados. Excepto en la dirofilariosis pulmonar y en el síndrome de hiperinfección por Strongyloides sp., es frecuente encontrar eosinofilia en sangre periférica, lo que puede ayudar en la sospecha de esta posibilidad diagnóstica. Tras la sospecha clínica, el empleo de métodos directos (visualización del parásito, detección de proteínas específicas o material genético) o indirectos (serología) permitirá el diagnóstico final88-93. En la tabla IV se resumen las principales técnicas diagnósticas directas. Aunque existen procedimientos comerciales de diagnóstico, creemos pertinente señalar que en ocasiones dan lugar a resultados falsos (tanto positivos o negativos), lo que conduce a errores importantes en la práctica clínica (T. Gárate, comunicación personal).
Tratamiento
El tratamiento de las helmintosis que afectan al aparato respiratorio es principalmente farmacológico, reservándose la cirugía para la hidatidosis4,11,12,15,27,52,53,66,67,84,85,94-98. Los fármacos más utilizados son: albendazol, ivermectina, praziquantel y dietilcarbamacina (los 3 últimos únicamente accesibles a través de medicamentos extranjeros).
El tratamiento de la hidatidosis pulmonar se basa en la cirugía y/o empleo de fármacos (albendazol y/o praziquantel)4,66. En esta localización no es útil la estrategia PAIR (punción, aspiración, inyección y reaspiración), empleada en otras regiones anatómicas. La cirugía está indicada de entrada en presencia de quistes de gran tamaño, localización superficial, complicaciones locales, afectación de estructuras vitales o gran efecto de masa. Puede encontrarse una revisión exhaustiva de las técnicas quirúrgicas concretas en el artículo de Ramos et al67. Independientemente de la técnica empleada, existen 2 aspectos importantes: a) si es posible, el tratamiento preoperatorio (con albendazol asociado o no a praziquantel) durante un mes disminuye la viabilidad del parásito94,95, y b) es esencial evitar la diseminación de protoescólices durante la intervención. Sin embargo, la utilidad del empleo intraoperatorio de sustancias protoescolicidas (etanol, suero salino hipertónico, cetrimida) no está perfectamente establecida. Además de su utilidad en el tratamiento preoperatorio, el uso de antiparasitarios es una opción adecuada en casos sin las indicaciones quirúrgicas previamente señaladas. El más eficaz es el albendazol, empleado de forma aislada o asociado a praziquantel (aunque el efecto de este último es indirecto, al aumentar la concentración de aquél). Tradicionalmente se indicaban entre 3 y 6 ciclos mensuales de albendazol con intervalos libres de 15 días, aunque estudios recientes señalan que el tratamiento continuado es más eficaz95.
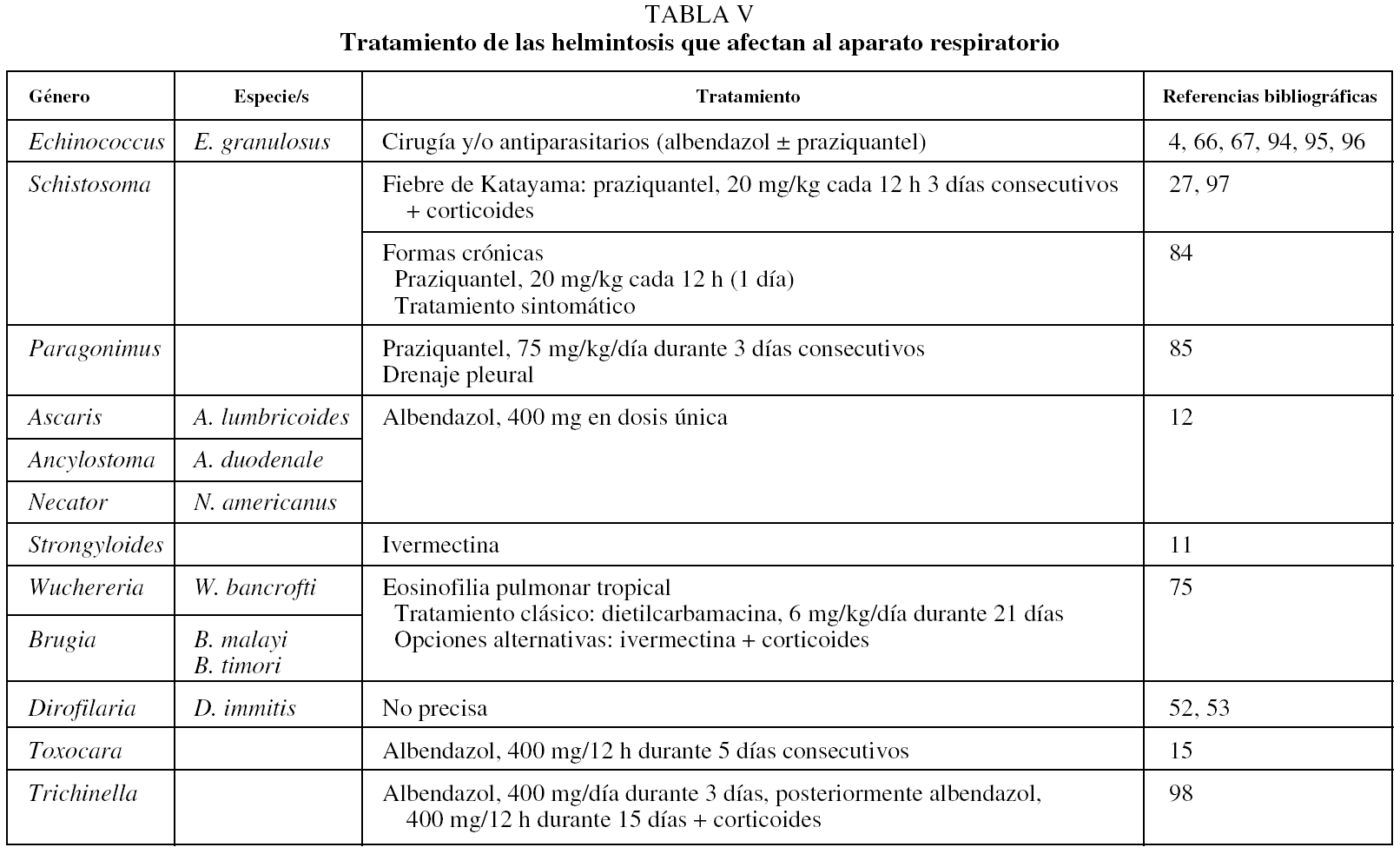
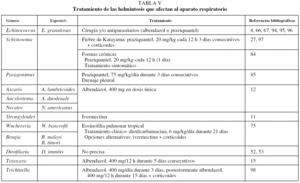
En la tabla V se indican las pautas terapéuticas más útiles en el resto de las parasitosis mencionadas.
Recibido: 11-2-2005; aceptado para su publicación: 1-3-2005.
Correspondencia: Prof. J.L. Pérez-Arellano.
Departamento de Ciencias Médicas y Quirúrgicas.
Centro de Ciencias de la Salud.
Universidad de Las Palmas de Gran Canaria.
35080 Las Palmas de Gran Canaria. Las Palmas. España.
Correo electrónico: jlperez@dcmq.ulpgc.es