Introducción
La protección de los sujetos objeto de la investigación constituye la base fundamental de la ética en la investigación clínica1. Los ensayos clínicos controlados son, indiscutiblemente, el instrumento para valorar la eficacia y seguridad de los nuevos medicamentos y corresponden, en general, a la fase culminante de la investigación farmacéutica en biomedicina. Debemos tener siempre presente que la participación de los sujetos en un ensayo clínico genera una situación en la que fácilmente se pueden vulnerar sus derechos básicos. Por esta razón, los ensayos clínicos con medicamentos deben conducirse de acuerdo con las normas éticas y legales que rigen la investigación con seres humanos2.
Al diseñar un ensayo clínico en neumología se debe considerar que es obligado precisar y delimitar adecuadamente diversos aspectos que son específicos y propios de cada enfermedad. Tener en cuenta este hecho es necesario para que el ensayo clínico alcance el nivel científico requerido y esté éticamente justificado y, por tanto, para que sus resultados sean útiles a los participantes y a la sociedad. En definitiva, el objetivo de un ensayo clínico es responder a preguntas concretas que han de formularse con carácter previo3.
Por otro lado, no debemos perder de vista que, aunque el juicio ético se realice sobre un ensayo clínico en concreto, la industria farmacéutica promotora y las autoridades reguladoras son conocedoras del plan de desarrollo clínico de un fármaco y tienen un panorama más amplio, en el cual el ensayo clínico concreto constituye sólo un paso en un proceso con un objetivo final: la autorización de la comercialización del fármaco y su ulterior correcta utilización terapéutica, que se alcanza tras recorrer con éxito diferentes etapas para poder contestar las diversas preguntas planteadas4.
El acuerdo tácito entre los editores de revistas biomédicas de la Convención de Vancouver de no publicar los originales derivados de proyectos de investigación que no hayan recibido la aprobación de un comité ético de investigación clínica (CEIC) ha incrementado la necesidad de conocer los requisitos en este sentido5.
Haciendo un breve recorrido histórico advertimos que los códigos, declaraciones y regulaciones éticas sobre investigación clínica son posteriores a la Segunda Guerra Mundial y, en su inicio, una de las consecuencias de lo ocurrido en los campos de concentración nazis, donde se sometió a los prisioneros a crueles experimentos en contra de su voluntad, como consecuencia a hechos determinados y para evitar futuros escándalos.
El Código de Nuremberg (1947)6, que surge como consecuencia de la decisión judicial que condenó las atrocidades acometidas por los nazis, se centra en la necesidad de obtener el consentimiento del sujeto y en el balance favorable de la relación beneficio/riesgo. Sin embargo, no trata de la justa selección de los sujetos ni de la evaluación independiente de los ensayos. Posteriormente, la Asociación Médica Mundial desarrolló la Declaración de Helsinki (1964), con sus posteriores revisiones (Tokio 1975, Venecia 1993, Hong Kong 1989, Sudáfrica 1996 y Edimburgo 2000)7, que vino a cubrir las deficiencias del Código de Nuremberg introduciendo por primera vez los principios éticos que debe seguir el médico al llevar a cabo una investigación con seres humanos, y que trata de distinguir entre la investigación médica asociada a la asistencia y la investigación biomédica no terapéutica con seres humanos. En la práctica, esta distinción resulta muchas veces difícil de establecer, de la misma forma que es difícil delimitar la función médica asistencial de la investigación. El Informe Belmont (1979)8 establece, por el contrario, una línea continua entre ambas actividades (asistencia e investigación) y unos principios básicos aplicables a todas las situaciones. Se centra en el consentimiento informado, en el balance favorable de la relación beneficio/riesgo y en la necesidad de protección de las poblaciones vulnerables para que no sean objeto de investigaciones de riesgo. Las directrices éticas sobre investigación biomédica con seres humanos del CIOMS (Council for International Organizations of Medical Sciences), propuestas en 1982, revisadas en 1993 y en 1999 y publicadas finalmente en 2002, recogen además una sección sobre la compensación para los sujetos en caso de que sufran daños derivados de la investigación9. En la tabla I se recoge una selección de normas éticas fundamentales para la investigación biomédica en seres humanos.
El Informe Belmont8 fue el primero en proporcionar una estructura analítica que pudiera servir de guía para resolver problemas éticos planteados por la investigación con seres humanos y estableció los principios básicos de la bioética. Su aplicación sigue siendo válida hoy día10.
El primer principio ético básico es el de autonomía, que incorpora 2 convicciones éticas: a) se debería tratar a los individuos como sujetos autónomos, y b) las personas cuya autonomía está disminuida deben ser objeto de protección (ignorancia, incapacidad psíquica, inmadurez etc.). La consecuencia práctica de este primer principio es la obligatoriedad de obtener el consentimiento informado antes de iniciar cualquier investigación. La cuestión clave consiste en transmitir al paciente, de forma fidedigna y no engañosa, cuáles van a ser los beneficios que va a obtener por su participación en un determinado ensayo y cuáles los riesgos que puede entrañar.
El segundo y el tercer principios básicos son los de beneficencia y su consecuencia, la no maleficencia, que el investigador debe entender como una obligación casi absoluta y sólo limitada por la necesidad de respetar simultáneamente el principio de autonomía. El respeto a este principio en el ámbito de la investigación clínica supone que un ensayo clínico sólo es justificable cuando se reducen al mínimo los posibles riesgos y se potencian al máximo los posibles beneficios para los participantes11.
El cuarto gran principio es el de justicia. Su proyección práctica es la respuesta a la pregunta: ¿quién debe recibir los beneficios de la investigación y quién sufrir sus cargas? Debería existir una proporción entre los sujetos que participan en un ensayo y el colectivo que recibirá los posibles beneficios. El posible beneficio para la sociedad de una investigación frente a los riesgos que debe afrontar un sujeto determinado es un juicio difícil de establecer y requiere un análisis minucioso por todas las partes implicadas: promotor, evaluador, investigador, CEIC y sujeto participante en el ensayo. Por parte de este último, su participación en el ensayo supone un acto de altruismo para con la sociedad, en beneficio de otros, que debe valorarse convenientemente11.
Para poder establecer la relación que existe entre dichos principios y buscar en cada caso una situación de equilibrio, Gracia12 estableció 2 niveles que se explican a continuación. El primer nivel contiene los principios de justicia y de no maleficencia, cuyo incumplimiento debería llevar a la denegación de toda investigación. No deberían permitirse los ensayos en los que el sujeto vaya a sufrir daño gratuito, bien sea porque se le ha seleccionado por su situación de vulnerabilidad o por participar en un estudio mal diseñado y del cual no va a obtenerse beneficio alguno para él o para la sociedad. En el segundo nivel se situarían los principios de beneficencia y autonomía, a los cuales no podemos dar un valor absoluto, ya que, por ejemplo, si un paciente quiere participar en un determinado ensayo, pero el investigador está convencido de que esa opción sería perjudicial para él, la consideración absoluta del principio de autonomía no sería posible sin vulnerar el de beneficencia. Por el contrario, si un investigador está plenamente seguro de que la mejor opción para un paciente es su participación en un ensayo concreto, pero éste no desea participar en él, nos encontramos en una situación en la que la consideración absoluta del principio de beneficencia no es posible sin vulnerar el de autonomía.
Las normas de buena práctica clínica también surgieron de la necesidad de garantizar la calidad de la investigación y la protección de los derechos de los sujetos en investigación clínica, con la finalidad de controlar el registro para la comercialización de nuevos medicamentos. Establecidas por la Food and Drug Administratrion estadounidense en 197713, posteriormente se implementaron en Europa, donde son de obligado cumplimiento desde 199114,15.
Legislación en España
En España la Constitución es la norma de rango superior y las leyes deben respetarla. Los valores recogidos en ella constituyen el entramado jurídico positivo de los derechos fundamentales desde los cuales se deben valorar y organizar los ensayos clínicos. En caso de discordancia o contradicción entre los valores y derechos constitucionales y otros de cualquier tipo, deben prevalecer los primeros2.
La Ley 25/1990 de 20 de diciembre, del Medicamento16, marca el inicio de una nueva época en la que la investigación clínica deberá efectuarse en España de acuerdo con los conceptos éticos y técnicos más modernos. Posteriormente, el Real Decreto 561/1993, de 16 de abril, establece las funciones y responsabilidades concretas de los agentes implicados en la realización de ensayos clínicos, así como los requisitos para su autorización. En este reglamento se hace referencia a la necesidad de seguir las normas de buena práctica clínica y se recogen los aspectos éticos mínimos de obligado cumplimiento para la práctica de ensayos clínicos con medicamentos (artículos 10 y 12, respeto a postulados éticos)17.
El nuevo Real Decreto 223/2004 de 6 de febrero (RCL 2004, 325)18, incorpora la Directiva 2001/20/CE del Parlamento Europeo y del Consejo, de 4 de abril de 2001 (LCEur 2001, 1529)19, que ha venido a armonizar las legislaciones de los Estados miembros de la Unión Europea sobre ensayos clínicos con medicamentos en seres humanos. En este Real Decreto se tienen en cuenta los fundamentos de la Declaración de Helsinki, el Convenio de Oviedo20 sobre los derechos humanos y la biomedicina, así como las normas para la adecuada protección de los datos personales que establece la Ley Orgánica de Protección de Datos de Carácter Personal 15/1999, de 13 de diciembre de 1999, en nuestro país21. Incorpora además la obligación de aplicar las normas de buena práctica clínica a la planificación, realización, registro y comunicación de todos los ensayos clínicos que se practiquen en España, como conjunto de exigencias éticas y científicas de calidad reconocidas a escala internacional y como garantía de la salvaguarda de los derechos, la seguridad y el bienestar de los sujetos participantes en investigación, así como sobre la fiabilidad de sus resultados22.
Queremos destacar los principios generales que este nuevo Real Decreto establece para los ensayos clínicos en España23:
1. No se podrá iniciar ningún ensayo clínico sin contar con el dictamen favorable del CEIC correspondiente y la autorización de la Agencia Española de Medicamentos y Productos Sanitarios.
2. A todos los ensayos clínicos que se efectúen en España les aplicarán las normas de buena práctica clínica de la Unión Europea.
3. Ningún sujeto podrá ser incluido en un ensayo clínico si previamente no ha expresado su consentimiento tras haber sido informado de los posibles riesgos. Se dedica especial atención a las poblaciones vulnerables, como los menores y adultos incapacitados
4. Todos los ensayos clínicos con medicamentos, salvo los que se efectúen con medicamentos en las indicaciones autorizadas, deberán contar con un seguro que cubra los daños y perjuicios que, como consecuencia del ensayo clínico, pudieran resultar para los sujetos participantes en él.
5. El promotor del ensayo ha de comunicar la información de seguridad del medicamento en investigación a las autoridades competentes y a los CEIC encargados del seguimiento del ensayo.
La transposición de este Real Decreto ha supuesto además cambios importantes en cuanto a la evaluación de los ensayos por parte de los CEIC. La exigencia del "dictamen único" por país para ensayos multicéntricos y su puesta en marcha ha supuesto una enorme complicación y un gran esfuerzo para los CEIC españoles, que de momento no reciben el suficiente respaldo de las Autoridades Sanitarias competentes en esta materia24. El nuevo Real Decreto ha venido a incrementar las dificultades clásicas de los CEIC (falta de medios y de incentivos) y la desmotivación de sus miembros al no poder compaginar la carga de trabajo que representa ser miembro de un CEIC con la sobrecarga asistencial diaria. En estos momentos, los CEIC se enfrentan a difíciles problemas, como el de encontrar miembros dispuestos a trabajar sin ningún tipo de compensación y con la formación suficiente en aspectos éticos, legales y metodológicos para evaluar correctamente los estudios.
No debemos olvidar que los CEIC son los organismos que, en la práctica, garantizan que todas las normas, regulaciones y leyes se cumplan y son, según la definición del Real Decreto 223/2004, "un organismo independiente, constituido por profesionales sanitarios y miembros no sanitarios, encargado de velar por la protección de los derechos, seguridad y bienestar de los sujetos que participen en un ensayo y de ofrecer garantía pública al respecto, mediante un dictamen sobre el protocolo del ensayo, la idoneidad de los investigadores y la adecuación de las instalaciones, así como los métodos y los documentos que vayan a utilizarse para informar a los sujetos del ensayo con el fin de obtener su consentimiento informado".
Quedan muchos aspectos organizativos por resolver en relación con el nuevo sistema de funcionamiento y evaluación de los ensayos clínicos por parte de los CEIC. La falta de operatividad del Centro Coordinador de CEIC y el escaso apoyo, en muchos casos, de las comunidades autónomas y de la gerencias de los hospitales han hecho que los CEIC trabajen aplicando criterios individuales sin coordinación entre ellos. En nuestra opinión, sería muy deseable que estos problemas prácticos se resolviesen lo antes posible, pues el papel de estos organismos es principalmente el de velar por el respeto de los derechos de los pacientes y, en muchos casos, son los impulsores de la buena práctica en investigación clínica.
Otro de los problemas que añade el nuevo Real Decreto radica en las dificultades con que se encuentran los investigadores para actuar como promotores de los ensayos no financiados por la industria. Estas dificultades son 2 principalmente: la aportación de la póliza de seguro o garantía financiera que cubra los posibles daños a los sujetos participantes, y el suministro de los fármacos en investigación. Además, podemos añadir el profundo desconocimiento de las obligaciones y responsabilidades que implica para el investigador cuando actúa como promotor.
Papel de la neumología en la investigación clínica con medicamentos en nuestro hospital
Al revisar y analizar todos los ensayos clínicos sometidos y evaluados por el CEIC de nuestro hospital en el período 2000-2003 y asignar cada uno de ellos al servicio al que pertenece el investigador principal, hemos obtenido los siguientes resultados: de los 639 ensayos totales evaluados (156 en 2000, 140 en 2001, 165 en 2002 y 178 en 2003), el 56% (n = 359) han sido de especialidades médicas y el 7,5% (n = 27) de respiratorio. La neumología se sitúa en el sexto lugar en la investigación clínica con medicamentos en nuestro hospital. Una gran mayoría de estos ensayos (93%) han estado promovidos por la industria farmacéutica y sólo el 7% son independientes de ésta y han estado promovidos por clínicos y/o sociedades científicas.
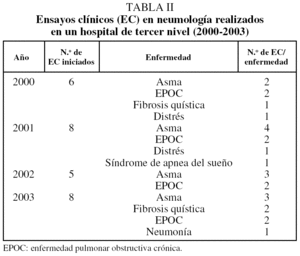
En la tabla II se recogen las enfermedades sobre las que se han efectuado dichos estudios. Observamos que el 74% de los ensayos clínicos en neumología pertenecen a 2 grupos de enfermedades: asma (44%) y enfermedad pulmonar obstructiva crónica (29,6%). Hemos detectado además que los ensayos clínicos en afecciones como la neumonía no se llevan a cabo en el servicio de neumología, salvo en contadas ocasiones, y sí en los de medicina interna y urgencias.
Aspectos éticos que deben considerarse en un ensayo clínico en neumología
La buena posición de la neumología en la investigación con medicamentos obliga a los investigadores a conocer y llevar a la práctica las normas éticas y legales que regulan este tipo de investigación, y no sólo a ser expertos en los procedimientos específicos, análisis estadísticos, medición de resultados y otros aspectos científicos del ensayo.
Como punto de partida para evaluar los aspectos éticos de un ensayo clínico puede resultar útil considerar uno a uno los 7 requisitos éticos (tabla III) propuestos por Emanuel et al25. Estos requisitos pretenden ser universales y es necesario que se cumplan en su totalidad, aunque deben aplicarse al caso concreto del protocolo propuesto, considerando las particularidades de los sujetos participantes, del equipo investigador y del centro, todo ello con el marco de referencia de la legislación vigente en España.
Vamos a detenernos a analizar estas cuestiones éticas problemáticas en relación con dichos requisitos en los ensayos clínicos para el desarrollo de nuevos fármacos en neumología.
Valor intrínseco de la investigación
El resultado previsible que se obtenga de una investigación debe ser valioso para los participantes y/o para la sociedad a corto o largo plazo. Esto debería significar mejoras terapéuticas o diagnósticas de una determinada enfermedad. Sólo de esta manera será justificable someter a los sujetos participantes en la investigación a posibles riesgos y usar recursos limitados. Los resultados, además, deberán publicarse, con independencia de que hayan sido positivos o negativos.
Un ensayo clínico no será ético si sus resultados no son generalizables, si la hipótesis inicial es inconsistente, si su diseño es erróneo o si su resultado ha sido ya demostrado.
La práctica clínica, normalmente, implica decidir cuál de los tratamientos disponibles es el más adecuado o si administrar un tratamiento a un paciente es mejor que no hacerlo, y éstas son las preguntas que deberían guiar la elección del tratamiento control en los ensayos clínicos. Es evidente que en investigación clínica la elección incorrecta del grupo control puede invalidar el estudio.
Validez científica del ensayo clínico
Toda investigación debe ser metodológicamente rigurosa. Un ensayo clínico puede plantearse un objetivo ambicioso pero, si no se conduce correctamente, no llegará a proporcionar la respuesta a la pregunta que se plantea y será intrínsecamente no ético. Expone a los participantes a riesgos sin que se obtenga nada a cambio y derrocha los recursos finitos disponibles para la investigación. Tampoco sería ético si la respuesta exacta que se busca ya ha sido contestada en el mismo ámbito. Un ensayo clínico que compara tratamientos debe tener una hipótesis nula adecuada y justa; de aquí la importancia del concepto de equipoise, que estrictamente se da cuando el cociente beneficio/riesgo es similar para 2 (o más) intervenciones, con la necesidad ética de que exista una duda razonable acerca de la superioridad de un tratamiento sobre el otro, incluido placebo, para justificar la puesta en marcha del ensayo. No obstante, esta situación se da rara vez en investigación clínica. Los beneficios y los riesgos son diferentes con cada una de las intervenciones y lo que se estudia son ambos factores de forma concurrente11. Si hubiera aceptación sobre cuál es el mejor tratamiento, no habría hipótesis nula y la investigación quedaría invalidada, pues sus resultados no vendrían a ampliar el conocimiento sobre cuál es el mejor tratamiento o sobre cuál es el balance beneficio/riesgo más favorable.
Justa selección de los pacientes
La justa selección de los pacientes engloba decisiones que van desde el desarrollo de los criterios de inclusión-exclusión del ensayo hasta la estrategia a seguir para conseguir el reclutamiento de los pacientes.
Los objetivos del ensayo deben ser la base para decidir el grupo de pacientes que se incluirán en él, no otros factores como la vulnerabilidad, la facilidad para el reclutamiento u otros no relacionados con los objetivos del ensayo. Tampoco sería ético privar a un grupo de pacientes de la oportunidad de participar en un ensayo sin una razón científica o sin datos que justifiquen su exclusión por ser más vulnerables a sufrir daños.
Es deseable que la investigación se haga en una población de pacientes que posteriormente pueda beneficiarse de sus resultados. Si un producto en fase de investigación tiene como destinatarios finales a las mujeres o a menores, debería probarse en estos grupos para tener datos de cómo puede afectarles. No obstante, no es necesario que todas las fases de desarrollo se efectúen en menores, pero sí sería adecuada la participación de éstos en fases avanzadas, tras haber probado la seguridad del producto en adultos.
Tampoco se debe perder de vista que el balance beneficio/riesgo resultante de un ensayo puede variar en función de la población en que se lleve a cabo. De acuerdo con los objetivos del ensayo, se debe seleccionar a los sujetos participantes para minimizar los riesgos, pero no para aumentar los resultados positivos buscados.
Relación beneficio/riesgo favorable
Un ensayo clínico sólo será justificable éticamente cuando: a) los riesgos potenciales para los sujetos participantes están minimizados; b) los beneficios potenciales para los sujetos participantes están favorecidos, y c) los beneficios potenciales para los sujetos participantes y/o para la sociedad son proporcionados o superan a los riesgos. Este requisito engloba los principios básicos de bioética de no maleficencia y beneficencia.
Las reflexiones metodológicas sobre el diseño de un estudio (hipótesis, tratamiento de control) que afectan al tamaño de la muestra de sujetos participantes en un ensayo clínico tienen una repercusión directa sobre la relación beneficio/riesgo individual del pacientes que toma parte en él.
El uso de placebo como grupo control es una de las cuestiones más controvertidas en investigación clínica. La polémica ética se basa en si es aceptable utilizar placebo como grupo control de comparación en un ensayo clínico cuando existe un tratamiento eficaz para una enfermedad. En el artículo 29 de la revisión realizada en octubre de 2000 de la Declaración de Helsinki de Edimburgo7, se establece que sólo es permisible el uso de placebo cuando no existe un método terapéutico probado. Esta indicación dio lugar a una gran controversia, que finalmente finalizó con la publicación de una nota aclaratoria por la Asamblea General de la Asociación Médica Mundial, en Washington, en 200226. En ella se indica que los ensayos clínicos controlados con placebo, en caso de existir un tratamiento probado, pueden ser éticamente aceptables si hay razones metodológicas firmes y convincentes que hagan necesario su uso, o si se investiga una enfermedad benigna y el sujeto participante que recibe placebo no corre ningún riesgo añadido que pueda causarle un daño grave o irreversible.
Proceso de revisión independiente del estudio
En nuestro país son los CEIC y la Agencia Española del Medicamento y Productos Sanitarios los garantes de que este requisito se cumpla y tienen la autoridad de aprobar, modificar o denegar un ensayo clínico. La investigación clínica pone en riesgo a seres humanos en beneficio de la sociedad. La evaluación por parte de estos organismos independientes garantiza a la sociedad que los sujetos participantes en estas investigaciones son tratados éticamente y evita que parte de la sociedad pueda beneficiarse a costa del abuso de otros seres humanos. Además, certifica a los posibles sujetos participantes que el ensayo tiene un diseño ético y que el balance beneficio/riesgo es favorable. Actualmente existen, para algunos estudios internacionales, comités independientes que practican análisis intermedios periódicos de datos de eficacia y seguridad durante toda la marcha del ensayo y tienen la capacidad de modificar el protocolo o interrumpirlos si lo consideran necesario.
Los organismos e instituciones públicos deberían apoyar más firmemente la actuación y labor de estos organismos independientes que velan por el bienestar y los derechos de los sujetos participantes en investigación.
Consentimiento informado
El consentimiento informado es el documento básico que garantiza el principio de autonomía y el derecho a la privacidad de los datos del paciente en la investigación. Mediante su firma, los sujetos competentes eligen libremente participar en el ensayo, y autorizan el procesamiento y análisis de los datos de sus historias clínicas15.
El consentimiento informado es un proceso que se inicia con la información al potencial participante de los pormenores del ensayo transmitida por el investigador mediante la hoja de información. Además, el investigador tiene el compromiso ético de garantizar la capacidad del sujeto para conceder el consentimiento. Cuando el sujeto esté privado de autonomía, serán sus representantes legales quienes deberán dar el consentimiento.
En ensayos clínicos en menores, la hoja de información debe dirigirse a los padres o representantes legales, a quienes se solicita el consentimiento para que su hijo o tutelado participe en el ensayo. Además, deberá existir una hoja de información para los menores maduros (mayores de 12 años y menores de 18), siempre que el menor esté en condiciones de entenderla, adaptada a su nivel de comprensión, donde se resuma la información general del estudio, para obtener su asentimiento.
La hoja de información al paciente debe ser cuidadosamente revisada y validada por el CEIC antes de la aprobación del estudio. De hecho, la mayoría de las aclaraciones y cambios solicitados por el CEIC de nuestro hospital afectan a la hoja de información.
Respeto a los derechos del sujeto
Los requisitos éticos para un determinado ensayo no terminan cuando el sujeto firma el consentimiento informado para participar. Los sujetos participantes deben continuar recibiendo un trato que respete sus derechos durante todo el ensayo, incluso si deciden interrumpir su participación por cualquier causa. Desde el inicio del estudio hasta su finalización se deben respetar los siguientes derechos:
1. Derecho a no participar o a la revocación del consentimiento sin perjuicios.
2. Derecho a ser informados de cualquier hecho relevante que surja durante el ensayo y que pueda influir en su decisión de continuar en él.
3. Derecho a que se mantenga la confidencialidad, con mención expresa a la Ley de Protección de Datos de Carácter Personal 15/1999, y a la protección de su intimidad.
4. Derecho a que el ensayo sea cuidadosamente monitorizado, controlando en todo momento que el protocolo se lleve a cabo según lo establecido y de acuerdo con los principios de la bioética y las normas de buena práctica clínica.
El seguimiento de los ensayos clínicos, desde su inicio hasta la recepción del informe final, es una de las funciones de los CEIC establecidas en el artículo 10 del capítulo III del Real Decreto 223/200418. Esta tarea es actualmente la "asignatura pendiente" de los CEIC. Llevarla a cabo de forma eficaz y estricta supondría, en hospitales como el nuestro, disponer de recursos humanos dedicados exclusivamente a esta labor.
Las agencias reguladoras también deben velar porque se mantengan altos los estándares de calidad del diseño y de la conducción de los ensayos clínicos, previamente establecidos por los promotores, investigadores y monitores, y ratificados por el CEIC. Los investigadores que conocen la normativa de buenas prácticas clínicas y la aplican a la investigación no deben tener problemas con las auditorías estipuladas por estos organismos. La mayoría de las compañías farmacéuticas desarrollan sus propias unidades de garantía de calidad, formadas por personal independiente de los ensayos clínicos, para auditar a los investigadores clínicos. Las deficiencias más frecuentes detectadas por auditores en los ensayos clínicos afectan principalmente al consentimiento informado, registro inadecuado de datos, seguimiento incorrecto del protocolo y mala contabilidad del fármaco1.
Conclusiones
La investigación clínica en neumología desempeña un papel cada vez más relevante en el desarrollo de la especialidad. Por ello se hace necesario el conocimiento de los aspectos éticos en investigación con seres humanos y, en concreto, en ensayos clínicos con medicamentos.
La protección de los sujetos participantes en investigación es una responsabilidad compartida entre varias personas y grupos de personas, pero es imprescindible que el investigador que conduce el estudio reconozca, lo antes posible, cualquier circunstancia que pueda afectar a su seguridad y/o sus derechos27.
En la actualidad se han abierto nuevas vías para progresar en el conocimiento de diversas enfermedades respiratorias y los ensayos clínicos son una herramienta esencial para avanzar en este sentido. La farmacología respiratoria proporcionará agentes y dispositivos o sistemas cada vez más útiles y con menores efectos secundarios. En consecuencia, los ensayos clínicos en neumología tienen su continuidad garantizada. Es más, con toda seguridad su importancia e implantación crecerán en los próximos años. Es esperable que los enfermos sean los beneficiarios finales de estos avances.
Ello viene a reforzar la idea de que los ensayos clínicos en nuestra especialidad deben ser muy rigurosos y ajustarse en todo momento a las normas éticas en investigación clínica para, en definitiva, proteger al máximo a los pacientes.
Agradecimiento
Se agradece la colaboración de todos los miembros del Comité Ético de Investigación Clínica del Hospital Universitario La Paz.
Recibido: 15-2-2005; aceptado para su publicación: 1-3-2005.
Correspondencia: Dr. R. Álvarez-Sala.
Servicio de Neumología (planta 12). Hospital Universitario La Paz.
Paseo de la Castellana, 261. 28046 Madrid. España.
Correo electrónico: ralvarezw.hulp@salud.madrid.org