La neumonía adquirida en la comunidad (NAC) es una infección frecuente y grave. El objetivo de este trabajo es estudiar la utilidad pronóstica del porcentaje de neutrófilos (NCP) y del cociente neutrófilos/linfocitos (NLR) en pacientes con NAC.
MétodosEstudio retrospectivo de pacientes hospitalizados por NAC con analítica al ingreso y una segunda extracción de control a los 3-5 días. Se consideraron variables desenlace la mortalidad a 30 y 90 días.
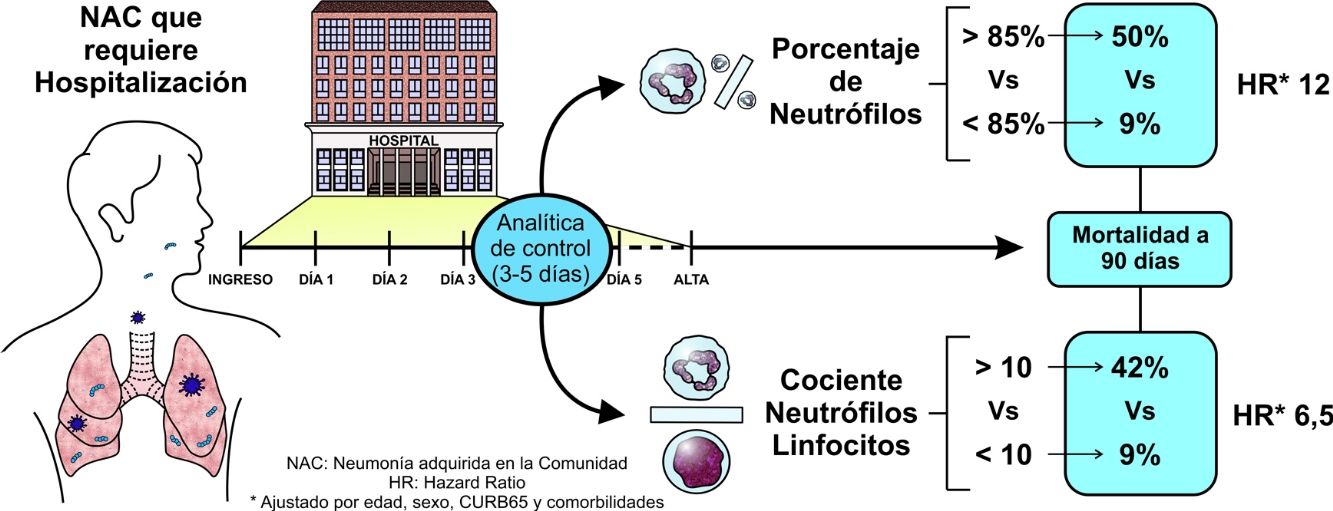
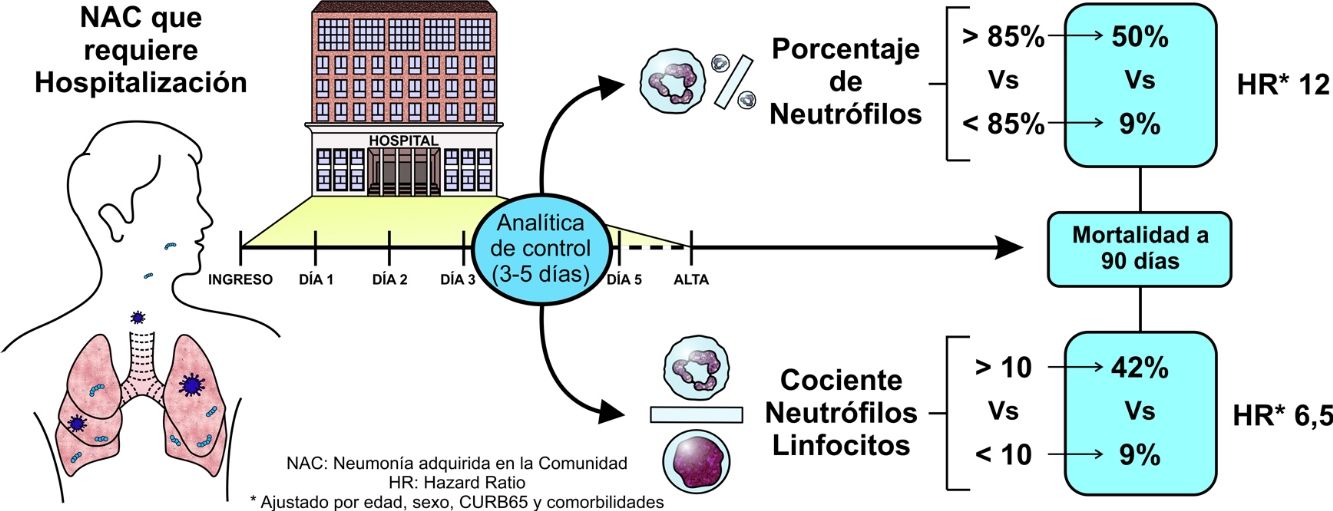
ResultadosSe incluyó a 209 pacientes. Los pacientes que sobrevivieron redujeron significativamente el NCP y el NLR entre la analítica al diagnóstico y la de control (desde el 85,8 hasta el 65,4% para NCP y de 10,1 a 3,2 para NLR). Fallecieron 25 pacientes en los primeros 90 días. En ellos hubo un menor descenso no significativo para el NCP (del 84,8 al 74,0%) y para NLR (de 9,9 a 6,9). Los valores de NCP y NLR en la analítica de control fueron significativamente mayores en los pacientes fallecidos que en los supervivientes. Aquellos pacientes que presentaron en la analítica de control un NCP superior al 85% o un NLR superior a 10, presentaron un riesgo de mortalidad superior tras ajuste multivariable (HR para NCP 12 y para NLR 6,5).
ConclusiónNCP y NLR son parámetros sencillos y de bajo coste, con utilidad pronóstica especialmente al medirse a los 3-5 días del diagnóstico de NAC. Niveles altos de NLR o NCP se asocian con mayor riesgo de mortalidad a los 90 días.
Community-acquired pneumonia (CAP) is a common serious infection. This study aimed to evaluate the prognostic utility of neutrophil count percentage (NCP) and neutrophil-lymphocyte ratio (NLR) in patients with CAP.
MethodsRetrospective study of hospitalized patients with CAP. Patients had a blood test at admission and 3-5 days after hospitalization (early-stage test). The main outcome variables were 30-day and 90-day mortality.
ResultsTwo hundred and 9patients were included. Patients who survived had significant reductions in both NCP and NLR between admission and the day 3-5 blood tests (from 85.8% to 65.4% for NCP and from 10.1 to 3.2 for NLR). Twenty-five patients died in the first 90 days. Patients who died had lower, non-significant reductions in NCP (from 84.8% to 74%) and NLR (from 9.9 to 6.9) and significantly higher early-stage NCP and NLR than those who survived. NCP values higher than 85% and NLR values higher than 10 in the early-stage blood test were associated with a higher risk of mortality, even after multivariate adjustment (HR for NCP: 12; HR for NLR: 6.5).
ConclusionNCP and NLR are simple, low-cost parameters with prognostic utility, especially when measured 3-5 days after CAP diagnosis. High NLR and/or NCP levels are associated with a greater risk of mortality at 90 days.
La neumonía adquirida en la comunidad (NAC) es una infección frecuente y potencialmente mortal1,2. Uno de los objetivos en la asistencia a pacientes con NAC es establecer en el momento del diagnóstico una estimación pronóstica, para decidir la necesidad de ingreso hospitalario o programar el seguimiento más idóneo. Para dicha labor existen numerosas escalas de valoración de gravedad y riesgo de la NAC como la escala Confussion-Urea-Respiratory rate-Blood pressure-65-years-old (CURB65)3, el índice de gravedad de neumonía (Pneumonia Severity Index [PSI])4 o la escala de gravedad de NAC (Severe Community Acquired Pneumonia [SCAP])5. Estas escalas han sido ampliamente validadas en grandes cohortes poblacionales y actualmente son las herramientas disponibles más útiles para evaluar el pronóstico de los pacientes con NAC en el momento del diagnóstico6-8.
Estamos asistiendo a un intento por mejorar el valor pronóstico de estas escalas clínicas. Dado que la neumonía supone un proceso infeccioso localizado que condiciona una respuesta inflamatoria sistémica, se postula que estudiar ese proceso inflamatorio permitiría evaluar la gravedad de la NAC y con ello tratar de predecir su evolución. En este sentido, se han estudiado diversos biomarcadores en el momento del diagnóstico de la NAC como la procalcitonina (PCT), proadrenomedulina (proADM) o copeptina9-15; estas moléculas medidas al diagnóstico han mostrado un poder pronóstico superior al de la proteína C reactiva (PCR) o el número de leucocitos totales, pero no han demostrado ser superiores a las escalas tradicionales. Diversos autores han replanteado el uso de marcadores al diagnóstico más sencillos y accesibles, como son el cociente o ratio neutrófilos/linfocitos (NLR)16,17 o el porcentaje de neutrófilos (NCP)18, con la ventaja de que ambos parámetros son fáciles de determinar y con bajo coste. En esa línea, Curbelo et al. compararon el NCP frente a PCT, proADM y copeptina, sin ser significativamente inferior en cuanto a capacidad pronóstica de mortalidad a corto y medio plazo.
En esta situación de búsqueda de biomarcadores eficientes, otros autores han planteado utilizar parámetros sencillos y económicos, y evaluar su utilidad no solo en el diagnóstico, sino también en el seguimiento de pacientes con NAC. Zhydkov et al. muestran en su estudio cómo en pacientes hospitalizados por NAC el recuento de leucocitos totales o la PCR mejoran su poder pronóstico si son evaluados en analíticas durante el seguimiento de pacientes con NAC19. Por su parte, otros estudios demuestran que la utilidad del NLR o NCP en la analítica de control (a los 3-5 días) es tan útil o más que la determinación en la analítica al ingreso18, y se sugiere que ambos parámetros podrían ser muy útiles como marcadores pronósticos de la evolución de pacientes hospitalizados por NAC.
El objetivo de este estudio es evaluar la utilidad del NCP y el NLR medidos durante la evolución de la NAC, y su papel como predictores de mortalidad a 30 y 90 días.
Material y métodosEstudio retrospectivo de pacientes ingresados por NAC en los servicios de Neumología o Medicina Interna entre 2010 y 2012 en el Hospital Universitario de La Princesa, en Madrid. El protocolo de estudio fue aprobado por el Comité de Ética de Investigación Clínica del mismo centro. Para la recogida de datos se siguieron las disposiciones recogidas en la legislación vigente, Ley 15/1999 de Protección de Datos de Carácter Personal.
Los criterios de inclusión fueron tener una edad superior a 18 años en el momento del diagnóstico y haber sido hospitalizado por NAC en los Servicios de Neumología y Medicina Interna. Para ello se corroboró que tanto en el informe de ingreso como en el informe de alta constase la NAC como diagnóstico principal, y se confirmó a través de la historia clínica la presencia de síntomas de tracto respiratorio inferior (tos, expectoración, disnea, taquipnea o dolor pleurítico) junto a la aparición de un nuevo infiltrado radiográfico sin otra causa justificable20. Así mismo, también fue criterio de inclusión la realización de analítica en el momento del diagnóstico de NAC, y al menos otra analítica de control, antes del alta hospitalaria. Esta segunda analítica fue aquella extraída a los 3-5 días desde la fecha de ingreso. Los niveles de leucocitos y su clasificación se midieron, a partir de sangre periférica en EDTA, mediante citometría de flujo fluorescente y enfoque hidrodinámico (dispersión lateral y frontal) con Analizador Hematológico Automático Sysmex XE-2100™ (Sysmex, Kobe, Japón).
Se excluyó a aquellos pacientes en los que se adoptó la decisión de no administrar tratamiento antibiótico en el contexto de adecuación de esfuerzo terapéutico. Así mismo fueron criterios de exclusión la presencia de enfermedades hematológicas u oncológicas activas e inmunodeprimidos graves (pacientes con trasplante o con infección por virus de la inmunodeficiencia humana con menos de 500 CD4+).
A todos los pacientes se les calculó la escala de valoración pronóstica PSI y CURB65, y se registraron sistemáticamente sus características sociodemográficas, comorbilidades y tratamiento. Se calculó el índice de comorbilidad de Charlson según modificación propuesta por Bordon et al. para pacientes con NAC21. Además, se registraron variables clínicas, radiológicas y analíticas relacionadas con el episodio neumónico. Las definiciones de algunas de estas enfermedades se pueden consultar en el anexo. Los pacientes fueron tratados de acuerdo con la práctica clínica habitual, siguiendo las recomendaciones terapéuticas de las principales guías clínicas europeas. Se consideró la variable desenlace principal el fallecimiento por cualquier causa a los 30 y a los 90 días tras el diagnóstico de NAC.
Análisis estadísticoLas diferencias entre variables cualitativas se analizaron mediante test de la chi cuadrado o, en caso de frecuencias esperadas inferiores a 5, test exacto de Fisher. Las diferencias en las variables cuantitativas se analizaron mediante test t de Student o, en caso de ausencia de normalidad de la distribución de la variable, test no paramétrico de Wilcoxon. Para evaluar la evolución de los parámetros de NCP y NLR entre la analítica al diagnóstico y la de control, se realizó un análisis intrasujeto.
Se analizó el poder predictivo de NCP y NLR sobre la mortalidad a 90 días mediante curvas ROC y cálculo de áreas bajo la curva (AUC). Así mismo, se analizó la utilidad de puntos de corte para NCP y NLR propuestos por la literatura; en el caso del NLR, se analizó la utilidad del punto de corte de 10 propuesto por de Jager et al.16. Para la NCP se analizó el punto de corte de 85 propuesto en artículos previos por nuestro grupo de investigación18. Para esta evaluación se calculó la hazard ratio (HR) o razón de incidencia de mortalidad en función del NCP y NLR; posteriormente, se hizo ajuste multivariable mediante regresión de Cox incluyendo las variables que mostraran diferencias con p <0,10, bajo criterio clínico y manteniendo el principio de parsimonia del modelo.
Para el cálculo del tamaño muestral se utilizaron los datos del estudio prospectivo de referencia18. En dicho estudio, los pacientes con NCP en la analítica de control mayor del 85% presentaron una mortalidad a 90 días del 55% frente al grupo con NCP menor del 85%, que tuvieron una mortalidad del 7,5%. La ratio entre ambos grupos fue de 1:12, por lo que para un error alfa del 5% y una potencia del 95% es necesario un tamaño muestral de 173 sujetos. Para el punto de corte de 10 del NLR en la analítica de control se obtuvieron resultados similares. Con base en estos datos, se marcó como objetivo un tamaño muestral de 200 sujetos.
Se consideraron estadísticamente significativos los valores de probabilidad p <0,05. El análisis estadístico se realizó con el software Stata (version 13.1; Stata Corporation, College Station, Texas, EE. UU.).
ResultadosSe analizó a 275 pacientes de forma consecutiva no dirigida. Se excluyó a 28 episodios por tratarse de reingresos y 38 por carecer de analítica de control a los 3-5 días. La muestra final quedó constituida por 209 pacientes, con el objetivo de llegar al tamaño muestral estimado (200 pacientes).
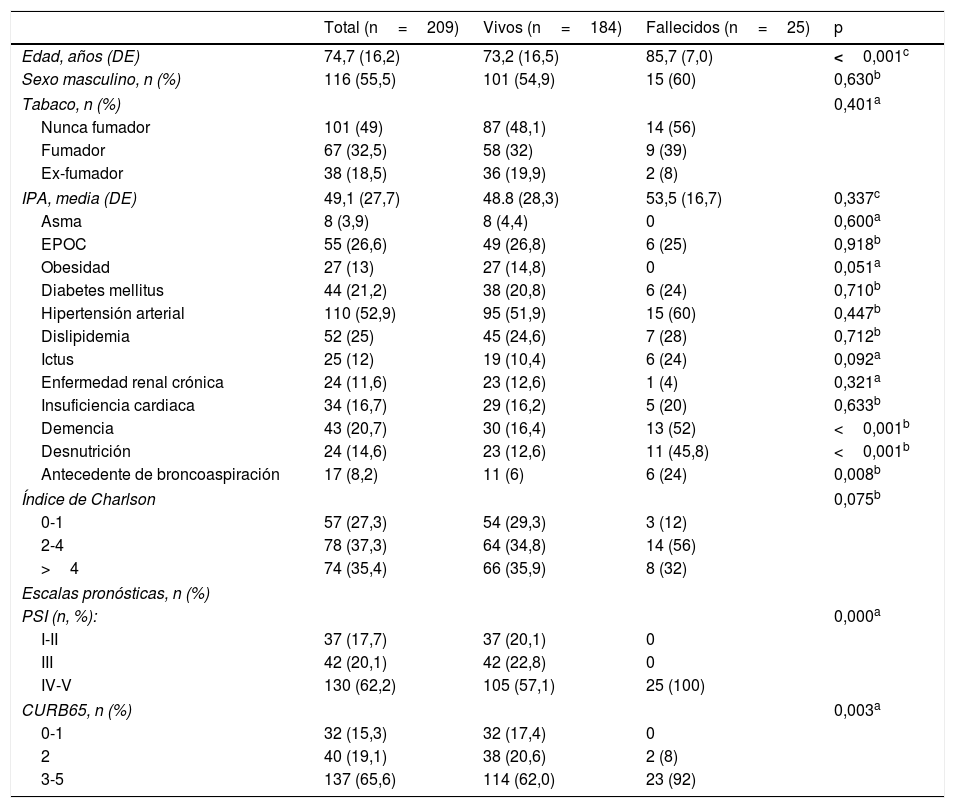
Durante la hospitalización fallecieron un total de 9 pacientes, es decir, el 4,3% (intervalo de confianza [IC] del 95%: 2,3-8), mientras que a los 30 días había fallecido el 5,7% (IC del 95%: 3,3-9,8). Tras 90 días desde el diagnóstico, 25 pacientes habían fallecido, con una mortalidad acumulada del 12% (IC del 95%: 8,2-17,1). Las características basales de la población de estudio y las diferencias entre fallecidos y supervivientes tras 90 días se pueden consultar en la tabla 1. Los pacientes fallecidos presentaban una edad media superior (85,7 años vs. 73,2, p <0,001). Este subgrupo de pacientes presentó una prevalencia de deterioro cognitivo, malnutrición y antecedentes de broncoaspiración significativamente superior. La comorbilidad medida mediante el índice de Charlson fue discretamente superior en los pacientes fallecidos; en dicho grupo el 88% presentaba un índice de 2 o superior, frente al 70,7% en el grupo de los supervivientes; sin embargo, dicha diferencia no alcanzó la significación estadística (p=0,075). Así mismo, los pacientes con evolución adversa presentaron una gravedad de la NAC evaluada por PSI o CURB65 significativamente mayor.
Características basales de la población de estudio según la mortalidad a 90 días
| Total (n=209) | Vivos (n=184) | Fallecidos (n=25) | p | |
|---|---|---|---|---|
| Edad, años (DE) | 74,7 (16,2) | 73,2 (16,5) | 85,7 (7,0) | <0,001c |
| Sexo masculino, n (%) | 116 (55,5) | 101 (54,9) | 15 (60) | 0,630b |
| Tabaco, n (%) | 0,401a | |||
| Nunca fumador | 101 (49) | 87 (48,1) | 14 (56) | |
| Fumador | 67 (32,5) | 58 (32) | 9 (39) | |
| Ex-fumador | 38 (18,5) | 36 (19,9) | 2 (8) | |
| IPA, media (DE) | 49,1 (27,7) | 48.8 (28,3) | 53,5 (16,7) | 0,337c |
| Asma | 8 (3,9) | 8 (4,4) | 0 | 0,600a |
| EPOC | 55 (26,6) | 49 (26,8) | 6 (25) | 0,918b |
| Obesidad | 27 (13) | 27 (14,8) | 0 | 0,051a |
| Diabetes mellitus | 44 (21,2) | 38 (20,8) | 6 (24) | 0,710b |
| Hipertensión arterial | 110 (52,9) | 95 (51,9) | 15 (60) | 0,447b |
| Dislipidemia | 52 (25) | 45 (24,6) | 7 (28) | 0,712b |
| Ictus | 25 (12) | 19 (10,4) | 6 (24) | 0,092a |
| Enfermedad renal crónica | 24 (11,6) | 23 (12,6) | 1 (4) | 0,321a |
| Insuficiencia cardiaca | 34 (16,7) | 29 (16,2) | 5 (20) | 0,633b |
| Demencia | 43 (20,7) | 30 (16,4) | 13 (52) | <0,001b |
| Desnutrición | 24 (14,6) | 23 (12,6) | 11 (45,8) | <0,001b |
| Antecedente de broncoaspiración | 17 (8,2) | 11 (6) | 6 (24) | 0,008b |
| Índice de Charlson | 0,075b | |||
| 0-1 | 57 (27,3) | 54 (29,3) | 3 (12) | |
| 2-4 | 78 (37,3) | 64 (34,8) | 14 (56) | |
| >4 | 74 (35,4) | 66 (35,9) | 8 (32) | |
| Escalas pronósticas, n (%) | ||||
| PSI (n, %): | 0,000a | |||
| I-II | 37 (17,7) | 37 (20,1) | 0 | |
| III | 42 (20,1) | 42 (22,8) | 0 | |
| IV-V | 130 (62,2) | 105 (57,1) | 25 (100) | |
| CURB65, n (%) | 0,003a | |||
| 0-1 | 32 (15,3) | 32 (17,4) | 0 | |
| 2 | 40 (19,1) | 38 (20,6) | 2 (8) | |
| 3-5 | 137 (65,6) | 114 (62,0) | 23 (92) | |
DE: desviación estándar; EPOC: enfermedad pulmonar obstructiva crónica; IPA: índice paquetes-año en fumadores y exfumadores; PSI: Pneumonia Severity Index.
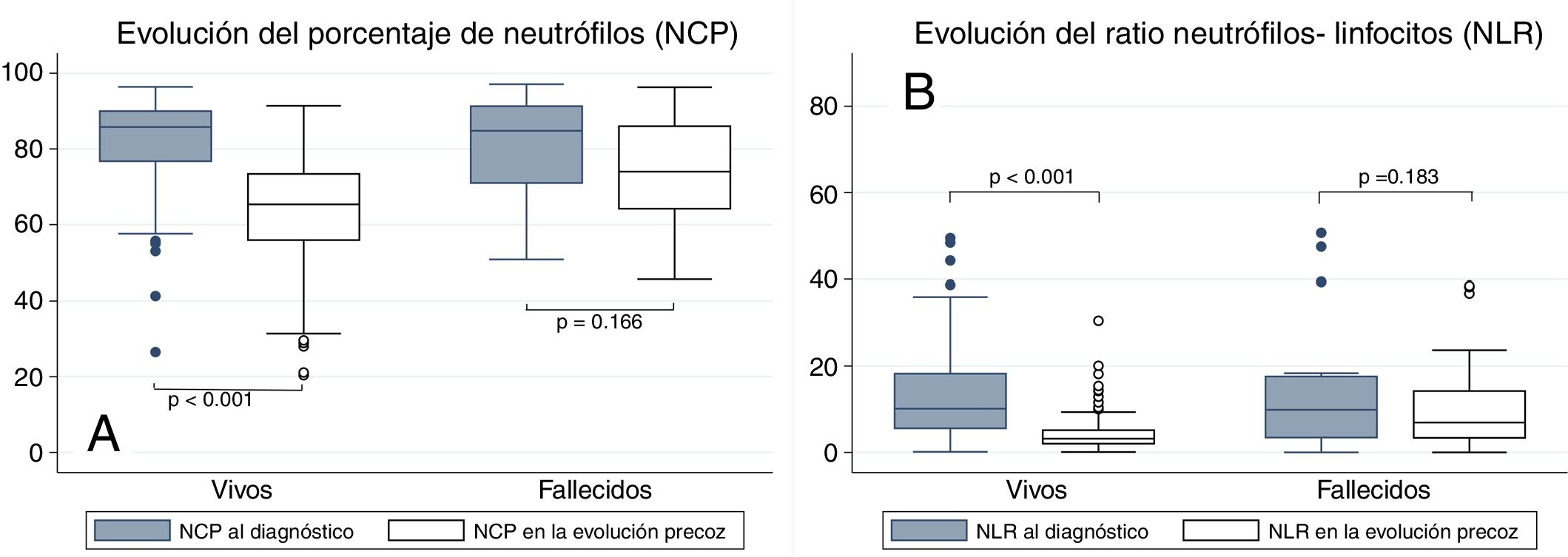
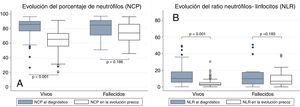
El análisis de la relación entre NCP y NLR con la mortalidad se muestra en la figura 1. Puede apreciarse que los pacientes que fallecieron presentaron valores de NCP en la analítica de ingreso similares a los pacientes con buena evolución (84,8% vs. 85,8%, p=0,794) y lo mismo ocurre con el NLR (9,9 vs. 10,1, p=0,652). Por el contrario, en la analítica de la evolución temprana, sí hubo diferencias significativas entre los fallecidos y los supervivientes en lo que respecta al NCP (74% vs. 65,4%, p <0,001) y al NLR (6,9 vs. 3,2, p <0,001). Al analizar la evolución analítica intrasujeto, se puede apreciar que los pacientes que sobreviven presentan una reducción significativa del NCP entre la analítica de ingreso y la de la evolución precoz (–19,1, p <0,001); idéntica situación sucede con el NLR (–6,9, p <0,001). Sin embargo, aunque los fallecidos experimentaron una disminución en su analítica del NCP (–4,4), dicha reducción no fue significativa (p=0,166). Lo mismo ocurrió con el NLR (reducción de –1,6 con p=0,183).
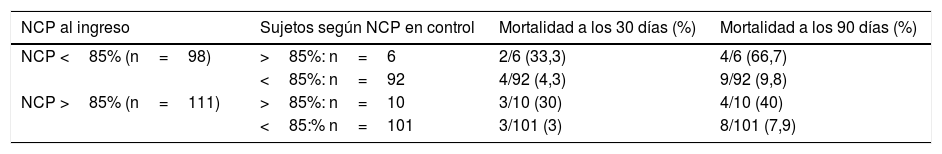
Partiendo de los puntos de corte propuesto en estudios previos, se estratificó a los pacientes según presentaran al ingreso o en el control valores de NCP superiores al 85%, o valores de NLR superiores a 10 (tabla 2). En el análisis de NCP se aprecia que aquellos pacientes que presentaban al ingreso y al alta valores superiores al 85% tuvieron una mortalidad a los 30 días del 30% y a los 90 días del 40%. Por otro lado, aquellos sujetos que presentaron al ingreso NCP inferior al 85% pero posteriormente en el control elevaron NCP por encima del 85% tuvieron una mortalidad a 30 días del 33,3% y a 90 días del 66,7%. En el otro extremo, los pacientes que tuvieron valores persistentemente menores del 85%, o partiendo de niveles elevados estos descendieron, tuvieron mortalidades sensiblemente menores a 30 días (el 4,3 y el 3%, respectivamente) y a 90 días (el 9,8 y el 7,9%). Situación similar se reprodujo al analizar la evolución del NLR.
Análisis de la mortalidad a 30 y 90 días en función de los valores del porcentaje de neutrófilos (NCP) y del cociente neutrófilos-linfocitos (NLR)
| NCP al ingreso | Sujetos según NCP en control | Mortalidad a los 30 días (%) | Mortalidad a los 90 días (%) |
|---|---|---|---|
| NCP <85% (n=98) | >85%: n=6 | 2/6 (33,3) | 4/6 (66,7) |
| <85%: n=92 | 4/92 (4,3) | 9/92 (9,8) | |
| NCP >85% (n=111) | >85%: n=10 | 3/10 (30) | 4/10 (40) |
| <85:% n=101 | 3/101 (3) | 8/101 (7,9) |
| NLR al ingreso | Sujetos según NLR en control | Mortalidad a los 30 días (%) | Mortalidad a los 90 días (%) |
|---|---|---|---|
| NLR <10 (n=104) | >10: n=8 | 2/8 (25) | 3/8 (37,5) |
| <10: n=96 | 4/96 (4,2) | 10/96 (10,4) | |
| NLR>10 (n=105) | >10: n=11 | 4/11 (36,4) | 5/11 (45,5) |
| <10: n=94 | 2/94 (2,1) | 9/94 (7,4) |
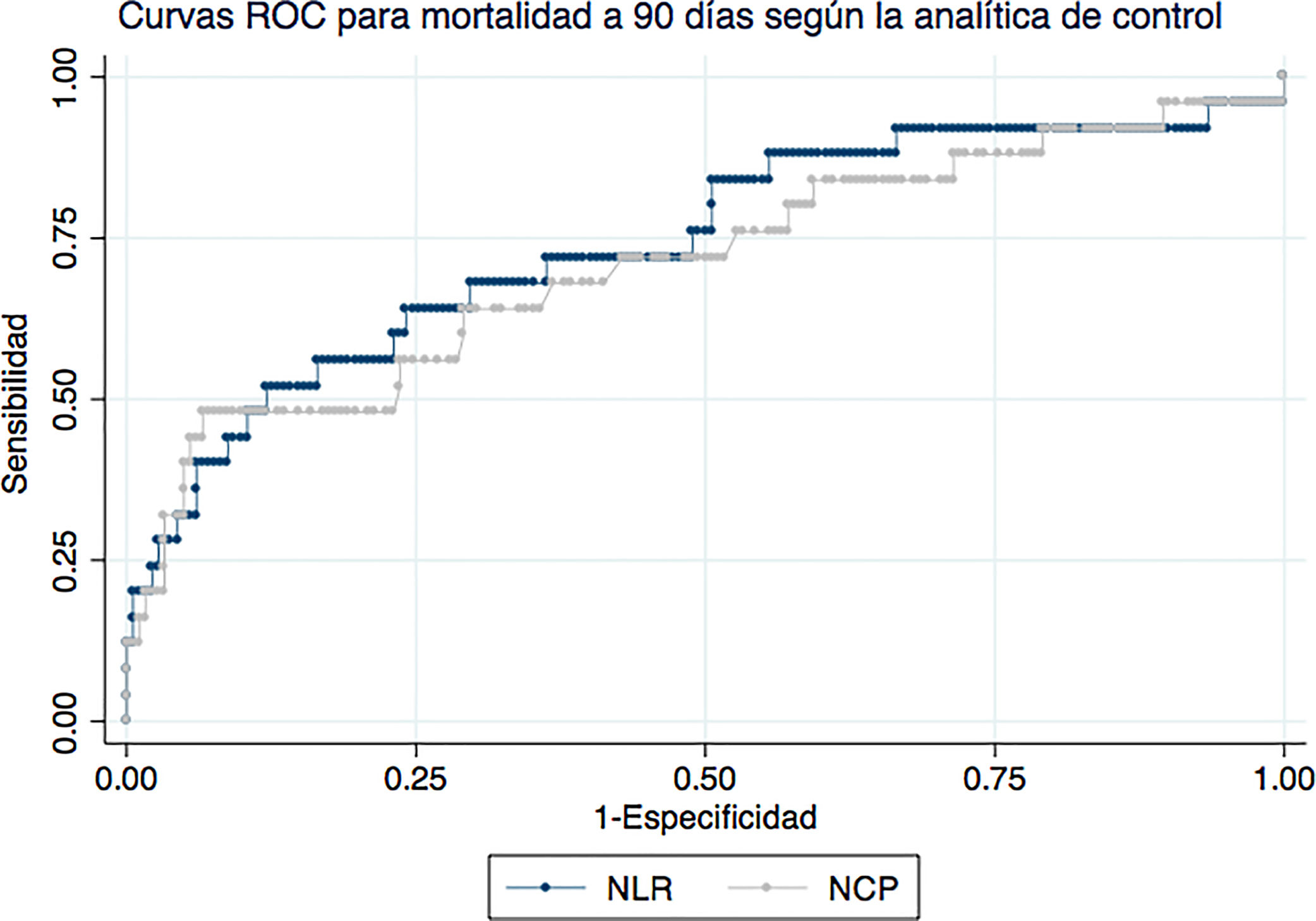
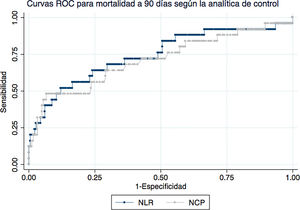
La figura 2 representa las curvas ROC para NCP y NLR en la analítica de control para mortalidad a 90 días. El AUC para NCP fue de 70,9 (IC del 95%: 58,3-83,6) y para NLR 74 (IC del 95%: 62,1-86). Para mortalidad a 30 días, el AUC de NCP en la analítica de control fue de 84 (IC al 95%: 72,1-96) y para el NLR de 88,3 (IC del 95%: 79,4-97,2).
En lo que respecta a las escalas, el AUC de la escala CURB65 fue 68,4 (IC del 95%: 59,4-77,5) para mortalidad a 90 días y 69,8 (IC del 95%: 59,2-80,4) para mortalidad a 30 días. El AUC de la escala PSI para mortalidad a 90 días fue 76,7 (IC del 95%: 69,9-83,6) y 78,4 (IC del 95%: 69-87,8) para mortalidad a 30 días. Ninguna de las escalas resultó superior estadísticamente a los valores de NLR o NCP en la analítica de control.
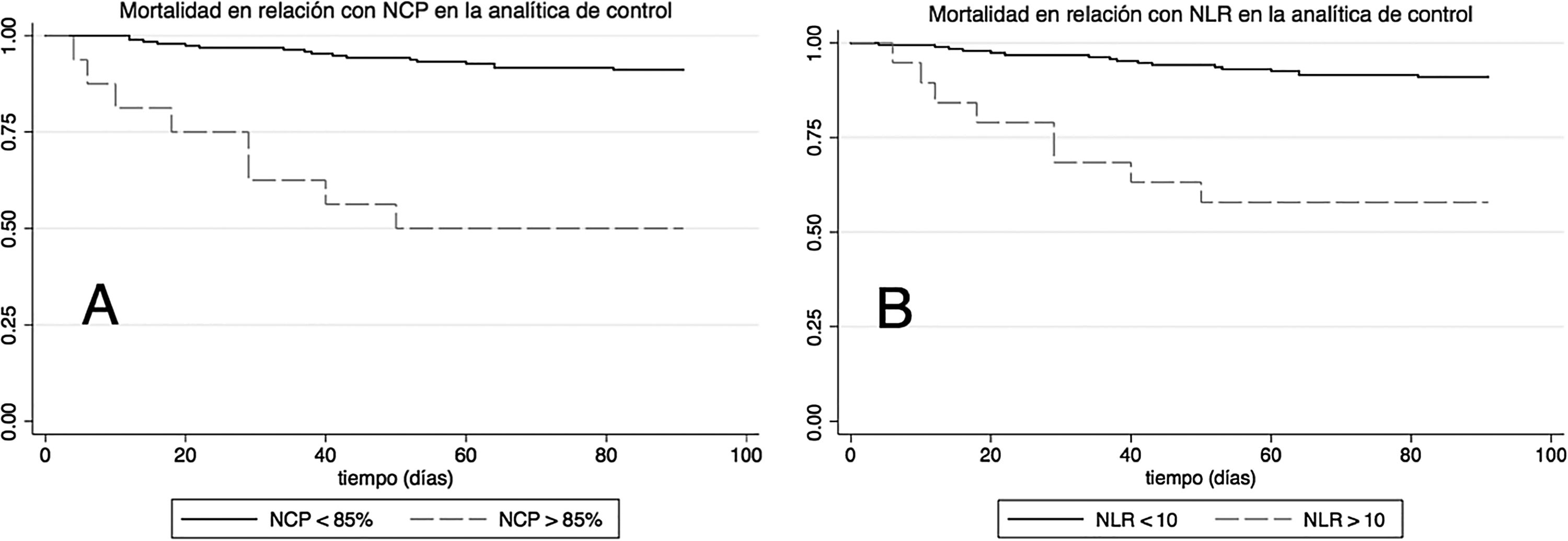
Para evaluar el poder predictivo de estos parámetros en la analítica de control se calculó la HR para mortalidad a 90 días. Así, presentar un NCP superior al 85% en la analítica de control se acompañó de una HR para mortalidad a 90 días de 8,16 (IC del 95%: 3,5-19) es decir, un riesgo de mortalidad 8 veces superior frente a los pacientes con NCP inferior al 85%. La figura 3 muestra la mortalidad en función del NCP. Tras ajustar por edad, sexo, malnutrición, antecedentes de ictus, deterioro cognitivo, antecedentes de broncoaspiración y gravedad de la NAC evaluada por CURB65, la HR fue de 12 (IC del 95%: 4,3-33,3), es decir, mantuvo su significación estadística. Al analizar la diferencia del NCP entre la analítica de ingreso y la de control, para la reducción de 10 unidades del NCP se obtuvo una HR ajustada estadísticamente significativo de 0,67 (0,50-0,90). Es decir, que aquellos sujetos que consiguieron disminuir su porcentaje de NCP en 10 unidades durante la evolución tenían un riesgo de mortalidad un tercio menor que los que no reducían su NCP.
En el caso del NLR la situación fue similar (fig. 3, panel B). Un NLR superior a 10 en la analítica de control se acompañó de una HR univariante para mortalidad a 90 días de 6,1 (IC del 95%: 2,6-14,2) y tras ajuste multivariable el valor de la HR fue de 6,5 (IC del 95%: 2,5-16,7), estadísticamente significativo. Al analizar la diferencia del NLR entre la analítica de ingreso y la de control, para una disminución de 5 unidades del NLR se obtuvo una HR ajustada de 0,83 (0,70-0,98).
El análisis de mortalidad a 30 días mostró resultados similares: la HR para el punto de corte de NCP del 85% en la analítica de control, tras ajuste multivariable, fue de 18,3 (IC del 95%: 3,8-88,6) y para el valor de 10 en el NLR la HR fue de 9,9 (IC del 95%: 2,5-38,7). En este caso, la reducción de 10 unidades sobre el valor basal de NCP en la analítica de control respecto a la de ingreso se acompañó de una HR de 0,5 (IC del 95%: 0,3-0,9). Del mismo modo, la reducción de 5 unidades de NLR durante la evolución analítica se acompañó de una HR de 0,8 (IC del 95%: 0,6-0,9).
DiscusiónEn esta serie de pacientes hospitalizados por NAC se muestra la utilidad pronóstica de NCP y NLR. Los niveles de NCP y NLP elevados al ingreso no son tan buenos marcadores de mortalidad como el hecho de que sus valores persistan elevados o se eleven durante la hospitalización. La presencia de NCP superior al 85% o NLR superior a 10 en la analítica de control se asocian a alto riesgo de mortalidad con independencia de la edad, el sexo, las comorbilidades o la gravedad de la NAC evaluada por escalas tradicionales.
Los pacientes que acaban falleciendo no reducen de manera significativa el NCP o el NLR en la evolución de su enfermedad, o partiendo de niveles bajos, elevan estos marcadores. Eso permite plantear la hipótesis de que una respuesta inmunitaria descontrolada, con predominio de neutrófilos sobre el resto de leucocitos (NCP) o sobre la población linfocitaria (NLR), podría estar alertando de una respuesta inmunitaria persistente e ineficaz marcadora de evolución clínica adversa. Zhydkov et al. realizaron extracciones analíticas al ingreso y en los días 3, 5, 7 y al alta19. En ese trabajo demostraron la utilidad pronóstica de la PCT, pero también del recuento de leucocitos totales y de la PCR, no tanto en la analítica inicial, sino sobre todo en las siguientes analíticas evolutivas. Desafortunadamente, en ese estudio no se mostraron datos de NCP y NLR, ni cálculos de AUC para los marcadores aislados. En proyectos previos de nuestro grupo realizamos 2extracciones analíticas a una cohorte prospectiva de pacientes con NAC que requirieron hospitalización, mostrando la utilidad de parámetros como NLR y NCP al ingreso, pero especialmente en la analítica de control, con poder pronóstico comparable con el de otras moléculas como proADM, PCT o copeptina18. El presente estudio fortalece la evidencia que aportan estos trabajos previos, subrayando la utilidad de la analítica sanguínea como parte del control de la evolución de pacientes con NAC grave que requieren hospitalización.
La PCT es el biomarcador sobre el que más evidencia existe en cuanto a su utilidad para monitorizar la evolución de las infecciones respiratorias. La normalización de sus niveles se ha correlacionado con la mejoraría clínica en pacientes con neumonía22. Además, existen diversos ensayos clínicos que muestran que el manejo clínico guiado por niveles de PCT circulante en pacientes con infecciones del tracto respiratorio inferior puede suponer una reducción de la duración del tratamiento antibiótico23,24, si bien este último aspecto es controvertido25,26. En ninguno de estos estudios se ha comparado la PCT frente al NCP o el NLR. Las escasas publicaciones donde existe comparación directa entre PCT y NLR o NCP son estudios observacionales y en ellos NCP y NLR no muestran inferioridad cuando se miden en el ingreso o en los análisis de control18. Este estudio apoya los resultados obtenidos por otros grupos de trabajo sobre la utilidad de NCP y NLR como marcadores pronósticos en la evolución del proceso infeccioso. Además, sus resultados abren la posibilidad a que la monitorización del paciente basada en estos sencillos parámetros quizá sea suficiente, con el consecuente ahorro económico.
Tanto los índices de CURB65 como PSI permiten estratificar el riesgo de los pacientes con NAC en el momento del diagnóstico, y ningún biomarcador ha mostrado superioridad frente a estas escalas de manera consistente. Tras el diagnóstico, en aquellos con NAC grave, el clínico solo dispone de la propia evolución de la enfermedad. En el subgrupo de pacientes con NAC grave, la determinación de NCP o NLR en la analítica de control permitiría ayudar a identificar pacientes con mayor riesgo de evolución adversa e intensificar la vigilancia o programar un estrecho seguimiento. Es necesario matizar que, si bien las AUC para mortalidad a 30 y 90 días de NLR o NCP en la analítica de control son similares a las de CURB65 o PSI, no son comparables. Las escalas de valoración de la NAC estratifican el riesgo en el momento del diagnóstico, en tanto que la utilidad que aportan NLR o NCP es pasada la fase aguda, tras el inicio del tratamiento antibiótico.
Este proyecto sigue la línea de otros autores, que plantean una reflexión sobre el uso de nuevos biomarcadores en la práctica clínica habitual. Otros parámetros sencillos y de bajo coste, como NCP o NLR, permiten obtener información de utilidad clínica. Además, en la mayoría de los proyectos de investigación los biomarcadores se comparan frente a la PCR o la cifra de leucocitos totales. Parece razonable que cualquier nuevo biomarcador deba ser comparado con estos 2parámetros.
Las limitaciones principales de este proyecto son su carácter retrospectivo y unicéntrico. Así mismo, la cohorte de pacientes con NAC, al estar restringida a aquellos que son hospitalizados y que tienen analítica de control, no representa todo el espectro de gravedad de la enfermedad. La inclusión de sujetos hospitalizados supone la exclusión de pacientes con NAC leve que recibieran manejo ambulatorio. Por otro lado, el criterio de requerir analítica de control ha supuesto la exclusión de pacientes que han podido presentar un curso evolutivo grave con fallecimiento precoz. Otra potencial limitación es el hecho de que la analítica de control no se ha realizado un día concreto sino a los 3-5 días desde el ingreso. Este aspecto, si bien puede generar cierto grado de imprecisión, le aporta pragmatismo y cercanía a la práctica clínica habitual; una extracción protocolaria en días fijos probablemente sea poco trasladable a la asistencia cotidiana.
ConclusionesEl NCP y el NLR son parámetros de fácil determinación y bajo coste que informan del pronóstico de los pacientes con NAC grave cuando se analizan en la evolución precoz, a los 3-5 días del diagnóstico de neumonía. Presentar valores de NLR o NCP elevados tras varios días de hospitalización por NAC se relaciona con mayor riesgo de mortalidad a 90 días, independientemente de las comorbilidades y de la gravedad de la neumonía.
FinanciaciónEl presente trabajo ha sido financiado por el Instituto de Salud Carlos III (European Regional Development Fund) (PI 12/01142 y PI 15/01311) y por la Sociedad Española de Neumología y Cirugía Torácica (SEPAR 89/2013 y SEPAR 98/2016).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Demencia. Por demencia se entiende un síndrome clínico caracterizado por un trastorno global adquirido, de la memoria, el intelecto y la personalidad, que se produce en una persona alerta y vigil. Para este estudio se ha considerado que un paciente presentaba demencia cuando su puntuación en la escala Mini Examen Cognoscitivo de Lobo (MEC-30) era menor de 24 o cuando su puntuación en la escala Global Dementia Score (GDS) era mayor o igual a 4.
Malnutrición. Se define malnutrición como la alteración de la composición corporal por deprivación absoluta o relativa de nutrientes que produce la disminución de los parámetros nutricionales por debajo del percentil 75. A efectos de clasificación, se han considerado como malnutridos a aquellos pacientes con puntuaciones en la escala COntrolling NUTritional Status (CONUT) mayores o iguales a 5 (riesgo de malnutrición moderado o grave).
Antecedentes de broncoaspiración. La broncoaspiración es la entrada anormal de fluidos, sustancias exógenas o secreciones endógenas en las vías aéreas inferiores. En este trabajo se ha considerado que un paciente tenía antecedentes de broncoaspiración en 2situaciones: 1) pacientes que habían presentado al menos un cuadro de neumonitis química o neumonía infecciosa posterior a un episodio de broncoaspiración presenciado por familiares o cuidadores; 2) pacientes con enfermedades neurodegenerativas, enfermedades cerebrovasculares o fragilidad, con alto riesgo de disfagia, a los que se les había hecho un test ORL de disfagia con anterioridad y había resultado positivo, pese a no haber presentado episodios broncoaspirativos presenciados.