El objetivo del estudio ha sido establecer la eficacia del tratamiento con pulsos intravenosos de ciclofosfamida y corticoides orales en la fibrosis pulmonar idiopática, comparados con el tratamiento estándar con corticoides y azatioprina.
Pacientes y métodosEstudio prospectivo, no controlado, con 2 grupos paralelos. Un grupo recibió prednisona más azatioprina oral durante 24 meses (grupo AZA). El segundo grupo (grupo CIC) recibió prednisona y pulsos intravenosos de ciclofosfamida (6 mensuales y 6 trimestrales). El objetivo principal fue la supervivencia o período sin necesidad de trasplante a los 36 meses, y los objetivos secundarios, los valores de capacidad vital forzada, capacidad de difusión del monóxido de carbono y presión arterial de oxígeno basalmente y a los 3; 6; 12; 18; 24; 30, y 36 meses.
ResultadosSe incluyó en el estudio a 46 pacientes, de los que 25 se asignaron al grupo AZA y 21 al grupo CIC. La supervivencia o ausencia de trasplante pulmonar a los 36 meses fue del 44% en el grupo AZA y del 76% en el grupo CIC (p=0,028). La capacidad vital forzada a los 36 meses empeoró un 8,8% en el grupo AZA frente a un 6,7% en el grupo CIC (p=0,16). La capacidad de difusión del monóxido de carbono empeoró un 11,81% en los pacientes del grupo AZA y un 4,4% en los del grupo CIC (p=0,0569). No se registraron diferencias significativas en la evolución de la presión arterial de oxígeno. Hubo un abandono de tratamiento con prednisona.
ConclusionesEl tratamiento con pulsos intravenosos de ciclofosfamida produjo una mejoría significativa de la supervivencia. No hubo diferencias significativas en los parámetros de función pulmonar e intercambio gaseoso. No se produjeron efectos adversos graves relacionados con ambos citostáticos.
The purpose of the study was to establish the efficacy of treatment with intravenous cyclophosphamide pulses and oral corticoids in idiopathic pulmonary fibrosis, compared with the standard treatment with corticoids and azathioprine.
Patients and methodA prospective, non-controlled study with 2 parallel groups. One group received prednisone plus oral azathioprine for 24 months (AZA group). The second one (CIC group) received prednisone plus intravenous cyclophosphamide pulses (6 monthly and 6 three-monthly). The primary outcome was survival or period without need for a transplant at 36 months. The secondary outcomes were the forced vital capacity, the carbon monoxide diffusing capacity, and baseline arterial oxygen pressure at 3, 6, 12, 18, 24, 30, and 36 months.
ResultsA total of 46 patients were included in the study, of whom 25 were assigned to the AZA group and 21 to the CIC group. The survival or absence of lung transplant at 36 months was 44% in the AZA group and 76% in the CIC group (P=0.028). The forced vital capacity was worse in 8.8% of the AZA group compared to 6.7% in the CIC group (P=0.16). The carbon monoxide diffusing capacity worsened in 11.81% of patients of the AZA group and in 4.6% of those in the CIC group (P=0.0569). No significant differences were observed in the arterial oxygen pressure. There was one dropout of treatment with prednisone.
ConclusionsTreatment with intravenous cyclophosphamide pulses produced a significant improvement in survival. There were no significant differences in the lung function parameters or gas exchange. Neither of the cytostatics had serious side effects.
La fibrosis pulmonar idiopática (FPI) es una enfermedad fibrosante y crónica de etiología desconocida, cuya evolución conduce inexorablemente a la insuficiencia respiratoria terminal y muerte entre los 2 y 5 años del inicio de los síntomas1,2. Los corticoides han sido, desde hace 50 años, la piedra angular del tratamiento, pero su eficacia es controvertida dada la ausencia de ensayos clínicos multicéntricos, aleatorizados y controlados con placebo3. El tratamiento farmacológico propugnado actualmente por diversas sociedades científicas neumológicas es la combinación de corticoides a dosis bajas y un inmunodepresor oral, preferentemente azatioprina, debido a sus menores efectos adversos en relación con la ciclofosfamida4,5. El tratamiento con pulsos o bolos intravenosos de ciclofosfamida, ampliamente usado en diversos procesos inmunológicos, apenas se ha estudiado en las enfermedades pulmonares en general y en la FPI en particular. El objetivo de nuestro estudio ha sido comparar la eficacia y seguridad de dicho tratamiento con las del tratamiento estándar con azatioprina.
Pacientes y métodosSe incluyó en el estudio a pacientes diagnosticados de FPI en nuestro servicio entre marzo de 2003 y marzo de 2006. Para el diagnóstico de FPI se requirieron los criterios del consenso de la American Thoracic Society y la European Respiratory Society (ATS/ERS)4:
- 1.
Pacientes con neumonía intersticial usual en la biopsia pulmonar:
- •
Exclusión de otras causas conocidas de enfermedad intersticial.
- •
Alteraciones en la exploración de la función respiratoria (alteración ventilatoria restrictiva) y/o alteración del intercambio de gases—aumento de la diferencia existente entre los valores de la presión alveolar de oxígeno y los de la presión arterial de oxígeno (PaO2) en reposo o en las pruebas de esfuerzo, o disminución de la capacidad de difusión del monóxido de carbono (DLCO)—.
- •
Alteraciones típicas de la enfermedad en la radiografía de tórax o en la tomografía computarizada de alta resolución.
- •
- 2.
En los pacientes sin biopsia pulmonar, deben cumplirse los siguientes 4 criterios mayores y 3 de los menores:
- •
Criterios mayores: a) exclusión de otras causas conocidas de enfermedad intersticial; b) alteraciones en la exploración funcional respiratoria (alteración ventilatoria restrictiva) y/o alteración del intercambio de gases (aumento de la diferencia existente entre los valores de la presión alveolar de oxígeno y los de PaO2 en reposo o en las pruebas de esfuerzo, o disminución de la DLCO); c) alteraciones típicas de la enfermedad en la radiografía de tórax o en la tomografía computarizada de alta resolución, y d) ausencia de alteraciones en la biopsia transbronquial o en el lavado broncoalveolar que apunten a un diagnóstico alternativo.
- •
Criterios menores: a) edad superior a 50 años; b) disnea de esfuerzo de comienzo insidioso, no explicada por otra causa; c) duración de los síntomas superior a 3 meses, o d) estertores crepitantes bibasales, inspiratorios y persistentes.
- •
Un primer grupo de pacientes recibió tratamiento con prednisona y azatioprina, ambos por vía oral, durante 24 meses (grupo AZA). Un segundo grupo (grupo CIC) recibió tratamiento con prednisona oral y pulsos intravenosos de ciclofosfamida (6 pulsos mensuales y posteriormente 6 trimestrales). La dosis administrada de prednisona fue la siguiente: 0,5mg/kg/día el primer mes; 0,25mg/kg/día los 2 meses siguientes; 0,25mg/kg a días alternos desde el mes 3 hasta el 12, y 10mg a días alternos del mes 13 al 24. La dosis administrada de azatioprina fue de 2mg/kg/día (máximo, 150mg/día), en dosis única diaria. La ciclofosfamida se administró a dosis de 750mg/m2 de superficie. Todos los pacientes recibieron N-acetilcisteína de forma indefinida (1.800mg/día), omeprazol (20 o 40mg/día) y tratamiento preventivo de osteoporosis inducida por corticoides con calcio, vitamina D y bifosfonatos (alendronato o risedronato en pauta semanal). Dos pacientes del grupo CIC recibieron bosentán por hipertensión pulmonar asociada “desproporcionada”. Se realizaron controles analíticos mensuales el primer año (hemograma, perfil hepático y perfil renal) y trimestrales el segundo. En los pacientes del grupo CIC se realizaron sedimento urinario trimestral y citologías de orina semestrales.
El objetivo principal del estudio fue la supervivencia o período sin necesidad de trasplante pulmonar a los 36 meses del inicio del tratamiento. Las variables secundarias de estudio fueron: capacidad vital forzada (FVC), DLCO y PaO2 a los 36 meses. Los parámetros de función pulmonar se midieron basalmente y a los 3; 6; 12; 18; 24; 30, y 36 meses.
Se registraron los efectos adversos relacionados con el tratamiento en ambos grupos.
Los criterios de exclusión fueron los siguientes: enfermedad cardíaca, hepática o hematológica, insuficiencia renal, neoplasia maligna activa, deterioro cognitivo, epilepsia, enfermedad pulmonar obstructiva previa, PaO2 inferior a 55mmHg en el momento del diagnóstico y edad igual o superior a 75 años.
Análisis estadísticoLas variables continuas se presentan como media±desviación estándar. Para la comparación de variables cualitativas se emplearon los tests de la χ2 y de Fisher (si <5 casos). Las variables cuantitativas se compararon mediante la prueba de la t de Student. Se realizó un análisis multivariante mediante regresión lineal. Para las variables de tiempo se utilizó el análisis de supervivencia de Kaplan-Meier (rango logarítmico). Se consideró estadísticamente significativo un valor de p <0,05. El análisis estadístico se realizó con el programa SPSS para Windows versión 12.
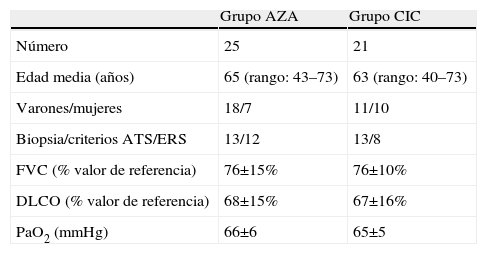
ResultadosSe incluyó en el estudio a un total de 46 pacientes, de los que 25 se asignaron al grupo AZA y 21 al grupo CIC. Las características basales de ambos grupos se muestran en la tabla 1.
Características basales de los pacientes
| Grupo AZA | Grupo CIC | |
| Número | 25 | 21 |
| Edad media (años) | 65 (rango: 43–73) | 63 (rango: 40–73) |
| Varones/mujeres | 18/7 | 11/10 |
| Biopsia/criterios ATS/ERS | 13/12 | 13/8 |
| FVC (% valor de referencia) | 76±15% | 76±10% |
| DLCO (% valor de referencia) | 68±15% | 67±16% |
| PaO2 (mmHg) | 66±6 | 65±5 |
ATS/ERS: consenso de la American Thoracic Society y la European Respiratory Society; AZA: azatioprina oral; CIC: pulsos intravenosos de ciclofosfamida; DLCO: capacidad de difusión del monóxido de carbono; FVC: capacidad vital forzada; PaO2: presión arterial de oxígeno.
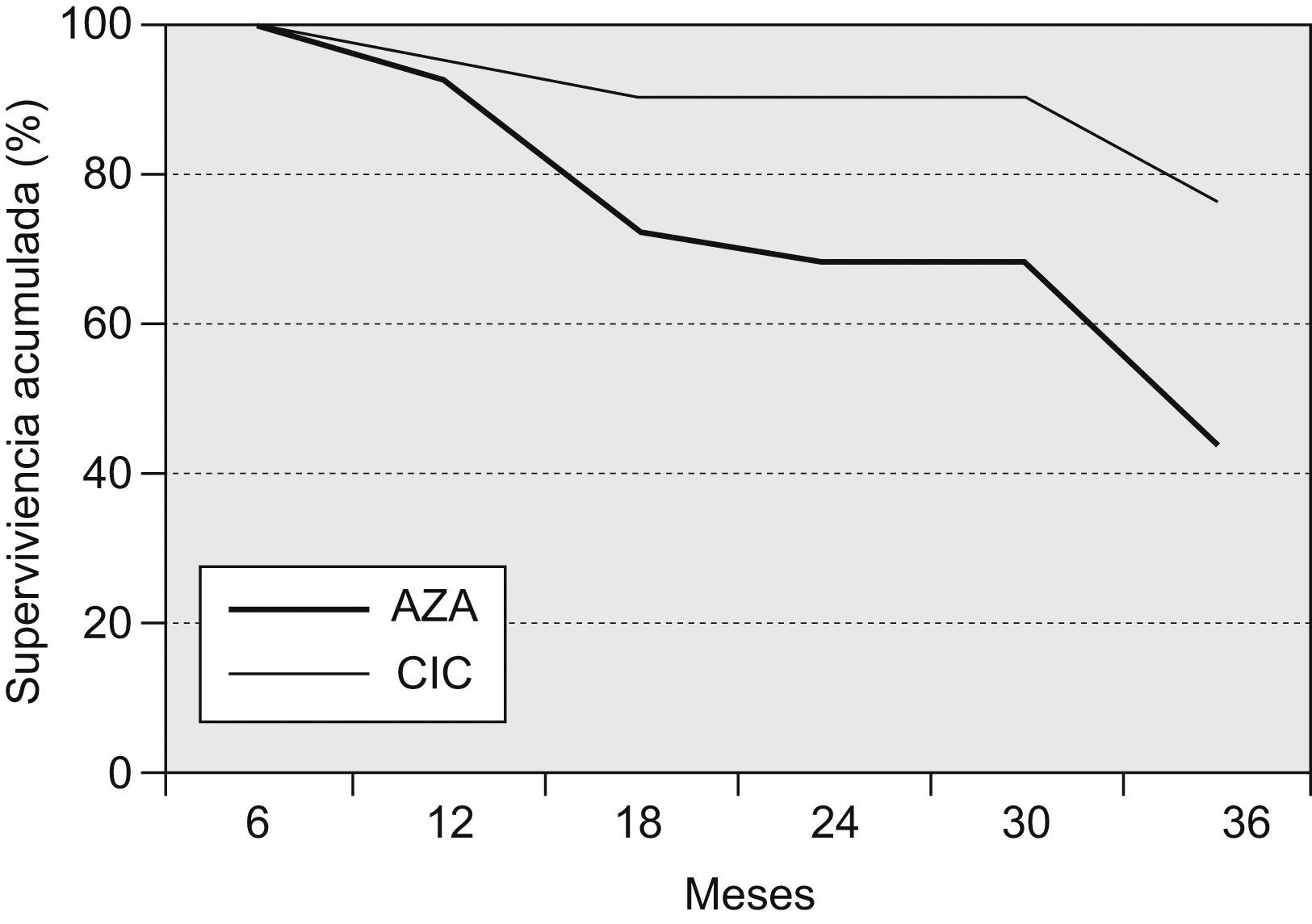
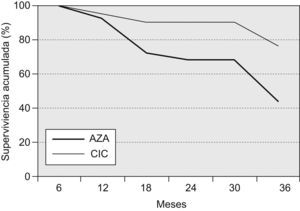
Un total de 19 pacientes fallecieron o recibieron un trasplante pulmonar a los 36 meses del inicio del tratamiento (18 fallecimientos y un trasplante pulmonar; 14 pertenecían al grupo AZA y 5 al grupo CIC), lo que corresponde a una supervivencia global del 58,7% (del 44% en el grupo AZA y del 76% en el grupo CIC; p=0,028). En los primeros 12 meses fallecieron 3 pacientes, 2 del grupo AZA (supervivencia del 92%) y uno del grupo CIC (supervivencia del 94,2%; diferencia no significativa). A los 24 meses, 8 pacientes del grupo AZA y 2 del grupo CIC habían fallecido, lo que representa una supervivencia acumulada del 68 y el 90,5%, respectivamente (p=0,0476) En la figura 1 se muestra la supervivencia de ambos grupos.
Todos los pacientes fallecieron por causas respiratorias. Las causas de muerte en el grupo AZA fueron: 7 pacientes por insuficiencia respiratoria progresiva atribuida a progresión de la enfermedad, 3 por exacerbación de fibrosis pulmonar, 2 por neumonía comunitaria, uno por mesotelioma pleural y uno empiema pleural. Por su parte, en el grupo CIC la mortalidad se debió a insuficiencia respiratoria progresiva (3 casos) y exacerbación de la FPI (un caso). Un paciente recibió un trasplante pulmonar en el mes 32. El paciente trasplantado y otra paciente fallecida del grupo CIC fueron los que recibieron bosentán por hipertensión pulmonar desproporcionada.
En el modelo de regresión logística no hubo diferencias estadísticamente significativas entre supervivencia y las siguientes variables: sexo, edad, tipo de diagnóstico (biopsia o no), FVC y DLCO en el momento del diagnóstico. Sólo resultaron estadísticamente significativos para la supervivencia el tipo de tratamiento (p=0,0176) y un valor de PaO2 superior a 65mmHg en el momento del diagnóstico (p=0,0255). Además, por cada milímetro de mercurio de aumento de la PaO2 por encima de 65mmHg en el momento del diagnóstico, el tiempo de supervivencia aumentó un 2,93%.
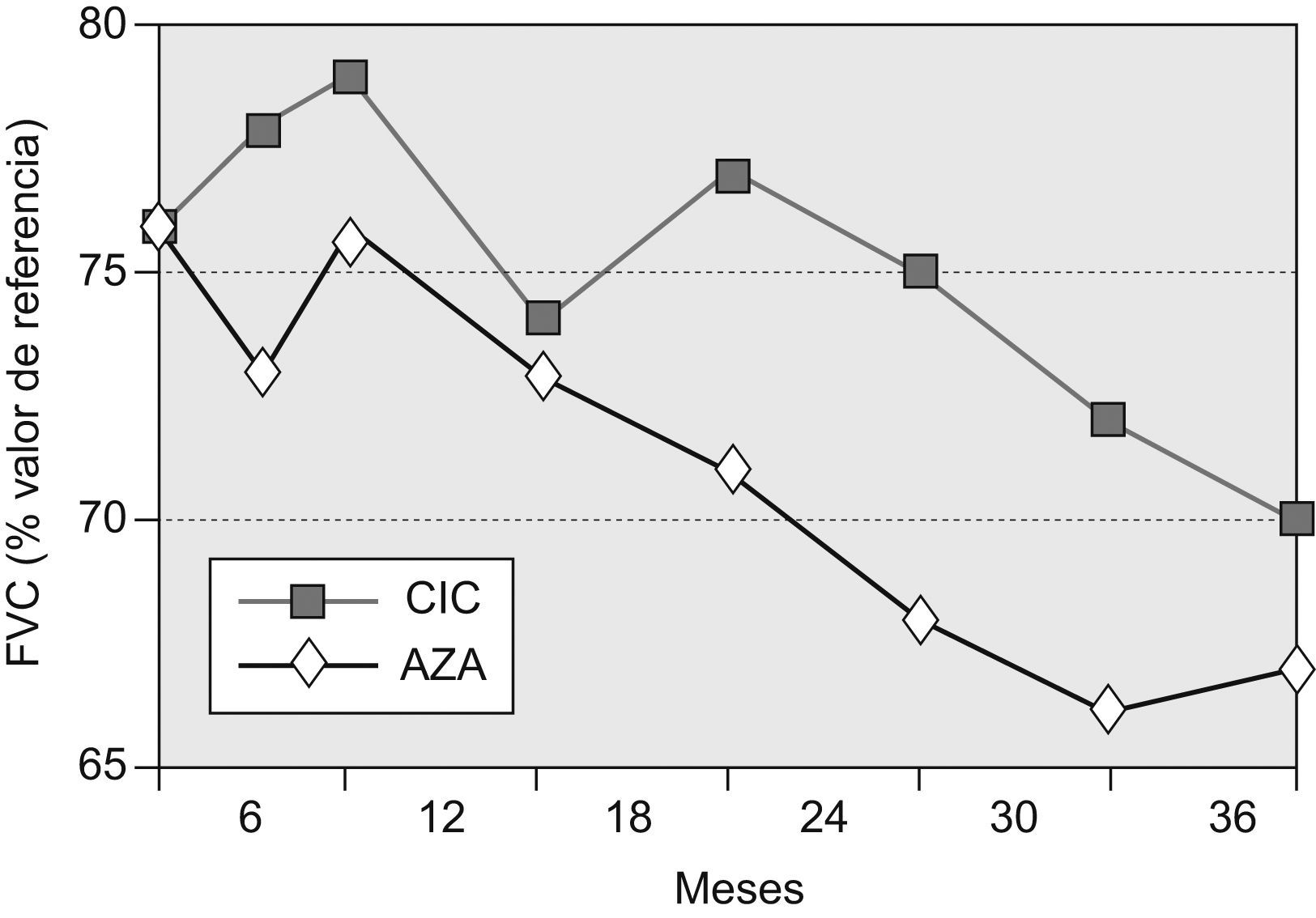
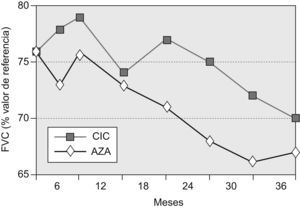
Capacidad vital forzadaLa FVC media (±desviación estándar) de los pacientes supervivientes del grupo AZA a los 36 meses fue del 67,2±15,3% (diferencia basal–36 meses=−8,8%), mientras que la del grupo CIC fue del 69,5±12,3 (diferencia basal–36 meses=–6,7%). La diferencia entre ambos grupos no fue significativa (p=0,16). No se registraron diferencias significativas entre ambos grupos en ninguno de los controles periódicos practicados en el seguimiento.
La evolución temporal de este parámetro de función pulmonar se muestra en la figura 2.
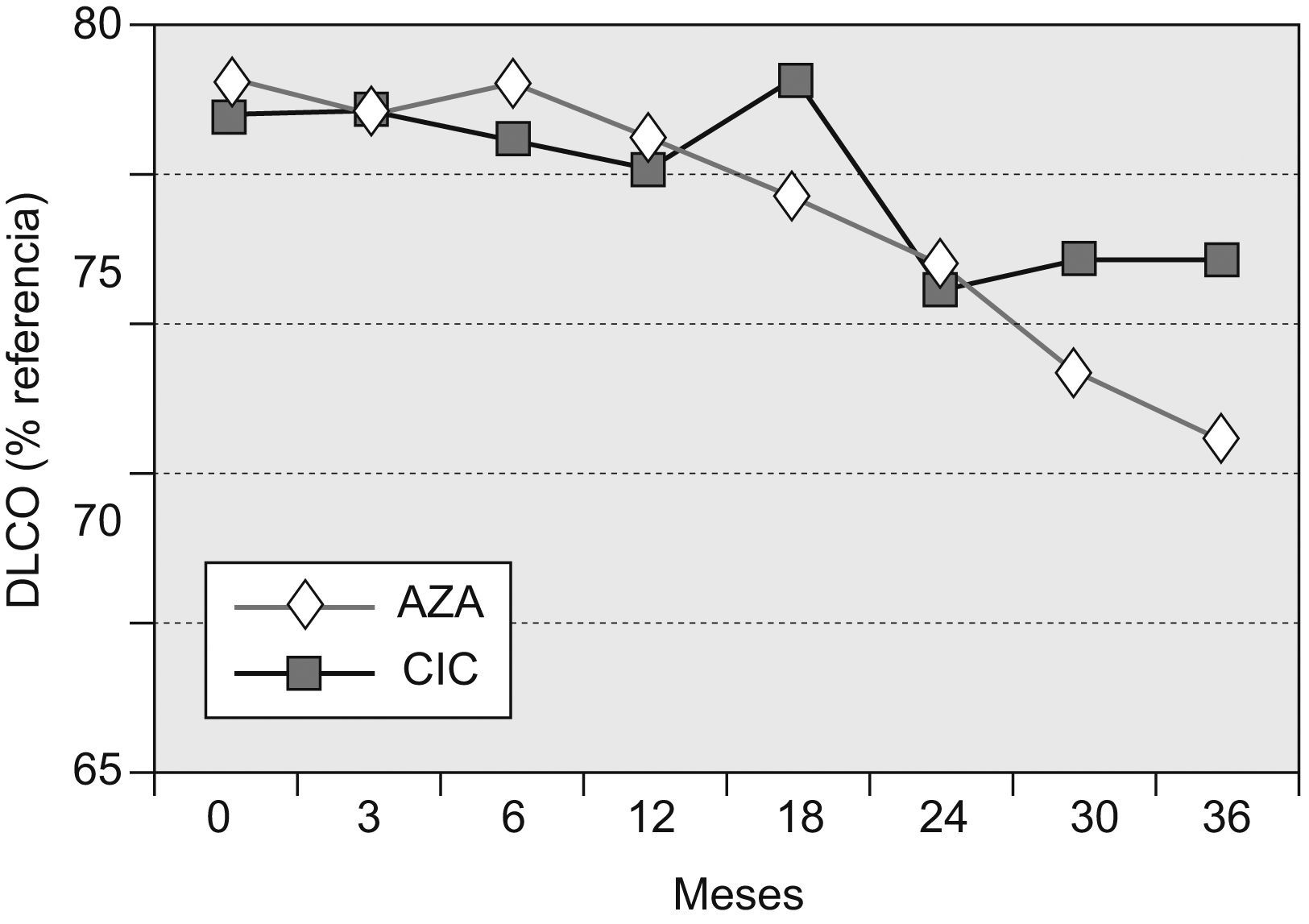
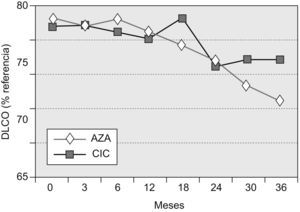
Capacidad de difusión del monóxido de carbonoEn los pacientes supervivientes a los 36 meses del grupo AZA, la DLCO fue del 55,8±16% (diferencia basal–36 meses=−11,81%), y en los del grupo CIC, del 62,1±17,9% (diferencia basal–36 meses=−4,4%). La diferencia entre ambos grupos de tratamiento, aunque mostró una tendencia a la significación estadística, no llegó a alcanzarla (p=0,0569). En los distintos puntos de control, sólo resultó significativa la diferencia en el control practicado en el mes 18 (grupo AZA:−1%; grupo CIC: +4%; p=0,048).
La evolución temporal de la DLCO se muestra en la figura 3.
Presión arterial de oxígenoNo hubo diferencias estadísticamente significativas entre ambos grupos para los valores basales y los medidos a los 36 meses: 66±6,2 frente a 64,4±8,3mmHg en el grupo AZA, y 65,9±5,8frente a 62,14±6,48mmHg en el grupo CIC.
Efectos adversosDos pacientes del grupo AZA y un paciente del grupo CIC presentaron leucopenia moderada, que se corrigió reduciendo la dosis de ambos fármacos. Un paciente del grupo CIC presentó cefalea relacionada con los pulsos intravenosos. En ninguno de los pacientes citados fue necesaria la retirada del fármaco. Un paciente del grupo AZA presentó aplastamiento vertebral en el mes 9 de tratamiento, por lo que se le retiró el corticoide y permaneció en tratamiento únicamente con azatioprina. No se registraron hepatotoxicidad, trastornos urinarios ni toxicidad pulmonar en ninguno de los 2 grupos durante el estudio. En el seguimiento postestudio, una paciente del grupo CIC fue diagnosticada de carcinoma de cérvix in situ en el curso de una revisión ginecológica ordinaria.
DiscusiónSi controvertido es el papel de los corticoides en la FPI, aún lo es más el de los agentes inmunodepresores. Basándose en los trabajos de Johnson et al6 y Raghu et al7, que mostraban una ligera mejoría de la supervivencia de los pacientes tratados con ciclofosfamida más prednisolona en comparación con prednisolona sola en el primer caso, y azatioprina más prednisona frente a prednisona sola en el segundo, el consenso ATS/ERS4 recomienda el tratamiento combinado con un corticoide y un agente inmunodepresor. El mismo consenso indica, no obstante, que no hay evidencia basada en ensayos clínicos bien realizados, aleatorizados y controlados con placebo, que demuestren que el tratamiento combinado corticoide-inmunodepresor produce una mejoría de la supervivencia o de la calidad de vida de los pacientes afectados de FPI, y que los potenciales y graves efectos adversos pueden tener más peso que los potenciales beneficios de dicha terapéutica. Hay trabajos retrospectivos que no demuestran beneficios en la supervivencia de pacientes con tratamiento combinado corticoide-inmunodepresor frente a aquéllos sin tratamiento farmacológico8. La Biblioteca Cochrane, en su revisión sobre la eficacia de los agentes inmunomoduladores en el tratamiento de la FPI9, indica que hay pocas pruebas para justificar el uso habitual de agentes no corticoides en el tratamiento de la FPI. En esa misma revisión se indica que la calidad general de los estudios identificados es deficiente y que los agentes inmunodepresores antiguos (azatioprina y ciclofosfamida) no se han evaluado de manera apropiada. Un segundo problema, además de la ausencia de ensayos clínicos bien realizados, es que un buen número de trabajos son previos a la actual clasificación de las neumonías intersticiales idiopáticas10, por lo que probablemente se hayan evaluado enfermedades y condiciones heterogéneas.
La ciclofosfamida es un agente alquilante que puede administrarse por vía oral e intravenosa11. Por esta última puede administrarse a dosis bajas-medias diarias o bien a dosis altas mensuales (pulsos o bolos). El tratamiento con bolos intravenosos de ciclofosfamida se utiliza ampliamente en vasculitis y enfermedades sistémicas autoinmunitarias12. Su eficacia es superior a la pauta oral en algunos procesos, como la nefritis lúpica o los síndromes de hemorragia alveolar asociados a lupus eritematoso sistémico13, así como en el control de enfermedades inmunológicas fulminantes14. La toxicidad es también menor que por vía oral—fundamentalmente toxicidad urológica (cistitis hemorrágica y carcinoma vesical)—, ya que la dosis acumulativa es 6-7 veces menor en la modalidad de bolos que por vía oral11.
Las referencias a la eficacia y seguridad de los bolos de ciclofosfamida en la FPI son muy escasas. Baughman y Lower15, en un trabajo publicado en 1992, trataron a 33 pacientes con bolos quincenales de ciclofosfamida y prednisolona durante un máximo de 18 meses. Los pacientes que sobrevivieron más de 6 meses mostraron una mejoría significativa en la FVC, que se mantuvo durante el año siguiente. Kolb et al16, en un estudio retrospectivo de 18 pacientes tratados con bolos de ciclofosfamida y prednisolona oral durante un año, observaron un efecto favorable en 11 (estabilización o mejoría de la FVC y PaO2). Este efecto se mantuvo al menos 3 meses después de la retirada del tratamiento. Los 2 estudios mencionados carecían de grupo comparativo.
El estudio más interesante, a nuestro juicio, es el realizado por Pereira et al17. Se trata de un estudio retrospectivo comparativo que incluyó a 82 pacientes, de los que 26 recibieron sólo corticoides y 56 corticoides más un agente inmunodepresor (azatioprina oral, ciclofosfamida oral o ciclofosfamida en bolos). La mediana de supervivencia fue de 25 meses en el grupo de corticoides solos y de 45 meses en el grupo de corticoides más inmunodepresor, diferencia que resultó estadísticamente significativa, si bien se asoció a pacientes con una FVC en el momento del diagnóstico superior al 70% del valor de referencia. El estudio no indica diferencias entre las 3 modalidades empleadas de tratamiento inmunodepresor. En nuestro estudio, la FVC en el momento del diagnóstico no es un parámetro estadísticamente significativo de supervivencia. En cambio sí ha influido la PaO2 en el momento del diagnóstico, con un punto de corte en 65mmHg. Es destacable en el estudio de Pereira et al la existencia de efectos adversos en el 8% de los pacientes del grupo de corticoide solos, y del 29% en el grupo de corticoide más inmunodepresor. El tratamiento con ciclofosfamida se interrumpió en 6 pacientes por cistitis hemorrágica, fatiga y leucopenia. Estos datos contrastan con los descritos en nuestros pacientes: sólo en uno se suspendió el tratamiento debido a fractura vertebral espontánea relacionada con prednisona. Tanto la azatioprina como la ciclofosfamida se toleraron bien. El principal efecto adverso en nuestro estudio fue la aparición de carcinoma de cérvix in situ en una paciente durante el seguimiento posterior a la finalización del estudio, si bien su relación con dicha modalidad terapéutica es discutible.
Es destacable en nuestro estudio la mejoría, estadísticamente significativa, de la supervivencia en el segundo y tercer años en el grupo CIC con respecto al grupo AZA (no así en el primer año). Esta mejoría en la supervivencia no se traduce, sin embargo, en una diferencia estadísticamente significativa en ambos grupos en las pruebas de función pulmonar e intercambio gaseoso: tan sólo la diferencia en la DLCO se acerca al valor de significación estadística, y sí es significativa en algún momento concreto de la evolución (control del mes 18) a favor del grupo CIC. Estas diferencias entre los objetivos de diversos estudios (supervivencia, función pulmonar, puntuación radiológica, índices de disnea y calidad de vida) han sido reseñadas en algunos trabajos18. Así, en el estudio inicial sobre la eficacia y seguridad de la pirfenidona, no se observó, durante un año de seguimiento, un deterioro significativo radiológico ni en la PaO2, que sin embargo no se acompañó de un efecto terapéutico en la supervivencia19,20. El estudio IFIGENIA21, un ensayo multicéntrico y aleatorizado en el que se estudiaron la eficacia y seguridad de la N-acetilcisteína combinada con azatioprina y corticoides frente a azatioprina y corticoides solos durante un año, se evidenció una tasa menor de declive de la función pulmonar (FVC y DLCO) en el grupo que recibió N-acetilcisteína. Este efecto beneficioso en la función pulmonar no se acompañó de una mejoría en la supervivencia. No está clara esta falta de correspondencia entre supervivencia y ganancia o pérdida de función pulmonar.
En definitiva, nuestros resultados muestran una mejoría significativa de la supervivencia en pacientes tratados con bolos de ciclofosfamida comparados con aquellos que recibieron azatioprina, con escasa repercusión en la función pulmonar.