Mycobacterium szulgai es una micobacteria ambiental no tuberculosa (MNT), de crecimiento lento y aislamiento muy infrecuente1. En más de 36.000 muestras de MNT procedentes de 14 países, entre ellos España, representó menos del 0,2% de los aislamientos2. Como el resto de MNT, puede estar presente en el polvo, el suelo, el agua, las plantas y los animales3. Su aislamiento del árbol respiratorio no siempre implica enfermedad por lo por lo que, como para otras MNT, la American Thoracic Society y la Infectious Diseases Society of America han elaborado una serie de criterios diagnósticos para intentar establecer su papel patógeno cuando se aísla de muestras biológicas4.
Se describe el caso de una mujer de 49 años, de profesión limpiadora, fumadora de 35 paquetes/año, enolismo crónico y EPOC moderado, trasladada a urgencias por el 061 en coma (índice de Glasgow 3 puntos), shock (TA 50/30mmHg) e insuficiencia respiratoria (SO2 75% con FIO2 al 0,21) procediendo a intubación, ventilación mecánica, administración de aminas vasoactivas e ingreso en la UCI. Dos meses antes refería malestar general, pérdida de 10kg de peso y, en la última semana, fiebre de hasta 39°C, tos y expectoración mucopurulenta.
La exploración evidenció un déficit ponderal grave (IMC 14,2) y disminución global del murmullo vesicular en ambos campos pulmonares. Los parámetros analíticos a su ingreso fueron 16.200 leucocitos/mm3 (81% neutrófilos, 9% linfocitos y 10% monocitos), VSG 111mm/1.ª hora, glucemia de 174mg/dl, ALP 133UI/l, gamma GT 231UI/l, LDH 392UI/l y proteína C reactiva de alta sensibilidad 9mg/dl. El resto de parámetros del hemograma, hemostasia, bioquímica, incluyendo procalcitonina e inmunoglobulinas resultaron normales. El antígeno urinario frente a Streptococcus pneumoniae fue negativo y frente a Legionella pneumophila serogrupo 1 fue positivo, por lo que el tratamiento empírico inicial con ceftriaxona y azitromicina fue sustituido por levofloxacino.
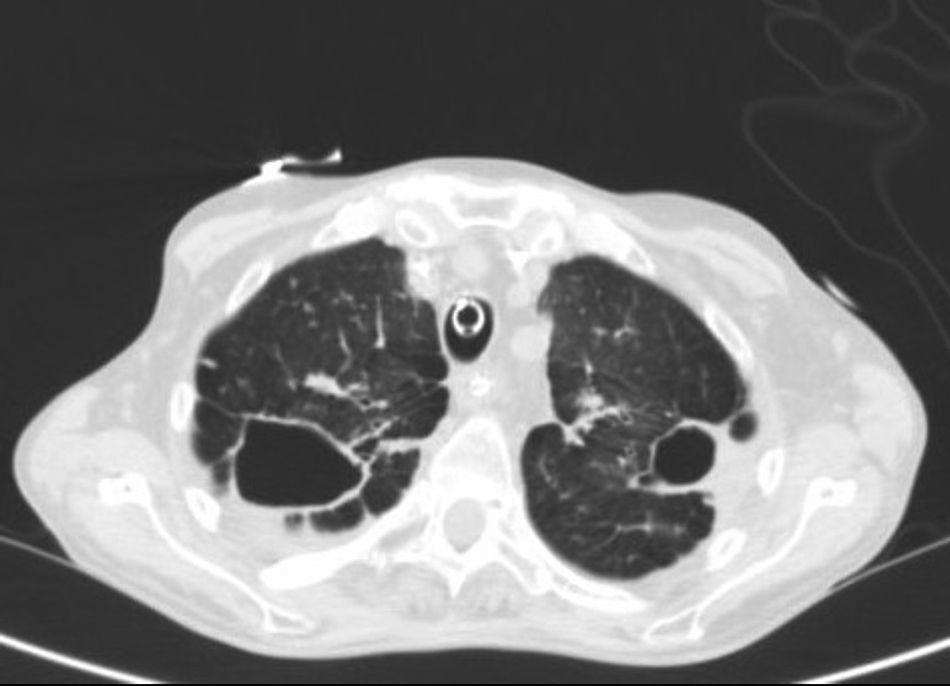
En la Rx tórax se observaron tractos fibrocavitados en ambos campos superiores y signos de atrapamiento aéreo que confirmó la TAC (fig. 1). No se objetivaron anomalías destacables en cráneo ni abdomen. Se realizó una fibrobroncoscopia en la que se objetivaron signos de inflamación de la mucosa bronquial y se tomaron muestras de aspirado bronquial para cultivo convencional y micobacterias. En el cultivo convencional se observó crecimiento de flora saprofita y no se obtuvo crecimiento de Legionella spp ni de hongos. En la tinción de Ziehl-Neelsen no se observaron bacilos ácido-alcohol resistente (BAAR). Se realizó estudio serológico frente al VIH y anticuerpos IgM frente a Mycoplasma pneumoniae, Coxiella burnetii, Chlamydophila pneumoniae, Legionella pneumoniae e IFI frente a Chlamydophila psittaci con resultado negativo. Los hemocultivos y el Mantoux también resultaron negativos.
A la semana de ingreso en la UCI, se practicó una nueva broncoscopia con hallazgos similares y negatividad de PCR frente a Mycobacterium tuberculosis (GeneXpert®, Cepheid). Tras extubarla, se diagnosticó un carcinoma epidermoide de base de lengua estadio IVA. A las 3 semanas se observó crecimiento de BAAR en 2 aspirados bronquiales obtenidos por broncoscopia. Se realizó hibridación en fase sólida mediante GenoType® Mycobacterium CM/AS (Hain Lifescience, Alemania), que no logró identificar la cepa por lo que se remitió al Grupo de Genética de Micobacterias de la Universidad de Zaragoza, identificándose como Mycobacterium szulgai (M. szulgai). Se inició tratamiento con rifampicina 600mg, etambutol 600mg y azitromicina 250mg/día, manteniendo el tratamiento hasta su fallecimiento a los 10 meses, por progresión tumoral. Inicialmente, y a pesar del tratamiento para su neoplasia con quimioterapia y radioterapia, la paciente presentó una evolución favorable clínica y radiológica, sin evidenciar crecimiento de M. szulgai en los controles de esputo.
Según los criterios de la ATS/IDSA, el aislamiento de M. szulgai conlleva en mayor medida que otras MNT una verdadera enfermedad pulmonar5,6. Aunque se ha descrito en estados de inmunosupresión, toma de fármacos, neoplasias y VIH, su asociación es considerablemente menor que con otras MNT7–13. Es excepcional que su diagnóstico sea la primera manifestación de una neoplasia subyacente, aunque en la paciente descrita existían otros factores de riesgo implicados que pudieron favorecer el desarrollo de la enfermedad como el alcoholismo crónico, el tabaquismo y la EPOC.
Más frecuente en varones (>85% de los pacientes comunicados), puede aparecer a cualquier edad, aunque la mayoría poseen una edad media alrededor de los 50-60 años. En más de 2 tercios de los pacientes, la enfermedad se limita al sistema respiratorio, y el cuadro clínico radiológico es indistinguible del producido por Mycobacterium tuberculosis y otras MNT. Se ha descrito, también, enfermedad extrapulmonar, así como enfermedad diseminada en pacientes inmunocomprometidos.
Philley y Griffith, siguiendo las guías ATS/IDSA, recomiendan la asociación de al menos 3 fármacos por vía oral: etambutol 15mg/kg/día, rifampicina 600mg/día o rifabutina 150-300mg/día, conjuntamente con azitromicina 250mg/día o claritromicina 500mg/12h o moxifloxacino 400mg/día, durante al menos 12 meses tras un cultivo negativo con buena respuesta en la mayoría de pacientes14.
La paciente cumplía los criterios ATS/IDSA para pensar que M. szulgai producía enfermedad pulmonar, ya que tenía lesiones radiológicas compatibles en la Rx y la TAC, se aisló M. szulgai en 2 muestras de aspirado bronquial con un período de una semana de intervalo, se descartó la presencia de otras micobacterias, otros patógenos y tumor broncogénico. La evolución clínica y radiológica de la infección fue adecuada con rifampicina, etambutol y azitromicina, a pesar de que posteriormente la paciente falleció por progresión de su neoplasia de base de lengua.
Queremos agradecer a la doctora Sofía Samper del Grupo de Genética de Micobacterias de la Universidad de Zaragoza, por su amabilidad y disponibilidad para realizar la identificación de M. szulgai.