*Los componentes del Grupo de Trabajo del PMIT-2 aparecen relacionados al final del artículo.
Introducción
La curación de los enfermos tuberculosos es una prioridad para el control de la tuberculosis (TB), puesto que la manera más eficaz de prevenir la transmisión y evitar la aparición de farmacorresistencias es la detección temprana y el adecuado tratamiento de los casos. La Organización Mundial de la Salud (OMS) ha propuesto como meta para el control de la TB en el año 2005 la curación de, al menos, el 85% de los enfermos bacilíferos. Para conseguir esta meta se recomienda la implantación de la estrategia DOTS (siglas en inglés de tratamiento acortado y directamente observado), en la que la monitorización de los resultados del tratamiento es un elemento esencial en la evaluación de la efectividad de los programas de control1.
Un grupo de trabajo conjunto entre la OMS y la Unión Internacional contra la Tuberculosis y las Enfermedades Respiratorias (UICTER) elaboró en 1997 una normativa para la monitorización de los resultados del tratamiento antituberculoso en la Región Europea de la OMS2. Dado que los objetivos de control global de la TB contemplan un 85% de resultados satisfactorios y que se considera aceptable una mortalidad del 5%, estas recomendaciones proponen que cuando se supere el 10% de resultados potencialmente insatisfactorios (RPI) (fallo del tratamiento, traslados y abandonos), se realice una investigación para averiguar las causas.
Entre los países de la Unión Europea, España ocupa el segundo lugar en incidencia tanto de TB como de sida3,4. Además, la TB ha sido de forma constante la enfermedad que con mayor frecuencia ha llevado al diagnóstico de sida, alcanzándose un máximo en 1994, fecha en la cual el 41,9% de los casos de sida tuvieron la TB como primera enfermedad diagnóstica5. Según los resultados del Proyecto Multicéntrico de Investigación en Tuberculosis (PMIT), al menos el 18% de todos los casos tuberculosos diagnosticados entre mayo de 1996 y abril de 1997 presentaban infección por el virus de la inmunodeficienca humana (VIH)6.
Estos datos indican que, como han apuntado otros autores7, ha habido una marcada interacción entre la TB y el sida en nuestro país al superponerse las poblaciones afectadas por ambos patógenos, y que el VIH ha producido un incremento de los casos de TB en España en décadas recientes. A pesar de ello, en el ámbito comunitario no hay mucha información disponible sobre el efecto del VIH en el resultado del tratamiento antituberculoso en España. Este artículo analiza este aspecto a partir de la información obtenida en una cohorte de casi 5.000 casos tuberculosos identificados a través del PMIT en 6 comunidades autónomas; los casos provienen de una población que supone el 32% de la población española8.
Pacientes y métodos
En el curso del PMIT se identificó a una cohorte de enfermos tuberculosos a través de búsqueda activa en distintos registros de 6 comunidades autónomas: Asturias, Galicia, País Vasco, La Rioja, Murcia y Cataluña. Se definió como caso de TB a toda persona que cumpliera las siguientes condiciones: a) presentar baciloscopia y/o cultivo positivo para Mycobacterium tuberculosis complex, y b) prescripción de tratamiento por un médico con 2 o más fármacos antituberculosos. Los sujetos que cumplían la segunda condición pero no la primera fueron incluidos como casos sólo si la prescripción de tratamiento se mantenía al cabo de 3 meses; aquellos con cultivo positivo para M. tuberculosis que no habían recibido tratamiento, bien por muerte o bien por cualquier otra causa excepcional, también se consideraron casos.
Se excluyeron de este estudio los casos de TB no iniciales y aquellos que se encontraban en prisión en el momento del diagnóstico por razones logísticas, así como los casos que no tenían historia clínica en el momento del diagnóstico, ya que ésta fue, junto con los registros de mortalidad, la fuente de información para el estudio.
La información clinicoepidemiológica y sobre resultados del tratamiento se recogió de la historia clínica. En los pacientes que se perdieron durante el seguimiento, cuya historia clínica no se encontró, o cuando la información sobre el resultado del tratamiento disponible en la historia no fue suficiente, se realizó una búsqueda en los registros de mortalidad de las comunidades autónomas para averiguar si el paciente había fallecido.
Puesto que la determinación del VIH no se realiza de forma sistemática en todos los pacientes tuberculosos, a efectos del estudio se clasificó a los pacientes como seropositivos cuando en la historia clínica aparecía un resultado positivo del test del VIH o bien este antecedente estaba recogido; como seronegativos, cuando estaba disponible el resultado negativo del test del VIH o bien se indicaba como tal en la historia, y como sin constancia de VIH, en las circunstancias restantes.
Los casos iniciaron tratamiento entre mayo de 1996 y abril de 1997, y el seguimiento se prolongó hasta 3 meses después de la fecha prevista de finalización del tratamiento.
Las categorías del resultado del tratamiento se definieron, de acuerdo con las recomendaciones europeas2, de la siguiente forma: a) resultado satisfactorio: persona que ha completado el tratamiento y a quien su médico ha dado de alta en un tiempo no superior a 3 meses desde la fecha prevista para la finalización del tratamiento; b) muerto: persona que muere, independientemente de la causa, en una fecha previa a la de finalización del tratamiento; c) traslado: persona que se ha trasladado antes de completar el tratamiento y de la cual no se conoce el resultado de éste; d) fracaso terapéutico: persona que a los 5 meses de haber iniciado el tratamiento no ha alcanzado la conversión bacteriológica, o que después de una conversión previa vuelve a tener cultivos positivos, y a la que se ha reemplazado el tratamiento de primera línea por uno de segunda línea, y e) interrupción del tratamiento (abandono): persona que ha interrumpido el tratamiento durante más de 2 meses consecutivos o que no lo ha completado 3 meses después de la fecha de finalización prevista, o que ha tomado menos del 80% de las dosis prescritas.
Estas categorías se agruparon posteriormente en 3: a) resultado satisfactorio; b) muerte, y c) RPI, que incluye traslado, fracaso e interrupción del tratamiento.
A efectos del estudio, también se consideró RPI cuando no existía suficiente información acerca del resultado del tratamiento en la historia clínica o bien ésta no se pudo localizar.
Análisis estadístico
En cuanto al análisis, se calcularon las distribuciones de frecuencia de los resultados del tratamiento según diferentes variables y se evaluaron las posibles asociaciones usando la prueba de la χ². Para evaluar la existencia de asociación entre las distintas variables independientes y muerte o RPI, se emplearon como medidas de asociación la odds ratio (OR) y su intervalo de confianza (IC) del 95%. En el análisis multivariante se utilizó la regresión logística para analizar las relaciones entre el resultado del tratamiento y las variables de interés. Para la construcción del modelo y verificación de bondad del ajuste, se siguieron las directrices de Hosmer y Lemeshow9, construyendo un modelo inicial en el que se incluyeron todas las variables significativas en el analisis bivariante (p ≤ 0,25). Mediante un procedimiento "hacia atrás", se eliminaron una a una las variables no relevantes utilizando la prueba de la razón de verosimilitudes (likelihood ratio test) para comparar los sucesivos modelos. Al modelo resultante de este proceso se le añadieron, una a una, las variables con relevancia epidemiológica, aunque no fueran estadísticamente significativas, y se evaluó si se incluían o no en el modelo final.
El programa estadístico utilizado fue el STATA (versión 6.0)10.
Resultados
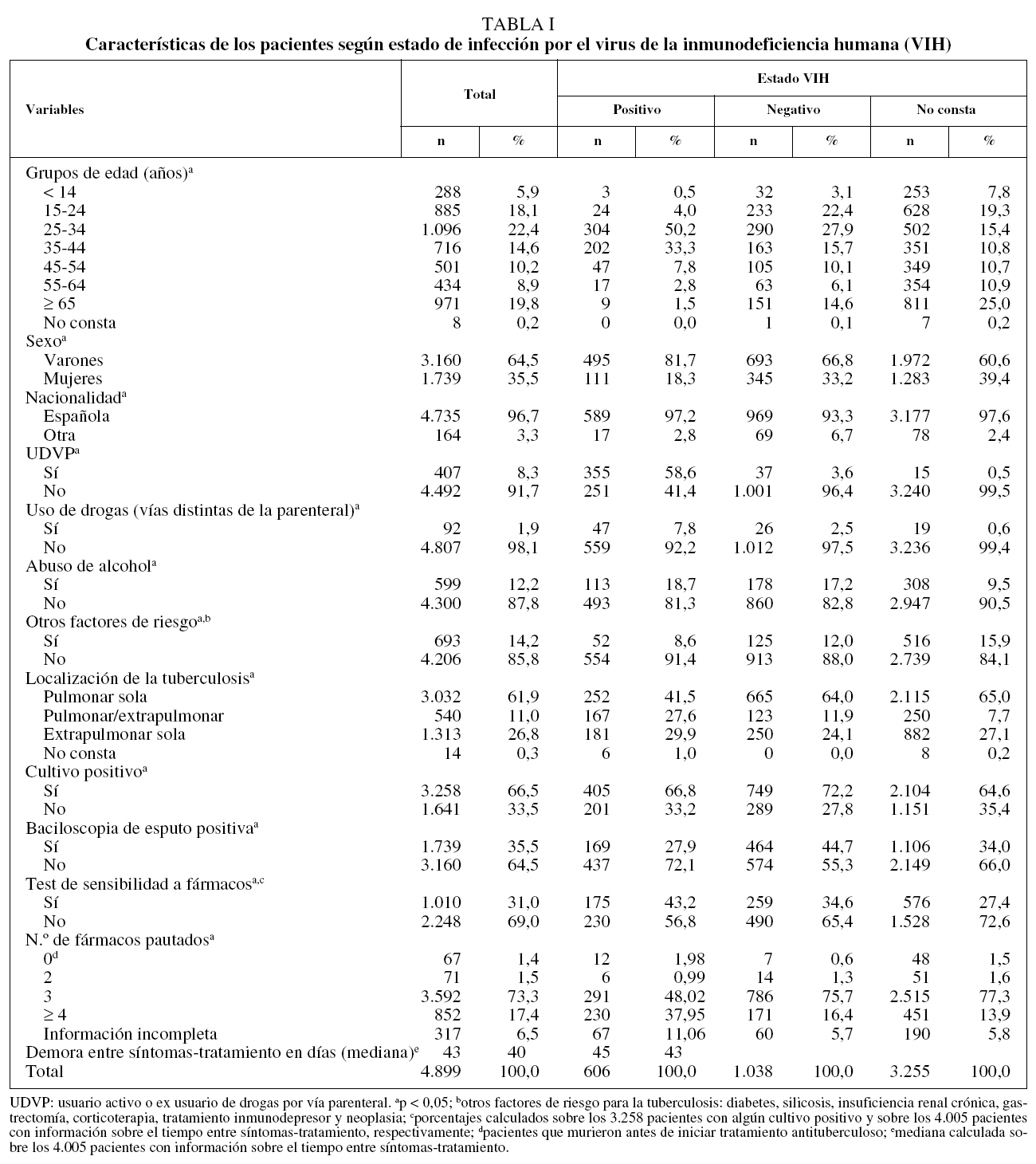
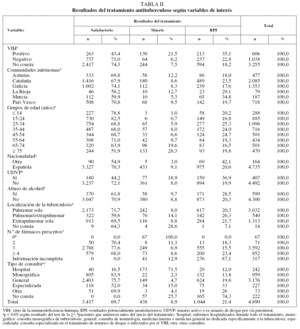
Un total de 4.899 casos nuevos de TB cumplieron los criterios de inclusión del estudio. De éstos, 606 (12,4%) presentaban infección por el VIH, 1.038 (21,2%) eran seronegativos y en 3.255 (66,4%) se desconocía este antecedente. La descripción de los casos, estratificados según su estado VIH, se muestra en la tabla I.
Se encontró información suficiente sobre el resultado del tratamiento antituberculoso en 4.240 pacientes (un 86,6% del total; rango, 73,3% en Murcia-89,5% en Galicia); esta información fue inadecuada en 342 historias (un 7% del total; rango, 5,7% en Galicia-16,0% en Murcia), y no se encontró la historia clínica en 317 casos (un 6,5% del total; rango, 3,5% en Galicia-10,2% en Murcia).
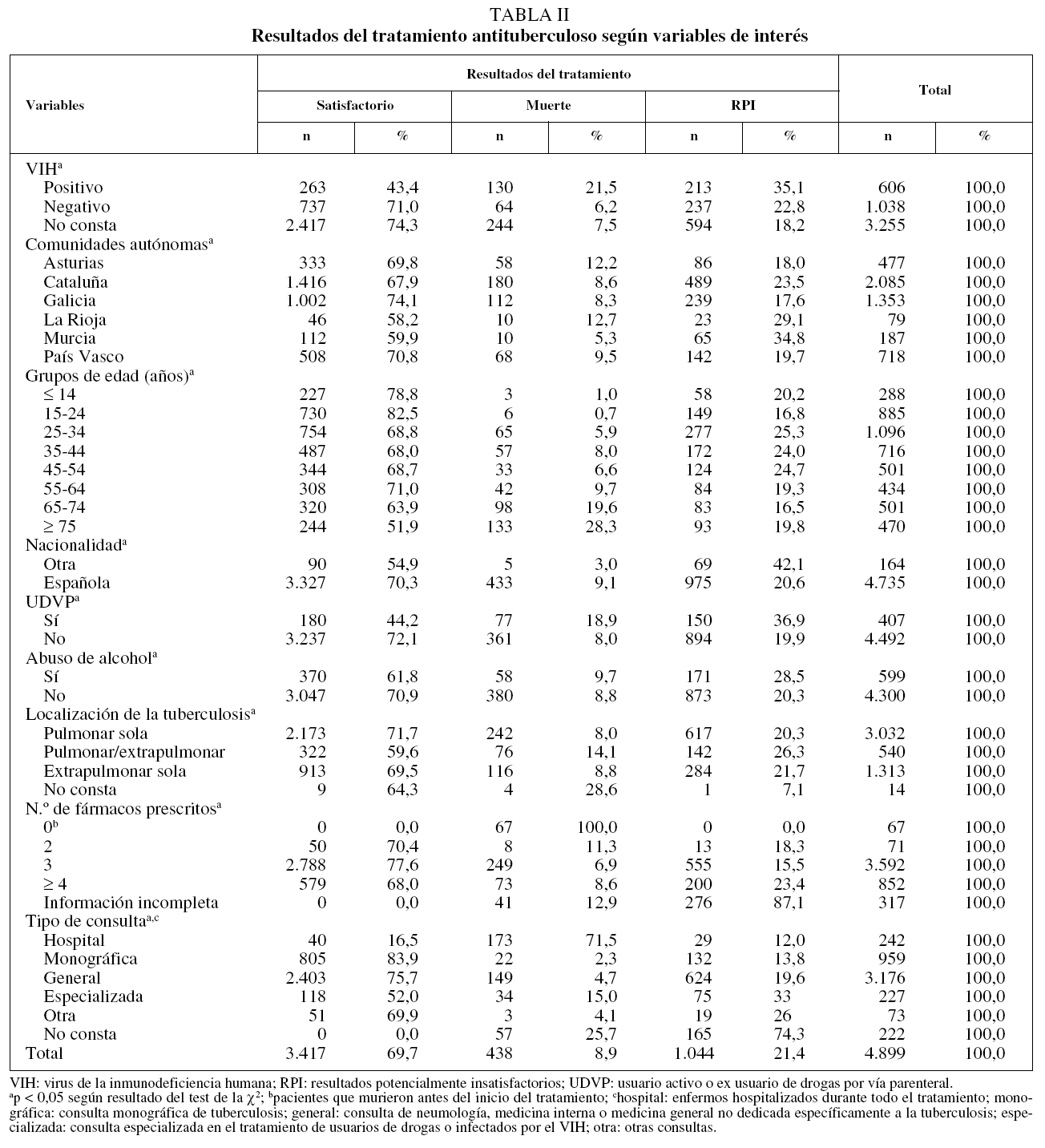
Los resultados del tratamiento fueron los siguientes: 3.417 casos (69,7%) tuvieron un resultado satisfactorio; 438 (8,9%) murieron antes o durante el curso del tratamiento, y 1.044 (21,4%) cumplieron la definición de RPI. De estos últimos, en 480 (un 9,8% del total) había información adecuada sobre el resultado del tratamiento en su historia clínica, en 288 (un 5,9% del total) no la había y en 276 casos (5,6% del total) no se pudo localizar la historia, aunque se sabía que el paciente no había fallecido. Entre estos casos con RPI, sólo 16 cumplieron con la definición de fallo terapéutico y en 57 se documentó el traslado; debido a esta baja proporción de fallos del tratamiento y traslado, y a que las recomendaciones europeas aconsejan agrupar fracaso terapéutico, traslado e interrupción del tratamiento en el mismo epígrafe (RPI), los resultados se muestran de esta forma en el presente artículo.
Cuando se estratificó el resultado del tratamiento según el estado VIH, las diferencias que se encontraron fueron enormes. Los casos de TB con coinfección por el VIH registraron una proporción mucho menor de resultados satisfactorios respecto a aquellos que eran seronegaticos o en quienes no constaba el estado VIH (un 43,4, un 71,0 y un 74,3%, respectivamente). Esta menor proporción de resultados satisfactorios fue consecuencia tanto de una mortalidad más elevada como de una alta proporción de RPI (tabla II).
Además del VIH, en el análisis univariante se observaron otras variables que tenían efecto sobre el resultado del tratamiento. Por comunidades autónomas, se encontró el mayor porcentaje de resultados satisfactorios en Galicia (74,1%), la mayor mortalidad en La Rioja (12,7%) y la mayor proporción de historias clínicas perdidas o con información insuficiente en Murcia (un 9,1 y un 15,5%, respectivamente). Los pacientes mayores de 64 años tuvieron la menor proporción de resultados satisfactorios, a costa, principalmente, de su mayor mortalidad. Entre los extranjeros se registró una mayor proporción de RPI, pero tuvieron una menor mortalidad que los de nacionalidad española. Los casos que eran o habían sido usuarios de drogas por vía parenteral (UDVP) también tuvieron peores resultados que los no UDVP tanto en términos de mortalidad como de RPI. Sin embargo, los casos alcohólicos tuvieron mayor porcentaje de RPI respecto a los no alcohólicos, pero la mortalidad fue casi la misma. Los pacientes con enfermedad conjunta pulmonar y extrapulmonar tuvieron peores resultados tanto en mortalidad como en RPI que aquellos con afectación pulmonar sola o extrapulmonar sola. También se encontraron diferencias notables en los resultados al estratificar por número de fármacos antituberculosos prescritos y tipo de consulta donde se trató a los enfermos (tabla II).
Se realizaron análisis separados para investigar los factores relacionados con la mortalidad y con los RPI; mientras que para el primer análisis se tuvo en cuenta a todos los pacientes, para el segundo se excluyó a los que habían fallecido (n = 438). Ambos análisis mostraron que el estado VIH era un fuerte modificador del efecto de otras variables sobre el resultado del tratamiento antituberculoso, por lo que, para analizar los predictores de la mortalidad y los RPI, se decidió ajustar modelos de regresión logística separados para cada una de las categorías del VIH.
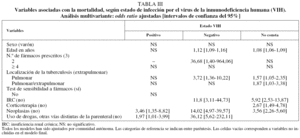
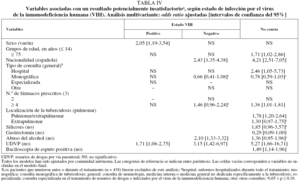
La mortalidad por todas las causas fue mucho más alta en los pacientes infectados por el VIH que entre los que no lo estaban y aquellos en los que no constaba este antecedente (el 21,5 frente al 6,2 y el 7,5%, respectivamente) (tabla II). En el análisis multivariante, las únicas variables asociadas con la mortalidad en los casos con coinfección por el VIH fueron la presencia de neoplasias además de la TB (OR = 3,5; IC del 95%, 1,4-8,8) y el uso de drogas por otras vías distintas de la parenteral (OR = 2,0; IC del 95%,1,0-4,0). Además de la presencia de neoplasias y el uso de drogas por otras vías distintas de la parenteral, la mortalidad entre los pacientes sin infección por el VIH estuvo positivamente asociada con la edad (OR = 1,1; IC del 95%, 1,1-1,2), insuficiencia renal crónica (OR = 11,8; IC del 95%, 3,1-44,7) y localización pulmonar de la TB (comparada con la extrapulmonar) (OR = 3,7; IC del 95%,1,4-10,2). Entre los pacientes en quienes no constaba el estado VIH, la mortalidad se incrementó con la edad (OR = 1,08; IC del 95%, 1,06-1,09) y fue más alta en los pacientes con enfermedad pulmonar (OR = 1,6; IC del 95%, 1,1-2,6) o pulmonar/ extrapulmonar (OR = 1,9; IC del 95%, 1,0-3,4) (tabla III).
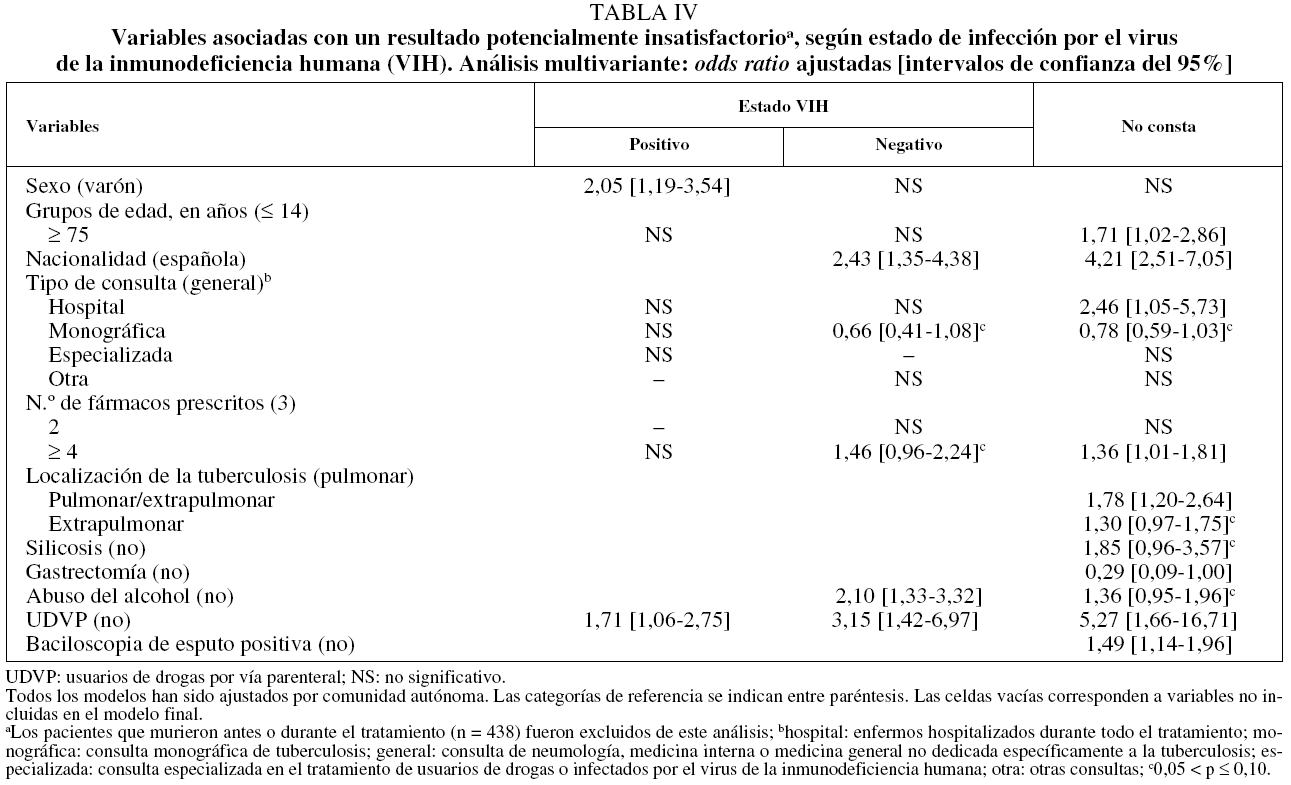
Respecto a los factores predictores de los RPI, entre los casos de TB con coinfección por el VIH, los RPI aumentaron en las mujeres (OR = 2,1; IC del 95%, 1,2-3,5) y en los UDVP (OR = 1,7; IC del 95%, 1,1-2,8).
En los individuos sin infección por el VIH, los RPI, además de estar asociados con los UDVP (OR = 3,2; IC del 95%, 1,4-7,0), aumentaron entre los alcohólicos (OR = 2,1; IC del 95%, 1,3-3,3) y los casos extranjeros (OR = 2,4; IC del 95%, 1,4-4,4), y decrecieron en los casos tratados en unidades monográficas de TB (OR = 0,7; IC del 95%, 0,4-1,08). En los pacientes en los que no constaba su estado VIH, los RPI estuvieron positivamente asociados con el hecho de ser UDVP (OR = 5,3; IC del 95%, 1,7-16,7), extranjero (OR = 4,2; IC del 95%, 2,5-7,1), tener más de 75 años (OR = 1,7; IC del 95%, 1,0-2,9), tener una baciloscopia de esputo positiva (OR = 1,5; IC del 95%, 1,1-2,0), haber realizado tratamiento con 4 o más fármacos (OR = 1,4; IC del 95%, 1,0-1,8), ser alcohólico (OR = 1,4; IC del 95%, 1,0-2,0), tener antecedentes de silicosis (OR = 1,9; IC del 95%, 1,0-3,6) y presentar localización pulmonar/extrapulmonar (OR = 1,8; IC del 95%, 1,2-2,6) o extrapulmonar sola (comparadas con la pulmonar) (OR = 1,3; IC del 95%, 1,0-1,8); finalmente, los RPI disminuyeron cuando los enfermos recibieron tratamiento para la TB en una unidad monográfica (OR = 0,8; IC del 95%, 0,6-1,0) (tabla IV).
Discusión
En un estudio llevado a cabo para investigar los resultados del tratamiento antituberculoso en España, la proporción de resultados satisfactorios no alcanzó el objetivo del 85% propuesto por la OMS, debido principalmente a la proporción de RPI, que excedió el 10% recomendado para la Región Europea de la OMS2.
Los resultados varían de forma importante respecto al estado VIH: entre los seropositivos, la proporción de casos con resultado satisfactorio fue sólo del 43,4%, mientras que para los casos seronegativos y aquellos en los que no constaba el estado VIH fueron del 71 y el 74,3%, respectivamente; además, tanto la mortalidad como los RPI fueron más altos entre los casos tuberculosos con coinfección con el VIH.
Cuando se comparan estos resultados con los publicados en otros estudios se han de tener en cuenta las diferencias metodológicas. En primer lugar, en este trabajo los casos cuyas historias clínicas no se encontraron o tenían información insuficiente sobre el resultado del tratamiento se clasificaron como RPI, mientras que en otros estudios estos casos se excluyen del análisis11,12. Cabría argumentar si no hubiera sido más correcto excluir a estos enfermos del análisis, puesto que podrían haber completado el tratamiento satisfactoriamente aunque la historia no esté disponible o su información sea incompleta; de hecho, si se les hubiera excluido, los resultados satisfactorios habrían aumentado hasta el 53,2, el 81,9 y el 82,2% para los enfermos con coinfección por el VIH, sin ella y en los que no constaba el estado VIH, respectivamente. Sin embargo, en nuestra opinión es más acertado considerar estos casos RPI, porque extraviar la historia o no anotar en ella qué ha pasado con un paciente, que además de no curarse puede ser infeccioso, no es obviamente buena práctica clínica; por lo demás, al actuar de esta manera seguimos la misma lógica que los organismos internacionales2 que consideran RPI los traslados de enfermos cuando no se conoce el resultado final del tratamiento.
En segundo lugar, el resultado del tratamiento antituberculoso se valoró 3 meses después de la fecha prevista de su finalización. Hubo 295 casos que continuaban en tratamiento después de esta fecha y que completaron el tratamiento con éxito más tarde; por lo tanto, si no se hubiera tenido en cuenta el límite de los 3 meses, a estos pacientes se les podría haber clasificado como resultado satisfactorio y el porcentaje de casos en esta categoría habría ascendido al 53% para los coinfectados por el VIH, al 77,2% para los seronegativos y al 79,6% para los pacientes con estado VIH desconocido.
La mortalidad por todas las causas entre los casos tuberculosos con coinfección por el VIH en este estudio fue más baja que la comunicada en Barcelona hace varios años13, y similar a la registrada en el Distrito de Salud Pública de Sevilla en el período 1994-199814. Con respecto a los RPI, otros estudios españoles de ámbito limitado también observan diferencias relacionadas con el VIH, de forma similar a nuestros datos14,15.
Varios estudios realizados fuera de nuestras fronteras han encontrado variaciones en la mortalidad de los casos tuberculosos relacionadas con el estado VIH, pero no así en las interrupciones del tratamiento16,17. Sin embargo, otros trabajos internacionales18,19 encuentran, como nosotros, diferencias tanto en la mortalidad como en la proporción de pacientes que no completan el tratamiento. Como se ha señalado en una reciente revisión20, las discrepancias entre estudios se explican a veces por diferencias en la metodología o en la población de estudio. Por ejemplo, las diferencias entre el estudio presente y el realizado entre los mineros sudafricanos17 se pueden explicar en cierta medida por el "efecto del trabajador sano", especialmente entre los infectados por el VIH, y por diferencias en la población (la mayoría de los seropositivos en nuestro estudio fueron UDVP con alta comorbilidad y el trabajo es de ámbito comunitario, mientras que los mineros vivían en condiciones especiales). Por otra parte, las diferencias entre los 2 estudios en términos de tratamiento de los pacientes son enormes, lo que sin duda tiene importancia: sólo el 3,3% de casos españoles (el 8,7% en los coinfectados por el VIH) tuvieron tratamiento directamente observado, mientras que en el estudio sudafricano dicho tratamiento fue universal.
Una cuestión a debatir es si la elevada mortalidad observada entre los coinfectados por el VIH en comparación con los no coinfectados puede atribuirse a diferencias en las pautas terapéuticas, retrasos en la instauración del tratamiento o farmacorresistencia. En relación con las diferencias en el tratamiento, es verdad que éstas existen, pero van en el sentido de tratar a los coinfectados con el VIH durante más tiempo como recomiendan las guías españolas21 y con más fármacos. Con respecto a la demora, la mediana de tiempo entre la aparición de síntomas y el tratamiento fue menor entre los infectados por el VIH que en el resto de los pacientes (40 frente a 44 días). Por último, en cuanto a las variaciones en la farmacorresistencia relacionadas con el VIH, no es posible descartarlas por completo puesto que desafortunadamente no fue posible obtener los resultados de los antibiogramas. Sin embargo, la resistencia a fármacos antituberculosos es moderada en España3,22 y no se han observado diferencias relacionadas con el VIH entre los casos nuevos de TB23,24.
En el análisis multivariante las únicas variables asociadas con mortalidad en los casos de TB coinfectados con el VIH fueron la presencia de neoplasias y el uso de drogas por otras vías distintas de la parenteral. Por tanto, la explicación más probable para su mayor mortalidad parece ser la mayor gravedad de la enfermedad y el hecho de que muchos de estos pacientes eran usuarios de drogas, cuya probabilidad de morir por causas distintas de la TB es mayor que la de los otros casos tuberculosos de edad similar, al margen de su estado VIH.
Las únicas variables asociadas con los RPI entre los casos coinfectados con el VIH en el análisis multivariante fueron ser UDVP y ser mujer. Aunque el primer resultado es común a los enfermos sin coinfección con el VIH, no ocurre lo mismo con la asociación al género femenino, lo que puede explicarse de 2 formas. En primer lugar, podría deberse a la mala situación social de estas mujeres, ya que en España las personas que se encuentran en estas circunstancias tienen más probabilidad de tener infección tuberculosa o TB activa25 y, además, la mejor educación se ha relacionado inversamente con el desarrollo de sida26. Por tanto, no resultaría sorprendente que los factores sociales estuvieran influyendo en el resultado del tratamiento antituberculoso. Desafortunadamente, en la historia clínica no suele recogerse información válida sobre la clase social y no hemos podido realizar ningún ajuste por esta variable. La segunda explicación nos conduce a pensar en la existencia de un efecto de discriminación entre las mujeres con infección por el VIH que no existe en el resto de las mujeres. Los resultados de otros estudios no apoyan esta explicación, ya que habitualmente las mujeres con infección por el VIH presentan mejores resultados después del tratamiento antirretroviral de gran actividad (TARGA) que los varones27. Sería interesante realizar estudios con información fiable sobre la clase social, los cuales podrían aclarar este tema.
Este estudio, de ámbito muy amplio, refleja la experiencia del tratamiento antituberculoso en condiciones reales en un momento en que se produjo una interacción importante entre la TB, el VIH y el UDVP, al mismo tiempo que proporciona un análisis en profundidad del efecto del VIH sobre los resultados del tratamiento antituberculoso y de la forma en que esta variable modifica los efectos de otras. En este sentido, los resultados no sólo son interesantes para España, sino también para otros países que ahora atraviesan una situación similar a la nuestra en la década de los noventa como puede ser el caso de Rusia.
Los resultados de este trabajo sugieren que, con respecto al resultado del tratamiento antituberculoso, hay 2 poblaciones claramente diferenciadas en nuestro país: los infectados por el VIH y los no infectados. Aunque entre estos últimos caben mejoras en cuanto al resultado del tratamiento antituberculoso (en particular, entre los inmigrantes, niños y alcohólicos), los resultados en los coinfectados con el VIH son mucho peores y requieren intervenciones específicas para mejorar la situación, sobre todo entre los usuarios de drogas. Está claro que la implantación en esta población de programas de tratamiento directamente observado, que han demostrado su efectividad incluso entre los UDVP28, debe ser prioritaria. Los programas de mantenimiento de metadona son una buena alternativa, ya que han demostrado ser costo-efectivos incluso para la terapia preventiva29 y hay evidencia de buena efectividad en nuestro medio30.
Respecto a las mujeres con TB/VIH, se deberían realizar investigaciones más detalladas para establecer si son necesarias actividades específicas en este colectivo para ayudarlas a completar el tratamiento antituberculoso.
Aunque la generalización del TARGA ha supuesto un descenso en la incidencia de los casos de TB relacionados con el VIH5,31, su disponibilidad per se no mejora el resultado del tratamiento antituberculoso. Por el contrario, el aumento de la toxicidad y las interacciones entre TARGA y algunos fármacos antituberculosos favorecen las interrupciones del tratamiento en los casos de TB coinfectados con el VIH, lo que complica el manejo clínico de estos pacientes32.
Este trabajo ha contado con la financiación del Fondo de Investigación Sanitaria, exp. 99/0016.
Grupo de Trabajo del Proyecto Multicéntrico de Investigación en Tuberculosis (PMIT-2)
Unidad de Investigación en Tuberculosis: M. Díez, J.A. Hernández, M.J. Bleda, A. Díaz, T. Caloto, C. Huerta, M.T. Moreno y F. Pozo.
Asturias: M.F. Vázquez, E. Bona, J. Bruno, M. Caicoya, M.L. Cornejo, B. del Busto, M.L. Fernández, M.L. García-Alcalde, M.C. García, M.D. Martín, N. Méndez, E. Lombardero, T. Pascual, J.R. Quirós y C. Valenzuela.
Cataluña: A. Domínguez, J. Alcaide, M. Alseda, N. Altet, J. Álvárez, J. Armengol, A. Artigues, E. Barbeta, J.A. Blasco, N. Camps, M.A. Carmona, R. Clos, N. Escatllar, N. Follia, F. García-Bragado, P. Godoy, S.J. Hernández, C. Izquierdo, J.M. Jansà, J. Maldonado, S. Mínguez, P. Molina, A. Orcau, M.N. Oyaga, J.M. Pina, J. Rebull, M.A. Romero, C. Sala, N. Torner, J. Torres, J. Ventosa y J. Vilaseca J.
Galicia: P. Gayoso, L. Anibarro, V.M. del Campo, E. Casariego, E.R. Cerdeira, M. Cueto, D. Díaz, M. Fernández, R. Lema, J.M. Lis, S. Pita, B. Uriel, R. Vázquez y E. Vázquez.
La Rioja: J.M. López, M.P. Díez, M.E. Lezaun, M. Perucha y E. Ramalle.
Murcia: A. García-Fulgueiras, F. Galvañ, J.J. Guillén, E. Gutiérrez, M. Lorenzo, C. Navarro, B. Párraga, F. Sánchez y C. Santiuste.
País Vasco: C. Castells, R. Alkiza, M. Azpiazu, M. Basterrechea, E. Centeno, A. Celaya, J.E. Ciruelos, J.A. Crespo, F. García, M.A. García, J. Laparra, J.M. Merino y C. Salinas.