Tras las últimas recomendaciones de la Sociedad Española de Neumología y Cirugía Torácica (SEPAR) para el diagnóstico y el tratamiento del síndrome de apneas-hipopneas del sueño (SAHS) publicadas en 1998 y el Documento de Consenso Nacional sobre el SAHS (DCNSAHS) del Grupo Español de Sueño (GES) de 2005, la normativa actual intenta actualizar con la mejor evidencia disponible las recomendaciones de diagnóstico y tratamiento del SAHS, definido como un índice de apnea-hipopnea alterado (IAH > 5), acompañado al menos de ronquido y/o apneas presenciadas. Se ha seguido el sistema Grade1 (tabla 1) para establecer recomendaciones (consistente o débil) en función de la calidad de la evidencia (alta, moderada, baja o muy baja) de los estudios en la literatura.
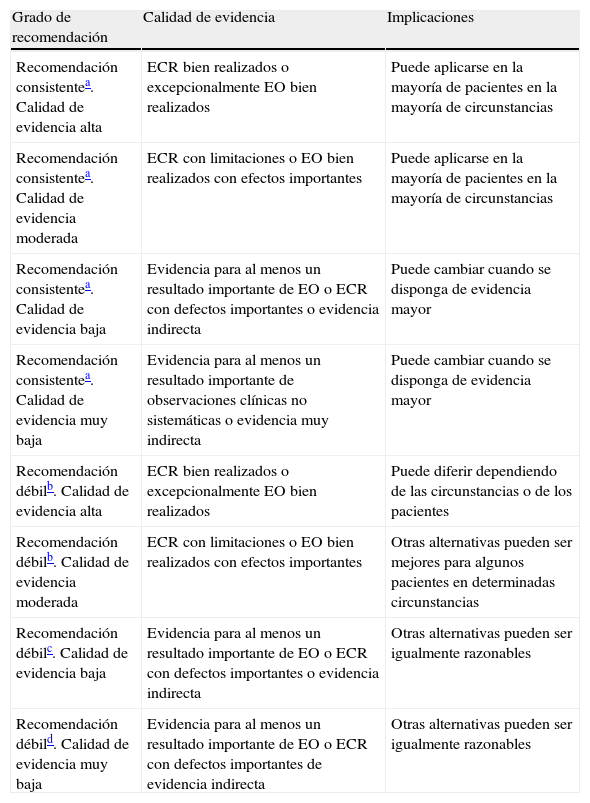
Clasificación de las recomendaciones y calidad de evidencia según el sistema Grade1
| Grado de recomendación | Calidad de evidencia | Implicaciones |
| Recomendación consistentea. Calidad de evidencia alta | ECR bien realizados o excepcionalmente EO bien realizados | Puede aplicarse en la mayoría de pacientes en la mayoría de circunstancias |
| Recomendación consistentea. Calidad de evidencia moderada | ECR con limitaciones o EO bien realizados con efectos importantes | Puede aplicarse en la mayoría de pacientes en la mayoría de circunstancias |
| Recomendación consistentea. Calidad de evidencia baja | Evidencia para al menos un resultado importante de EO o ECR con defectos importantes o evidencia indirecta | Puede cambiar cuando se disponga de evidencia mayor |
| Recomendación consistentea. Calidad de evidencia muy baja | Evidencia para al menos un resultado importante de observaciones clínicas no sistemáticas o evidencia muy indirecta | Puede cambiar cuando se disponga de evidencia mayor |
| Recomendación débilb. Calidad de evidencia alta | ECR bien realizados o excepcionalmente EO bien realizados | Puede diferir dependiendo de las circunstancias o de los pacientes |
| Recomendación débilb. Calidad de evidencia moderada | ECR con limitaciones o EO bien realizados con efectos importantes | Otras alternativas pueden ser mejores para algunos pacientes en determinadas circunstancias |
| Recomendación débilc. Calidad de evidencia baja | Evidencia para al menos un resultado importante de EO o ECR con defectos importantes o evidencia indirecta | Otras alternativas pueden ser igualmente razonables |
| Recomendación débild. Calidad de evidencia muy baja | Evidencia para al menos un resultado importante de EO o ECR con defectos importantes de evidencia indirecta | Otras alternativas pueden ser igualmente razonables |
EO: estudios observacionales; ERC: estudios controlados aleatorizados.
La normativa se ha estructurado en 8 temas que abordan la definición, aspectos epidemiológicos, clínicos (incluyendo las complicaciones cardiovasculares por su especial implicación en la decisión terapéutica), métodos diagnósticos y tratamiento. De acuerdo con la evidencia derivada de recientes y sólidos estudios de cohorte que demuestran un aumento de morbimortalidad cardiovascular en los pacientes con SAHS, especialmente en aquellos con un IAH ≥ 30, en esta normativa se acepta como criterio de tratamiento un IAH ≥ 30, aún en los pacientes con escasa sintomatología.
El síndrome de hipoventilación-obesidad y la respiración de Cheyne-Stokes son trastornos respiratorios durante el sueño que frecuentemente se asocian al SAHS, por lo que también se revisan en esta normativa. Se dedica un capítulo al SAHS infantil, cuyo reconocimiento y prevalencia están aumentando, y que causará un incremento en la actividad de las Unidades de Sueño. Finalmente, se repasa el tema del riesgo de accidentes y la dificultad que sigue planteando la concesión y renovación del permiso de conducir en pacientes con SAHS.
Concepto, definiciones, gravedad, patogenia y epidemiologíaEl Documento Nacional de Consenso sobre el SAHS de 2005 definió el SAHS como «un cuadro de somnolencia excesiva, trastornos cognitivo-conductuales, respiratorios, cardiacos, metabólicos o inflamatorios secundarios a episodios repetidos de obstrucción de la vía aérea superior (VAS) durante el sueño2 (recomendación consistente, calidad de la evidencia alta). Estos episodios se miden con el índice de apneas-hipopneas (IAH) (tabla 2). Un IAH > 5 asociado a síntomas relacionados con la enfermedad y no explicados por otras causas, confirma el diagnóstico2 (grado de recomendación consistente, calidad de la evidencia baja). Esta definición es controvertida. Así, considerar un IAH > 5 como anormal es discutible y es probable que el umbral de anormalidad sea diferente, en relación al sexo y a la edad (recomendación consistente, calidad de la evidencia baja). Por otra parte, la asociación del SAHS con la excesiva somnolencia diurna (ESD) se estableció de manera arbitraria.
Definiciones aceptadas de los principales eventos respiratorios y recomendadas por el Documento Nacional de Consenso sobre el síndrome de apnea-hipoapnea del sueño.
| Apnea obstructiva | Ausencia o reducción > 90% de la señal respiratoria (termistores, cánula nasal o neumotacógrafo) de > 10 segundos de duración en presencia de esfuerzo respiratorio detectado por las bandas toracoabdominales |
| Apnea central | Ausencia o reducción > 90% de la señal respiratoria (termistores, cánula nasal o neumotacógrafo) de > 10 segundos de duración en ausencia de esfuerzo respiratorio detectado por las bandas toracoabdominales |
| Apnea mixta | Es un evento respiratorio que, habitualmente, comienza con un componente central y termina en un componente obstructivo |
| Hipopneaa | Reducción discernible (> 30% y < 90%) de la amplitud de la señal respiratoria de > 10 segundos de duración o una disminución notoria del sumatorio toracoabdominal que se acompaña de unas desaturación (≥ 3%) y/o un microdespertar en el EEG |
| Esfuerzos respiratorios asociados a microdespertares (ERAM) | Período > 10 segundos de incremento progresivo del esfuerzo respiratorio (idealmente detectado por un incremento progresivo de la presión esofágica que acaba, con un microdespertar (no hay una reducción evidente de la amplitud del flujo –criterio de hipopneas-). También puede detectarse por periodos cortos de limitación del flujo –aplanamiento de la señal de la sonda nasal o reducciones del sumatorio toracoabdominal acompañados de un microdespertar) |
| Índice de apneas hipopneas (IAH)b índice de alteración respiratoria (IAR)b | Suma del número de apneas e hipopneas (es el parámetro más frecuentemente utilizado para valorar la gravedad de los trastornos respiratorios durante el sueño. Consiste en la suma del número de apneas + hipopneas + ERAM por hora de sueño (o por hora de registro si se usa una poligrafía respiratoria). El IAR se corresponde con el Respiratory Disturbance Index (RDI) de la literatura |
| Definición de SAHS: SAHS = 1 + (A o B) | 1. IAR > 5 asociado a uno de los siguientes síntomas |
| A. Excesiva somnolencia diurna (ESD) no explicada por otras causas | |
| B. Dos o más de los siguientes | |
| B1. Asfixias repetidas durante el sueño | |
| B2. Despertares recurrentes durante el sueño | |
| B3. Percepción del sueño como no reparador | |
| B4. Cansancio y/o fatiga durante el día | |
| B5. Dificultades de concentración |
La ESD es un síntoma difícil de medir y muy prevalente entre la población general3,4 por lo que un IAH > 5 y la ESD resultan ser, por su elevada prevalencia, elementos concurrentes pero no necesariamente asociados. Además, la mayoría de los estudios no encuentran una asociación entre el IAH y la ESD3 lo que sugiere que el SAHS tiene una expresión plurifenotípica donde hay sujetos que responden a la definición clásica (IAH elevado y ESD), con o sin complicaciones secundarias, mientras que en otros puede haber complicaciones sin síntomas o bien, exclusivamente, un IAH elevado (grado de recomendación consistente, calidad de la evidencia baja). Por lo tanto, y teniendo en cuenta todos los datos disponibles, la presencia de un IAH > 15 está asociada con un aumento del riesgo cardiovascular, con o sin síntomas asociados, y este riesgo es mucho mayor para pacientes con un IAH > 30. Estos datos sugieren fuertemente que la definición de SAHS debe estar basada, prioritariamente, en la objetivación de un IAH anormal y así se reconoce en las recientes recomendaciones de la American Academy of Sleep Medicine5.
FisiopatologíaLos mecanismos fisiopatológicos del SAHS no son plenamente conocidos y se sugiere un origen multifactorial donde interaccionan factores anatómicos y funcionales (grado de recomendación consistente, calidad de la evidencia moderada). El colapso de la VAS se produciría como consecuencia de un desequilibrio de fuerzas entre las que tienden a cerrarla y las que la mantienen abierta. Se acepta que existen factores que tienden a cerrar la luz de la VAS secundarios a una deficiencia en sus reflejos, en los centros respiratorios o en la propia musculatura de la VAS, causando los diferentes eventos respiratorios y los trastornos fisiopatológicos y biológicos secundarios, para los que se ha sugerido una base genética y ambiental (recomendación consistente, calidad de la evidencia baja).
EpidemiologíaEl SAHS es una enfermedad muy prevalente en la población general que puede causar deterioro de la calidad de vida, hipertensión arterial, enfermedades cardiovasculares, cerebrovasculares, accidentes de tráfico y se relaciona con un exceso de mortalidad1,2,6–9 (recomendación consistente, calidad de la evidencia alta). Además, se ha demostrado que los pacientes no diagnosticados duplican el consumo de recursos sanitarios con respecto a los diagnosticados y tratados10,11. Por todo ello, se considera el SAHS como un problema de salud pública de primera magnitud. En España entre el 3 y el 6% de la población padece un SAHS sintomático y entre el 24 y el 26% un IAH > 54.
En cuanto a los factores de riesgo, la edad, el sexo masculino y el índice de masa corporal son los más importantes. La prevalencia del SAHS se incrementa con la edad llegando a triplicarse en los ancianos comparados con las edades medias. Asimismo, la relación hombre/mujer es en las edades medias de 2-3/1, tendiendo a igualarse a partir de la menopausia. Otras variables que influencian la aparición de un SAHS o su agravamiento son el alcohol, tabaco, sedantes, hipnóticos y barbitúricos y la posición en decúbito supino. Otros factores importantes son los genéticos, familiares y raciales (recomendación consistente, calidad de la evidencia alta). Con respecto a la clasificación por gravedad se establece en: leve (IAH: 5-14,9); moderada (IAH: 15-29,9); grave (IAH > 30)12 (recomendación consistente, calidad de la evidencia baja-moderada).
Todos los indicios apuntan que el desarrollo de la Medicina personalizada nos permitirá identificar qué factores genéticos condicionan la aparición de un SAHS, así como en quiénes un IAH elevado supondrá un riesgo determinado de salud que podamos cuantificar y diferenciar de aquellos otros que, por sus características genéticas, estarán más protegidos frente a las consecuencias del SAHS lo que nos permitirá diseñar intervenciones que tendrán influencia en la prevención y en el tratamiento. En el momento actual tenemos que continuar guiándonos por el riesgo epidemiológico y este indica que un IAH elevado implica un daño potencial para la salud.
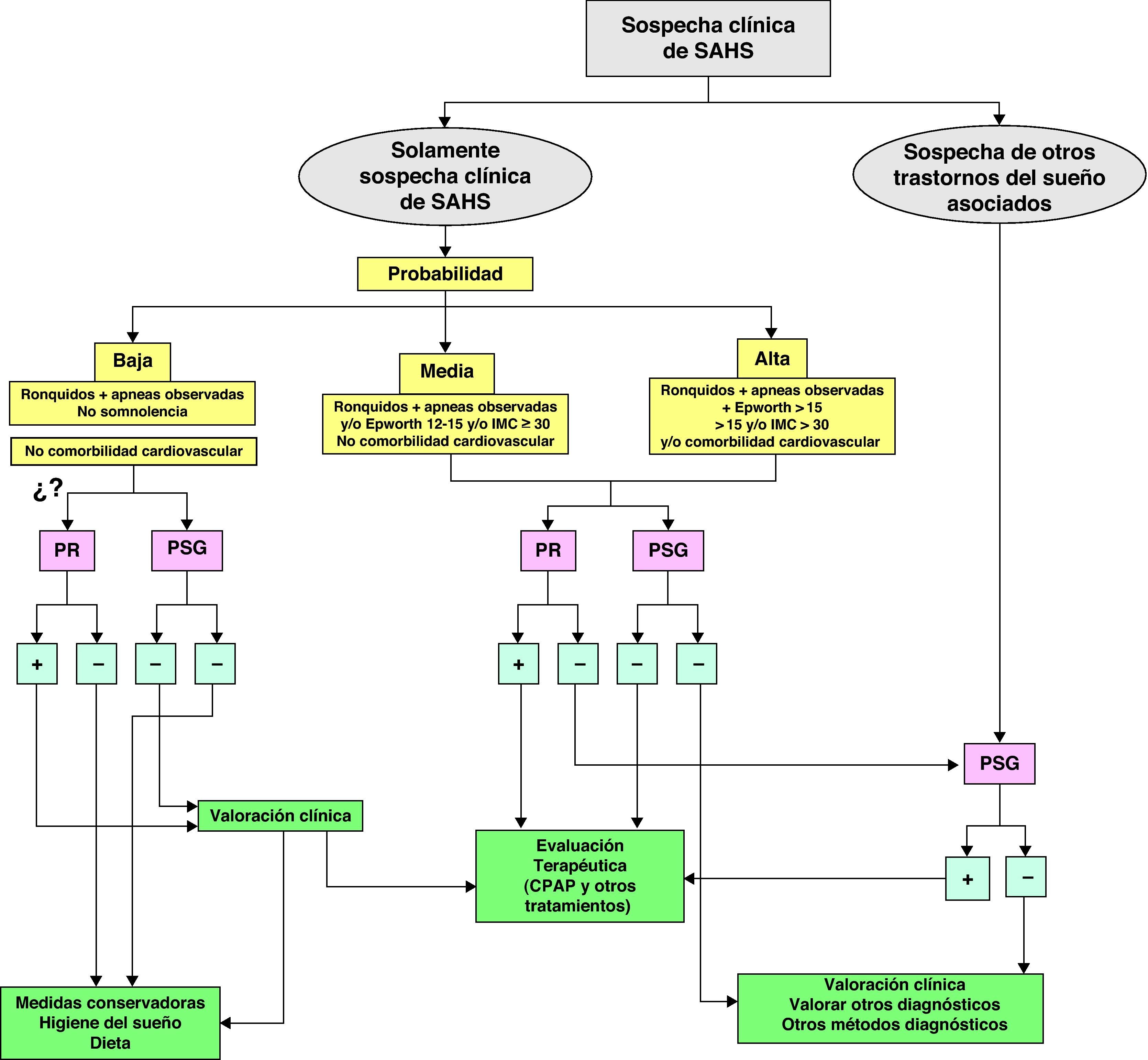
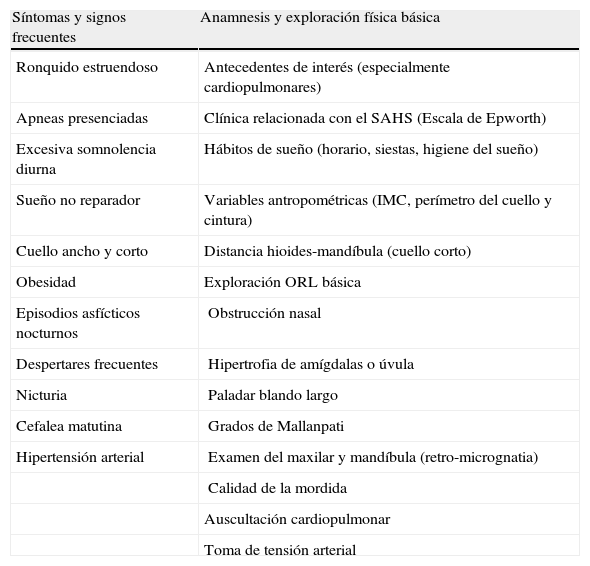
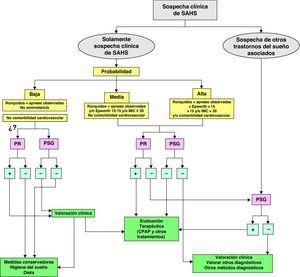
Clínica y exploración física del SAHSLa clínica relacionada con el SAHS aparece como consecuencia de dos hechos fisiopatológicos fundamentales: por una parte, las apneas, hipopneas e hipoxia intermitentes y por otra, la desestructuración del sueño2. Los síntomas y signos más frecuentes, ya sean diurnos o nocturnos se recogen en la tabla 3. Ningún parámetro clínico aislado o en combinación con otros ha demostrado suficiente valor en el diagnóstico del SAHS dado que también pueden aparecer en individuos sanos con una elevada frecuencia o estar ausentes en pacientes con SAHS (recomendación consistente, calidad de evidencia alta) si bien la valoración clínica y exploración física exhaustivas son necesarias ya que nos permiten clasificar a los pacientes en alta, media o baja probabilidad clínica «pretest» (fig. 3: métodos diagnósticos), lo cual es imprescindible para valorar posteriormente el método diagnóstico a utilizar, (recomendación consistente, calidad de evidencia baja). La triada clínica principal del SAHS la componen 3 síntomas13:
- -
Roncopatía crónica: es el síntoma con mayor sensibilidad (su ausencia hace poco probable el diagnóstico de SAHS). Sin embargo la mayoría de roncadores no tienen SAHS (roncan el 40% de los varones y el 20% de las mujeres de la población general). Por ello la presencia de roncopatía crónica como síntoma único no es suficiente para la realización de una prueba de sueño con intención diagnóstica de SAHS.
- -
Apneas presenciadas: es el síntoma con mayor especificidad, la cual aumenta si son observadas de forma repetida durante la misma noche y si son prolongadas.
- -
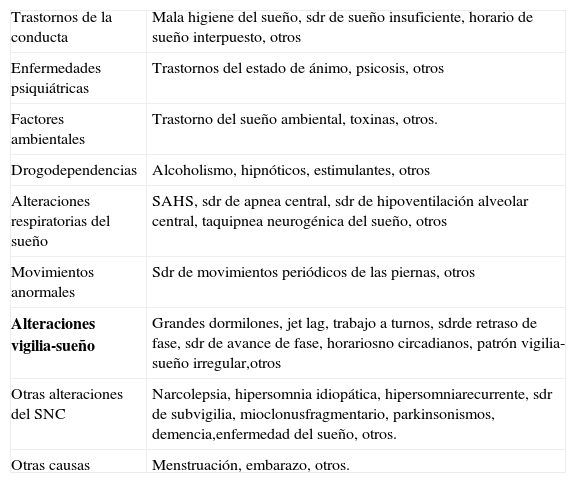
Hipersomnia diurna o tendencia a dormirse involuntariamente ante situaciones inapropiadas: síntoma poco específico y sensible pero el de mayor importancia ya que marca la intensidad clínica del SAHS. Su presencia no explicada por circunstancias evidentes es suficiente aun en ausencia de otros síntomas o signos para la realización de un estudio de sueño con carácter diagnóstico. Es importante descartar otras causas de hipersomnia (tabla 4). La medición de la hipersomnia puede realizarse mediante métodos subjetivos u objetivos. Entre los métodos subjetivos, el más utilizado es el cuestionario de Epworth14. La presencia de una puntuación por encima o igual a 12 puntos (sobre 24 puntos) indica hipersomnia patológica. Aunque está sujeto a variaciones culturales, de edad y sexo y tiene escasa correlación con las medidas objetivas, es útil especialmente en el seguimiento del paciente con medidas repetidas. Por su simplicidad también puede utilizarse la clasificación en grados de la hipersomnia (leve, moderada o grave). Son métodos objetivos el test de latencias múltiples del sueño (TLMS), test de mantenimiento de la vigilia (TMV), el test de Osler y el test de vigilancia motriz.
Tabla 4.Diagnóstico diferencial de la hipersomnia.
Trastornos de la conducta Mala higiene del sueño, sdr de sueño insuficiente, horario de sueño interpuesto, otros Enfermedades psiquiátricas Trastornos del estado de ánimo, psicosis, otros Factores ambientales Trastorno del sueño ambiental, toxinas, otros. Drogodependencias Alcoholismo, hipnóticos, estimulantes, otros Alteraciones respiratorias del sueño SAHS, sdr de apnea central, sdr de hipoventilación alveolar central, taquipnea neurogénica del sueño, otros Movimientos anormales Sdr de movimientos periódicos de las piernas, otros Alteraciones vigilia-sueño Grandes dormilones, jet lag, trabajo a turnos, sdrde retraso de fase, sdr de avance de fase, horariosno circadianos, patrón vigilia-sueño irregular,otros Otras alteraciones del SNC Narcolepsia, hipersomnia idiopática, hipersomniarecurrente, sdr de subvigilia, mioclonusfragmentario, parkinsonismos, demencia,enfermedad del sueño, otros. Otras causas Menstruación, embarazo, otros.
Síntomas y signos más frecuentes del SAHS.
| Síntomas y signos frecuentes | Anamnesis y exploración física básica |
| Ronquido estruendoso | Antecedentes de interés (especialmente cardiopulmonares) |
| Apneas presenciadas | Clínica relacionada con el SAHS (Escala de Epworth) |
| Excesiva somnolencia diurna | Hábitos de sueño (horario, siestas, higiene del sueño) |
| Sueño no reparador | Variables antropométricas (IMC, perímetro del cuello y cintura) |
| Cuello ancho y corto | Distancia hioides-mandíbula (cuello corto) |
| Obesidad | Exploración ORL básica |
| Episodios asfícticos nocturnos | Obstrucción nasal |
| Despertares frecuentes | Hipertrofia de amígdalas o úvula |
| Nicturia | Paladar blando largo |
| Cefalea matutina | Grados de Mallanpati |
| Hipertensión arterial | Examen del maxilar y mandíbula (retro-micrognatia) |
| Calidad de la mordida | |
| Auscultación cardiopulmonar | |
| Toma de tensión arterial |
IMC: índice de masa corporal; ORL: otorrinolaringológico.
En la tabla 3 aparecen los síntomas y signos más frecuentes relacionados con el SAHS, así como la anamnesis y exploración básica necesarias. Otros síntomas y signos frecuentes que no aparecen en la tabla (en ocasiones relacionados con la edad y el sexo del paciente) son: diaforesis, pesadillas, sueño agitado, insomnio, reflujo gastroesofágico, enuresis, disminución de la libido, cambios de personalidad, pérdida de memoria, dificultad de concentración, disminución del rendimiento profesional y en los estudios, apatía, irritabilidad, náuseas matutinas, síntomas depresivos, cansancio crónico, movimientos anormales, caídas frecuentes, eventos cardiovasculares, poliglobulia y crisis epilépticas.
La normativa de SAHS recomienda la solicitud de un perfil analítico metabólico que incluya hemograma, bioquímica básica y perfil lipídico en todos los pacientes. La radiografía de tórax, electrocardiograma, niveles de hormonas tiroideas y espirometría forzada tan sólo serán solicitadas en caso de sospecha de enfermedad concomitante.
El SAHS en el ancianoEl número de trastornos respiratorios durante el sueño aumenta con la edad de forma lineal ya sea por el propio envejecimiento (aumento de la colapsabilidad de la vía aérea) o por una verdadera situación patológica (SAHS)15. Se desconoce en la actualidad cuál es el punto de corte en el IAH que debe considerarse patológico. Es un problema de especial importancia epidemiológica dada la cada vez mayor longevidad de la población. La clínica de SAHS en ocasiones difiere de lo habitual dado que el impacto del SAHS en el anciano puede centrarse más en la esfera neurocognitiva16. Hay que ser cuidadoso a la hora de valorar el cuestionario de Epworth dado que tampoco está validado en ancianos. No existe ningún estudio con un nivel de evidencia suficiente que analice el efecto del tratamiento con CPAP u otros tratamientos en los ancianos17. La recomendación actual es que en el diagnóstico y tratamiento del SAHS en el anciano, la edad no sea por sí sola (salvo en situaciones extremas) un obstáculo (recomendación consistente, calidad de evidencia baja). La prueba con CPAP durante unos meses con evaluación posterior de la respuesta clínica puede ser una buena alternativa en caso de duda. Se desconoce si existe una edad a partir de la cual la CPAP podría ser retirada, por lo que de momento no se aconseja esta práctica.
El SAHS en la mujerEn la población general, la prevalencia del SAHS en la mujer es menor que en los hombres pero existe un mayor porcentaje de falta de diagnóstico. En mujeres postmenopáusicas la prevalencia aumenta igualándose a la del varón. Existe poca evidencia científica en relación al SAHS en las mujeres. La presentación clínica puede variar respecto a la típica de varones sobre todo por una mayor frecuencia de síntomas depresivos, ansiedad, cansancio general, falta de energía y cefalea. Tener en mente estas variaciones clínicas es importante a la hora de decidir la probabilidad clínica pretest de la paciente y el método diagnóstico a utilizar18. El impacto del SAHS en las mujeres también podría ser diferente al de los hombres sobre todo en la premenopausia, modulada por el estado hormonal. Sin embargo en la actualidad se recomienda que las pautas de diagnóstico y tratamiento del SAHS no varíen con respecto a las utilizadas en los varones (recomendación consistente, calidad de evidencia baja).
En la tabla 5 aparece la lista de enfermedades o situaciones de riesgo que pueden asociarse al SAHS y en las que se debería realizar una anamnesis de síntomas compatibles con SAHS.
Pacientes con alto riesgo de SAHS en los que se deberían evaluar síntomas relacionados.
| Obesidad (IMC > 35) |
| Insuficiencia cardíaca |
| Fibrilación auricular |
| Hipertensión refractaria |
| Diabetes mellitus tipo 2 |
| Arritmias nocturnas |
| Accidentes cerebrovasculares |
| Hipertensión pulmonar |
| Individuos con alto riesgo de accidentabilidad |
| Preoperatorio de cirugía bariátrica |
| Enf. respiratorias crónicas con mayor deterioro gasométrico del esperable |
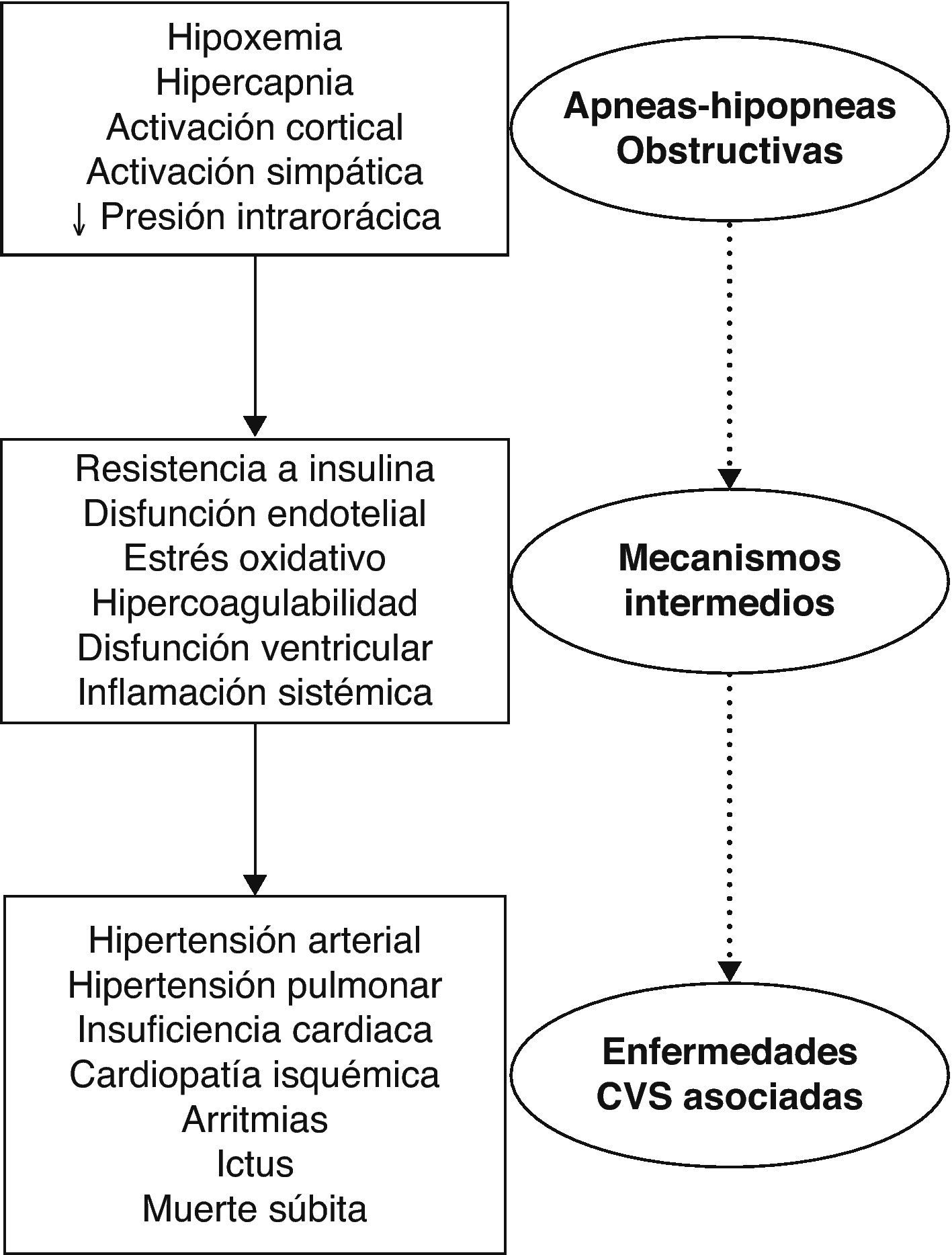
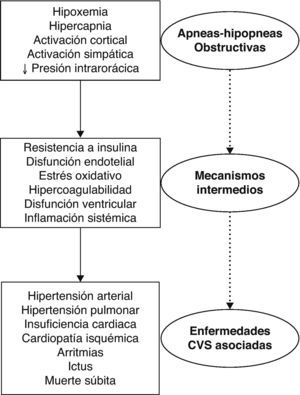
El SAHS se asocia con grados variables de hipoxemia, hipercapnia, reducción de la presión intratorácica y activación simpática y cortical. Estos eventos inducen mecanismos intermedios que potencialmente favorecen el desarrollo de enfermedades cardiovasculares, metabólicas y muerte prematura (fig. 1). En este capítulo se resume la evidencia disponible sobre las consecuencias cardiovasculares (mecanismos intermedios de enfermedad) y la morbimortalidad cardiovascular asociada.
Consecuencias cardiovasculares del SAHSDurante las apneas, la hipoxemia-hipercapnia estimula quimiorreceptores y la ausencia de respiración bloquea las aferencias inhibitorias simpáticas procedentes del tórax. Ambos mecanismos aumentan la descarga simpática que a su vez es responsable de vasoconstricción generalizada, aumento de la presión arterial y aumento del consumo miocárdico de O2 (calidad de evidencia alta)19. La obstrucción de la faringe induce un esfuerzo inspiratorio ineficaz. Se generan entonces presiones intratorácicas muy negativas que aumentan la presión transmural del ventrículo izquierdo y el retorno venoso al corazón derecho. Entonces el tabique interventricular se desplaza hacia la izquierda, aumentando la precarga del ventrículo derecho y la postcarga de ambos ventrículos. La consecuencia final es la reducción del volumen sistólico y la ausencia de relajación diastólica. El tratamiento con CPAP en pacientes con SAHS e insuficiencia cardiaca revierte estos fenómenos (recomendación consistente, calidad de evidencia moderada)20.
Los episodios repetitivos de desoxigenación y reoxigenación inducen la producción excesiva de radicales libres de O2, citoquinas proinflamatorias, células inflamatorias circulantes, proteína C-reactiva y moléculas de adhesión endotelial. Estos cambios promueven lesión endotelial generalizada y favorecen el desarrollo de ateroesclerosis (calidad de evidencia alta)21.
De forma independiente al índice de masa corporal (IMC), los pacientes con SAHS muestran elevada resistencia a la insulina circulante y mayor riesgo de desarrollar diabetes tipo 2 (calidad de evidencia alta). Sin embargo, los resultados de un estudio aleatorizado no demostraron que la CPAP mejorase de forma significativa el control de la glucemia o la resistencia a la insulina en varones con diabetes tipo 2 y SAHS22.
Morbilidad cardiovascular- -
Hipertensión arterial (HTA). Un 50% de pacientes con SAHS son hipertensos y un 80% de pacientes con hipertensión resistente tienen SAHS. Existe relación directa entre la gravedad del SAHS y la probabilidad de hipertensión y el SAHS es un factor causal de HTA. En estudios aleatorizados, controlados con placebo, la CPAP reduce de forma significativa la TA principalmente en pacientes con SAHS grave, hipertensos y con buena cumplimentación de CPAP (recomendación consistente, calidad de evidencia moderada)23.
- -
Insuficiencia cardíaca (IC). La prevalencia de IC en pacientes con SAHS es superior al 10%. El conjunto de estudios disponibles indican una mejoría significativa en la fracción de eyección del VI, reducción en el número de hospitalizaciones y aumento de la supervivencia en pacientes con IC-SAHS que toleran y usan la CPAP (recomendación consistente, calidad de evidencia moderada)20.
- -
Arritmias. La prevalencia de todo tipo de arritmias, especialmente de fibrilación auricular (FA) está aumentada en pacientes con SAHS. El tratamiento con CPAP, en pacientes con SAHS y FA revertida por cardioversión, se sigue de una reducción en la probabilidad de recurrencia de FA (recomendación consistente, calidad de evidencia moderada)24.
- -
Cardiopatía isquémica (CI). Estudios poblacionales y con base clínica han demostrado una asociación independiente entre el grado de SAHS y la probabilidad de padecer CI. Este exceso de riesgo respecto a la población sana se produce sobre todo en personas de menos de 50 años y es independiente del IMC (calidad de evidencia moderada)25.
- -
Ictus. Estudios epidemiológicos indican que la probabilidad de padecer ictus en pacientes con SAHS es de 1,6 a 4,3 veces respecto a sujetos sin SAHS (calidad de evidencia moderada)26.
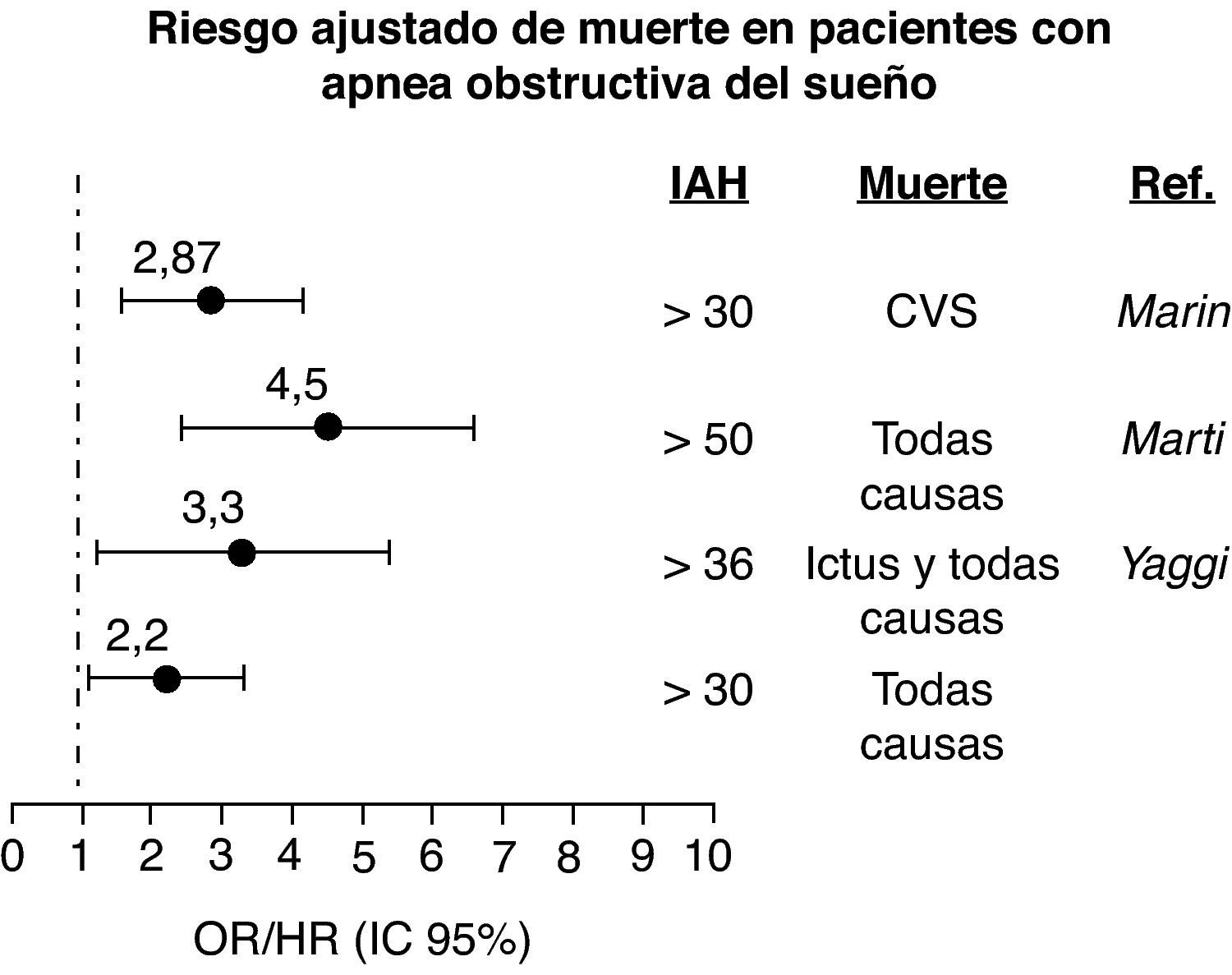
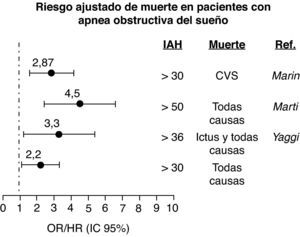
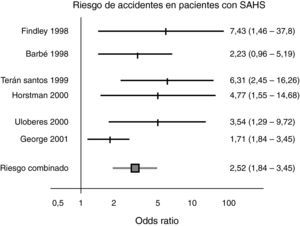
No se ha demostrado una relación causal entre SAHS y mortalidad cardiovascular. Estudios transversales y prospectivos de base poblacional muestran una asociación entre el SAHS y un exceso de mortalidad cardiovascular. Numerosos estudios de cohorte tanto de base poblacional como clínica y de 10 años de duración confirman esta asociación, especialmente para pacientes con SAHS grave (p. e. IAH > 30) y en décadas centrales de la vida (p. e. 30-60 años). Este exceso de mortalidad se ha relacionado especialmente con la muerte por ictus e infarto de miocardio (fig. 2) (RC, calidad de evidencia moderada)9,27,28. En estudios de cohorte el tratamiento con CPAP reduce este exceso de mortalidad cardiovascular en pacientes con SAHS grave y buena cumplimentación (recomendación consistente, calidad de evidencia moderada)9,27–29.
Riesgo quirúrgicoLos pacientes con SAHS que deben ser intervenidos mediante anestesia general presentan un mayor riesgo de complicaciones peroperatorias, especialmente debido a los efectos de los anestésicos sobre el control de la ventilación y sobre el tono de la musculatura de la vía aérea superior. La aplicación de CPAP nasal tras la extubación y colocación del paciente en posición semi-sentada son recomendaciones generales del post-operatorio (RC, calidad de evidencia baja).
Métodos diagnósticos. IndicacionesLa polisomnografía convencional (PSG) vigilada por un técnico en el laboratorio de sueño es el método de referencia para el diagnóstico de los pacientes con sospecha de SAHS y otros trastornos no respiratorios del sueño (recomendación consistente, calidad de evidencia alta)2,30. Consiste en un registro continuo del electroencefalograma, electrooculograma y electromiograma mentoniano (para cuantificar las fases del sueño y microdespertares), así como de otras variables para cuantificar los trastornos respiratorios y sus repercusiones (pulsioximetría, flujo aéreo nasobucal mediante cánula nasal y termistor, ronquidos, movimientos toracoabdominales y electrocardiograma). La PSG se debe realizar en horario nocturno o en el habitual de sueño del sujeto, con un registro no menor de 6,5 horas y debe incluir por lo menos 3 horas de sueño. La PSG es una técnica relativamente cara, laboriosa y técnicamente compleja que no está al alcance de todos los centros, y que debido a la gran demanda de exploraciones no se puede utilizar en todos los pacientes.
Para afrontar esas dificultades se han desarrollado equipos portátiles que registran solamente las variables respiratorias, por lo que esa técnica se ha denominado poligrafía respiratoria (PR). La American Academy of Sleep Medicine (AASM) ha clasificado los estudios del sueño en 4 tipos31. El tipo 1 es la PSG convencional vigilada por un técnico en el laboratorio de sueño (con un mínimo de 7 canales); el tipo 2 es la PSG realizada con un equipo portátil y no vigilada por un técnico; el tipo 3 corresponde a lo que denominamos PR, donde se registra la respiración, esfuerzo toracoabdominal y pulsioximetría (con un total de 4-7 canales); y el tipo 4 corresponde a estudios supersimplificados con aparatos de 1 o 2 canales (oximetría y/o respiración).
A pesar del gran número de estudios que confirman la utilidad de la PR (en el hospital y en el domicilio)32, en los últimos dos años se han publicado dos importantes documentos en Estados Unidos, donde tras una revisión exhaustiva de la literatura, finalmente se avala el uso de la PR a domicilio. En el primero, publicado por la AASM33 se concluye que los registros no vigilados con monitores de tipo 3 (PR) se pueden usar como alternativa a la PSG en pacientes con una probabilidad moderada o alta de SAHS. En el segundo, un documento oficial de Medicare34 se aceptan como métodos diagnósticos para poder prescribir CPAP los monitores tipo 2, 3 o 4 (con al menos 3 canales).
Por todo ello, consideramos que la PR (tanto en el hospital como en el domicilio) es un método aceptable para confirmar el diagnóstico de los pacientes con sospecha clínica de SAHS moderada o alta (recomendación consistente, calidad de evidencia moderada). La utilización de la PR para los casos con probablidad baja de SAHS no está validado pero forma parte de la práctica clínica habitual. La PR permite reducir los costes y el tiempo de espera, y hace accesible el diagnóstico del SAHS a los centros que no dispongan de PSG convencional (Unidades de Sueño básicas según acreditación SEPAR)35. Los inconvenientes de la PR son que no se evalúa la calidad del sueño, se infravaloran los trastornos respiratorios (que se expresan por hora de registro en lugar de horas de sueño), y no se pueden evaluar otros trastornos no respiratorios del sueño. La PR a domicilio tiene la ventaja de que el paciente duerme en la cama de su casa, por lo que el sueño puede ser más representativo del día a día.
Con respecto a los sistemas supersimplificados (monitores tipo 4), no hay estudios de validación que aconsejen su utilización (recomendación débil, calidad de evidencia baja). La oximetría nocturna puede demostrar la presencia de apneas o hipopneas, pero no distingue los trastornos centrales de los obstructivos ni detecta eventos sin desaturación, por lo que no se aconseja su uso como método diagnóstico. Estudios recientes sobre sistemas monocanal con flujo36,37 o bicanal con flujo y saturación38 sugieren que podrían tener un papel en el diagnóstico del SAHS.
Los equipos digitales actuales pueden realizar un análisis automático de las señales, pero el registro debe ser revisado y/o analizado manualmente por médicos expertos en trastornos respiratorios del sueño y PSG (recomendación consistente, calidad de evidencia alta), ya que el análisis automático no es fiable. Antes de las pruebas diagnósticas se debe realizar una completa evaluación clínica del paciente (especialmente de los trastornos del sueño) por un médico con experiencia en ese tipo de trastornos para decidir qué tipo de estudio es el más adecuado. Si hay sospecha clínica de SAHS y la PR es negativa o técnicamente deficiente, se ha de realizar una PSG. Los centros que sólo dispongan de PR deberían trabajar en coordinación con unidades de referencia que dispongan de PSG (Unidades Multidisciplinares o Unidades Respiratorias según acreditación SEPAR)35 para que les puedan ayudar a solucionar los casos en los que la PR no sea suficiente. En la figura 3 se resume la estrategia diagnóstica recomendada ante la sospecha de SAHS.
Si se sospechan otros trastornos del sueño asociados, se debe hacer una PSG. Si solamente se sospecha SAHS, se puede hacer tanto una PR como una PSG. Si la PR es negativa y la probabilidad clínica de SAHS es media o alta se ha de realizar una PSG. La utilización de la PR para descartar el SAHS en los casos con baja probabilidad, aunque forma parte de la práctica clínica habitual, no está validado, por lo que su utilización es cuestionable.
Apneas centrales, respiración de Cheyne-Stokes, síndrome de overlap, síndrome de hipoventilación-obesidadApneas centralesLas apneas centrales (AC) y las hipopneas centrales se producen por ausencia o disminución de esfuerzo inspiratorio y suelen desencadenarse al caer la PaCO2 por debajo de un umbral apneico. Para la correcta valoración de las hipopneas se precisan medidas de presión esofágica por lo que en adelante nos referiremos a las AC. Se considera SAHS central si ≥ 50% de eventos son centrales y se acompañan de síntomas. Las AC idiopáticas ocurren en < 5% de pacientes con SAHS pero las secundarias a insuficiencia cardiaca representan el 40-80%. Las AC pueden presentarse con hipercapnia diurna (alteración del control ventilatorio o de los músculos respiratorios) o con normocapnia (inestabilidad transitoria del control ventilatorio)39.
El incremento de mortalidad derivado de las AC en la insuficiencia cardiaca es controvertido (recomendación débil, calidad de evidencia moderada). Se recomienda el diagnóstico mediante PSG. No hay suficiente evidencia para recomendar un tratamiento específico. El primer paso es optimizar el tratamiento de la enfermedad subyacente y si persisten las AC probar la CPAP (AC sin hipercapnia) (recomendación débil, calidad de evidencia moderada). La CPAP mejora la fracción de eyección ventricular izquierda y el IAH, sin aumentar la supervivencia, debiéndose comprobar la eficacia de la CPAP (siendo IAH residual < 15) o de lo contrario debería suspenderse40. Ensayos clínicos con servoventilación adaptativa (ASV) demuestran mejor tolerancia y mayor reducción de las AC (recomendación débil, calidad de evidencia moderada). En las AC con hipercapnia se puede emplear ventilación no invasiva (VNI) (recomendación débil, calidad de evidencia baja).
Existe un tipo de AC observadas al titular CPAP (complejo apnea de sueño o «CompSAS»), que se producen ya sea por desaparición de los eventos obstructivos que las ocultaban o por el efecto «hipocápnico» de la CPAP (umbral apneico). Su presencia podría provocar persistencia de síntomas (recomendación débil, calidad de evidencia baja) y desaparecen al mantener el tratamiento con CPAP o con ASV41 (recomendación débil, calidad de evidencia moderada).
Respiración de Cheyne-StokesSe trata de AC o hipopneas con oscilaciones periódicas en la ventilación, asociadas frecuentemente a insuficiencia cardiaca (también a ictus y a sedación). La ventilación crece y decrece progresivamente hasta llegar a la AC o hipopnea, reiniciándose el ciclo cada 60-90 segundos, lo que provoca hipoxia intermitente. Empeora el pronóstico de la insuficiencia cardiaca y aumenta la mortalidad42 (recomendación consistente, calidad de evidencia moderada). El tratamiento consiste en optimizar el tratamiento de la enfermedad subyacente y ensayar con CPAP aunque los efectos en la supervivencia no están demostrados 40,42 (recomendación débil, calidad de evidencia moderada). La ASV parece mostrar mejoría en la somnolencia y activación neurohormonal (recomendación débil, calidad de evidencia moderada).
Síndrome overlapEs la concurrencia de SAHS y EPOC. La prevalencia de SAHS en los pacientes con EPOC no es mayor que en la población general43. Clínicamente, los pacientes presentan mayor somnolencia y desaturación nocturna, más riesgo de insuficiencia cardiaca derecha, insuficiencia respiratoria hipercápnica e hipertensión pulmonar. Estas consecuencias pueden contribuir a un mayor riesgo de mortalidad44 (recomendación débil, calidad de evidencia baja). El método diagnóstico recomendado es la PSG. El tratamiento consiste en oxigenoterapia si cumple criterios para la misma (recomendación consistente, calidad de evidencia alta), y ensayar la CPAP para eliminar los eventos obstructivos y las desaturaciones nocturnas, lo cual puede conducir a una mejoría en la supervivencia de los pacientes con SAHS y EPOC más graves hipoxémicos45(recomendación débil, calidad de evidencia baja). En los pacientes con hipercapnia puede ser necesaria la VNI (recomendación débil, calidad de evidencia baja). No se ha demostrado mayor supervivencia con la oxigenoterapia exclusivamente nocturna para el tratamiento de las desaturaciones nocturnas persistentes46 (recomendación consistente, calidad de evidencia alta).
Síndrome de hipoventilación-obesidad (SHO)El SHO es la concurrencia de hipoventilación diurna (PaCO2 > 45mmHg) y obesidad (IMC > 30) cuando otras causas de hipercapnia pueden excluirse. Cerca del 90% de los pacientes padecen apneas durante el sueño. La prevalencia del SHO es desconocida, aunque puede afectar a una minoría de la población obesa. La prevalencia de SHO en sujetos con sospecha de SAHS varía entre diferentes estudios (del 10 al 30%).
El tratamiento ideal es la pérdida de peso. Volver a un peso normal revierte la insuficiencia respiratoria, hipertensión pulmonar y las alteraciones del sueño (recomendación consistente, calidad de evidencia baja), pero es difícil conseguirlo. La cirugía bariátrica es una alternativa para una minoría de pacientes, dado su elevada morbimortalidad (recomendación débil, calidad de evidencia baja). La VNI produce mejoría clínica, gasométrica, de las alteraciones durante el sueño y descenso en días de hospitalización47 (recomendación consistente, calidad de evidencia moderada). No hay ensayos controlados que hayan evaluado la mortalidad.
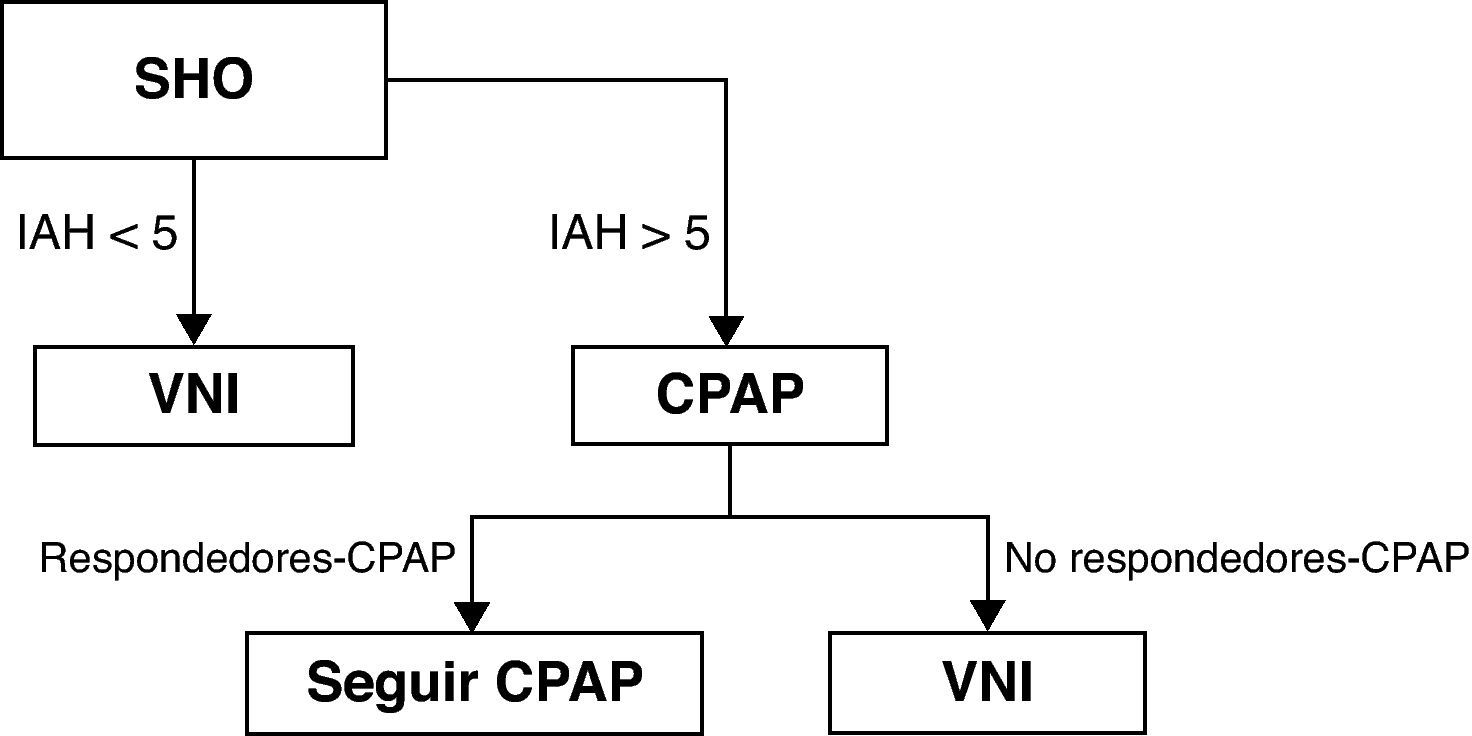
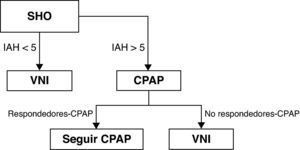
La CPAP corrige los eventos apneicos pero la PaCO2 diurna no se normaliza en todos los casos. El tiempo en apnea podría ser un marcador de eficacia de la CPAP48. La CPAP y VNI tienen similar efecto a corto plazo en pacientes seleccionados por respuesta favorable a una noche de tratamiento con CPAP49 (recomendación consistente, calidad de evidencia moderada). No existen estudios similares en pacientes no seleccionados o sobre si estos tratamientos son más efectivos que la pérdida de peso. Hasta disponer de más evidencia, podemos seguir el esquema de la figura 4.
Pacientes con SHO y IAH patológico serían inicialmente tratados con CPAP. Si persiste hipoventilación nocturna o diurna (no-respondedores), la VNI sería la mejor opción de tratamiento. En el caso de mejoría inicial con CPAP (respondedores), los pacientes seguirían con el mismo tratamiento. Pacientes con SHO sin IAH patológico, serían tratados directamente con VNI.
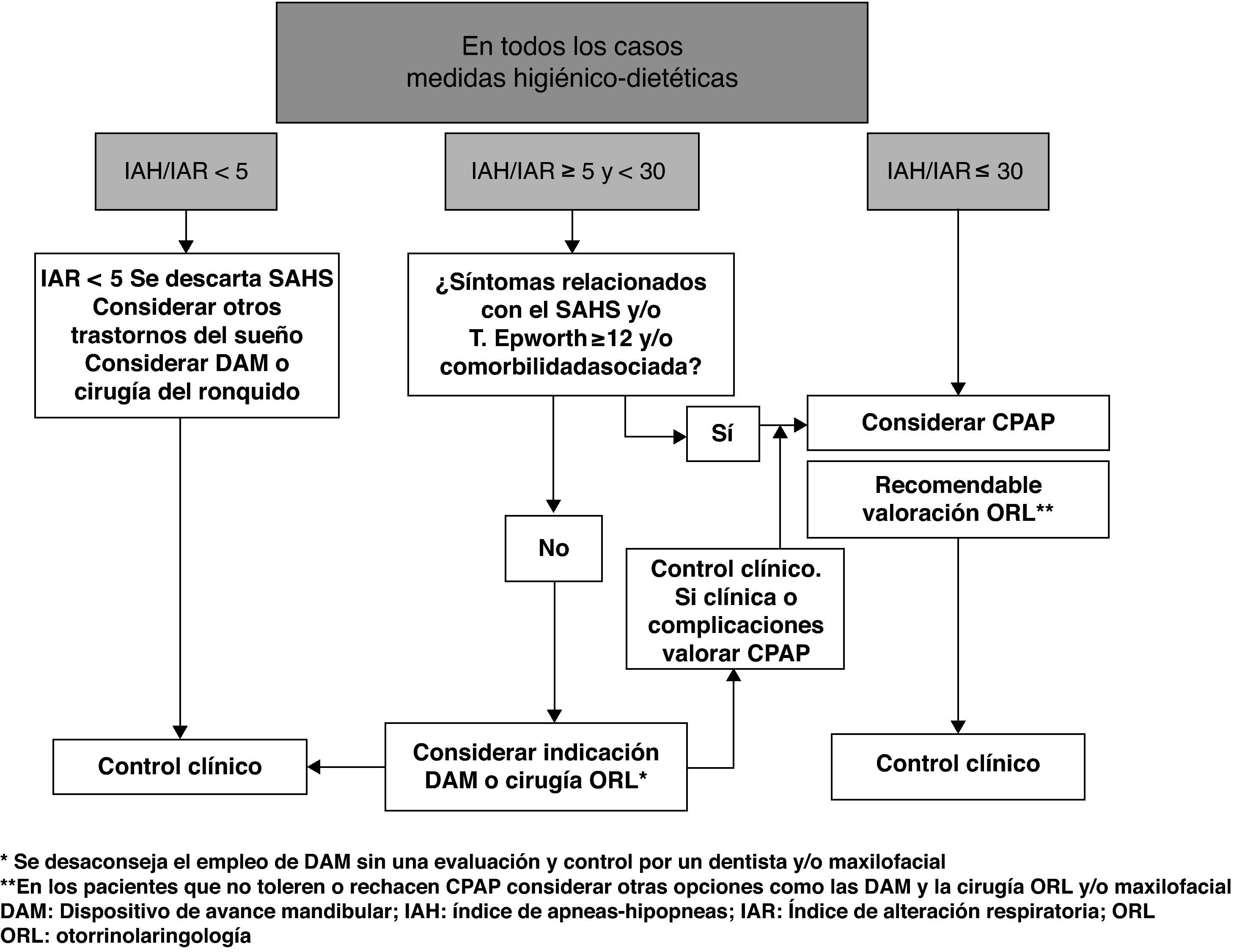
Tratamiento y seguimiento del SAHS: criterios y opciones terapéuticasLos objetivos del tratamiento serán, por un lado conseguir el control de los síntomas (fundamentalmente la somnolencia) y por otro minimizar el riesgo de accidentabilidad y cardiovascular. En cuanto al tratamiento a recomendar, partiendo de la base de que la CPAP nasal es el de primera elección en la mayoría de casos (recomendación consistente, calidad de evidencia alta), deberá también tenerse en cuenta la presencia de factores etiológicos concomitantes modificables (tabla 6) y ofrecer el tratamiento pertinente ya sea como único o combinado con la CPAP nasal. Los pacientes diagnosticados de SAHS, independientemente del tratamiento recomendado, requerirán un seguimiento médico2,5.
Factores etiológicos/coadyuvantes del síndrome de apnea-hipoapnea del sueño modificables con el tratamiento.
| La mala higiene del sueño (irregular e insuficiente) |
| La obesidad |
| La posición en la cama |
| La ingesta de sedantes, alcohol o el tabaquismo |
| El taponamiento nasal (por rinitis, fundamentalmente) |
| Factores anatómicos como la hipertrofia adenoidea y/o amigdalar, las malformaciones o deformidades óseas básicamente mandibulares, la obstrucción nasal anatómica |
| Las enfermedades metabólicas que puedan asociarse a SAHS como el hipotiroidismo o la acromegalia |
Consideraremos las siguientes opciones terapéuticas:
- 1.
Medidas higiénicas del sueño (recomendación consistente, calidad de evidencia moderada)
Conseguir una buena higiene del sueño es importante ya que la causa más frecuente de somnolencia excesiva durante el día es el mal hábito de sueño, por insuficiente o por irregular. Consideraremos también: la abstinencia de alcohol y tabaco, evitación de benzodiacepinas (si son necesarios inductores del sueño, se deberían utilizar hipnóticos no benzodiacepínicos) y el dormir en decúbito supino (aplicación de molestia física en la espalda si fuese necesario). Incorporar la cabecera 30° también puede ser útil.
- 2.
Dieta (recomendación consistente, calidad de evidencia moderada)
La pérdida ponderal en pacientes obesos puede ser curativa. Reducciones del 10% del peso pueden disminuir el IAH y mejorar la sintomatología. Debemos recomendar dieta y cambio de estilo de vida a pacientes con IMC > 25. En pacientes con obesidad mórbida (IMC > 40) se puede valorar la cirugía bariátrica en un contexto adecuado.
- 3.
Otros tratamientos conservadores (recomendación consistente, calidad de evidencia baja)
a) Tratamiento médico de la obstrucción nasal: la congestión nasal puede ser un factor de empeoramiento del SAHS. Su tratamiento con corticoides nasales puede mejorar el SAHS y, en especial, la tolerancia a la CPAP nasal. b) Calidad de evidencia: se ha observado una reducción del IAH después del tratamiento sustitutivo. c) Calidad de evidencia no recomendable si no es que existe insuficiencia respiratoria asociada al SAHS o por otros motivos cardiacos o respiratorios y ésta persiste después de 3 meses de tratamiento con CPAP nasal. d) Calidad de evidencia hoy en día sin indicación: la protriptilina y la medroxiprogesterona están en desuso, y los inhibidores selectivos de la recaptación de serotonina se hallan en fase de investigación. e) Calidad de evidencia: no hay evidencia de mejoría clara. f) Calidad de evidencia: está en cuestión si su tratamiento puede mejorar el SAHS y viceversa.
- 4.
Tratamiento con CPAP nasal
- 4.1.
Efectos
La CPAP nasal es más efectiva que el placebo para mejorar la somnolencia y la calidad de vida en pacientes con SAHS. Corrige los fenómenos obstructivos, el ronquido, las desaturaciones y los arousals secundarios a eventos respiratorios, la arquitectura de sueño, la capacidad de atención, entre otras variables cognitivas, reduce el riesgo de accidentes de tráfico y normaliza las cifras de tensión arterial en un porcentaje de enfermos hipertensos. Los sistemas bipresión no demuestran claras ventajas50.
- 4.2.
Indicaciones
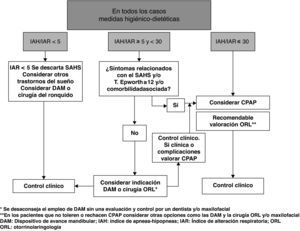
Las indicaciones de tratamiento con CPAP nasal quedan reflejadas en el algoritmo del DCNSAHS (fig. 5)2. Los pacientes con IAH ≥ 5 y síntomas (somnolencia excesiva) son susceptibles de tratamiento con CPAP nasal. Si no tienen síntomas, con o sin trastorno cardiovascular, se debe considerar el tratamiento si el IAH ≥ 30, especialmente en pacientes con edad inferior a 70 años51 (recomendación consistente, calidad de evidencia alta).
Figura 5.Pautas de tratamiento: algoritmo.
Adaptado del DCNSAHS, GES2
- 4.3.
Ajuste de la presión óptima
Es imprescindible una adecuada información y preparación del enfermo. Pueden utilizarse diversas técnicas para el ajuste. La PSG completa es la que mejor asegura la corrección de todos los fenómenos patológicos (respiratorios y neurológicos). Otras opciones son la PSG en noche partida para pacientes con IAH > 20, el ajuste empírico mediante fórmula matemática, que puede usarse de manera provisional, a la espera de titulación52, y un sistema de auto-CPAP validado y con análisis visual52 (recomendación consistente, calidad de evidencia moderada).
- 4.4.
Efectos secundarios
Suelen aparecer la primera semana y ser menores y transitorios. Los más comunes son congestión nasal, irritación cutánea, sequedad faríngea y frío (mejorable con la introducción de un humidificador-calentador), ruido, conjuntivitis, epistaxis, insomnio y aerofagia.
La única contraindicación absoluta es la fístula de líquido cefalorraquídeo y debe usarse con precaución en todas aquellas situaciones que puedan empeorar con la administración de presión positiva.
- 4.5.
Seguimiento
Puesto que no es un tratamiento curativo debe usarse de forma continuada. El cumplimiento mínimo que se asocia a una clara mejoría de síntomas es de 3,5h/noche. Por lo tanto, en todo paciente con un cumplimiento inferior a 3h/noche deberán indagarse por una parte las posibles causas y por otra la mejoría sintomática. La decisión de retirada del tratamiento en estos casos por mal cumplimiento deberá individualizarse. Se recomiendan revisiones al mes, cada 3 meses durante el primer año, a los 6 meses el segundo año y después anualmente y siempre que se requiera por parte del paciente (recomendación consistente, calidad de evidencia baja). En caso de aumento o disminución de peso significativos (10%) o de reaparición de sintomatología relacionada con el SAHS estaría indicado un nuevo estudio de titulación de CPAP.
- 4.1.
- 5.
Dispositivos de avance mandibular (DAM)53
Son eficaces en el tratamiento del ronquido, del SAHS leve y moderado con bajo IMC y desaturaciones no importantes (recomendación consistente, calidad de evidencia moderada). También pueden ser útiles en pacientes con síndrome de resistencia aumentada de la VAS y como segunda elección en pacientes que no toleran la CPAP nasal, que no son candidatos a la cirugía o tienen riesgo quirúrgico elevado. Los hay de avance fijo y de avance regulable. Determinadas características cefalométricas mejoran el rendimiento de los DAM. Se recomienda regulación progresiva y control polisomnográfico de sus efectos.
- 6.
Tratamiento quirúrgico54
- 6.1.
Cirugía nasal
No soluciona de forma aislada el SAHS. Debe considerarse especialmente en los casos de intolerancia a la CPAP nasal por obstrucción.
- 6.2.
Cirugía palatofaríngea
Puede realizarse a través de técnica quirúrgica convencional, láser o radiofrecuencia, según el contexto (recomendación débil, calidad de evidencia baja). En general, se señala que estas técnicas son útiles para el ronquido en un 80-90% de los casos, pero este desciende al 50% después del primer año. Por lo que respecta a la resolución de las apneas, la tasa de éxitos se sitúa en un 40-50%, en función de la gravedad. Su indicación dependerá de la exploración anatómica, de la gravedad del SAHS, la edad, el estado general del paciente y de su elección tras ser adecuadamente informado. Los implantes palatinos han demostrado, de momento, una eficacia limitada55.
- 6.3.
Cirugía reductora de la base de lengua
La técnica utilizada puede ser el láser o la radiofrecuencia y dependiendo de la experiencia del cirujano pueden obtenerse tasas de éxito de hasta el 40% en casos de SAHS leve o leve-moderado (recomendación débil, calidad de evidencia baja). Su indicación deberá estar sometida a las mismas condiciones que en el caso anterior.
- 6.4.
Cirugía multinivel o en fases de Stanford (maxilomandibular)
Recomendación débil, calidad de evidencia moderada. Se trata de técnicas quirúrgicas en general muy intervencionistas que deben ir precedidas de un estudio anatómico muy preciso y que si bien en manos expertas pueden ser eficaces56, hasta el momento, en nuestro medio quedan reservadas a fracasos de la CPAP nasal o bien a pacientes que lo rechazan de entrada, ya que no se han podido reproducir altas tasas de éxitos.
- 6.1.
El SAHS en los niños se define como un trastorno de la respiración durante el sueño caracterizado por una obstrucción parcial o completa de la vía aérea superior (apnea obstructiva) que altera la ventilación normal durante el sueño y los patrones de sueño. Se asocia con síntomas que incluyen ronquido habitual nocturno, dificultades con el sueño y/o problemas de comportamiento57.
PrevalenciaLa prevalencia del SAHS en los niños de 4-5 años se estima entre 0,2% y 4,1% con un pico de incidencia máxima entre los 2 y 6 años58 (calidad de evidencia alta). La causa más frecuente de SAHS en la infancia es la hipertrofia adenoamigdalar57 (calidad de evidencia alta), pero la patogenia del SAHS infantil es un proceso dinámico y es la conjunción de factores anatómicos y funcionales lo que lleva a un desequilibrio y colapso de la VAS.
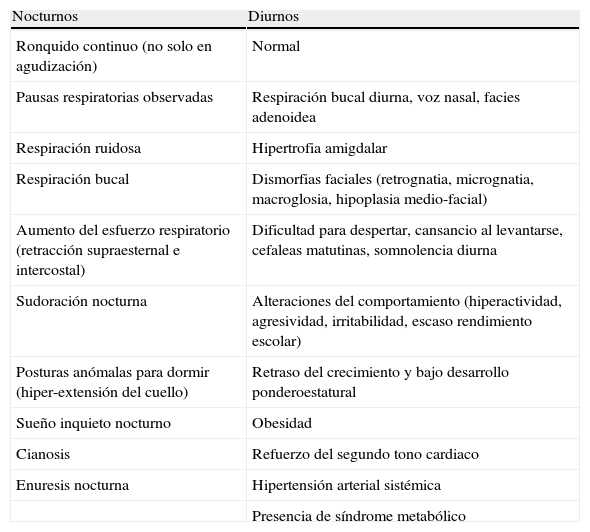
Clínica y morbilidadLas manifestaciones clínicas del SAHS en la infancia se muestran en la tabla 7. Las consecuencias inmediatas de la obstrucción de la VAS durante el sueño son: aumento del trabajo respiratorio, hipoxemia intermitente, fragmentación del sueño e hipoventilación alveolar, que pueden conducir a retraso de crecimiento y desarrollo, hipertensión pulmonar y cor pulmonale, hipertensión arterial sistémica, alteraciones del aprendizaje y del comportamiento57 y en los casos de obesidad la asociación con síndrome metabólico (calidad de evidencia alta).
Síntomas y signos sugestivos de SAHS en niños.
| Nocturnos | Diurnos |
| Ronquido continuo (no solo en agudización) | Normal |
| Pausas respiratorias observadas | Respiración bucal diurna, voz nasal, facies adenoidea |
| Respiración ruidosa | Hipertrofia amigdalar |
| Respiración bucal | Dismorfias faciales (retrognatia, micrognatia, macroglosia, hipoplasia medio-facial) |
| Aumento del esfuerzo respiratorio (retracción supraesternal e intercostal) | Dificultad para despertar, cansancio al levantarse, cefaleas matutinas, somnolencia diurna |
| Sudoración nocturna | Alteraciones del comportamiento (hiperactividad, agresividad, irritabilidad, escaso rendimiento escolar) |
| Posturas anómalas para dormir (hiper-extensión del cuello) | Retraso del crecimiento y bajo desarrollo ponderoestatural |
| Sueño inquieto nocturno | Obesidad |
| Cianosis | Refuerzo del segundo tono cardiaco |
| Enuresis nocturna | Hipertensión arterial sistémica |
| Presencia de síndrome metabólico |
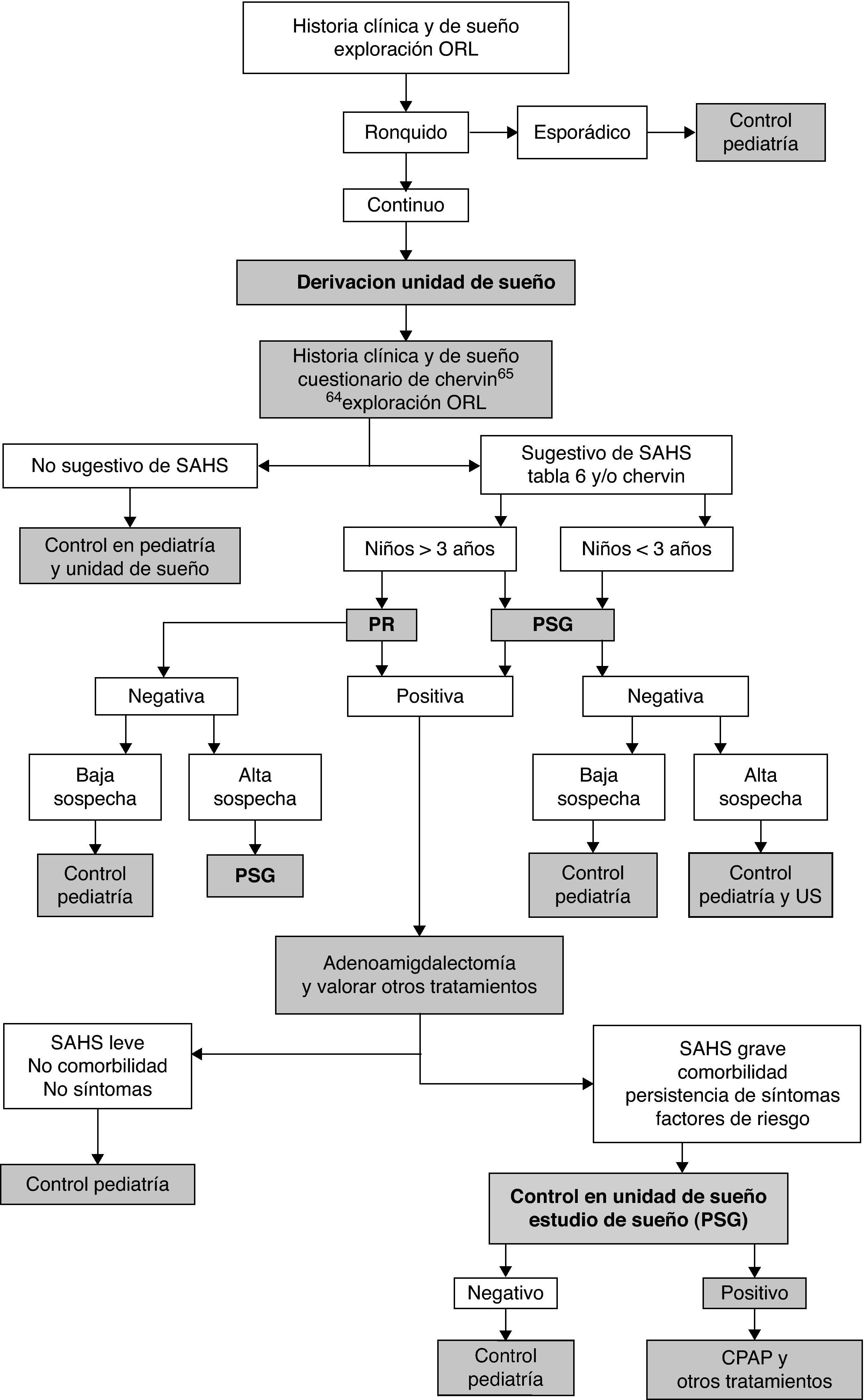
El método diagnóstico de elección del SAHS en los niños es la PSG2,57,59,60. La codificación de la PSG en los niños difiere de los adultos y se utilizan los criterios de la AASM59 (calidad de evidencia alta). En base a los conocimientos actuales, en el DCNSAHS del GES se acepta un índice de apneas obstructivas entre 1 y 3 como punto de corte de normalidad2.
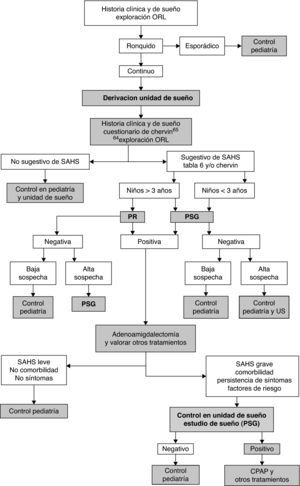
La PR con registro de variables cardiorrespiratorias es objeto de estudio en la actualidad59,61 (recomendación débil, calidad de evidencia moderada). Esta normativa reconoce la utilidad diagnóstica de la PR, siempre que sea realizada en Unidades de Sueño debidamente acreditadas y con polígrafos validados en población infantil (fig. 6).
TratamientoEl tratamiento de elección del SAHS en los niños es la adenoamigdalectomía2,57,62,63, cuya eficacia es del 78% (recomendación consistente, calidad de evidencia moderada). La CPAP constituye la segunda línea de tratamiento del SAHS en la infancia57,63, en casos de imposibilidad de tratamiento quirúrgico, ante persistencia de SAHS después de adenoamigdalectomía y en algunos casos de niños con obesidad, alteraciones craneofaciales o enfermedades neuromusculares (recomendación débil, calidad de evidencia moderada). La educación sanitaria en hábitos dietéticos, la higiene de sueño y la evaluación ortodóncica deben ser la norma en todos los niños con SAHS.
Para el diagnóstico de SAHS en niños es indispensable mantener un alto nivel de sospecha clínica en las consultas de Pediatría General.
SAHS y accidentabilidadLos accidentes de tráfico son una importante causa de mortalidad en el mundo occidental y diferentes estimaciones sugieren que entre el 1 y el 20% de los mismos están relacionados con excesiva somnolencia. Dentro de los trastornos del sueño, merece especial atención el SAHS, cuya relación con la producción de accidentes se ha analizado extensamente en la literatura médica.
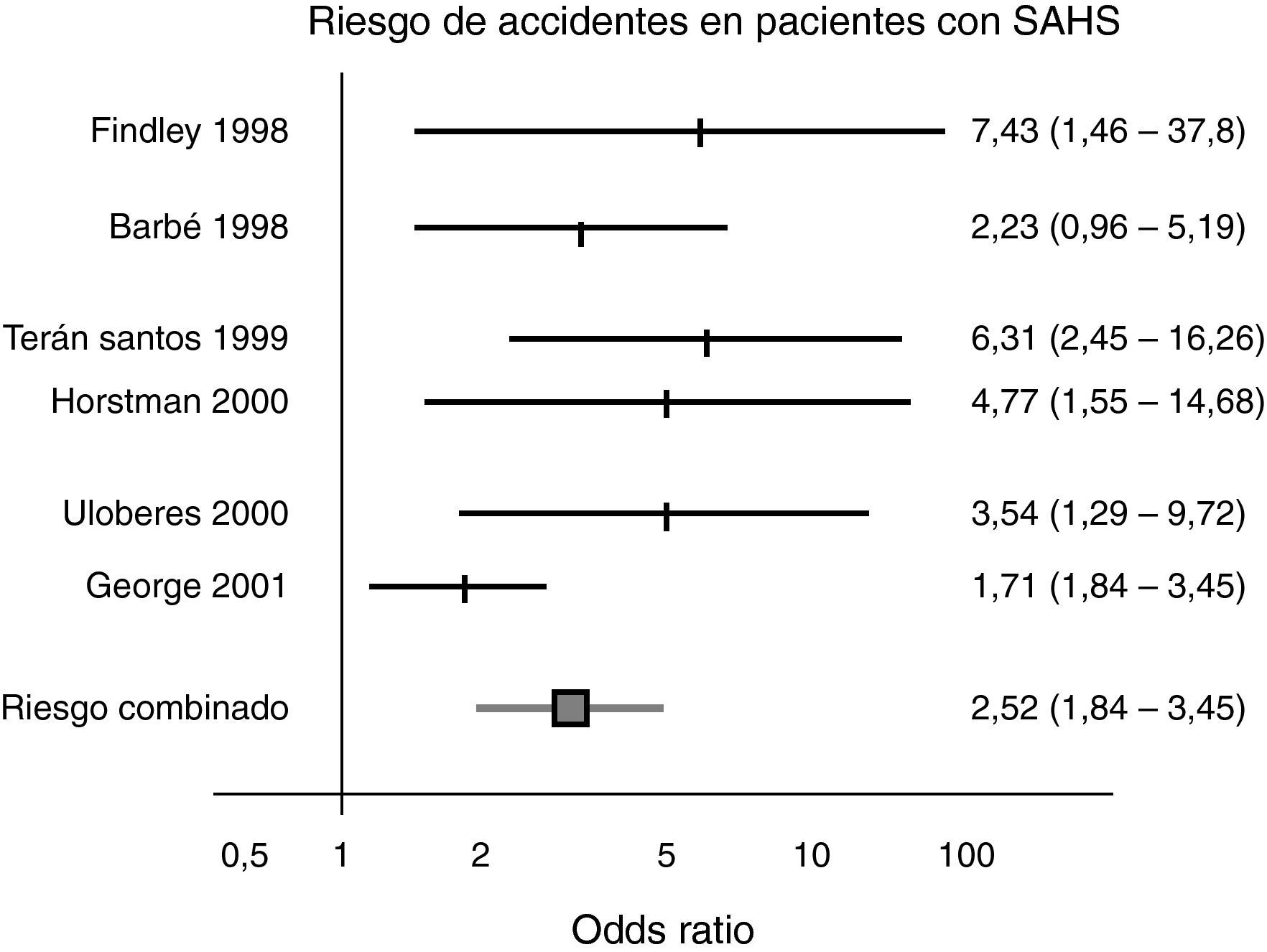
El exceso de riesgo en conductores tanto no profesionales como profesionales muestra una odds ratio de 1,3 a 13, con una media de 3,1 (fig. 7) teniendo en cuenta los diferentes diseños, criterios de selección y resultados medidos (calidad de evidencia alta)65–67. Cuando se analizan en la literatura los factores de riesgo que incrementan la probabilidad de accidente en personas con SAHS, la mayoría de los estudios demuestran que cuanto más grave es el cuadro medido por el IAH, mayor es el riego de accidentes (calidad de evidencia alta)68.
Sin embargo la somnolencia diurna, síntoma que se ha mostrado asociado a SAHS, medida por tests subjetivos (cuestionarios) u objetivos (latencias de sueño, etc.) no se relaciona de forma sólida con la aparición de accidentes de tráfico, mientras que sí lo hace la somnolencia al conducir (calidad de evidencia media)67.
Los estudios que incluyen a conductores profesionales, en los que el SAHS parece ser más prevalente en posible relación con la obesidad y el sedentarismo, no indican en modo alguno que los conductores profesionales tengan un riesgo mayor, cuando esto se analiza por kilómetros recorridos/año69.
El tratamiento con CPAP reduce el porcentaje de accidentes a los niveles encontrados en la población general (calidad de evidencia alta)69. Así el tratamiento con CPAP es coste efectivo y Sassani et al70 realizan una estimación de ahorro sobre 800.000 colisiones por apnea de sueño, de aproximadamente 11 billones de dólares y 980 vidas anuales en Estados Unidos.
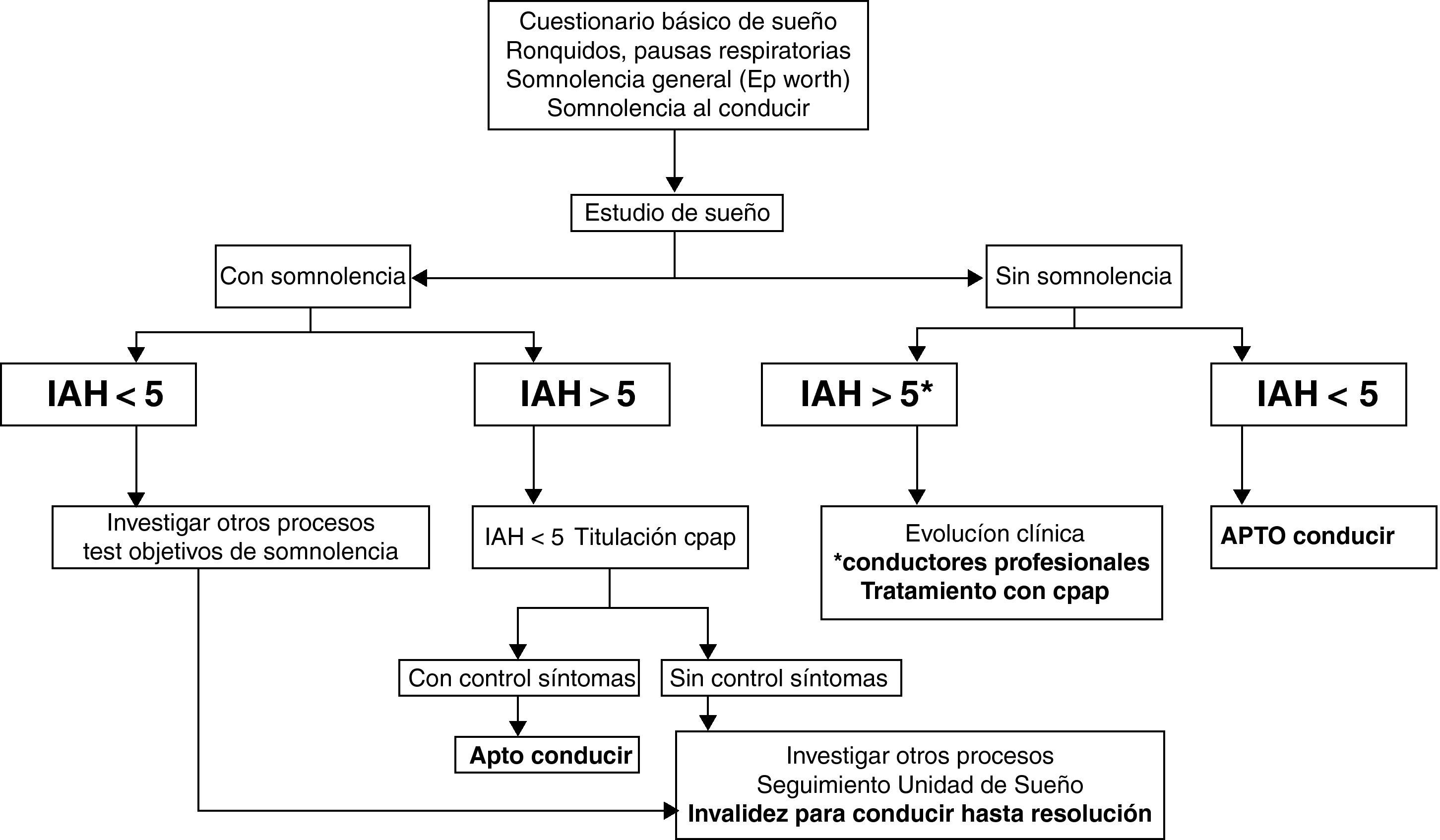
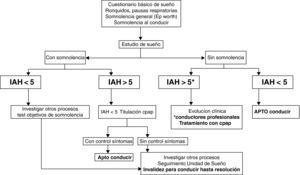
Es difícil para los médicos valorar el riesgo y la capacidad para conducir de los pacientes con apnea de sueño, pero es imprescindible valorar en cada paciente el riesgo durante la conducción y advertirles de la necesidad de no conducir si se sienten somnolientos. En España la detección del conductor de riesgo corre a cargo de los centros de reconocimiento de conductores, basándose en el anexo IV del R.D. 772/1997, que tipifica el SAHS en su apartado 7.2 dentro del grupo de Trastornos del sueño de origen respiratorio estableciéndose que los conductores con SAHS no podrán obtener o renovar su permiso de conducción sin informe previo de una Unidad de Sueño, siendo el período de vigencia de 2 años para conductores no profesionales y de 1 año para los profesionales71,72.
SEPAR urge a la elaboración de una directiva europea en relación con causas de excesivo sueño diurno, y a establecer reglamentariamente el modo de tener en cuenta el SAHS como limitativo de las capacidades para la obtención de los permisos y licencias para conducir73 (fig. 8).
Uncited Reference64.