Debido al brote epidémico producido por SARS-CoV-2, muchos de los hospitales españoles han sufrido un colapso que ha obligado a demorar toda la actividad sanitaria no urgente. Además, durante la pandemia se ha producido un retraso diagnóstico en determinadas patologías agudas, en ocasiones por miedo de los pacientes a acudir al ámbito hospitalario. En este caso, presentamos un caso de disnea aguda secundaria a una causa poco frecuente de derrame pleural derecho.
La perforación cardíaca por la implantación de un marcapasos o desfibrilador es una complicación poco frecuente, pero potencialmente mortal. En raras ocasiones no se produce en el momento de la intervención y puede aparecer en diferido, como es el caso que nos ocupa.
Caso clínicoVarón de 77años, exfumador, con antecedentes de síndrome de apneas del sueño, enfermedad pulmonar obstructiva crónica, miocardiopatía hipertrófica septal, flutter auricular y taquicardia ventricular monomórfica no sostenida. Por este motivo se procedió a la colocación de un desfibrilador automático implantable (DAI) bicameral el 03/03/2020 como prevención primaria, y se inició tratamiento anticoagulante con apixabán desde el 12/03/2020.
Durante la pandemia consultó con su neumólogo habitual por presentar disnea progresiva y cifras de saturación de oxígeno por debajo de las habituales. Rechazó el consejo de acudir al hospital para valoración urgente, por la situación de pandemia vivida durante esos días, e inició tratamiento domiciliario sin mejoría.
Ante la persistencia de los síntomas y empeoramiento de las cifras de saturación de oxígeno finalmente acudió a Urgencias el 17/04/2020 tras un mes de evolución de la disnea hasta hacerse de mínimos esfuerzos. A su llegada el paciente presentaba insuficiencia respiratoria (saturación de oxígeno del 91% con gafas nasales a 4l) y se encontraba hemodinámicamente estable. En la analítica de sangre destacaba linfopenia y elevación de PCR, con BNP dentro de la normalidad. Se realizó test de PCR para SARS-CoV-2 que resultó negativo. En la radiografía de tórax se observó derrame pleural derecho que ocupaba un tercio de dicho hemitórax. Se realizó ECG que no presentaba cambios con respecto a previos y se interrogó el DAI sin evidenciarse alteraciones.
Se procedió a realizar toracocentesis diagnóstica en la que se extrajo líquido pleural de aspecto hemorrágico, siendo un exudado por criterios de Light. Al haber recibido tratamiento crónico con diuréticos, se calculó el gradiente de albúmina, siendo este >1,2g/dl.
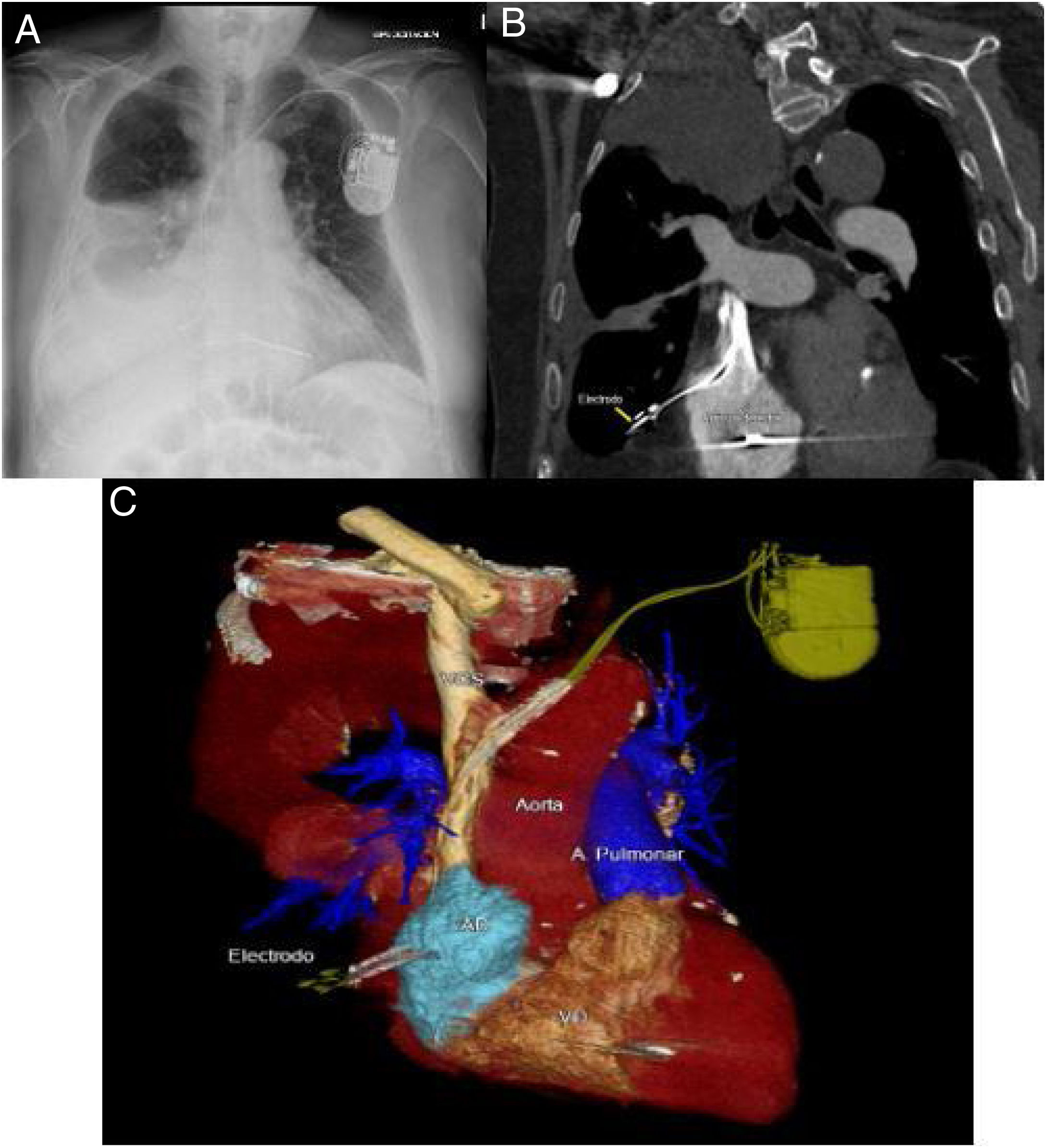
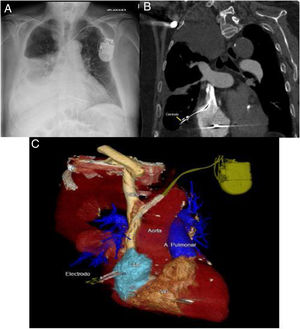
Ante la sospecha de perforación cardíaca secundaria al DAI por las imágenes de la radiografía de tórax (fig. 1A), se realizó tomografía computarizada (TC) de tórax (fig. 1B y fig. 1C) donde se observó perforación de pared auricular derecha por cable del DAI con enclavamiento del mismo en parénquima pulmonar inferior derecho. Se asociaba marcado derrame pleural derecho y discreto neumotórax apical ipsilateral. Se derivó a centro de referencia para tratamiento, donde se realizó retirada del electrodo por vía percutánea sin complicaciones.
A) Arriba a la izquierda, radiografía de tórax en la que se observa el electrodo de la aurícula derecha con su extremo distal más lateralizado de lo que debería, con derrame pleural ipsilateral asociado. B) Arriba a la derecha, corte coronal donde se observa el electrodo enclavado en el parénquima pulmonar y derrame pleural derecho. C) Abajo, reconstrucción en 3D de la tomografía computarizada en la que puede observarse el electrodo del DAI en el momento de la perforación de la aurícula derecha. A la derecha, A. Pulmonar: arteria pulmonar.
La perforación cardíaca se presenta con una prevalencia del 0,1-0,85 en el implante de marcapasos y del 0,6-5,2 en DAI1,2. La incidencia más alta descrita es del 27% en pacientes con electrodos auriculares (en autopsias)3. El lugar más frecuente de la perforación es la pared del ventrículo derecho4,5, siendo menos frecuente la perforación auricular. Se han descrito como factores de riesgo para la perforación la anticoagulación, el sexo femenino y el tratamiento con esteroides3,6,7.
Las perforaciones cardíacas secundarias a implante de DAI se distinguen entre agudas (<24h), subagudas (hasta 1mes) o crónicas. La mayoría de las perforaciones se producen en el momento de la intervención, siendo más inusual la presentación de perforación en diferido, como es el caso presentado8.
Los síntomas más frecuentes son disnea, tos y dolor torácico6, pudiendo pasar prácticamente desapercibido en otras ocasiones, demorando su diagnóstico9. El registro de EE.UU. sobre perforación cardíaca secundaria a implantación de dispositivos reportó un incremento de complicaciones, siendo las más relevantes la parada cardiorrespiratoria y aquellas que determinan un compromiso hemodinámico (infarto agudo de miocardio, taponamiento cardíaco, hemotórax o neumotórax)1,3,4,10,11. El derrame pleural suele ser izquierdo por perforación ventricular4.
Lo métodos diagnósticos más rentables son el registro del DAI, aunque con escasa especificidad, y las pruebas de imagen como la radiografía de tórax, la ecocardiografía y, fundamentalmente, el TAC torácico12.
El tratamiento depende de la estabilidad clínica, las complicaciones asociadas y el tiempo de perforación. Incluye desde la retirada del electrodo de manera percutánea hasta la necesidad de toracotomía13,14.
ConclusiónExiste patología aguda potencialmente mortal cuya atención se ha visto demorada por la situación de pandemia producida por el SARS-CoV-2. Este caso nos lleva a reflexionar sobre el impacto que la situación vivida en los hospitales ha podido tener sobre el manejo de dicha patología y las estrategias futuras a adoptar para asegurar la atención de estos pacientes ante posibles rebrotes.