La hemorragia pulmonar es una entidad potencialmente mortal que en ocasiones requiere una intervención inmediata para detener el sangrado. Cuando el sangrado no es identificable, por ejemplo, en la hemorragia alveolar, las opciones terapéuticas son limitadas e incluyen la corrección de los defectos de la coagulación junto con tratamiento de soporte vital según necesidades1–3.
En este contexto, el ácido tranexámico (AT), un agente antifibrinolítico sintético, ha sido aprobado en el tratamiento o profilaxis de episodios hemorrágicos en pacientes con trastornos de la coagulación por vía oral o intravenosa. Su eficacia en el control del sangrado local de tejido mucoso (nariz, colon, recto y boca) llevó a evaluar su actividad en el sangrado pulmonar de diferentes etiologías4–6.
Presentamos el caso de un varón de 18 años, diagnosticado de hemosiderosis pulmonar idiopática, que había seguido varias líneas de tratamiento y en la actualidad se encontraba en tratamiento con corticoides, hidroxicloroquina e inmunoglobulinas.
Ingresó en la UCI por un cuadro de disnea y hemoptisis franca, que requirió de intubación orotraqueal por insuficiencia respiratoria global. La radiografía de tórax mostró infiltrados bilaterales con anemización de hasta 2g/dl de hemoglobina. Se realizó broncofibroscopia, observándose la mucosa bronquial tapizada de sangre roja, refluyendo esta desde ambos lóbulos inferiores. Se inició tratamiento antimicrobiano de amplio espectro y se aumentó dosis de corticoterapia a 1mg/kg de peso/12h.
En las siguientes horas el paciente presentó mala evolución, continuando la salida de contenido hemático por tubo orotraqueal. Se desarrolló nueva anemización de 1,5g/dl de hemoglobina y mayor dificultad para la ventilación y oxigenación, con disminución de la distensibilidad pulmonar. La radiografía torácica evolucionó con aumento de condensaciones bilaterales parcheadas. Una nueva broncofibroscopia evidenció aspiración de sangre fresca proveniente de ambos lóbulos inferiores.
Ante el empeoramiento clínico y con la sospecha de un sangrado alveolar difuso se inició tratamiento con AT nebulizado en el tercer día de ingreso, manteniéndose tratamiento antimicrobiano y sedoanalgesia. Para la realización de las nebulizaciones se empleó el sistema kit 22 de Cirrus® 2 Nebuliser Breathing. Mediante este sistema de nebulizaciones con un flujo del gas de 8l/min, el 77% del volumen de salida incluirá partículas de menos de 5μm de diámetro con un diámetro medio de masa (MMD) de 2,7μm7.
La dosis de AT utilizado fue de 500mg/5ml/12h, el tiempo que el enfermo permaneció con ventilación mecánica.
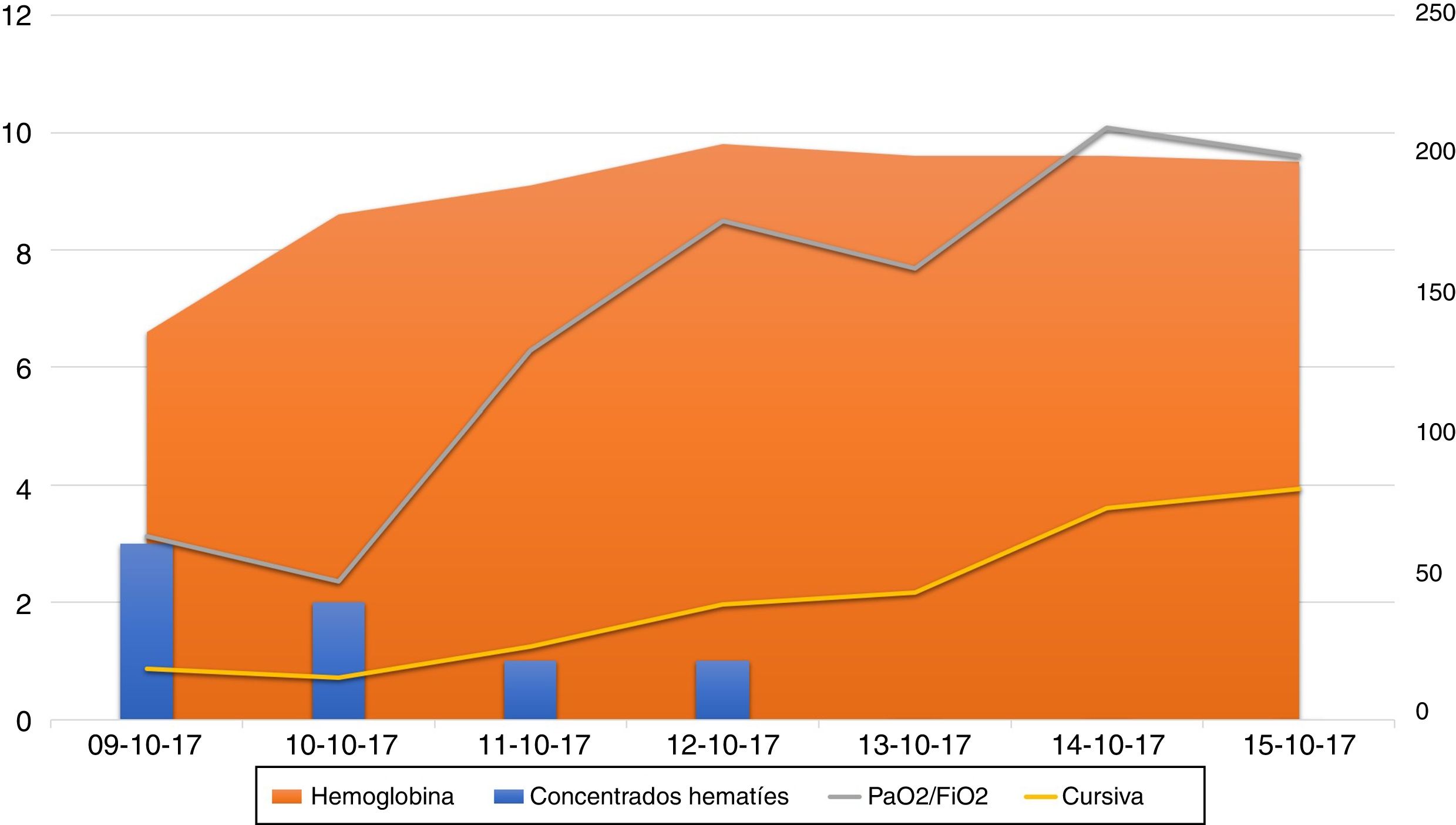
El enfermo presentó importante mejoría en los días sucesivos, sin nuevos episodios de sangrados ni anemización, mejorando la situación respiratoria, pudiendo ser retirada la sedación, despertando el paciente correctamente y pudiéndose progresar en el destete de la ventilación mecánica, siendo extubado en su noveno día de ingreso. La evolución, en términos de compliance pulmonar, PaO2/FiO2, anemización y necesidad de trasfusión, durante los primeros 7 días en la UCI, momento en el que se inician maniobras de destete de la ventilación mecánica se muestra en la figura 1.
Curso evolutivo: se muestra la evolución en términos de anemización y necesidad de trasfusión (número de concentrados de hematíes) en el eje vertical izquierdo de la figura. En el eje vertical derecho se muestra el evolutivo de la compliance pulmonar y la PaO2/FiO2 hasta el momento de iniciar maniobras de destete de la ventilación mecánica.
La hemorragia alveolar difusa, ya sea idiopática o asociada a trastornos hematológicos es una entidad con una tasa de mortalidad que oscila entre el 70 y el 90%8,9.
El AT, un derivado sintético del aminoácido lisina, posee actividad anti-fibrinolítica porque se une al plasminógeno, bloqueando su unión a la fibrina y la activación subsecuente de la plasmina4.
Una revisión Cochrane identifica 2 ensayos clínicos que evalúan el uso de AT (Anchafibrin®) por vía oral y por vía intravenosa10. No hay evidencia suficiente para su recomendación, aunque pruebas limitadas indican que puede reducir la duración de la hemorragia. Sin embargo, un artículo de revisión de las series de pacientes publicadas concluye que, aunque no se puede dar una recomendación con evidencia fuerte, el AT puede reducir tanto la duración como el volumen de sangrado, con bajo riesgo de enfermedad tromboembólica a corto plazo (recomendación débil, 2B)11.
El fundamento fisiopatológico que justifica su administración inhalado en la hemorragia pulmonar podría ser el aumento de la actividad de factores anti-fibrinolíticos empobrecidos en aquellas localizaciones de sangrado continuado a lo largo del árbol bronquial. Los estudios que sugieren una efectividad superior cuando la administración del fármaco es local en lugar del tratamiento sistémico, justifican que dicha vía de administración traduzca una mejor y más duradera inhibición de la fibrinólisis, con menor absorción sistémica y por tanto una reducción en el riesgo de trombosis asociado con la absorción sistémica. De hecho, parece demostrado que la aplicación local de AT ha sido eficaz en el control del sangrado por diferentes causas sin observarse efectos adversos significativos12,13.
Con los datos encontrados podría considerarse el AT un método efectivo, barato, seguro y fácil de administrar, capacidades que sugieren que podría ser considerado en el tratamiento de la hemorragia pulmonar en salas de urgencias o incluso en plantas de hospitalización convencional.
No obstante, no puede deducirse una relación causa-efecto, ya que la evolución favorable pudiera ser debido a una resolución espontánea del caso, motivo por el cual consideramos que se necesitan estudios clínicos aleatorios prospectivos adicionales para evaluar el uso de AT en esta configuración, puesto que la duración y la dosis de tratamiento aún no está completamente aclarada.