La enfermedad pulmonar obstructiva crónica (EPOC) es una de las primeras causas de morbilidad y mortalidad en el mundo. En 2002 se estimó que era la undécima causa de años de vida perdidos ajustados por incapacidad, con una tendencia creciente que podría situarla en el séptimo lugar en 20301. En promedio, la presenta un 10% de los adultos en todo el mundo2 y el factor etiológico más importante es el consumo de tabaco3. A pesar de su importancia, se reconoce que la investigación sobre la EPOC realizada en las últimas décadas ha sido del todo insuficiente. La Global Initiative for Chronic Obstructive Lung Disease (GOLD), un amplio consenso internacional sobre EPOC, formuló un conjunto de recomendaciones sobre las prioridades de investigación en esta enfermedad, entre las que destacan la necesidad de un mayor conocimiento de las características fenotípicas de la EPOC y del curso de la enfermedad4.
Las guías de consenso sobre la EPOC de la American Thoracic Society y la European Respiratory Society la definen como una enfermedad prevenible y tratable, que se caracteriza por una limitación al flujo aéreo que no es del todo reversible, es habitualmente progresiva y se asocia a una respuesta inflamatoria anormal de los pulmones a partículas o gases nocivos, principalmente del humo del tabaco5. Así pues, en la práctica clínica y en investigación la definición de EPOC se basa en la medida de la limitación al flujo aéreo, básicamente el volumen espiratorio forzado en el primer segundo (FEV1) y el cociente FEV1/capacidad vital forzada (FVC). Sin embargo, en los últimos años ha emergido la tendencia a considerar que la EPOC, además del problema funcional respiratorio, incluye una amplia gama de fenómenos celulares, orgánicos, funcionales, clínicos y sociales6,7 que se relacionan con su evolución8–11. De hecho, las guías mencionadas ya afirman que, aunque la EPOC afecta a los pulmones, también tiene consecuencias sistémicas importantes. No obstante, la investigación realizada para acomodar esta tendencia a un nuevo marco teórico de la EPOC ha sido escasa. Cabe destacar el sistema de estadificación de la EPOC propuesto por Celli et al12, que incorpora, además del FEV1, la disnea, la distancia caminada en 6 min y el índice de masa corporal.
La evidencia disponible en la literatura médica invita a pensar que la caracterización fenotípica de la EPOC, incorporando un amplio abanico de rasgos fenotípicos, permitiría clasificar la enfermedad en subtipos clínica y epidemiológicamente relevantes. Para evaluar esta posibilidad es necesario investigar con profundidad la interrelación entre los distintos rasgos fenotípicos de la EPOC y el grado en que las asociaciones (agrupaciones) observadas se relacionan con la evolución de la enfermedad. El proyecto Caracterización Fenotípica y Evolución de la EPOC (PAC-COPD) propone aplicar este planteamiento en una amplia cohorte de pacientes con EPOC incipiente, elegidos en el momento de su primer ingreso hospitalario, cuando el tiempo esperado de evolución de la enfermedad es todavía considerable y susceptible de ser modificado. Los grupos que participan en el proyecto han llevado a cabo numerosos estudios sobre EPOC que han proporcionado hallazgos relevantes sobre diversos aspectos de su expresión clínica y evolución, de modo que ahora es posible plantearse un grado mayor de integración y de originalidad de las hipótesis que guiaron dichos estudios.
En este artículo se presentan los objetivos a corto y largo plazo del estudio y se describe en detalle el método utilizado para la selección de los participantes y la evaluación de sus características fenotípicas, así como el plan de análisis planteado y otros aspectos organizativos. Dado el creciente interés por la comprensión y las implicaciones de la heterogeneidad fenotípica del la EPOC y de otras enfermedades como el asma13 o la neoplasia bronquial14, creemos que nuestro enfoque puede resultar de utilidad para otras iniciativas similares.
Así pues, los objetivos principales del estudio PAC-COPD son los siguientes:
1. Caracterizar la variabilidad fenotípica de los pacientes que ingresan por primera vez por agudización de la EPOC y proponer una clasificación en subtipos.
2. Estimar la asociación entre los subtipos definidos y a) la evolución clínica y funcional de la EPOC (pérdida de función pulmonar, hipoxemia, indicación de oxigenoterapia crónica domiciliaria, disminución de calidad de vida, etc.); b) la utilización de recursos sanitarios (visitas a domicilio, a atención primaria, al especialista, a urgencias, ingresos; tratamientos recibidos, etc.), y c) la mortalidad.
3. Identificar los factores de riesgo de reingreso por agudización de la EPOC, tras reducir el sesgo de indicación al seleccionar a los pacientes durante el primer ingreso, y evaluar si hay interacción entre los subtipos definidos y los factores de riesgo.
Los objetivos secundarios propuestos son: a) seleccionar y seguir a largo plazo a una cohorte de pacientes con EPOC incipiente caracterizados fenotípicamente de manera exhaustiva, y b) crear un banco de muestras biológicas y de ADN de una población con EPOC caracterizada fenotípicamente de manera exhaustiva.
Pacientes y método DiseñoSe trata de un estudio transversal y de seguimiento de una cohorte de pacientes con EPOC seleccionados durante su primer ingreso por agudización de ésta en 9 hospitales terciarios de 3 comunidades autónomas españolas. En el anexo 1 se muestra la organización del estudio y en el anexo 2 se indican los centros e investigadores participantes.
Población de estudio Selección de pacientesSe considera candidato a todo paciente ingresado por primera vez por agudización de la EPOC en alguno de los 9 hospitales participantes, durante el período comprendido entre enero de 2004 y marzo de 2006 (27 meses). Se define ingreso como toda admisión en cualquier departamento del hospital o estancia en urgencias superior a 18 h, con diagnóstico clínico15 de agudización de la EPOC según el neumólogo responsable del estudio en cada hospital. El criterio de primer ingreso hospitalario se establece mediante cuestionario al paciente, revisión de la historia clínica y verificación de los registros hospitalarios. El diagnóstico de EPOC se confirma según criterios espirométricos (FEV1/FVC tras broncodilatación=0,705) al menos 3 meses después del ingreso y en situación clínica estable.
Los criterios de exclusión son los siguientes: a) edad inferior a 45 años; b) comorbilidad orgánica grave, como cáncer en fase avanzada o terminal, tuberculosis pulmonar con afectación de más de un tercio del parénquima pulmonar total, neumectomías o neumoconiosis; c) edad avanzada o fragilidad general (dificultad para caminar, falta de autonomía, etc.) que pueda dificultar sustancialmente la participación del paciente en el estudio, con independencia de su voluntad para participar; d) incapacidad mental diagnosticada por el médico responsable u objetivada mediante el miniexamen cognoscitivo de Folstein16, más conocido como Mini-Mental Test, en la versión adaptada y validada en España17; e) no residir en la provincia donde está ubicado el hospital, y f) no entender el castellano.
El proceso funcional de la selección de pacientes se ha adaptado a los utilizados por nuestro grupo en estudios anteriores para reducir al máximo la posibilidad de sesgo de selección18. Se recoge información sobre los sujetos que se niegan a participar en el estudio con el objetivo de estudiar el grado de sesgo de selección por falta de respuesta. El proyecto ha sido aprobado por los comités éticos de todos los centros participantes. Todos los pacientes reciben información por escrito sobre los objetivos del estudio y firman la hoja de consentimiento informado, con firma independiente para los análisis genéticos.
SeguimientoEl período de seguimiento pretende abarcar hasta un mínimo de 5 años. El seguimiento de los pacientes lo es únicamente a efectos del estudio, y todos ellos se derivan y tratan según los criterios asistenciales de cada centro. El seguimiento comprende visitas y entrevistas de seguimiento activo —una evaluación completa cada 18-24 meses (visitas 1; 3; 5, etc.) y evaluaciones abreviadas telefónicas (visitas 2; 4; 6, etc.) intercaladas entre las evaluaciones completas—, así como obtención de información mediante seguimiento pasivo (a partir de los registros hospitalarios y los registros de mortalidad). Se plantean mecanismos adicionales para maximizar la tasa de respuesta en el seguimiento (dirección y teléfonos de familiares o contactos de referencia).
Tamaño de la muestraEn un estudio previo de 346 pacientes con EPOC de diversos hospitales de Barcelona se observó que el 19% de los ingresos por EPOC corresponde a primeros ingresos19. Esta proporción equivale a una media de 30 primeros ingresos de EPOC anuales en cada uno de los hospitales participantes, y a un total superior a 500 candidatos. Suponiendo una proporción de falta de respuesta del 30% (superior a estudios previos, dado que no son pacientes muy graves), el estudio permitiría estudiar entre 300 y 400 pacientes con EPOC. Como para el estudio de clasificación fenotípica mediante análisis factorial no existen fórmulas de tamaño muestral estandarizadas, se aplica el criterio de que el número de observaciones debe superar al número de variables, lo cual se cumpliría sobradamente en nuestro caso. Para el análisis de la evolución, utilizando los datos del estudio antes mencionado20, suponemos que el 15 y el 20% de los seleccionados en el primer ingreso por EPOC muere al cabo de uno y 2 años, respectivamente, mientras que el 50 y el 60% reingresa durante el primer y segundo años de seguimiento. Con estas tasas, si se clasifica a los pacientes en 2 grupos (fenotipos) del 50% cada uno, podrían estimarse riesgos relativos de mortalidad (log-rank de un modelo de Cox) de 1,8 o más, y riesgos relativos de reingreso de 1,5 o más, ambos para un riesgo alfa de 0,05 y un riesgo beta inferior a 0,20, en un contraste bilateral y estimando una tasa de pérdidas de seguimiento del 15%.
Variables e instrumentos de medidaLa información necesaria para caracterizar el fenotipo de los pacientes se obtiene a partir de cuestionarios o pruebas realizados en las visitas completas en el hospital. Durante el primer ingreso se aprovecha la estancia en el centro para obtener datos de filiación, sociodemográficos y de estilo de vida, así como algunos datos clínicos y funcionales. En las entrevistas telefónicas intercaladas entre las visitas anuales se obtiene información sobre cambios en algunos de los datos anteriores y utilización de servicios sanitarios. A continuación se describen con detalle las pruebas realizadas en cada fase y la información recogida.
Durante la selección de pacientesSe les administra por ordenador un cuestionario epidemiológico. Todas las preguntas procedentes de escalas o cuestionarios preexistentes están validadas en su versión española y los investigadores las han utilizado en estudios previos. Otras preguntas provienen del estudio EFRAM18, realizado en nuestro medio. Algunas preguntas se han adaptado para este estudio, previa validación en una muestra de 20 pacientes con EPOC del Hospital del Mar. El cuestionario incluye datos de filiación, uso de servicios sanitarios y atención medica (preguntas procedentes del estudio EFRAM18,21), disnea habitual (a partir del cuestionario de disnea modificado del Medical Research Council22), comorbilidades autodeclaradas (según lista incluida en la Enquesta de Salut de Barcelona de 198623), tratamiento farmacológico (todo tratamiento que el paciente haya tomado de forma regular para enfermedades crónicas, no sólo respiratorias; nombre del medicamento, dosis y forma de administración), hábito tabáquico (con preguntas procedentes del estudio EFRAM21, del European Community Respiratory Health Survey24 y del Estudio Español de Cáncer de Vejiga25), actividad física (a partir del cuestionario de Yale26 en su versión validada en adultos españoles27), rehabilitación respiratoria y oxigenoterapia domiciliaria (según preguntas del estudio EFRAM21) y datos sociodemográficos (detallados previamente en el estudio EFRAM21).
El neumólogo responsable del estudio en cada centro revisa la historia clínica y el informe de alta para obtener información sobre la espirometría forzada con prueba broncodilatadora y la gasometría arterial previas al alta, el índice de comorbilidades de Charlson28, los diagnósticos (primarios y secundarios) al alta y la participación en otros estudios de investigación que pudieran interferir en la evolución del paciente.
Evaluaciones completasTodas las evaluaciones completas se realizan en un período de estabilidad clínica, que se define a partir de los siguientes criterios: 3 meses sin ingreso por causa respiratoria, 3 meses sin corticoides orales o antibióticos, 2 semanas sin cambios sustanciales en los síntomas y 2 semanas sin cambios en el tratamiento. Todas las evaluaciones completas se organizan en un mínimo de 3 sesiones para no fatigar a los participantes y evitar interferencias entre las pruebas. Estas evaluaciones comprenden los siguientes cuestionarios y pruebas:
- Cuestionario epidemiológico administrado al paciente por ordenador. El cuestionario contempla: síntomas respiratorios (procedentes del European Community Respiratory Health Survey24, además de la disnea habitual a partir de las preguntas del cuestionario de disnea modificado del Medical Research Council 22 y la escala visual analógica29), cuestionario respiratorio St. George (a partir de la versión validada al español30 del St. George's Respiratory Questionnaire31), actividades de la vida diaria (a partir del índice de Barthel32), escala de somnolencia de Epworth (en la versión validada al español33 de dicho cuestionario34,35), escala de ansiedad y depresión —en la versión validada al español36 de la Hospital Anxiety and Depression Scale (HAD)37—, exposición ambiental a contaminantes atmosféricos24 y exposición domiciliaria a humo de carbón o leña38. Además, el cuestionario incluye preguntas sobre cambios en los datos obtenidos en entrevistas previas: datos de filiación y personales, tratamiento farmacológico, utilización de servicios sanitarios y atención médica, hábito tabáquico, rehabilitación respiratoria y oxigenoterapia domiciliaria.
- Exploración física, realizada por el neumólogo responsable del estudio.
- Pruebas completas de función respiratoria: espirometría forzada y prueba broncodilatadora, pletismografía corporal con volúmenes pulmonares y capacidad inspiratoria (antes y después de la administración de broncodilatador), capacidad de transferencia del monóxido de carbono y gasometría arterial basal. Todos los procedimientos se han estandarizado de acuerdo con el manual dedicado a los procedimientos de evaluación de la función pulmonar de Sociedad Española de Neumología y Cirugía Torácica (SEPAR)39,40. Para la prueba broncodilatadora se administraron 400 μg de salbutamol empleando aerocámara, de acuerdo con las recomendaciones de GOLD41.
- Pruebas de función muscular respiratoria medida en la boca a partir de la presión máxima generada durante inspiración forzada cercana al volumen residual y espiración forzada cercana a la capacidad pulmonar total. Se utilizan valores de referencia42,43.
- Pruebas de función muscular periférica con un dinamómetro de mano.
- Electrocardiograma de 12 derivaciones realizado por personal entrenado (con un mínimo de 3-5 latidos en cada derivación y una tira larga de D2 con 15-30 latidos).
- Determinación de compartimientos corporales mediante impedanciometría bioeléctrica, que permite obtener fácilmente el peso y la composición corporal, tal como ya se ha validado para pacientes con EPOC44. A fin de reducir la variabilidad, casi todos los centros utilizan el mismo equipo (Bioelectrical Body Composition Analyser, Quantum X, RSL Systems, Clinton Township, MI, EE.UU.).
- Radiografías de tórax, según protocolo acordado entre los radiólogos de los hospitales participantes: proyecciones posteroanterior y lateral izquierda, realizadas en bipedestación, con una distancia entre tubo y placa de 150 cm, utilizando una técnica con 120 kV o más y miliamperios variables según las características de cada paciente.
- Pruebas de alergia cutáneas, en las que se contemplan los siguientes alérgenos: Dermatophagoides pteronyssinus, gato, Alternaria alternata, Cladosporium herbarum, hierba timotea, abedul, Parietaria judaica, olivo y ambrosía, con un control positivo (histamina) y un control negativo. Sólo se realiza en la primera evaluación completa.
- Extracción de sangre para analítica estándar (colesterol, triglicéridos, proteínas totales, albúmina, albúmina/globulinas, tiempo de protrombina, fórmula leucocitaria, fibrinógeno, proteína C reactiva, eritrosedimentación, hemoglobina, hematócrito, inmunoglobulina E total, valores de alfa-1-antitripsina) y muestras de suero y plasma para congelar a –80 °C. El suero se utiliza para la medición centralizada de marcadores inflamatorios en el Hospital Son Dureta (factor de necrosis tumoral, interleucina-8, factor de crecimiento humano, interleucina-10, interleucina-6, proteína C reactiva) y de estrés oxidativo en el Institut Municipal dInvestigació Mèdica (carbonilos, nitrotirosinas, malondialdehído, factor de crecimiento hepatocitario). A partir del plasma se extrae ADN, que se conserva a –80 °C, con el que se realizarán mediciones en el futuro. Para los análisis genéticos se solicita un consentimiento informado específico y se aplican medidas de confidencialidad adicionales.
- Prueba de la marcha de 6 min para medir la capacidad de ejercicio. En todos los centros se sigue estrictamente el mismo protocolo, adaptado de las guías publicadas45,46. Brevemente, consiste en 2 intentos —con un mínimo de 30 min de descanso entre ambos— en pasillos de 30 m, incentivos cada minuto e interrupción de la prueba ante síntomas de agotamiento. Sólo en la primera evaluación completa se realizan 2 intentos y a partir de la segunda se efectúa una única prueba.
- Prueba de ejercicio cardiopulmonar para medir la capacidad de ejercicio, adaptada de las recomendaciones de la SEPAR47 y las guías de la American Thoracic Society48. La prueba se realiza en cicloergómetro con control electromagnético y consiste en: a) una fase de reposo antes del ejercicio (3 min); b) ejercicio sin carga (3 min), y c) incrementos progresivos de carga (10–20 W/min) hasta el límite de tolerancia (aproximadamente 10 min). Supervisa la prueba personal cualificado y durante ella se estimula a los pacientes para que consigan alcanzar el límite de tolerancia determinado por los síntomas. La valoración de los síntomas al final del ejercicio (disnea, fatiga muscular) se realiza mediante la escala de Borg y se obtienen muestras de sangre 1 min después de retirar la carga para determinar la concentración de lactato. La calibración de los equipos se efectúa antes de cada prueba. El análisis de los resultados se realiza mediante el promedio cada 15 s de los datos obtenidos, que son los siguientes: a) medición de oxígeno y anhídrido carbónico en aire espirado; b) carga de trabajo; c) ventilación por minuto y sus componentes (frecuencia respiratoria y volumen corriente); d) frecuencia cardíaca, y e) pulsioximetría. La representación gráfica se realiza por medio de los 8 gráficos básicos establecidos por normativa47 y se emplean los valores de referencia de Neder et al49. Sólo se realiza en la primera evaluación completa.
- Esputo inducido, obtenido por personal entrenado de acuerdo con un protocolo adaptado a partir de estudios previos50, para: a) cultivo microbiológico cuantitativo en cada centro; b) almacenamiento de cepas congeladas a –80 °C para estudio posterior centralizado en el Hospital Germans Trias i Pujol; c) congelación de sobrenadante a –80 °C para determinación centralizada en Son Dureta de marcadores de inflamación (interleucina-12p70, factor de necrosis tumoral, interleucina-10, interleucina-6, interleucina-1b e interleucina-8), y d) obtención de extensiones para lectura centralizada de citología (células viables, recuento porcentual) en el Hospital de Sant Pau.
- Pulsioximetría nocturna con pulsioxímetro portátil, utilizando el mismo equipo en prácticamente todos los centros (Pulsox 3i, Minolta, Osaka, Japón). Sólo se realiza en la primera evaluación completa.
- Tomografía computarizada. Se obtienen 2 series de imágenes: a) tomografía computarizada helicoidal en apnea inspiratoria con adquisición caudocraneal de cortes consecutivos de 7–8 mm, para valoración cuantitativa de volúmenes y densidades pulmonares, así como de índice de enfisema, y b) tomografía computarizada de alta resolución en apnea inspiratoria desde el cayado aórtico hasta la cúpula diafragmática más alta, con cortes de 1–2 mm cada 15 mm, para valoración visual de enfisema y vía aérea. Las imágenes digitalizadas se remiten al centro coordinador, desde donde se envían para la valoración cuantitativa mediante el programa PulmoCT® (Siemens, Munich, Alemania), que está centralizada en el Hospital del Mar, y para la valoración visual por parte de 4 radiólogos entrenados (de los Hospitales de la Vall dHebron, de la Santa Creu i Sant Pau y del Mar). Sólo se realiza en la primera evaluación completa.
- Ecocardiografía Doppler para medir dimensiones y función del ventrículo derecho, cuantificar la presión sistólica de la arteria pulmonar y medir otros signos indirectos de hipertensión pulmonar. Las dimensiones cardíacas se calculan en modo M, a excepción del diámetro del ventrículo derecho, que se evalúa en 2 dimensiones. La fracción de eyección del ventrículo izquierdo se calcula con el método de Simpson. La evaluación de las válvulas cardíacas se realiza mediante registro Doppler continuo y color. En caso de insuficiencia tricuspídea, se calcula la velocidad máxima del flujo regurgitante, que permite estimar el gradiente de presión transtricuspídea. En caso de registros subóptimos se utilizan ecocontrastes para potenciar la señal Doppler. La función diastólica se analiza mediante Doppler pulsado mitral/tricuspídeo y registro Doppler tisular del anillo mitral/tricuspídeo. Finalmente se toman medidas en 2 dimensiones y modo M de los diámetros de la vena cava. Todos los centros siguen el protocolo acordado por ecocardiografistas de los hospitales participantes, de acuerdo con las recomendaciones de la American Society of Echocardiography51,52. El control de calidad y la lectura se efectúan de forma centralizada en el Hospital Clínic. Se realiza doble lectura de una muestra aleatoria de las ecocardiografías. Sólo se lleva a cabo en la primera evaluación completa.
Cada 12-18 meses, entre las evaluaciones periódicas, los pacientes responden a un cuestionario telefónico por ordenador que administra en todos los casos el mismo entrevistador desde el centro coordinador (Institut Municipal dInvestigació Mèdica). El cuestionario, adaptado del empleado en las evaluaciones completas, consta de las siguientes secciones: utilización de servicios sanitarios, síntomas respiratorios, cambios en el tratamiento o en los factores de riesgo (oxigenoterapia, rehabilitación respiratoria, actividad física, peso) y cambios en los datos de filiación del paciente (u otra información relevante para mantener el seguimiento).
Seguimiento pasivoA partir del número de identificación personal de la tarjeta sanitaria se enlazará con el Conjunto Mínimo Básico de Datos de Altas Hospitalarias de cada comunidad autónoma, a fin de obtener la información sobre ingresos hospitalarios (número, lugar, fecha de ingreso y alta, diagnósticos primarios y secundarios), previa autorización de los comités éticos y las entidades correspondientes, y conforme a la ley del secreto estadístico (Ley 14/1987 de 9 de julio).
También se conectará, a partir del nombre y apellidos, del sexo y la fecha de nacimiento, con los Registros de Mortalidad de cada comunidad autónoma para obtener información sobre mortalidad (fecha y causas del fallecimiento), previa autorización de las entidades correspondientes y conforme a la ley del secreto estadístico (Ley 14/1987 de 9 de julio).
Control de calidadLa buena calidad de la información obtenida es clave para que los resultados del estudio sean válidos53 y para reducir la variabilidad. Para ello se ha realizado un estricto control de calidad en las diferentes fases del estudio, tanto en los hospitales donde se selecciona y evalúa a los pacientes como en el centro coordinador. Dicho control consta de las siguientes actuaciones:
- 1. Durante la elaboración del protocolo y antes de la recogida de datos de cada fase:
- Homogeneización de los protocolos de las pruebas en el seno del grupo investigador de acuerdo con las guías de consenso locales e internacionales, incluyendo los protocolos de radiología y ecocardiografía. Todos estos protocolos contemplan, entre otros aspectos, la necesidad de calibrar a diario los instrumentos de medida, el control de las condiciones ambientales y la repetición de pruebas hasta conseguir cierto mínimo de variabilidad aceptable según cada prueba (p. ej., <150 ml en fev 1 y FVC en 2 de 3 maniobras aceptables, o <5 de volumen gas torácico
- Entrenamiento, por parte de personal cualificado, de los responsables de la recogida de datos antes de cada fase del estudio (selección de pacientes, primera visita completa, primera entrevista telefónica, segunda visita completa, etc.).
- Automatización de variables filtro y definiciones de intervalos en el diseño de los cuestionarios y formularios. El programa informático Questionnaire Development System™ (NOVA Research Company, Bethesda, Maryland, EE.UU.) se ha utilizado para administrar todos los cuestionarios mediante ordenador (a fin de reducir posibles errores de transcripción) y generar las bases de datos correspondientes.
- 2. Durante la recogida de datos:
- Conversaciones telefónicas periódicas con los responsables de la recogida de datos de cada centro para comentar dudas y problemas, previo análisis preliminar de los datos recogidos en el que pudieran observarse diferencias de valores entre centros o entre entrevistadores.
- Envío semanal de hojas de seguimiento de la selección de pacientes y de las pruebas realizadas con el fin de elaborar tablas de resumen y detectar retrasos o errores.
- Envío mensual de los resultados de las pruebas realizadas con el fin de detectar y subsanar errores o desviaciones del protocolo.
- Grabación de las entrevistas en casetes para su evaluación en el centro coordinador mediante un formulario estandarizado.
- Visita anual a los centros para observar la realización de entrevistas y pruebas —rellenando un formulario estandarizado—, y detectar posibles errores o desviaciones del protocolo.
- 3. Tras la recogida de datos:
- Doble entrada de todos los datos de las pruebas y revisión detallada de las discordancias, con cálculo del número y porcentaje de datos discordantes por prueba, por centro y por grabador de datos.
- En la fase de depuración: comprobación de valores ilógicos, detección de valores límite, búsqueda de incongruencias y comprobación de valores perdidos.
- En la fase de análisis: distribución de los valores y de los valores perdidos, a) por tendencia temporal, para identificar si hay efecto aprendizaje o cansancio en la aplicación de los protocolos; b) por hospital, para detectar posibles diferencias sistemáticas en los resultados de las pruebas debidas a diferencias en los aparatos de cada centro, y c) por entrevistador, para detectar posibles diferencias sistemáticas debidas a diferencias en la aplicación de los métodos. En todos los casos, los resultados de este análisis se utilizarán en los análisis correspondientes a los objetivos del proyecto y en la interpretación de resultados, incluyendo si es necesario el período, el centro o el entrevistador como variables de ajuste.
Para el análisis de la variabilidad fenotípica y de los subtipos de EPOC (objetivo 1) se realizará un análisis descriptivo y estratificado de todas las variables basales. Se utilizará el análisis factorial descriptivo con la finalidad de establecer agrupaciones de variables fenotípicas (factores). Se considerará la posibilidad de aplicar un análisis factorial confirmatorio a posibles agrupaciones de rasgos fenotípicos basadas en hipótesis mecanísticas (p. ej., separar variables relacionadas con inflamación y variables relacionadas con enfisema).
Para el estudio de la asociación entre los distintos factores fenotípicos y los sucesos de la evolución (pérdida de FEV1, visitas médicas, hospitalizaciones, mortalidad; objetivos 2 y 3), se estimará la asociación independiente entre dichos factores (como variable de exposición) y las variables de resultado obtenidas en el seguimiento, para lo cual se empleará la estimación de la odds ratio en los modelos de regresión logística o la razón de riesgo (hazard ratio) en los modelos de Cox. Para análisis con variables de resultado con observaciones repetidas se utilizará la regresión de Poisson con el número total de eventos (p. ej., ingresos hospitalarios) como variable de resultado y se incluirá el logaritmo de personas-día en riesgo como offset. También se estudiará la asociación independiente de los diferentes rasgos fenotípicos con los sucesos de evolución.
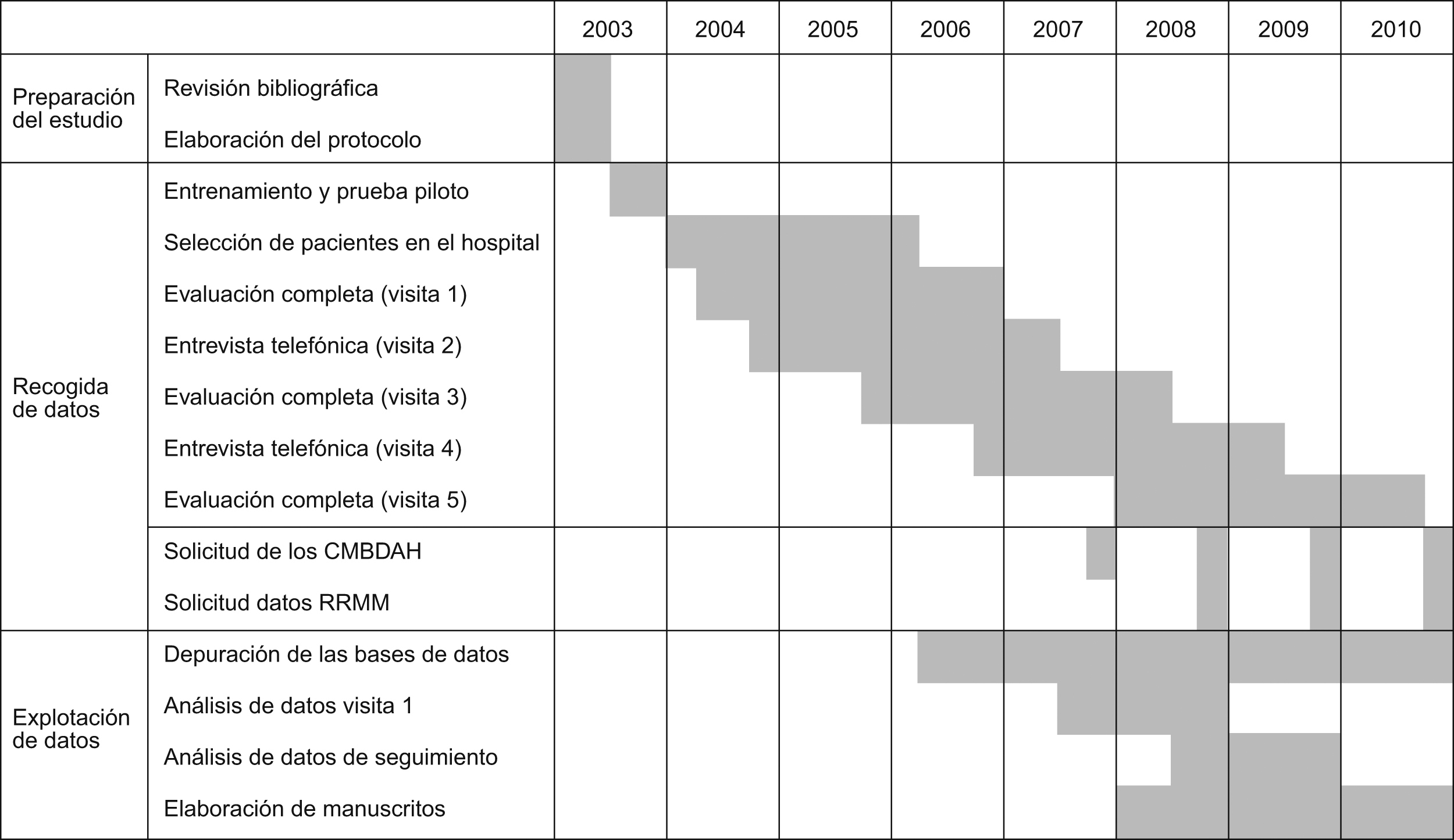
Plan de trabajo y situación del estudio en diciembre de 2007En la figura 1 se muestra el calendario del estudio desde su inicio hasta la tercera evaluación completa (aproximadamente 4 años de seguimiento activo por paciente).
Figura 1. Calendario del estudio desde su inicio hasta la tercera evaluación completa (en torno a 4 años de seguimiento activo por paciente). CMBDAH: Conjunto Mínimo Básico de Datos de Altas Hospitalarias; RRMM: Registros de Mortalidad.
En diciembre de 2007 ya habían finalizado la selección de pacientes y la primera evaluación completa. Se había identificado a un total de 1.111 candidatos potenciales, de ue se excluyó a 324 por comorbilidad grave, a 75 por incapacidad mental, a 33 por fragilidad, a 17 por no residir en la provincia donde estaba ubicado el hospital, a 9 por muerte anterior a la evaluación y a 49 por valores de FEV1/FVC mayores de 0,70 tras broncodilatación. De los 604 restantes (elegibles), 342 (57%) aceptaron participar en la primera evaluación completa. La primera entrevista telefónica de seguimiento ha finalizado con un total de 301 participantes (88%). Un total de 196 ya han participado en la segunda evaluación completa.
El proyecto ha permitido articular un segundo nivel de investigación en el que participan algunos de los grupos interesados en líneas de trabajo específicas. Hasta el momento se han redactado y financiado 4 proyectos anidados al proyecto general: Inflamación sistémica y autoinmunidad en la caracterización fenotípica de la EPOC (investigador principal [IP]: Jaume Sauleda), Efectos de la actividad física en la evolución de la EPOC (IP: Judith Garcia-Aymerich), Caracterización y efectos de la inflamación y colonización bronquiales (IP: Eduard Monsó) y Medida y efecto de la dieta en la EPOC (IP: Josep M. Antó).
Conclusiones y discusiónLa EPOC es una de las principales causas de morbimortalidad en el mundo1, a pesar de lo cual la investigación realizada hasta el momento es insuficiente para concebir estrategias diagnósticas y terapéuticas satisfactorias. El diagnóstico se basa principalmente en la limitación al flujo aéreo, aunque, dado que la pérdida de función pulmonar es un proceso a largo plazo, la enfermedad habitualmente se diagnostica en fases avanzadas y el infradiagnóstico es un problema importante3. Además, la distinción del asma es todavía un asunto sin resolver. Tras el diagnóstico, pocos tratamientos son realmente efectivos, aparte del abandono del hábito tabáquico y, en fase avanzada, la oxigenoterapia crónica en el domicilio6.
El proyecto PAC-COPD pretende mejorar el conocimiento de la heterogeneidad fenotípica de la EPOC en un esfuerzo con múltiples propósitos. Por una parte, puede ser útil para mejorar la definición de la enfermedad y su diagnóstico, incluida la mejora del diagnóstico diferencial respecto a otras enfermedades como el asma. Además, permitirá plantear nuevos sistemas de clasificación de la gravedad aplicables a nuevas guías terapéuticas o a los criterios de derivación de pacientes, lo que redundará en una mejor valoración pronóstica y adaptación de los criterios de seguimiento clínico a los marcadores de pronóstico. Por último, debería servir como marco para la identificación de nuevos tratamientos y la elección de las mejores medidas de resultado en los estudios de intervención. Obviamente, para cada una de estas aplicaciones se necesitarían estudios diseñados específicamente siguiendo los principios metodológicos adecuados, como los indicados por la medicina basada en la evidencia54. Como puntos fuertes adicionales cabe mencionar que este proyecto es el resultado de un esfuerzo grande por parte de diversos grupos de investigación españoles con notable experiencia en diferentes áreas de la EPOC, de manera que su integración en este proyec to representa una gran ventaja para aumentar la comprensión de esta enfermedad. El equipo, además de neumólogos y epidemiólogos, cuenta con la participación de radiólogos y cardiólogos. La estandarización de técnicas es un importante valor añadido que ha facilitado la colaboración de los diversos grupos en estudios de colaboración iniciados con posterioridad al presente proyecto, como algunos de los surgidos en el seno del CIBER de Enfermedades Respiratorias (p. ej., el estudio ECOS).
Entre las posibles limitaciones del presente estudio cabe mencionar el criterio de primer ingreso por agudización de la EPOC como punto de partida para la selección de los participantes con EPOC incipiente. El estudio excluiría a los pacientes con EPOC que en caso de agudización no acuden al hospital o acuden pero no ingresan porque presentan una agudización leve o por otras razones, así como a los pacientes con EPOC ingresados en hospitales privados. En este sentido, la decisión del grupo investigador estuvo motivada por cuestiones prácticas (disponibilidad de pacientes hospitalizados) y científicas (experiencia previa con otros grupos de pacientes con EPOC en los que se han encontrado problemas para extrapolar los resultados, como, por ejemplo, los pacientes seleccionados en consultas externas de los hospitales, que acostumbran tener más comorbilidades que el resto de afectados de EPOC). En términos de heterogeneidad fenotípica la validez interna no se ve comprometida por el criterio de primer ingreso, ya que las inferencias se restringen al tipo de pacientes incluidos en el estudio. La posibilidad de sesgo de selección por falta de respuestas se examinará mediante la comparación de las características sociodemográficas, clínicas, funcionales y de estilo de vida entre los participantes y los no participantes. El hecho de no excluir a los pacientes con asma que presenten también los criterios definidos de EPOC forma parte de la voluntad de estudiar y clasificar las diferentes formas de presentación de la EPOC, y es concebible que el estudio pueda hacer alguna aportación a la distinción entre asma y EPOC, dada la riqueza de información fenotípica que se obtendrá.
En resumen, el proyecto PAC-COPD permitirá replantear la definición y clasificación de la EPOC, así como comprender mejor los factores asociados a su evolución, lo que sin duda redundará en beneficio de los pacientes.
Anexo 1. Organización del estudioEl estudio está dirigido por un Grupo Investigador, que está formado por 30 investigadores de 10 centros y es responsable de la dirección científica del proyecto. Algunos de los investigadores se agrupan en 5 Grupos de Trabajo centrados en áreas en las que tienen probada experiencia y lideran subproyectos con financiación propia. El Comité de Coordinación, que está formado por los investigadores del centro coordinador y un investigador de cada centro, supervisa el estudio para que se desarrolle según lo previsto en el protocolo. Los responsables de la recogida de datos, que han sido entrenados para este estudio, seleccionan a los pacientes y realizan las pruebas y entrevistas según los protocolos (fig. A1 ).
Anexo 2. Centros e investigadores participantesInstitut Municipal dInvestigació Mèdica (IMIM), Barcelona (centro coordinador): Josep M. Antó (investigador principal), Judith Garcia-Aymerich (coordinadora), Jordi de Batlle y Marta Benet
Hospital Clínic i Provincial de Barcelona: Joan A. Barberà (coordinador de centro), Federico P. Gómez, Josep Roca, Robert Rodríguez-Roisin y Carles Paré
Hospital del Mar, Barcelona: Joaquim Gea (coordinador de centro), Eva Balcells, Mauricio Orozco-Levi y Àngel Gayete
Hospital de la Santa Creu i Sant Pau, Barcelona: Pere Casan (coordinador de centro), Rosa Güell, Ana Giménez y José Belda (actualmente en el Hospital General Universitari de València)
Hospital General Universitari Vall dHebron, Barcelona: Jaume Ferrer (coordinador de centro), Esther Rodríguez y Esther Pallissa
Hospital Universitari de Bellvitge, LHospitalet de Llobregat: Eva Farrero (coordinadora de centro) y Joan Escarrabill
Hospital Universitari Germans Trias i Pujol, Badalona: Eduard Monsó (coordinador de centro), Alicia Marín y Josep Morera
Hospital de Sabadell, Corporació Parc Taulí, Sabadell: Antoni Ferrer (coordinador de centro)
Hospital Son Dureta, Palma de Mallorca: Jaume Sauleda (coordinador de centro) y Àlvar Agustí
Hospital de Cruces, Baracaldo, Vizcaya: Batxi Gáldiz (coordinador de centro) y Lorena López
Financiación
El estudio ha contado con la siguiente financiación: Fondo de Investigación Sanitaria (FISPI020541), Agència d'Avaluació de Tecnologia i Recerca Mèdiques (AATRM 035/20/02), Sociedad Española de Neumología y Cirugía Torácica (SEPAR2002/137), Fundació Catalana de Pneumologia (FUCAP2003 Beca Marià Ravà), Fundació La Marató de TV3 (041110), Novartis Farmacèutica España, Astra Zeneca España, Red RESPIRA (RTICC03/11), Red RCESP (RTICC03/09), Fondo de Investigación Sanitaria (PI052486), Fondo de Investigación Sanitaria (PI052302). J. Garcia-Aymerich tiene un contrato de investigadora del Instituto de Salud Carlos III (CP05/00118). Las entidades financiadoras no han tenido nada que ver con la idea o el contenido del presente proyecto ni con la decisión de enviar el manuscrito para su publicación.
Autor para correspondencia.
J. Garcia-Aymerich
Dirección: jgarcia@creal.cat