Introducción
Los pacientes con enfermedad pulmonar obstructiva crónica (EPOC) con frecuencia desarrollan disnea progresiva de esfuerzo, afectación de la calidad de vida relacionada con la salud (CVRS) y limitación variable de su capacidad para realizar las actividades cotidianas. Como consecuencia de esto, se ven forzados a adoptar un estilo de vida sedentario y entran en un círculo vicioso que los conduce a un importante deterioro de la forma física.
La disminución de la tolerancia al esfuerzo es un problema común en los pacientes con EPOC. Varios estudios han indicado que la intolerancia al ejercicio en estos pacientes no depende exclusivamente de la limitación ventilatoria y de las anormalidades del intercambio gaseoso1-3. Otros factores, como la disfunción de los músculos esqueléticos (ME), también pueden contribuir a esta intolerancia.
Desde hace varios años se viene acumulando importante información sobre anormalidades estructurales y funcionales en los ME de los pacientes con EPOC4-6. Los hallazgos histoquímicos y bioquímicos apuntan a un cambio del metabolismo aeróbico oxidativo hacia el glucolítico anaerobio4-6. Algunos estudios han indicado que estas anormalidades pueden revertirse, al menos en parte, con el entrenamiento físico4,7-10.
A pesar de la amplia utilización del entrenamiento físico en el manejo clínico de los pacientes con EPOC, existen algunas controversias sobre el tipo, la intensidad y la duración óptima de estos programas. Algunos autores señalan que el entrenamiento de alta intensidad y duración prolongada puede inducir una adaptación central y periférica en las personas con EPOC8,9. Dos estudios en un mismo grupo de pacientes demostraron que el entrenamiento de alta intensidad y de 12 semanas de duración aumentó la actividad de las enzimas oxidativas mitocondriales, el tamaño de las fibras tipo I y el número de capilares en contacto con las fibras tipo I y IIa en pacientes con EPOC4,9. Sólo 2 trabajos han evaluado los cambios en los ME después de un programa de entrenamiento de 6 semanas de duración. Belman y Kendregan11 observaron que los pacientes con EPOC no eran capaces de ejercitarse a una intensidad suficiente para inducir la respuesta clásica del entrenamiento ni los cambios de las enzimas musculares. Por otra parte, Puente-Maestu et al12 encontraron un aumento de la capacidad oxidativa de los ME que se correlacionó con la duración del esfuerzo.
Hasta la fecha ningún estudio ha evaluado en pacientes con EPOC las modificaciones histoquímicas de los ME después de un entrenamiento físico de alta intensidad con una duración menor de 12 semanas, ni su relación con los cambios en la CVRS y la tolerancia al esfuerzo.
Este trabajo se diseñó para estudiar las características de los ME después de un programa de entrenamiento físico de alta intensidad que duró 6 semanas (18 sesiones), en pacientes con EPOC de moderada a grave, y su relación con los cambios en la prueba de la marcha de 6 min (M6M) y con los resultados del cuestionario de CVRS de St. George (SGRQ).
Pacientes y métodos
Pacientes
Se estudió a 10 pacientes, procedentes de la Consulta de Neumonología del Hospital Universitario de Caracas, con diagnóstico de EPOC moderada a grave, quienes previamente dieron su aprobación para participar en el estudio. El diagnóstico de EPOC se realizó siguiendo las recomendaciones de la American Thoracic Society13. En el momento de iniciar el estudio los pacientes se encontraban clínicamente estables, recibían un tratamiento broncodilatador adecuado (agonistas β2, anticolinérgicos, teofilina y esteroides inhalados) y no usaban de forma regular esteroides sistémicos. El Comité de Bioética de la institución aprobó la realización del estudio.
En la selección de los pacientes se utilizaron los siguientes criterios de exclusión: pacientes con respuesta significativa tras broncodilatación, definida como aumento del volumen espiratorio forzado en el primer segundo (FEV1) mayor del 12% y de 200 ml; pacientes con insuficiencia cardíaca congestiva, cardiopatía isquémica, problemas neuromusculares, y pacientes que hubiesen participado en un programa de entrenamiento previo.
Durante el entrenamiento 2 pacientes presentaron una exacerbación aguda de la enfermedad y por esta razón se retiraron del programa. Ocho pacientes lo completaron y fueron revaluados posteriormente.
Función pulmonar y calidad de vida relacionada con la salud
La función pulmonar en reposo se evaluó con un espirómetro (MedGraphics CardiO2 System, Wisonsin, EE.UU.). Los valores de la capacidad vital forzada (FVC), FEV1 y FVE1/FVC se calcularon siguiendo las recomendaciones de la American Thoracic Society14. Los valores normales se tomaron de fuentes de referencia15.
La afectación de la CVRS se evaluó antes y después del entrenamiento utilizando la versión en español del SGRQ16.
Marcha de 6 minutos
La M6M se llevó a cabo en un pasillo libre de tráfico de 22 m de largo. La prueba fue estandarizada siguiendo las recomendaciones internacionales17. Se realizaron 2 pruebas, separadas por un período de 30 min. Se instruyó a los pacientes y se les animó a caminar enérgicamente durante un período de 6 min, y se le permitió descansar durante este intervalo si así lo requerían. Durante la prueba se midieron la distancia recorrida en el tiempo preestablecido y la saturación de oxígeno con un oxímetro de pulso (Respironics, Model 950 Oximeter). También se determinaron, tanto en reposo como a máximo esfuerzo, la frecuencia cardíaca y la intensidad de la disnea utilizando la escala de Borg18. La distancia recorrida se midió en metros y se escogió para el análisis la máxima distancia alcanzada en las 2 pruebas.
Evaluación de los músculos esqueléticos
Las características histoquímicas y metabólicas de los ME se evaluaron en todos los pacientes que entraron en el protocolo tomando una biopsia muscular. Se efectuó una segunda evaluación de los ME en aquellos que completaron el programa de entrenamiento físico. Las biopsias se tomaron del vasto lateral (músculo cuádriceps) con las debidas precauciones de antisepsia y bajo anestesia local con lidocaína al 2%. Se utilizó la aguja de Bergström19 y la muestra se dividió en 2 partes. Una parte se montó en OCT (Tissue-Tek) y se congeló en isopentano enfriado en nitrógeno líquido. Se realizaron secciones transversales de 10 μm en un crióstato a 20 ºC. Para clasificar las fibras musculares se utilizó la reacción de la adenosina trifosfatasa miofibrilar (ATP-asa) con preincubación alcalina (pH de 10,3) y preincubación ácida (pH de 4,37 y 4,6)20. Los capilares se visualizaron por medio de la reacción alfa-amilasa-PAS21. Se tomaron microfotografías de estas secciones con un aumento de x200 y las fibras se identificaron por comparación con la sección de ATP-asa. Se delimitó un área de la fotografía y se midió con un planímetro, y se contaron las fibras y capilares para calcular los capilares/mm2 y la relación capilar/fibra. También se contaron los capilares alrededor de cada fibra, se calculó el promedio para cada tipo de fibra y los resultados se expresaron como capilares de contacto. Se agruparon todas las fibras de un mismo tipo y el área se midió por planimetría para calcular el área promedio de cada tipo de fibra.
La otra parte de la muestra muscular se congeló de inmediato con nitrógeno líquido y se usó para el análisis de las enzimas citrato sintetasa (CS), β-hidroxiacil-coenzima A deshidrogenasa (HAD) y lactatodeshidrogenasa (LDH), con técnicas fluorométricas22. Los resultados de las actividades de las enzimas se expresaron en µmol/min·g de peso húmedo (p.h.) del tejido.
Programa de entrenamiento físico
Todos los pacientes entraron en un programa de rehabilitación respiratoria que hacía especial hincapié en el entrenamiento de los miembros inferiores. Los pacientes asistieron 3 veces por semana, durante 6 semanas, al centro de rehabilitación. El entrenamiento de los miembros inferiores se realizó en un ergómetro cíclico calibrado, con una duración de 30 min por sesión.
Las sesiones de entrenamiento físico fueron supervisadas por un médico rehabilitador, quien estimuló a los pacientes a alcanzar la intensidad del entrenamiento predeterminada. La carga correspondiente al 70-80% del consumo de oxígeno máximo, alcanzado en una prueba de esfuerzo máxima previa al programa de rehabilitación, se utilizó para determinar la intensidad del entrenamiento físico. Esta prueba se realizó en un cicloergómetro (MedGraphics Cardio2 System) usando un incremento de carga en rampa. El protocolo comenzó con 2 min de reposo, seguido de un período de 3 min de pedaleo sin carga y, finalmente, del aumento progresivo de la carga (rampa) con un incremento de 10 W/min. El final de la prueba en cada caso estuvo determinado por síntomas tales como agotamiento extremo, disnea, o fatiga de miembros inferiores. Los pacientes fueron capaces de realizar el entrenamiento durante 30 min desde el inicio, pero con cargas menores que la máxima predeterminada. En las sesiones siguientes se fue incrementando la carga de forma progresiva de acuerdo con la tolerancia. Una vez que el paciente alcanzó la intensidad predeterminada, ésta se mantuvo hasta el final.
Las sesiones también incluyeron ejercicios de los miembros superiores, calentamiento y relajación. Durante el entrenamiento se administró oxígeno suplementario a los pacientes por presentar desaturación significativa.
Análisis estadístico
Los resultados de las características antropométricas, función pulmonar, M6M, CVRS y parámetros de los ME se expresan como promedio ± desviación estándar. Para determinar los cambios en la M6M, CVRS y los ME después del entrenamiento físico se utilizó la prueba de la t de Student para muestras dependientes. La prueba de correlación de Pearson (r) se utilizó para evaluar la relación entre los cambios en la M6M y SGRQ, con las modificaciones observadas en las características de los ME. El programa estadístico utilizado para el análisis fue StatSoft Statistica. Se aceptó un nivel de significación estadística con un valor de probabilidad menor de 0,05 (p < 0,05).
Resultados
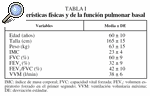
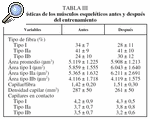
Los valores medios y la desviación estándar de las características físicas y la función pulmonar en reposo de los pacientes se muestran en la tabla I. Los datos de la función pulmonar indican que el grupo de pacientes tenía una importante obstrucción del flujo respiratorio (FEV1% y FEV1/FVC% de 32 ± 9 y 42 ± 10, respectivamente). Como era de esperar, los valores espirométricos no cambiaron después del entrenamiento físico.
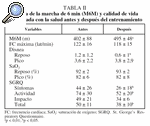
Los resultados obtenidos en la M6M y SGRQ, antes y después de la rehabilitación respiratoria, se muestran en la tabla II. En ésta se evidencia un compromiso basal en los diferentes aspectos evaluados de la CVRS (síntomas, actividades de la vida diaria e impacto de la enfermedad), con una disminución significativa de los componentes del SGRQ, después del entrenamiento físico. La distancia recorrida en la M6M también se modificó significativamente después del entrenamiento, de 403 ± 88 a 495 ± 48 m (p < 0,01). La saturación de oxígeno, la frecuencia cardíaca y la intensidad de la disnea al esfuerzo no cambiaron con el entrenamiento.
Las características histoquímicas de los ME antes y después del entrenamiento físico se muestran en la tabla III. Los pacientes presentaban una distribución alterada de las fibras musculares, caracterizada por una menor proporción de fibras oxidativas (tipo I) y mayor porcentaje de fibras tipo II, comparados con controles normales de nuestro laboratorio (tipo I: 48 ± 10%; tipo IIa: 38 ± 11%; tipo IIb: 15 ± 6%).
La proporción de los tipos de fibras, el área de cada tipo de fibra y los parámetros de capilaridad no cambiaron con el entrenamiento físico. Sin embargo, el área promedio de las fibras mostró una tendencia a incrementarse tras la rehabilitación respiratoria, aunque esta diferencia no alcanzó significación estadística (p = 0,08).
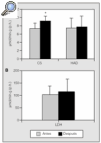
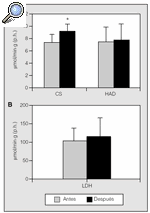
La actividad de las enzimas oxidativas (CS y HAD) y de la enzima glucolítica LDH antes y después del entrenamiento físico se muestra en la figura 1. La actividad de la CS se incrementó significativamente después del entrenamiento, de 7,4 ± 1,3 a 9,2 ± 1,2 μmol/g·min (p < 0,05). Los valores de las enzimas HAD y LDH no experimentaron cambios significativos (de 7,58 ± 2,27 a 7,74 ± 2,70 y de 106 ± 35,6 a 118,7 ± 60,48 μmol/g·min, respectivamente).
Fig. 1. Concentraciones de las enzimas citrato sintetasa (CS), β-hidroxiacil coenzima A deshidrogenasa (HAD) y lactatodeshidrogenasa (LDH) en los músculos esqueléticos de los pacientes con EPOC antes y después del entrenamiento. p.h.: peso húmedo. *p < 0,05.
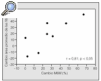
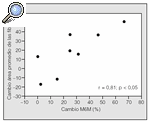
En la figura 2 se muestra la correlación significativa que se observó entre el incremento del porcentaje de la M6M y el cambio en porcentaje del área promedio de las fibras (r2 = 0,66; p < 0,05). No se observó relación entre la M6M y los cambios de la CS, y tampoco entre los cambios del SGRQ y los de los ME (CS y área promedio de las fibras).
Fig. 2. Correlación entre los cambios en porcentaje de la duración de la marcha de 6 min (M6M) y los cambios en el área promedio de las fibras (r2 = 0,66). p < 0,01.
Discusión
Los hallazgos más importantes en este estudio sobre las características de los ME en pacientes con EPOC tras 6 semanas de entrenamiento físico fueron: a) la respuesta muscular al entrenamiento estuvo representada por un incremento de la actividad de la enzima oxidativa CS, y b) si bien el aumento del área promedio de las fibras no alcanzó la significación estadística, mostró una correlación significativa con el incremento de la distancia recorrida en la M6M.
En pacientes con EPOC, Belman y Kendregan11 no observaron aumento de la CS después de 6 semanas de entrenamiento, mientras que sí se evidenció en los pacientes entrenados con alta intensidad por Puente-Maestu et al12, quienes comunicaron un incremento del 33% en las concentraciones de esta enzima. Los resultados de nuestro estudio indican un incremento en la actividad de la CS de un 20%. La diferencia entre los resultados de Belman y Kendregan11 y los nuestros probablemente puede explicarse por la baja intensidad del entrenamiento físico que utilizaron estos autores (aproximadamente un 50% de la capacidad máxima de esfuerzo). Por otra parte, las diferencias de nuestros hallazgos con respecto a los de Puente-Maestu et al12 probablemente se relacionen con la duración de cada sesión, que fue de 45 min en el trabajo citado y de 30 min en el presente estudio. Sin embargo, usando los mismos 30 min por sesión y prolongando el entrenamiento durante 12 semanas, se ha descrito un aumento de apenas el 12% en las concentraciones de CS9. En este último trabajo se observó un incremento de la HAD, que posiblemente necesite mayor tiempo de entrenamiento para apreciarse. Es de hacer notar que muy pocos pacientes con EPOC grave pueden iniciar el entrenamiento con una carga del 70-80% del consumo de oxígeno máximo, y que el tiempo para alcanzar esta meta varía de un paciente a otro, por lo que probablemente sea conveniente prolongar el entrenamiento hasta 12 semanas para alcanzar no sólo el aumento de la CS sino también de la HAD.
Algunos estudios han encontrado una relación significativa entre la distancia recorrida en la M6M y la capacidad oxidativa de los músculos periféricos en pacientes con EPOC12,23. Sin embargo, también se ha descrito una relación importante entre la fuerza del músculo cuádriceps y la M6M (r = 63)24; en este último estudio el análisis de regresión múltiple encontró que la fuerza isométrica del cuádriceps y la presión inspiratoria máxima (fuerza de los músculos inspiratorios) eran los mejores determinantes de la varianza total de la M6M. En la EPOC, la miopatía periférica muestra un predominio del metabolismo anaeróbico en el músculo, caracterizado por el predominio de las fibras tipo II4-6, la disminución de enzimas oxidativas y una mayor pendiente en el aumento de ácido láctico en el ejercicio25. Asimismo, se ha encontrado atrofia de las fibras musculares4,26, sea por desentrenamiento y/o por la presencia de una respuesta inflamatoria27. La atrofia se manifiesta en la disminución del área de las fibras. Ésta, a su vez, está directamente relacionada con la masa magra (masa libre de grasa) y con el índice de masa corporal en los pacientes con EPOC26. Se ha demostrado que la distancia recorrida en la marcha de 12 min tiene una buena correlación con la masa magra y con el peso corporal de los pacientes28; por lo tanto, el área de las fibras puede tener importancia en el resultado de la M6M. Todos estos hallazgos ayudan a explicar la correlación observada entre el incremento de la M6M y el cambio en el área promedio de las fibras tras el entrenamiento físico en nuestros pacientes.
Nuestros hallazgos, al igual que los comunicados por otros autores8,9,12, proporcionan evidencias que sustentan la teoría del desentrenamiento como un factor reversible involucrado en la disfunción de los ME en pacientes con EPOC y pudieran ayudar, al menos en parte, a explicar los beneficios observados en la tolerancia al esfuerzo que manifiestan estos pacientes con el entrenamiento físico.
En contraste con lo comunicado en otros trabajos4,9, nosotros no observamos cambios en la capilaridad ni en el área de los diferentes tipos de fibras. Estos hallazgos probablemente pueden explicarse por las diferencias en la duración del entrenamiento entre los estudios, así como por la gravedad de las alteraciones basales de los ME observadas en los pacientes. Un programa de entrenamiento físico de 6 semanas (18 sesiones) probablemente no sea suficiente para modificar todas las anormalidades musculares relacionadas con el desentrenamiento en los pacientes con EPOC. Por otra parte, el área promedio de las fibras y los parámetros de capilaridad en nuestros pacientes antes del entrenamiento eran similares a los comunicados por Whittom et al4 después de 12 semanas de rehabilitación. Es probable que el desentrenamiento muscular de nuestros pacientes fuera menor, ya que en general procedían de un estrato socioeconómico bajo y para trasladarse tienen que caminar largas distancias, y utilizar el sistema de transporte público; por esta razón su grado de actividad no se ve tan afectado como el de los pacientes que cuentan con mejores recursos. Los resultados de la M6M antes del entrenamiento en nuestros pacientes (tabla II) constituyen un argumento a favor de este planteamiento. Asimismo, nos atrevemos a especular que probablemente es difícil mejorar las anormalidades de los ME dependientes del desentrenamiento cuando son muy leves o se acercan a lo normal.
En el presente estudio los resultados indican que los valores del SGRQ diminuyeron significativamente después del entrenamiento. Sin embargo, no se observó relación entre la respuesta muscular y los cambios en la CVRS. Estos hallazgos son más difíciles de explicar únicamente sobre la base del descondicionamiento muscular, y es probable que otros factores participen en este proceso. También es posible que el número limitado de pacientes incluidos en el presente estudio no haya permitido determinar esta relación. Por lo tanto, son necesarios nuevos trabajos para determinar la contribución de la disfunción de los ME en las alteraciones de la CVRS de los pacientes con EPOC.
El presente estudio tiene algunas limitaciones por el tamaño relativamente pequeño de la muestra, por lo que no es posible extrapolar estos resultados a toda la población de pacientes con EPOC. Sin embargo, es importante mencionar que en general los estudios que evalúan las características histoquímicas de los ME incluyen un número reducido de sujetos, por lo difícil que es reclutar a pacientes cuando se realizan procedimientos invasivos como la biopsia de ME, en particular cuando es necesaria la toma de 2 muestras (antes y después del entrenamiento).
En conclusión, los resultados del presente estudio muestran que la intervención con 6 semanas de entrenamiento físico de alta intensidad en pacientes con EPOC modifica significativamente tanto la tolerancia al esfuerzo como la CVRS e induce cambios modestos en los ME que se relacionan con el incremento observado en la M6M. Estos hallazgos indican que los cambios en las anormalidades musculares relacionadas con el descondicionamiento probablemente mejoran con el entrenamiento físico y pudieran explicar en parte los beneficios observados en la tolerancia al esfuerzo tras la rehabilitación respiratoria.