La hipertensión arterial pulmonar (HAP) y la hipertensión pulmonar tromboembólica crónica (HPTEC) provocan una reducción en la calidad de vida relacionada con la salud (CVRS). El objetivo del estudio fue evaluar la CVRS en una muestra nacional.
Pacientes y métodosEstudio prospectivo y no intervencionista en 139 (89%) pacientes con HAP y 17 (11%) pacientes con HPTEC (mujeres, 70,5%; edad media, 52,2 años) reclutados en 21 hospitales españoles. El 55% presentaban HAP idiopática, el 34% otras HAP y el 11%, HPTEC. La CVRS se midió utilizando los cuestionarios Short Form 36 (SF-36) y EuroQoL-5D (inicial y 6meses).
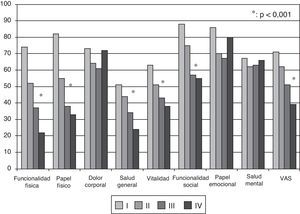
ResultadosLa CVRS en pacientes con HAP o HPTEC está deteriorada. El componente físico del SF-36 y el EuroQol-5D se correlacionó con la clase funcional. Las puntuaciones medias de la escala visual analógica del EuroQol-5D (EQ-5D EVA) fueron 73,5±18,4, 62,9±20,7 y 51,3±16,0 (p<0,0001) en pacientes con una clase funcional (CF) I, II y III, respectivamente. Cada aumento de una CF representa una pérdida de 4,0 en el PCS SF-36 y de 9,5 en el EQ-5D EVA. En 8pacientes que murieron o recibieron un trasplante durante el estudio, la CVRS fue peor al inicio, comparado con el resto. No se observaron cambios significativos en la CVRS en los supervivientes tras 6meses de seguimiento.
ConclusionesLa CVRS está deteriorada en esta población, especialmente en los pacientes con HAP/HPTEC al borde de la muerte. Las mediciones de CVRS ayudarían a predecir el pronóstico en la HAP y la HPTEC, así como proporcionar información adicional en estos pacientes.
Patients with pulmonary arterial hypertension (PAH) and chronic thromboembolic pulmonary hypertension (CTEPH) experience impaired health-related quality of life (HRQL). The objective of this study was to evaluate HRQL in a nation-wide sample.
Patients and methodsThis is a prospective, multicenter, non-interventional study of HRQL including 139 (89%) PAH and 17 (11%) CTEPH patients (women 70.5%; mean age, 52.2) recruited from 21 Spanish hospitals. 55% had idiopathic PAH, 34% other PAH and 11% CTEPH. HRQL was measured using the Short Form 36 Health Survey (SF-36) and EuroQoL-5D (baseline and after 6 months).
ResultsHRQL in the patients with PAH or CTEPH was impaired. The physical component of SF-36 and the EuroQol-5D correlated with the functional class (FC). Mean EuroQol-5D visual analogical scale (EQ-5D VAS) scores were 73.5±18.4, 62.9±20.7 and 51.3±16.0 (P<.0001) in patients with FC I, II and III, respectively. Every increase of one FC represented a loss of 4.0 on the PCS SF-36 and a loss of 9.5 on the EQ-5D VAS. Eight patients who died or received a transplant during the study period presented poorer initial HRQL compared with the rest of the population. No significant changes in HRQL were observed in survivors after 6 months of follow-up.
ConclusionsHRQL is impaired in this population, especially in PAH/CTEPH patients near death. HRQL measurements could help predict the prognosis in PAH and CTPH and provide additional information in these patients.
El término «hipertensión arterial pulmonar» (HAP) se refiere a un grupo de trastornos incurables asociados a un aumento progresivo de la resistencia vascular pulmonar (RVP), una reducción de la capacidad de ejercicio con un final marcado por un fallo cardíaco ventricular derecho y una muerte prematura1. La hipertensión pulmonar tromboembólica crónica (HPTEC) es una enfermedad rara, y posiblemente infradiagnosticada, con un comportamiento probablemente similar cuando la endarterectomía pulmonar no es factible. Hace 2décadas se observó que la supervivencia media de la HAP no tratada era de 2,8años después del diagnóstico2. Sin embargo, en los últimos 15años y tras una intensa investigación con más de 25ensayos clínicos multicéntricos y 2metaanálisis se demuestran beneficios en la supervivencia de los nuevos tratamientos3,4. La capacidad de ejercicio fue el objetivo principal en la mayoría de esos ensayos clínicos, y en solo algunos de ellos la calidad de vida relacionada con la salud (CVRS) fue incluida como objetivo secundario5-7. Dado que los nuevos tratamientos han conseguido que la HPTEC y la HAP hayan llegado a la situación de «enfermedad crónica manejable», las mejoras en la CVRS son cada vez más relevantes para los médicos y los pacientes a la hora de evaluar el impacto de los nuevos tratamientos médicos6,8. La medición de la CVRS también es útil para evaluar el coste-beneficio9. Aparte de algunos ensayos clínicos, son pocos los estudios dedicados a la CVRS en la HAP10,11 o la HPTEC12-14. Es conocido que, en comparación con los individuos sanos, los pacientes con HAP presentaron una reducción de su movilidad física, niveles menores de energía, un aumento del dolor y un mayor aislamiento social12.
El objetivo de este estudio observacional, multicéntrico, no intervencionista y descriptivo fue el de evaluar prospectivamente la CVRS en una cohorte de pacientes españoles diagnosticados con HAP o HPTEC en una población no seleccionada proveniente de hospitales de diferente tamaño y experiencia. Además, se planteó como objetivo adicional estudiar en estos pacientes qué factores influyen en su CVRS.
Pacientes y métodosDiseño del estudioSe trata de un estudio prospectivo, no intervencionista y descriptivo llevado a cabo en 21centros españoles que reclutaron al menos a 5pacientes ambulatorios consecutivos diagnosticados con HAP o HPTEC en febrero de 2008. Los centros participantes fueron seleccionados con la exigencia de seguir un mínimo de 5pacientes al mes. El reclutamiento de los centros participantes y la recogida de datos para su análisis fueron realizados por Pfizer. Los centros participantes (anexo 1) incluyeron todos los hospitales con mayor actividad según el Registro Español de Hipertensión Arterial Pulmonar (REHAP). El análisis y la interpretación de los datos fueron hechos por los autores de forma independiente. El estudio incluyó 2 visitas, una al inicio y otra 6meses después. El periodo de reclutamiento fue conocido en el centro de los investigadores con 2semanas de antelación, para intentar evitar cualquier sesgo y poder reclutar pacientes ambulatorios de HAP o HPTEC consecutivos y no seleccionados.
Criterios de inclusiónPacientes ambulatorios consecutivos de ≥18 años de edad, con un consentimiento informado por escrito y un diagnóstico de hipertensión pulmonar (HTP), pertenecientes al grupo de la clasificación de HTP. La definición de HTP usada en este estudio fue la presión arterial pulmonar media (PAPm) de ≥25mmHg en reposo, la presión de enclavamiento de los capilares pulmonares (PECP)≤15mmHg y la RVP>3unidades Wood. La disponibilidad de datos hemodinámicos diagnósticos fue uno de los criterios de inclusión.
Criterios de exclusiónPacientes con HTP que no pertenezcan a los grupos i o iv, pacientes que no podían leer y comprender los cuestionarios de CVRS, o los que no aceptaron participar en el estudio.
EvaluacionesLa CVRS se evaluó en el momento inicial y después de 6 meses usando los cuestionarios de salud autoadministrados Short Form 36 (SF-36) y EuroQoL-5D (EQ-5D). Los resultados de la CVRS fueron analizados de acuerdo con la clase funcional (CF), la distancia recorrida en 6min (DR6M), el tipo de enfermedad, el sexo, la edad (<50 años, ≥50 años), el tiempo desde el diagnóstico de HAP, el estado clínico, los pacientes que empeoraron/no empeoraron desde el momento inicial, los pacientes que murieron/recibieron un trasplante (o no) durante los 6meses del estudio, y los que recibieron distintos tratamientos para la HTP (terapia oral sola frente a terapia no oral) al inicio y tras los 6meses. Se definió como empeoramiento clínico cualquiera de las siguientes situaciones: a)muerte, trasplante de pulmón u hospitalización debido a un agravamiento de la enfermedad; b)empeoramiento de la CF, y c)cualquier aumento del tratamiento, incluyendo incrementos de las dosis o un cambio de fármaco debido a una impresión clínica de empeoramiento.
Este estudio cumplió todas las consideraciones éticas de la Declaración de Helsinki (1964) y sus enmiendas posteriores. Toda la información registrada se obtuvo siguiendo las directrices clínicas estándar y no se expuso a los pacientes a ninguna experimentación terapéutica ni diagnóstica. El estudio siguió las medidas de seguridad y confidencialidad estándar, cumpliendo exhaustivamente la legislación española relativa a la protección de datos (Ley Orgánica de 15/99). El Comité ético para la investigación médica del Hospital 12 de Octubre (Madrid) aprobó el presente trabajo como comité de referencia.
Análisis estadísticoSe usó la estadística descriptiva para todas las variables, incluyendo las mediciones de tendencia central y de dispersión para las variables cuantitativas, así como las frecuencias relativa y absoluta para las variables cualitativas, con intervalos de confianza (IC) del 95% en ambos casos. Se estudió el tipo de distribución de las variables cuantitativas, y su ajuste a la distribución de Gauss se evaluó usando el test de Kolmogorov-Smirnov. Para comparar los datos independientes de las variables descriptivas se utilizó la prueba t de Student para las variables cuantitativas; para las cualitativas se usó la prueba de chi-cuadrado o la de Mantel-Haenszel (en el caso de grupos de análisis con categorías ordenadas). La prueba t de Student se utilizó para las variables cuantitativas en el caso de los análisis con datos pareados (puntuaciones finales frente a las iniciales en las escalas). Para comparar los cambios en las puntuaciones de las escalas entre los datos independientes a partir de los distintos grupos, se realizó un análisis de covarianza (ANCOVA) ajustado para los valores iniciales. Se llevó a cabo un modelo de regresión lineal múltiple para buscar qué factores podrían influir potencialmente en las mediciones de CVRS. Las pruebas eran bilaterales, con un nivel de significación del 5%. Los datos fueron analizados usando el software estadístico SAS® 8.2 (SAS Institute, Cary, Carolina del Norte).
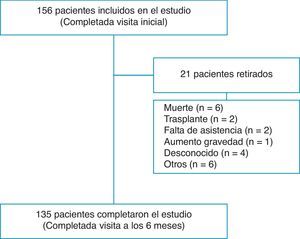
ResultadosFlujo de pacientes y demografía inicialCiento cincuenta y seis pacientes completaron la evaluación en la visita inicial y 135 (86,5%) completaron la visita de fin de estudio a los 6meses (fig. 1). Globalmente, el 70,5% eran mujeres, con una media de edad de 52,2 (17,2) años. Las categorías diagnósticas fueron las siguientes: 139 (89,2%) de HAP y 17 (10,8%) de HPTEC. Setenta y seis (48,7%) presentaron HAP idiopática (HAPI); 5 (3,2%), HAP hereditaria; 5 (3,2%), asociada a fármacos o ingestión de tóxicos; 2 (1,2%), enfermedad venooclusiva; 23 (14,7%), asociada a enfermedades del tejido conectivo (ETC); 8 (5,1%), HAP asociada a cardiopatías congénitas; 9 (5,7%), hipertensión portopulmonar; 6 (3,8%), asociada a una infección por el virus de inmunodeficiencia humana, y 17 (10,8%), a HPTEC. El 20% de pacientes fueron diagnosticados en los 12 meses anteriores al inicio del estudio y el 80% fueron diagnosticados con anterioridad. Durante el seguimiento de 6meses, 8 (5,1%) pacientes murieron o recibieron un trasplante de pulmón. Trece pacientes más no completaron el estudio por diferentes causas, tal como figura en la tabla 1.
Puntuaciones SF-36, de la escala visual analógica (EVA) del EQ-5D y la distancia recorrida en 6min (DR6M) estratificadas según las características iniciales de la población
| SF-36 PCS | SF-36 MCS | EQ-5D EVA (rango 0-100) | DR6M (metros recorridos) | |
| Clase funcional NYHA | ||||
| I | ||||
| n | 25 | 25 | 24 | 19 |
| Media (DE) | 46,5 (7,9) | 48,9 (7,6) | 71,5 (18,3) | 528,7 (67,5) |
| II | ||||
| n | 57 | 57 | 51 | 43 |
| Media (DE) | 39,5 (8,6) | 45,6 (9,2) | 62,1 (20,0) | 429,5 (77,8) |
| III | ||||
| n | 64 | 64 | 54 | 47 |
| Media (DE) | 33,7 (8,1) | 44,5 (9,3) | 51,7 (17,6) | 349,9 (109,0) |
| Valor de p | <0,0001 | >0,05 | <0,0001 | <0,0001 |
| Tipo de enfermedad | ||||
| HAPI | ||||
| n | 80 | 80 | 71 | 63 |
| Media (DE) | 38,8 (8,7) | 46,7 (7,7) | 59,3 (21,0) | 410,1 (119,4) |
| HAP-ETC | ||||
| n | 23 | 23 | 21 | 17 |
| Media (DE) | 31,3 (8,3) | 47,5 (9,9) | 52,6 (16,9) | 340,7 (115,9) |
| HPTEC | ||||
| n | 17 | 17 | 15 | 12 |
| Media (DE) | 38,8 (9,2) | 46,6 (8,8) | 64,8 (17,4) | 374,8 (94,5) |
| Valor de p | 0,0013 | >0,05 | >0,05 | >0,05 |
| Sexo | ||||
| Hombre | ||||
| n | 43 | 43 | 39 | 32 |
| Media (DE) | 40,2 (9,1) | 47,5 (7,1) | 56,0 (21,4) | 407,4 (116,8) |
| Mujer | ||||
| n | 102 | 102 | 89 | 75 |
| Media (DE) | 37,3 (9,6) | 45,6 (9,8) | 60,1 (20,3) | 402,9 (120,2) |
| Valor de p | >0,05 | >0,05 | >0,05 | >0,05 |
| Edad | ||||
| <50 años | ||||
| n | 66 | 66 | 59 | 49 |
| Media (DE) | 41,6 (7,8) | 47,3 (7,9) | 64,4 (17,9) | 467,9 (82,2) |
| ≥50 años | ||||
| n | 88 | 88 | 77 | 66 |
| Media (DE) | 35,3 (9,5) | 44,6 (9,8) | 54,9 (21,0) | 356,3 (115,8) |
| Valor de p | <0,0001 | >0,05 | 0,0057 | <0,0001 |
| Tiempo desde el diagnóstico inicial | ||||
| <1 año | ||||
| n | 37 | 37 | 33 | 30 |
| Media (DE) | 35,6 (9,7) | 44,0 (9,1) | 52,1 (17,8) | 376,0 (140,4) |
| 1-3 años | ||||
| n | 47 | 46 | 40 | 33 |
| Media (DE) | 37,1 (9,9) | 45,0 (10,3) | 60,6 (20,4) | 394,9 (93,9) |
| 4-6 años | ||||
| n | 30 | 30 | 28 | 25 |
| Media (DE) | 38,8 (8,5) | 46,0 (9,1) | 63,6 (21,7) | 408,7 (99,4) |
| ≥7 años | ||||
| n | 23 | 23 | 20 | 16 |
| Media (DE) | 43,1 (8,1) | 50,0 (6,9) | 65,0 (16,8) | 484,2 (85,2) |
| Valor de p | 0,0028 | 0,0183 | 0,0112 | 0,0036 |
| Empeoramiento/sin empeoramiento durante los primeros 6 meses desde el inicio | ||||
| Empeoramientoa | ||||
| n | 76 | 76 | 67 | 58 |
| Media (DE) | 37,0 (8,4) | 45,4 (8,5) | 58,2 (17,1) | 401,1 (107,1) |
| Sin empeoramiento | ||||
| n | 79 | 79 | 70 | 58 |
| Media (DE) | 38,8 (10,2) | 46,0 (9,7) | 59,4 (22,9) | 407,2 (125,1) |
| Valor de p | >0,05 | >0,05 | >0,05 | >0,05 |
| Muerte/trasplante durante los primeros 6 meses desde el inicio | ||||
| Muerte/trasplante | ||||
| n | 8 | 8 | 7 | 7 |
| Media (DE) | 31,4 (7,3) | 46,2 (4,6) | 43,9 (14,2) | 350,6 (120,8) |
| Sin muerte/trasplante | ||||
| n | 147 | 147 | 130 | 109 |
| Media (DE) | 38,3 (9,3) | 45,7 (9,3) | 59,7 (20,2) | 407,6 (115,4) |
| Valor de p | 0,0424 | >0,05 | 0,0436 | >0,05 |
| Terapia de la hipertensión pulmonar en la línea de base | ||||
| Terapia oralb | ||||
| n | 94 | 94 | 81 | 71 |
| Media (DE) | 38,0 (10,0) | 45,6 (9,0) | 57,5 (21,2) | 391,9 (132,2) |
| Terapia no oralc | ||||
| n | 51 | 51 | 47 | 37 |
| Media (DE) | 36,9 (7,5) | 46,5 (8,9) | 59,4 (17,7) | 415,0 (82,1) |
| Valor de p | >0,05 | >0,05 | >0,05 | >0,05 |
HAP-ETC: HAP asociada con una enfermedad del tejido conectivo; HAPI: hipertensión arterial pulmonar idiopática; HPTEC: hipertensión pulmonar tromboembólica crónica.
Se consideró que el paciente mostraba empeoramiento si se observaba algo de lo siguiente: retirada del estudio debido a la muerte, a un trasplante o a un ingreso por agravamiento de la enfermedad; aumento de la clase funcional; aumento del tratamiento con incremento de dosis o añadir nuevo fármaco.
La CF de los 152 pacientes visitados inicialmente se distribuyó de la siguiente manera: CFI, 25 (16,4%); CFII, 58 (38,2%); CFIII, 64 (42,1%), y CFIV, 5 (3,3%). La clase funcional en el momento inicial para los 21 pacientes que no completaron la visita a los 6meses fue la siguiente: CFI, 2; CFII, 7; CFIII, 9, y CFIV, 2 pacientes. Ocho de estos 21 murieron o recibieron un trasplante durante el periodo de estudio y presentaron la siguiente CF inicial: CFII, 2; CFIII, 4, y CFIV, 2 pacientes. La prueba DR6M fue de 404,1(115,9)m y 426(112,5)m en el momento inicial y tras 6meses de seguimiento, respectivamente.
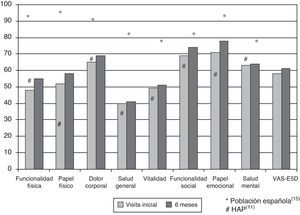
Resultados de la calidad de vida relacionada con la saludEn el momento inicial, el componente físico (PCS) medio (DE) del cuestionario SF-36, el componente mental (MCS) del SF-36, la escala visual analógica (EVA) del EuroQol 5D (EQ-5D) y la DR6M fueron de 37,9 (9,3), 45,7 (9,1) y 58,9 (20,2). Estas mediciones de la CVRS fueron considerablemente peores que las publicadas para la población normal. No se observaron cambios significativos al comparar los valores iniciales con los de los supervivientes tras 6 meses de seguimiento (fig. 2). El componente físico (SF-36 PCS) también resultó diferente de forma significativa entre las clases funcionales en la visita inicial (fig. 3) y se observaron valores de PCS progresivamente peores con un aumento de la CF (tabla 1). La figura 2 muestra que las diferencias observadas en cuanto a la CF en el SF-36 tuvieron lugar solamente en los dominios físicos, ya que los valores mentales del SF-36 no fueron significativamente diferentes entre los grupos en el momento inicial (p=0,0531;tabla 1). Se observó una asociación significativa (p<0,0001) en la visita inicial entre la percepción de los pacientes sobre su propio estado de salud en ese momento (escala visual analógica del EuroQol-5D [EQ-5DEVA]) y su clase funcional (tabla 1). En el análisis de regresión, cada aumento de una CF representa la pérdida de 4,0 en el componente físico del SF-36 y una pérdida de 9,5 en la escala visual analógica EQ-5DEVA. Además, con este modelo de regresión por pasos, cada aumento de un metro en la prueba de DR6M conlleva un aumento de 0,032 en el componente físico del SF-36.
Aunque no hubo diferencias significativas en el momento inicial respecto a la DR6M entre HAPI, hipertensión arterial pulmonar asociada a enfermedad del tejido conectivo (HAP-ETC) y HPTEC, sí se observaron diferencias estadísticamente significativas (p=0,0013) en el componente físico del SF-36 entre los tipos de enfermedad al inicio. Los pacientes con HAP-ETC obtuvieron puntuaciones peores que los pacientes con HAPI o HPTEC (tabla 1). Los pacientes con HAPI y HPTEC mostraron una mejoría modesta en el componente físico del SF-36 entre el momento inicial y los supervivientes en la visita a los 6 meses (+1,9, p=0,0149; +3,6, p=0,0421, respectivamente), pero no se dio ningún cambio significativo en los pacientes con HAP-ETC (p=0,7892).
Calidad de vida relacionada con la salud estratificada por resultados en el seguimiento a 6mesesOcho pacientes que murieron (6) o se sometieron a un trasplante de pulmón (2) durante el periodo del estudio presentaron una menor puntuación en el componente físico del SF-36 y del EQ-5D, pero sin diferencias en la DR6M de la visita inicial del estudio, en comparación con el resto de pacientes (tabla 1). La tabla 2 muestra la comparación entre 76 (48,7%) pacientes que empeoraron durante el periodo del estudio y 80 pacientes que no empeoraron. Únicamente se observó una pequeña diferencia en el componente físico inicial entre los grupos.
Comparación entre los pacientes que empeoraron y los que no empeoraron durante el seguimiento
| Empeoraron (n=76) | No empeoraron (n=80) | Valor de p | |
| Retirada del estudio | 9 (11,8%) | 12 (15%) | p=0,56 |
| CF (%): I, II, III, IV inicial | 9/25/38/2 | 16/33/26/3 | p=0,14 |
| CF (%): I, II, III, IV tras 6 meses de seguimiento | 7/32/25/6 | 21/31/17/3 | p=0,023 |
| PAPm (mmHg) | 50,7 (16,8) | 53,6 (19,1) | p=0,51 |
| PAPm (DE) mmHg | 15,1 (21,7) | 12,1 (14,3) | p=0,35 |
| RVP (DE) din/seg/cm–5 | 1.001 (661) | 1.048 (898) | p=0,74 |
| PCS inicial (DE) | 37 (8,4) | 38,8 (10,2) | p=0,28 |
| PCS tras seguimiento 6 meses (DE) | 38,2 (7,9) | 41,7 (10,2) | p=0,048 |
| MCS inicial (DE) | 45,4 (8,5) | 46 (9,7) | p=0,32 |
| MCS tras seguimiento 6 meses (DE) | 46,5 (10,1) | 47,7 (8,6) | p=0,84 |
| EQ-5D EVA inicial | 0,63 (0,19) | 0,67 (0,23) | p=0,19 |
| EQ-5D EVA tras seguimiento 6 meses | 0,68 (0,20) | 0,75 (0,21) | p=0,11 |
De los 156 pacientes evaluables iniciales, 119 (76,3%) estaban en tratamiento anticoagulante, 64 (41%) tomaban diuréticos, 39 (25%) usaban oxígeno en casa y 27 (17,3%), digoxina. No se observaron diferencias porcentuales en el uso de estos tratamientos a los 6meses. Una comparación entre los 117pacientes que en el momento de ser incluidos en el estudio estaban en tratamiento oral o inhalado frente a los 28pacientes que recibían tratamiento parenteral mostró que entre estos últimos se encontraba un mayor porcentaje de mujeres, eran más jóvenes y con peores parámetros hemodinámicos. En el grupo de tratamiento parenteral hubo más pacientes que fallecieron o recibieron un trasplante pulmonar durante los meses del estudio. Sin embargo, la comparación entre estos grupos de la CVRS en el momento inicial y a los 6 meses de seguimiento no presentó diferencias.
DiscusiónEn este estudio prospectivo hemos tratado de describir la evolución de la CVRS en una cohorte nacional española de pacientes con HAP o HPTEC. Se escogieron como instrumento de medida 2cuestionarios genéricos, el SF-36 y el EQ-5D, fundamentalmente porque han sido los más utilizados en los ensayos clínicos en HAP y también por la falta de disponibilidad de cuestionarios específicos de estas enfermedades desarrollados en castellano. Entre las ventajas de esta elección está que nos permite comparar con la población normal o con otras patologías graves. El primer resultado importante fue que la CVRS en la HAP y la HPTEC fue peor que en la población española normal15 y no cambió en los supervivientes a los 6meses de seguimiento. Un estudio australiano de una cohorte nacional de pacientes con HAP mostró también un deterioro en la CVRS, aunque en ese caso la población de pacientes incluida fue la que inició un tratamiento concreto16. Todos los pacientes con HAP incluidos estaban con tratamiento específico y, por ello, nuestro estudio sugiere que el impacto de los nuevos tratamientos para la HAP en la CVRS no es progresivo pero posiblemente es mantenido en el tiempo. Esta idea ya ha sido explorada previamente. Así, en un estudio de 177pacientes de HAP17, la CVRS mejoró de forma modesta tras la terapia con bosentán, y esta mejora se mantuvo estable durante 3meses. Este resultado contrasta con los resultados de CVRS en ensayos clínicos con fármacos específicos para HAP. De un total de 26ensayos clínicos publicados, 12 incluyeron la CVRS como criterio de valoración secundario6,18,19. De estos últimos, algunos midieron la CVRS utilizando un cuestionario específico para una enfermedad cardiovascular y solo unos pocos lo hicieron utilizando un cuestionario genérico. Las mediciones de la CVRS no variaron en 1/3 de estos estudios, aunque mejoraron moderadamente en el resto6,10,20. Por lo tanto, la ausencia de variación significativa de la CVRS a lo largo de los 6meses del estudio estaría en consonancia con la información previa. La mejor comparación posible de nuestros resultados la podemos hacer con el estudio SUPER10, donde se utilizaron los mismos cuestionarios en 278 pacientes y el SF-36 mostró resultados muy similares a los nuestros y alejados de la población española normal15.
Respecto a la CVRS en la HPTEC, ha sido evaluada en muy pocos estudios13,14, y ninguno de ellos con categoría de ensayo clínico. Un estudio japonés comparó 43pacientes tratados médicamente con 40pacientes tratados quirúrgicamente14. Las puntuaciones del SF-36 en el grupo tratado médicamente fueron muy parecidas a los resultados obtenidos en el presente estudio. Además, nuestros resultados apoyan la idea de que los pacientes con HPTEC atendidos por médicos dedicados a esta patología en España presentan una CVRS similar a la de los pacientes con HAP idiopática. Cuando analizamos las diferencias potenciales en el momento inicial entre los pacientes que empeoraron en el seguimiento con los pacientes que no empeoraron, no encontramos diferencias en los datos iniciales, incluyendo la CVRS. Este resultado pone de manifiesto las dificultades a la hora de establecer el pronóstico en los pacientes HAP o HPTEC. En este sentido, la información de la CVRS tiene una particular relevancia para ayudar a predecir qué pacientes morirán o precisarán un trasplante de pulmón en las próximas semanas o meses. En este estudio, este grupo de pacientes se presentó con una CVRS inicial peor que el resto de pacientes pero sin diferencias en la DR6M ni en la CF. Esta información es relevante e invita a profundizar en el diseño de nuevos estudios, ya que el valor de la CVRS como potencial predictor del pronóstico en la HAP y la HPTEC no está bien establecido en la literatura. Las diferencias en la CVRS observadas entre los pacientes que se mueren o necesitan un trasplante pulmonar y el resto no distan demasiado de la diferencia mínima relevante definida como el cambio más pequeño en la puntuación de la CVRS que se considera significativo para el paciente. El estudio más importante que intenta definir esta diferencia mínima relevante se realizó en la cohorte del estudio SUPER21. Los autores encontraron que la diferencia mínima importante para la escala de funcionalidad física del SF-36, rol de la funcionalidad social, de vitalidad y la DR6M fue de 13, 25, 21 y 15 puntos, y de 41m, respectivamente. Aunque el estudio cuenta con numerosas limitaciones reconocidas por los autores, incluyendo el hecho de que sea un análisis post-hoc en un estudio sin poder estadístico para este objetivo, es un primer punto de referencia para establecer diferencias mínimas relevantes de la CVRS en esta patología.
Se han asociado diversos condicionantes clínicos con el grado de afectación de la CVRS en estos pacientes, incluyendo el diagnóstico y la capacidad de ejercicio. Encontramos que los pacientes con HAP asociada a una ETC, sobre todo esclerodermia, experimentaron una CVRS peor que los pacientes con otras formas de enfermedad (tabla 2). A pesar de todas las medidas terapéuticas disponibles, estos pacientes no obtuvieron el mismo nivel de beneficios que los demás, y este hecho es coherente con el resto de estudios22-24. En nuestra cohorte, el componente físico del SF-36 y la puntuación de la escala visual análoga del EQ-5D se correlacionaron con la DR6M y las puntuaciones empeoraron a medida que la capacidad de ejercicio se iba reduciendo. Este resultado es coherente con los datos previamente publicados22,25 y apoya la idea de lo importantes que son estos parámetros clínicos en la práctica. Recientemente se ha observado una aceptable correlación entre los cambios en la DR6M y el componente físico del SF-36, lo cual ha servido como base para establecer en 33m la mínima diferencia clínicamente relevante en la DR6M26. Los pacientes diagnosticados en el año antes de la inclusión en el estudio presentaron una CVRS y una DR6M peores que los pacientes que fueron diagnosticados con anterioridad. Esto no se había estudiado previamente en la literatura, pero permite realizar especulaciones sobre las diferencias en la supervivencia entre los pacientes incidentes y los prevalentes. También formulamos la hipótesis que los pacientes con tratamiento parenteral complejo tendrían una CVRS peor que los que estaban con un tratamiento más simple. Sin embargo, no encontramos diferencias en la CVRS entre pacientes que estaban recibiendo tratamiento médico oral-inhalado u otro más invasivo. Este resultado, aunque sorprendente, es coherente con los estudios publicados12,23. Finalmente, es materia de especulación si esto refleja las diferencias en los factores que determinaron la elección de la terapia o si estos tratamientos diferentes tienen el mismo impacto sobre la CVRS.
El presente estudio cuenta con la limitación del seguimiento corto, de las pérdidas en el seguimiento y del uso únicamente de instrumentos genéricos para medir la CVRS. Además, debemos tener presente que el reclutamiento diseñado puede representar una limitación en la validez externa del estudio y, en teoría, no ser una buena representación de la población española de pacientes. Por último, en los futuros diseños será importante incluir cuestionarios específicos y un seguimiento más prolongado para poder conocer los pequeños cambios en la CVRS y su valor para tomar decisiones en estos pacientes.
En conclusión, nuestro estudio evalúa la CVRS sistemáticamente y su valor en un seguimiento a corto plazo en una cohorte nacional de pacientes con HAP y HPTEC. Confirmamos que existe una afectación grave a la CVRS en esos pacientes que varía poco en un plazo de 6meses. El resultado más relevante fue el hecho de que la CVRS medida usando instrumentos genéricos resulta peor en los pacientes que están al borde de la muerte. Será necesario realizar esfuerzos futuros y estudios prospectivos que incluyan, además de instrumentos genéricos, cuestionarios específicos para establecer definitivamente el valor de la CVRS como potencial predictor de los resultados en la HAP y la HPTEC.
Contribuciones de los autoresAR ha realizado contribuciones sustanciales a la concepción, el diseño, la recolección de los datos, el análisis de los datos y su interpretación, y la redacción del manuscrito; JAB ha realizado contribuciones a la recolección de datos, la interpretación de los datos y ha proporcionado una revisión crítica del manuscrito; JSR ha realizado contribuciones a la recolección de datos, la interpretación de datos y ha proporcionado una revisión crítica del manuscrito; RM ha realizado contribuciones al diseño, la recolección de datos, el soporte técnico y logístico, la interpretación de datos y ha proporcionado una revisión crítica del manuscrito; PE ha realizado contribuciones sustanciales a la concepción, el diseño, la recolección de datos, el análisis de los datos y su interpretación, y ha proporcionado una revisión crítica del manuscrito.
Conflicto de interesesEste estudio está patrocinado por Pfizer. La Sra. Rocío Muñoz actualmente trabaja en Laboratorios Pfizer, empresa que ha patrocinado este estudio. El resto de autores no tienen ningún conflicto de interés y han velado por asegurar la imparcialidad del artículo.
Los autores desean mostrar su agradecimiento a Xavier Masramon y Luz Samaniego por su contribución como estadísticos, a Josep Román por su contribución en la corrección crítica del manuscrito y a Silvia Martínez por su contribución en la revisión y el envío del artículo a la revista.
Hospital 12 de Octubre (Madrid), Hospital Arnau de Vilanova (Valencia), Hospital Clínic (Barcelona), Hospital de Cruces (Barakaldo, Bizkaia), Hospital de Galdakao (Galdakao, Bizkaia), Hospital de León (León), Hospital del Bierzo (Ponferrada, León), Hospital Dr. Negrín (Las Palmas de Gran Canaria), Hospital General Universitario de Alicante (Alicante), Hospital General Yagüe (Burgos), Hospital La Fe (Valencia), Hospital Marqués de Valdecilla (Santander), Hospital Miguel Servet (Zaragoza), Hospital Puerta de Hierro (Majadahonda, Madrid), Hospital Ramón y Cajal (Madrid), Hospital Reina Sofía (Córdoba), Hospital San Jorge (Huesca), Hospital Torrecárdenas (Almería), Hospital Universitario Dr. Peset (Valencia), Hospital Universitario Insular (Las Palmas de Gran Canaria), Hospital Universitario Virgen del Rocío (Sevilla), Hospital Vall d’Hebrón (Barcelona).