Un tercio de la población mundial presenta actualmente infección tuberculosa latente (ITL). En España la tuberculosis se sitúa como la tercera enfermedad de declaración obligatoria. La técnica habitual para el diagnóstico de ITL es la prueba de la tuberculina (PT), aunque su mayor problema es la especificidad, dado que las proteínas que utiliza no son específicas de Mycobacterium tuberculosis. En los últimos años se han investigado y aprobado nuevos métodos diagnósticos basados en la cuantificación in vitro de la respuesta inmune celular, los llamados interferon gamma release assays (IGRA). La diferencia fundamental con respecto a la PT es que detectan la liberación de interferón gamma en respuesta a antígenos tuberculosos específicos. En ausencia de una auténtica prueba de referencia para el diagnóstico de la infección tuberculosa es difícil establecer la sensibilidad y la especificidad de estas nuevas técnicas diagnósticas. Los IGRA han sido empleados en la detección de ITL en sujetos con alteración del sistema inmune (VIH, EEI, IRC, enfermedades reumatológicas) con buenos resultados. También están siendo muy utilizados en el estudio de contactos. En estudios recientes en los que se realizaron controles seriados sobre dichos test se observó que presentan conversiones y reversiones que ocurren después de la exposición a M. tuberculosis. A día de hoy y con los conocimientos actuales, parece que los IGRA pueden complementar la PT, pero no sustituirla.
One-third of the world-wide population currently presents latent tuberculosis infection (LTI). In Spain, TB is situated as the third disease of mandatory notification. The standard technique for the diagnosis of ITL is the tuberculin test (PPD), although its most important drawback is its specificity since the proteins used are not specific for Mycobacterium tuberculosis. In recent years, research has been done and new diagnostic methods have been approved based on the in vitro quantification of the immune cell response, the so-called interferon gamma release assays (IGRA). Compared with PPD, the main difference is that IGRAs detect the release of interferon-gamma in response to specific tuberculous antigens. In the absence of a true reference test for the diagnosis of tuberculosis infection, it is difficult to establish the sensitivity and specificity of these new diagnostic techniques. IGRAs have been used in the detection of ITL in subjects with immune system alterations (HIV, EEI, IRC, rheumatologic diseases) with good results. They are also being extensively used in the study of contacts. In recent studies involving serial controls of said tests, they were observed to present conversions and reversions that occur after exposure to M. tuberculosis. Today and with the current knowledge, it seems that IGRAs can complement PPD, but not substitute them.
Según datos de la Organización Mundial de la Salud (OMS)1, un tercio de la población mundial presenta actualmente infección tuberculosa latente (ITL). En 2006 hubo en el mundo más de 9.200.000 casos nuevos de tuberculosis (TBC), con una prevalencia de más de 14 millones de personas y casi 1,7 millones de muertes, lo que supone una letalidad del 18%. La OMS considera que la tasa de incidencia mundial de TBC ha alcanzado su pico alrededor de 2002 y que luego se ha estabilizado o ha comenzado a declinar, pero este hecho se ve contrarrestado por el aumento de la población, lo que hace que el número real de nuevos casos siga aumentando. En 2005 se notificaron en la región OMS de Europa 426.717 casos de TBC, con una tasa de incidencia de 48/100.000 habitantes, con una gran diferencia entre las distintas zonas del continente.
Tuberculosis en EspañaSegún los últimos datos publicados por la Red de Vigilancia Epidemiológica de España, a mediados de julio de 2009 ya se habían notificado 3.340 nuevos casos de TBC2.
Según datos provisionales publicados por este centro nacional, en 2009 se registraron 6.070 casos de TBC. Sin embargo, estas cifras deben considerarse con reservas, ya que a pesar de que la TBC es una enfermedad de declaración obligatoria, se estima que al menos una tercera parte de los casos no se notifican.
Población dianaLos datos de los que disponemos sobre la historia natural de la TBC sugieren que en los primeros dos años después de la infección por Mycobacterium tuberculosis, del 5 al 10% de los individuos infectados desarrollarán enfermedad tuberculosa3. Con una respuesta inmune adecuada por parte del individuo infectado, el bacilo puede permanecer inactivo durante décadas o incluso de por vida. Como consecuencia, el diagnóstico y el tratamiento de la infección tuberculosa serán más efectivos si se dirige a los individuos con mayor riesgo de progresión de infección a enfermedad tuberculosa, incluyendo individuos infectados recientemente y pacientes inmunodeprimidos4.
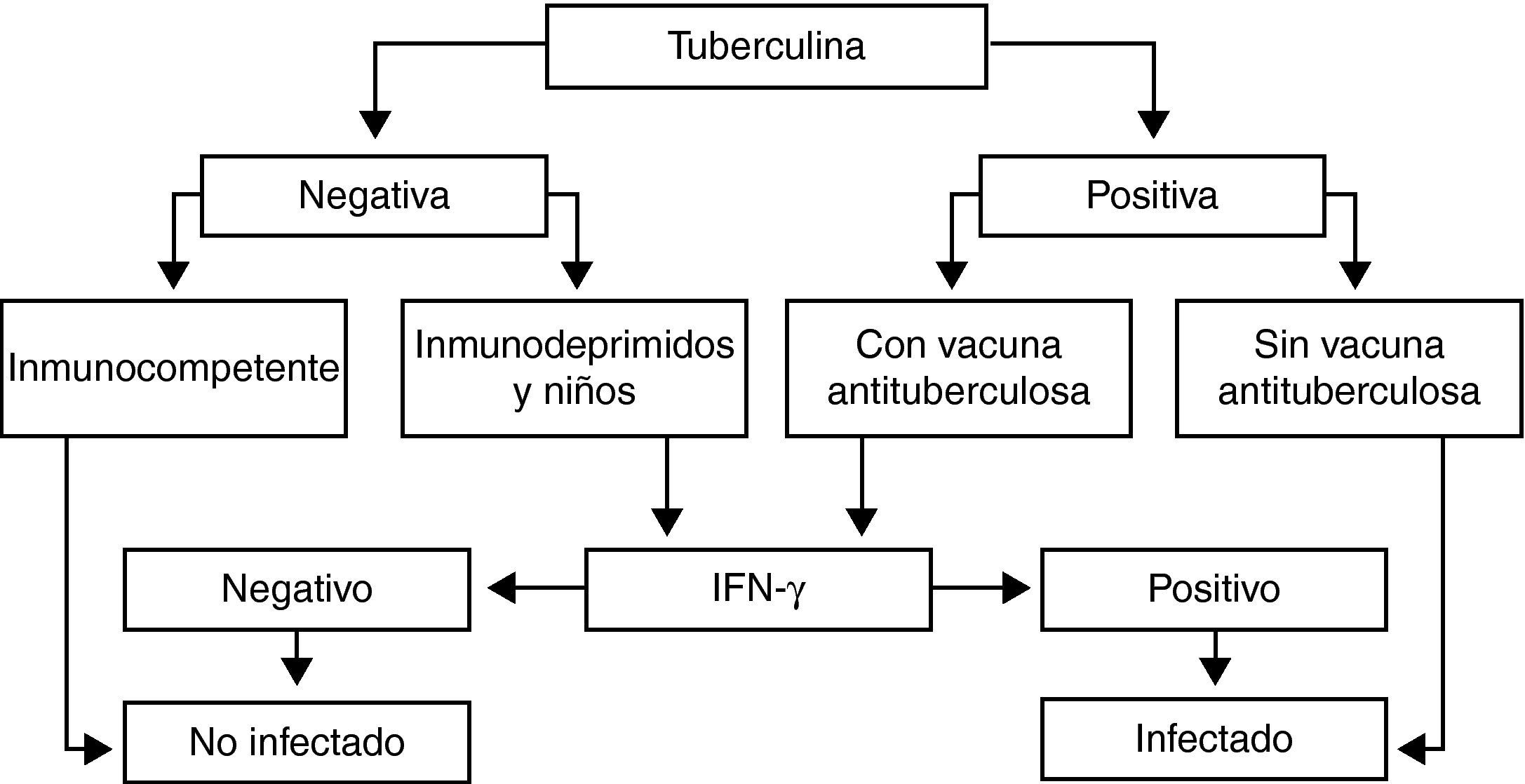
Diagnóstico de la infección tuberculosaLa técnica habitual para diagnosticar la infección tuberculosa es la prueba de la tuberculina (PT), que tras la inyección de un derivado proteico purificado (PPD) pone de manifiesto un estado de hipersensibilidad previo del organismo frente a dicha sustancia. La tuberculina utilizada en Europa es la PPD RT-23. En Estados Unidos existen dos preparaciones, Aplisol y Tubersol, ambas con respuesta similar a la RT-23. El principal inconveniente del PPD radica en que las proteínas utilizadas no son específicas del M. tuberculosis, sino que son compartidas con otras micobacterias no tuberculosas y M. bovis, hecho que disminuye la especificidad de dicha prueba.
Base inmunológicaEl individuo infectado por M. tuberculosis reacciona a la PT con una respuesta de hipersensibilidad retardada mediada por células (sobre todo linfocitos T), y a las 48-72h aparece una induración en la zona de la inyección. Esta respuesta de hipersensibilidad permanece de por vida, aunque puede verse disminuida en el anciano, así como en ciertas alteraciones clínicas. El hecho de realizarse PT de repetición en un individuo no sensibilizado no desencadena por sí mismo la respuesta inmunitaria.
Técnica empleadaLa técnica de Mantoux5 consiste en la inyección intradérmica con aguja del calibre 27 en la cara anterior del antebrazo de 2 unidades de tuberculina PPD RT-23 (0,1ml), en una zona donde no existan lesiones cutáneas. Para que la técnica sea correcta debe producirse una pápula de 6-10mm de diámetro en el momento de la inyección. Es el método más habitual para realizar la PT.
Lectura e interpretaciónA las 72h de la inyección se realiza la lectura midiendo el diámetro transversal de la induración según el eje longitudinal del antebrazo. El resultado se registra en milímetros. En el caso de no existir induración sino únicamente eritema, se interpreta como 0mm.
Según la Sociedad Española de Neumología y Cirugía Torácica (SEPAR), se considera positiva una induración6
- -
En personas no vacunadas ≥5mm.
- -
En personas vacunadas con BCG se plantea el problema de discernir ante una induración tuberculínica si se debe a una infección tuberculosa, o bien a una respuesta a antígenos compartidos con la vacuna BCG (M. bovis BCG). En esta situación se tienen en cuenta determinadas condiciones clínicas, considerando PT positiva con diámetro ≥5mm si además de vacunados son convivientes o mantienen contactos frecuentes con pacientes bacilíferos, si presentan radiografía de tórax con lesiones sugestivas de TBC antiguas y que nunca hubieran sido tratados, si están infectados por VIH o si son enfermos de neumoconiosis.
- -
En el resto de vacunados con BCG, se considera infección y no reacción secundaria a la vacuna si el tamaño de la induración es >15mm. En general, la reacción vacunal no suele producir induraciones de más de 14mm, y se considera que cuanto mayor sea el tamaño y más tiempo haya pasado desde la vacunación, más probable será que se deba a una infección tuberculosa y no a una reacción vacunal (los estudios en este sentido indican que la interferencia de la BCG sobre la reacción tuberculínica puede ser escasa pasados 10-15 años desde la vacunación)4.
Cuanto mayor sea la probabilidad de estar infectado o de desarrollar la enfermedad —por ejemplo en los casos de contactos recientes o de infectados por el VIH—, menos debe influir el antecedente de la vacunación en la interpretación de la prueba. En pacientes infectados por el VIH, una PT <5mm no excluye el diagnóstico de infección, ya que puede deberse a la situación de anergia por el compromiso inmunitario.
Las reacciones tuberculínicas con vesículas o necrosis en la zona de inoculación también se consideran indicativas de infección tuberculosa, independientemente del tamaño de la induración o del antecedente vacunal.
Cuando se trata de un estudio de contactos la interpretación se simplifica bastante, ya que no se debe tener en cuenta el antecedente vacunal y habrá que considerar una induración ≥5mm como indicativa de infección tuberculosa.
En la tabla 1 se resumen las situaciones que pueden provocar falsos positivos de la prueba.
Falsos positivos de la prueba de la tuberculina
| 1. Individuos vacunados con BCG |
| 2. Infección por micobacterias ambientales oportunistas (MAO) |
| 3. Individuos no sensibilizados a Mycobacterium tuberculosis que reciben transfusiones sanguíneas de personas sensibilizadas |
| 4. Rotura de vaso o infección en la zona de inyección |
Existen determinadas circunstancias dependientes del individuo que pueden desencadenar falsos negativos de la PT, tales como una infección viral concurrente, vacunaciones con virus vivos, situaciones de inmunosupresión o tratamiento con fármacos que disminuyan la respuesta inmunitaria.
En la tabla 2 se resumen las situaciones que podrían conllevar falsos negativos de la prueba.
Falsos negativos de la prueba de la tuberculina
| Relacionado con el individuo al que se le realiza la PT |
| 1. Infecciones víricas: VIH, varicela, sarampión, parotiditis |
| 2. Infecciones bacterianas: fiebre tifoidea, brucelosis, lepra, tos ferina, |
| tuberculosis pleural y diseminada |
| 3. Infecciones fúngicas: blastomicosis |
| 4. Vacunaciones con virus vivos: sarampión, parotiditis, varicela |
| 5. Alteraciones metabólicas: insuficiencia renal crónica |
| 6. Alteraciones del estado proteico: depleción proteica severa, |
| afibrinogenemia |
| 7. Enfermedades de los órganos linfoides: linfomas, leucemia linfocítica |
| crónica, sarcoidosis |
| 8. Fármacos: corticoides y otros inmunosupresores |
| 9. Edad: recién nacidos y ancianos |
| 10. Situaciones de estrés: cirugía, quemados, enfermedad mental, reacción |
| injerto contra huésped |
| Relacionado con la tuberculina utilizada |
| 1. Almacenamiento inadecuado (exposición a la luz y al calor) |
| 2. Diluciones inapropiadas |
| 3. Desnaturalizaciones químicas |
| 4. Contaminación |
| 5. Adsorción (parcial control con Tween 80) |
| Relacionado con el método de administración |
| 1. Inyección de cantidad insuficiente |
| 2. Inyección subcutánea |
| 3. Administración tardía una vez extraída del vial |
| 4. Inyección muy superficial con rotura de la vesícula formada y pérdida del |
| líquido |
| 5. Inyección en una zona inflamada y vascularizada difundiendo el líquido |
| Relacionado con la lectura |
| 1. Inexperiencia del lector |
| 2. Lectura inadecuada |
En algunos individuos, fundamentalmente en personas mayores infectadas años antes o en personas vacunadas en la infancia, una primera PT puede ser negativa y al repetirla 7-10 días después hacerse positiva. Este fenómeno (booster o de empuje) consiste en que la primera PT puede tener un efecto recuerdo en el sistema inmunitario, y que tras una segunda prueba se produzca la respuesta inmunitaria. Se considera que el resultado definitivo de la prueba es el de la segunda lectura.
Se denomina conversión tuberculínica a la situación en la que un individuo con PT conocida como negativa pasa a ser positiva. Representa la adquisición de una infección tuberculosa reciente y se define como «convertor». De forma operativa se lo define como el individuo que pasa de tener una tuberculina <5mm a ≥5mm, con una diferencia de al menos 5mm en menos de 2 años.
La PT, como toda prueba diagnóstica, tan solo debería ser usada en personas en las que de su resultado pueda derivarse una intervención terapéutica3. En la TBC solo existen dos posibilidades de intervención terapéutica: tratamiento de los enfermos, y quimioprofilaxis o tratamiento preventivo de los infectados con alto riesgo de desarrollar TBC.
En la tabla 3 se exponen las indicaciones de la PT según la SEPAR6.
Indicaciones de la prueba de tuberculina
| 1. Individuos con sospecha clínica de enfermedad tuberculosa |
| 2. Individuos con alto riesgo de progresión de infección a enfermedad tuberculosa debido a sus condiciones médicas: VIH, ADVP, tratamiento inmunodepresor, silicosis, diabetes mellitus, enfermedades malignas hematológicas, insuficiencia renal crónica, alcoholismo, desnutrición, gastrectomía, receptor de órgano sólido |
| 3. Individuos con riesgo social si desarrollan tuberculosis: personal sanitario, trabajadores de prisiones, educadores, personal de laboratorio, inmigrantes procedentes de países con altas tasas de infección |
| 4. Individuos con lesiones no evolutivas en radiología de tórax sugestivas de tuberculosis |
| 5. Estudios epidemiológicos |
| 6. Individuos en riesgo de infección reciente. Contacto de TBC |
En la población general no sintomática no está aconsejada su utilización como método de cribado.
En los últimos años se han investigado y aprobado nuevos métodos diagnósticos basados en la cuantificación in vitro de la respuesta inmune celular. Estos métodos, denominados genéricamente en la literatura anglosajona con el acrónimo de IGRA (interferon gamma release assays), detectan la liberación de interferón gamma en respuesta a antígenos tuberculosos específicos7.
Respuesta inmune frente a la infección tuberculosaEl interferón gamma es una molécula importante para el control de la infección tuberculosa, y su participación es imprescindible en la respuesta inmune protectora frente a dicho microorganismo. Esta citoquina, producida por los linfocitos T CD4+, CD8+ y NK, activa los macrófagos infectados, con la consiguiente liberación de IL-1 y TNF-α, que limitan el crecimiento y la multiplicación de las micobacterias. Los individuos con deficiencias en los receptores o en los genes que codifican la síntesis de esta molécula son más susceptibles de padecer infecciones micobacterianas con mayor frecuencia y de mayor gravedad.
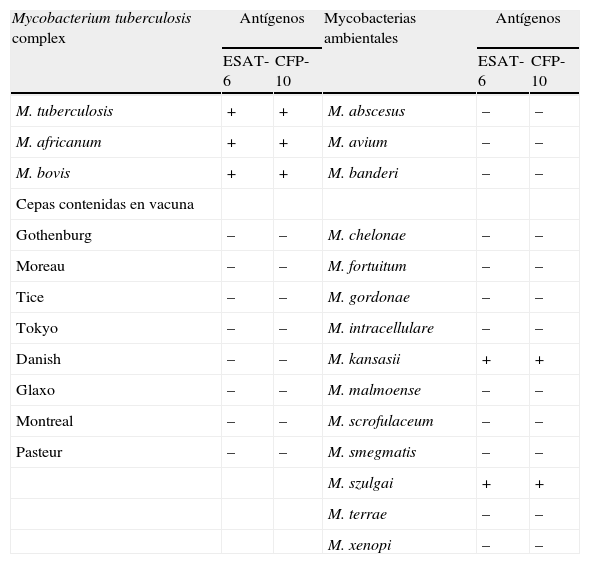
Técnicas de determinación de IGRAExisten dos técnicas comercializadas para el diagnóstico in vitro de la infección tuberculosa: el QuantiFERON-TB-Gold In Tube (Cellestis®, Victoria, Australia)8 y el T-SPOT.TB (Oxford Immunotec®, Oxford, Reino Unido)9. La primera generación de QuantiFERON-TB, aprobada por la Food and Drug Administration (FDA) en el año 2001, detectaba la liberación de interferón gamma en respuesta a PPD. En el año 2004, la FDA aprobó la segunda generación de esta prueba diagnóstica, denominada QuantiFERON-TB Gold, que, a diferencia de la primera generación, no utilizaba como antígenos micobacterianos el PPD, sino péptidos sintéticos que simulan antígenos más específicos, como son el Early Secreted Antigenic Target-6 (ESAT-6) y el Culture Filtrate Protein-10 (CFP-10). Estas dos moléculas están codificadas por la región RD-1 del genoma del M. tuberculosis e incrementan significativamente la especificidad con respecto al PPD. Estos antígenos están ausentes en M. bovis BCG y en la mayoría de las micobacterias no tuberculosas (excepto M. kansasii, M. marinum, M. szulgai) (tabla 4).
Especificidad de especie ESAT-6 y CFP-10 en las micobacterias
| Mycobacterium tuberculosis complex | Antígenos | Mycobacterias ambientales | Antígenos | ||
| ESAT-6 | CFP-10 | ESAT-6 | CFP-10 | ||
| M. tuberculosis | + | + | M. abscesus | – | – |
| M. africanum | + | + | M. avium | – | – |
| M. bovis | + | + | M. banderi | – | – |
| Cepas contenidas en vacuna | |||||
| Gothenburg | – | – | M. chelonae | – | – |
| Moreau | – | – | M. fortuitum | – | – |
| Tice | – | – | M. gordonae | – | – |
| Tokyo | – | – | M. intracellulare | – | – |
| Danish | – | – | M. kansasii | + | + |
| Glaxo | – | – | M. malmoense | – | – |
| Montreal | – | – | M. scrofulaceum | – | – |
| Pasteur | – | – | M. smegmatis | – | – |
| M. szulgai | + | + | |||
| M. terrae | – | – | |||
| M. xenopi | – | – | |||
En la actualidad ya se comercializa la tercera generación de esta prueba, denominada QuantiFERON-TB Gold In Tube (QFT-GIT), que incorpora un tercer antígeno micobacteriano: el TB 7.7, y tubos específicamente diseñados para esta prueba en los que debe recogerse la muestra de sangre (tabla 5).
Criterios de interpretación para el T-SPOT.TB (T-Spot)
| Control nuloa | Respuesta a TBb | Respuesta a mitógenoc | |
| Positivod | ≤10 manchas | ≥8 manchas | Cualquiera |
| Borderlinee | ≤10 manchas | 5, 6, o 7 manchas | Cualquiera |
| Negativof | ≤10 manchas | Cualquiera | ≤4 manchas |
| Indeterminadoe | >10 manchas≤10 manchas | <5 manchas | Cualquiera<20 manchas |
Basado en Oxford Immunotec Limited©.
El número de manchas resultantes de la incubación de células mononucleares de sangre periférica (PBMC) en medio de cultivo sin antígenos.
Número de manchas que resulta de la estimulación de PBMC con dos grupos por separado de los péptidos ESAT-6 y CFP-10 menos el control nulo.
- 1.
QFT-GIT. Para realizar la prueba se emplean 3 tubos específicos que se sirven con el kit de reactivos (uno de los tubos incluye los antígenos tuberculosos específicos ESAT-6, CFP-10, TB 7.7 —tubo problema—; otro contiene fitohemaglutinina —tubo control positivo—, y el tercero no contiene reactivos —tubo control negativo—). Se precisan en total 3ml de sangre (1ml por tubo) y la sangre es extraída directamente en los propios tubos. Posteriormente, y previa agitación de los tubos, se lleva a cabo la incubación de éstos durante 18-22h en estufa a 37°C, tras lo cual los tubos se centrifugan y el plasma obtenido se emplea para realizar el enzimoinmunoensayo que permite detectar y cuantificar el interferón gamma liberado por los linfocitos del paciente. Este paso puede realizarse de manera manual o totalmente automatizado. Después de la incubación, el plasma puede almacenarse varias semanas sin que se afecten los resultados, lo que, si fuera necesario, facilitaría la organización de la carga de trabajo del laboratorio. La técnica emplea software específico para la emisión de los resultados.
- 2.
T-SPOT.TB. Para realizar la prueba se emplean 8-10ml de sangre heparinizada. En el laboratorio, y siguiendo las indicaciones del fabricante, debe separarse la capa mononuclear, que tras los lavados oportunos y un posterior recuento de las células presentes, permitirá ajustar el número de células a una cantidad de 250.000 células/ml. Esta cantidad será la que se utilizará como inóculo de los 4 pocillos de los que consta esta prueba (2 pocillos contendrán los antígenos ESAT-6 y CFP-10, y los otros 2 se destinarán a control positivo y negativo, respectivamente). La placa se incubará 18-22h a 37°C en estufa de CO2, tras lo cual se procede a realizar el inmunospot, que permite cuantificar el número de células productoras de interferón (lo que se evidencia como número de manchas o spots; cada mancha representa la huella de un linfocito T individual secretor de interferón). Un algoritmo de interpretación facilitado por el fabricante posibilita la emisión de los resultados. Técnicamente, T-SPOT.TB, requiere más sangre, mayor tiempo de preparación y es más laborioso de realizar que QFT-GIT, y además no permite trabajar con las muestras de manera diferida. Las guías recomendadas por los fabricantes de estas pruebas para su interpretación se muestran en las tablas 5 y 68,9.
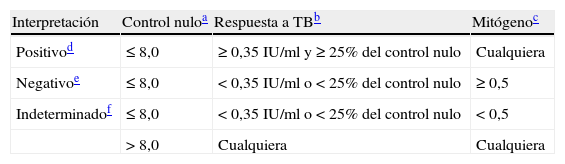
Tabla 6.Criterios de interpretación para el QuantiFERON-TB Gold In Tube Test (QFT-GIT)
Interpretación Control nuloa Respuesta a TBb Mitógenoc Positivod ≤8,0 ≥0,35 IU/ml y ≥25% del control nulo Cualquiera Negativoe ≤8,0 <0,35 IU/ml o <25% del control nulo ≥0,5 Indeterminadof ≤8,0 <0,35 IU/ml o <25% del control nulo <0,5 >8,0 Cualquiera Cualquiera Basado en Cellestis Limited. QuantiFERON-TB Gold©.
Las nuevas técnicas de diagnóstico in vitro de la infección tuberculosa ofrecen importantes ventajas sobre la PT: no presentan interferencias con la vacuna BCG, se evita la subjetividad de la interpretación, evitan la visita de lectura, e incorporan un control positivo que proporciona valiosa información a la hora de interpretar una prueba, aparentemente negativa, como verdadera negativa o indeterminada como resultado de errores técnicos o por la inmunosupresión.
Sensibilidad y especificidadEn ausencia de una auténtica prueba de referencia para el diagnóstico de la infección tuberculosa, es difícil establecer la sensibilidad y la especificidad de estas nuevas técnicas diagnósticas.
Para solventar el problema de la sensibilidad se han utilizado tres estrategias: 1) Evaluar a los pacientes que tienen una TBC activa y por lo tanto deben estar infectados. 2) Evaluar a los individuos que han estado en contacto con pacientes tuberculosos y estratificarles en función del grado de exposición. 3) Analizar la concordancia entre las pruebas de determinación de IGRA y la PT10,11.
Rendimiento clínico de las técnicas de determinación de IGRA en pacientes inmunocompetentesUna faceta importante de la transmisión de la TBC es que el riesgo de contagio está determinado principalmente por la frecuencia, la duración y la proximidad del contacto con la persona diagnosticada de enfermedad tuberculosa. Por lo tanto, una nueva técnica diagnóstica que sea considerada como más sensible y específica que la PT debería estar más estrechamente relacionada con el nivel de exposición y ser independiente del estado de vacunación (BCG). Esta teoría ha sido utilizada para comparar el grado de precisión de las técnicas de determinación de los IGRA respecto a la PT en los estudios de contactos11,12, concluyendo que estas nuevas técnicas se correlacionan igual o incluso mejor que la PT, siendo además independientes de la BCG.
En uno de los mayores estudios publicados hasta la fecha, en el que se incluyeron 535 sujetos12, los resultados de QTF-GIT y T-SPOT.TB no se vieron interferidos por el antecedente de la vacunación con BCG, lo que sí ocurría con la tuberculina, y esto evidencia una mayor especificidad de los mismos. Además, los IGRA también se correlacionaron mejor con la exposición a la enfermedad TBC13-18. En uno de los estudios llevado a cabo en niños expuestos18 se encontró una relación dosis-respuesta entre la carga de bacilos en el esputo y la positividad de los IGRA. Los que habían estado en contacto con los pacientes con mayor carga de bacilos en esputo tuvieron con mayor frecuencia prueba de tuberculina e IGRA positivos19-22.
Rendimiento clínico de QTF-GIT y T-SPOT.TB en pacientes inmunocomprometidosTuberculosis y VIHLa TBC se ha convertido en la causa más importante de coinfección en los pacientes infectados por el VIH, situación que afecta aproximadamente a 13 millones de personas en el mundo1. En África la TBC es la principal causa de muerte en pacientes infectados por el VIH, y además es la enfermedad más frecuente en los pacientes con sida que están en tratamiento con antirretrovirales. La detección de ITL es crucial en personas infectadas por VIH porque tienen una tasa más elevada de progresión a enfermedad tuberculosa que las personas no infectadas, aunque estén en tratamiento antirretroviral.
El diagnóstico de ITL en pacientes infectados por el VIH se ha basado tradicionalmente en la PT, que, además de los inconvenientes citados anteriormente, añade en estos pacientes una importante tasa de anergia23,24.
En comparación con la PT, los datos sobre la generación actual de las técnicas de determinación de IGRA sugieren mayor especificidad25, menor número de falsos positivos debido a vacunación previa con BCG26 y una mayor sensibilidad en poblaciones con baja incidencia de TBC27. Sin embargo, existen pocos datos que describan el rendimiento de los IGRA en personas infectadas por VIH, cuya alteración de la inmunidad puede afectar al rendimiento de estas pruebas, que se basan en la activación de linfocitos28.
En cuanto al rendimiento diagnóstico de IGRA en infectados por el VIH, una serie de estudios han añadido consistencia a la mayor sensibilidad de T-SPOT.TB sobre la PT. Un reciente estudio23 encontró que el T-SPOT.TB era más sensible que la PT y se correlacionaba mejor con TBC activa.
En lo que se refiere a la cifra de CD4, varios autores29 encontraron un número de resultados indeterminados que guardaban relación con la cifra de CD4 del paciente. Así, la tasa de resultados indeterminados en pacientes con CD4≥100células/mm3 fue del 3%, mientras que para los pacientes con CD4<100 células/mm3 fue del 24%. Si tenemos en cuenta la carga viral, el número de resultados indeterminados se incrementa de forma proporcional al aumento de la misma. Así, por ejemplo, en pacientes con carga viral indetectable se obtenían un 15% de resultados indeterminados. En los pacientes considerados como categoría 2 (1log-4log RNA HIV copias/ml) se obtuvieron un 17% de resultados indeterminados; en la categoría 3 (4log-7log RNA HIV-1 copias/ml) fue del 28%30,31
Enfermedad inflamatoria intestinalLa enfermedad inflamatoria intestinal (EII) abarca un grupo heterogéneo de trastornos que cursan con inflamación crónica de la mucosa gastrointestinal. Hasta un tercio de los pacientes con EII padecerán una forma grave de la enfermedad que precisará del uso de fármacos inmunomoduladores o de agentes biológicos para el control de la respuesta inapropiada del sistema inmune en estos pacientes. El factor de necrosis tumoral alfa (TNF-α) es una citoquina proinflamatoria que juega un papel importante en la patogénesis de la EII. El infliximab (IFX), un anticuerpo monoclonal IgG1 que se une específicamente al TNF-α, ha demostrado ser efectivo a la hora de inducir y mantener la remisión tanto en la enfermedad de Crohn como en la colitis ulcerosa.
En 2001 la FDA informó de 70 casos de TBC de los 147.000 pacientes tratados con IFX en todo el mundo, tanto para EII como para la artritis reumatoide. Dos tercios de los casos se encontraban en Europa, y España era el país europeo con el mayor número de pacientes afectados32. La mayoría tenían una localización extrapulmonar, con enfermedad diseminada en el 24% de los casos. Este tipo de enfermedad tuberculosa se asocia con inmunodepresión, lo que sugiere que el TNF-α juega un importante papel en la respuesta del huésped frente a la TBC, que incluye la formación de granulomas33. Dado que la mayoría de los casos aparecieron después de empezar tratamiento con IFX, que la prevalencia de la TBC en sus países de origen era baja y que no habían estado expuestos recientemente a enfermos diagnosticados de TBC, concluyeron que la TBC se produjo por la reactivación de una ITL34. Estos hallazgos sustentan la recomendación de adoptar medidas para descartar la existencia de ITL, previamente a la instauración de tratamiento con anticuerpos anti-TNF-α. En nuestro país el Grupo Español para la Enfermedad de Crohn y la Colitis Ulcerosa (GETECCU) publicó sus propias recomendaciones35 en 2003, que se revisaron36 en 2006, según las cuales los pacientes diagnosticados de ITL deberían recibir tratamiento con isoniazida antes de iniciar tratamiento con fármacos biológicos. Los resultados obtenidos hasta el momento muestran una importante disminución de casos de TBC dentro de esta población37-39.
Enfermedades reumatológicasLos pacientes con enfermedad reumática inflamatoria crónica tienen un elevado riesgo de TBC, que se ha incrementado aún más tras la incorporación de la terapia biológica. En la mayoría de los casos la enfermedad se produce como consecuencia de la reactivación de una infección latente, de ahí que su incidencia varíe considerablemente en función de la prevalencia de infección en el área estudiada.
La práctica de cribado sistemático tanto de infección como de enfermedad tuberculosa previo al inicio de la terapia biológica ha permitido reducir la incidencia de TBC en esta población. La experiencia de la cohorte española de pacientes tratados con agentes biológicos (BIOBADASER), de la Sociedad Española de Reumatología, muestra una reducción de los casos de TBC desde la implantación de las recomendaciones oficiales en 2002, respecto a la época previa (117 contra 522 casos/100.000 personas-año, respectivamente). Sin embargo, hay que reseñar un incremento importante en el uso de etanercept (proteína humana compuesta por el receptor p75 del factor de necrosis tumoral y la porción Fc de la IgG1 humana) durante el segundo período del estudio, en detrimento de IFX, lo cual podría explicar parte de la reducción de la incidencia. Aun asumiendo la efectividad de esas medidas, la incidencia de TBC en ese colectivo de pacientes continúa siendo casi cinco veces superior a la de la población general española. Varias causas podrían explicar este hecho: aplicación inadecuada de los protocolos, falta de cumplimiento del tratamiento de la infección tuberculosa, que se trate de una reinfección exógena, y las limitaciones de la PT para diagnosticar infección latente en el contexto clínico de estos pacientes.
Resultados con IGRA en la enfermedad inflamatoria intestinal y en enfermedades reumatológicasLa experiencia con IGRA en el diagnóstico de ITL en las enfermedades mediadas por mecanismo inflamatorio es todavía bastante limitada y procede de estudios a pequeña escala de tipo transversal centrados en evaluar la concordancia entre la PT y los IGRA, sin correlacionar los resultados con los factores de riesgo para la infección tuberculosa. En ellos se concluye que la concordancia entre la PT y los IGRA es baja y que los resultados discordantes PT(+), IGRA(–) tienen su origen en la vacunación previa con BCG37-41.
En lo que se refiere a la correlación entre IGRA y factores de riesgo para TBC, en un reciente estudio realizado sobre 142 pacientes con enfermedad mediada por mecanismo inflamatorio37, los IGRA estaban más estrechamente relacionados con factores de riesgo para ITL que la tuberculina. Además, la positividad de la PT se correlacionó con la vacunación previa con BCG, no así los IGRA. Martin et al.39 compararon los dos test IGRA en pacientes con artritis reumatoide y observaron que tanto QTF-GIT como T-SPOT.TB se correlacionaban con factores de riesgo para TBC.
Basándose en la evidencia actual se puede concluir que, en pacientes con enfermedad inflamatoria mediada por mecanismo inmune que siguen un tratamiento inmunosupresor, la especificidad de los IGRA es mayor que la de la PT.
Insuficiencia renal crónicaLos pacientes con insuficiencia renal crónica (IRC) que precisan hemodiálisis o diálisis peritoneal son un ejemplo de población que manifiesta característicamente anergia cutánea a los antígenos de la PT y que tiene un alto riesgo de desarrollar TBC activa42-45, aproximadamente de 10 a 25 veces mayor para la reactivación de una ITL en comparación con la población general46-48. Por otra parte, las unidades de hemodiálisis son lugares donde la TBC podría diseminarse con mayor facilidad49.
Se sabe que la IRC se asocia con numerosas alteraciones del sistema inmune, la mayoría relacionadas con la alteración de la inmunidad celular50,51. Entre ellas se encuentra la disminución en la respuesta proliferativa de los linfocitos, la deficiencia de interleucina-2, el déficit de linfocitos B periféricos y el aumento de la apoptosis celular52-54. En un estudio reciente sobre 203 pacientes con IRC sometidos a hemodiálisis55 se compararon tres modalidades de diagnóstico para la infección TB (PT, T-SPOT.TB y valoración por expertos). La PT mostró una sensibilidad muy baja y solo presentó positividad en uno de cada cinco pacientes. El T-SPOT.TB fue positivo en aproximadamente tres de cada cuatro pacientes con factores de riesgo para padecer ITL. La sensibilidad, avalada por el panel de expertos que confirmaron los casos de ITL, se aproximó al 75%.
En relación con la diálisis peritoneal, en el estudio realizado por Palomar et al.56 se refiere que estas nuevas técnicas miden un tipo de respuesta inmunitaria diferente a la que interviene en la respuesta de hipersensibilidad retardada a la PT, y a diferencia de lo que ocurre en el estudio de contactos, en los pacientes inmunodeprimidos es tan importante la infección tuberculosa reciente como la remota, concluyendo que los IGRA complementan la PT, ya que la realización de ambas simultáneamente aumenta la probabilidad diagnóstica de TBC.
Valor de QTF-GIT y T-SPOT.TB en la predicción del desarrollo de enfermedad tuberculosaPara una persona con una PT positiva, el riesgo de desarrollar TBC activa se estima del 5 al 10%57. Sin embargo, existen muy pocos estudios longitudinales que nos permitan concluir la capacidad de los IGRA para predecir el riesgo de desarrollar TBC activa.
En un estudio realizado en Alemania que contó con la participación de 601 contactos cercanos a personas con baciloscopia positiva y cultivo positivo para M. tuberculosis, el QFT-GIT obtuvo un mejor rendimiento en la predicción de TBC activa58 que la PT, utilizando un punto de corte de 5mm. Cinco (2,3%) de los 219 contactos con induración ≥5mm en la PT desarrollaron TBC, mientras que seis (14,6%) de los 41 contactos con resultados positivos para QFT-GIT desarrollaron la enfermedad (p=0,003). Sin embargo, una proporción inusualmente grande (59%) de los contactos tenían una induración (PT) que iba desde los 5 a los 9mm. La proporción de los que se consideran positivos por PT con un corte de 10mm que desarrollaron TBC activa (5 de los 90 [5,6%]) fue similar a la proporción positiva de QFT-GIT (6 de 41 [14,6%], p=0,1). Además, solo dos de los 6 contactos con resultados positivos GIT-QFT que desarrollaron TBC activa tuvieron el diagnóstico confirmado mediante cultivo. En otro estudio, la sensibilidad para predecir la posterior TBC activa no fue significativamente diferente para las dos pruebas59.
Otro estudio sobre 339 inmigrantes en los Países Bajos dio como resultado que la PT y el QFT GIT tienen un valor similar en la predicción de TBC activa60. Se realizó un seguimiento durante 2 años a los contactos cuya PT fue ≥5mm entre los 0 y 3 meses después del diagnóstico del paciente índice. Nueve (3,1%) de 288 contactos con PT ≥10mm desarrollaron TBC activa, frente a 7 (3,8%) de 184 con PT ≥15mm, 5 (2,8%) de 178 con un resultado positivo QFT-GIT, y 6 (3,3%) de 181 con un T-SPOT.TB positivo desarrollaron a su vez la enfermedad. La sensibilidad para la detección del desarrollo de TBC activa en el curso del período de seguimiento fue del 100% para una PT con un punto de corte de 10mm, del 88% para una PT con un punto de corte de 15mm, del 63% para QFT-GIT, y del 75% para T-SPOT.TB. A pesar de que la PT con un punto de corte de 10mm identificaba el mayor número de contactos que desarrollaron TBC activa (9 de 9 [100%]), y QFT-GIT identificaba el menor número de contactos que desarrollaron TBC activa (5 de 9 [63%]), la sensibilidad de las dos pruebas no fue estadísticamente diferente (p=0,08).
Como conclusión, los IGRA, en lo que se refiere a la predicción del desarrollo de enfermedad tuberculosa, no parecen aportar grandes diferencias en comparación con la PT.
El uso de QTF-GIT y T-SPOT.TB en estudios de contactosHasta el momento se han realizado numerosos trabajos basados en el estudio de contactos en TBC. Inicialmente se basaron en la PT, pero desde la incorporación de los IGRA, estas nuevas técnicas han sido objeto de investigación en numerosas ocasiones en relación con el estudio de contactos18,61-66. En dos de estas investigaciones18,66, la mayor exposición reciente (mayor duración de la exposición o mayor número de bacilos ácido-alcohol resistentes en las muestras de esputos de la fuente) estaba más asociada con resultados positivos para IGRA que con PT, lo que sugiere que los IGRA podrían ser mejores que la PT en la detección de infección reciente. En estos estudios las personas con menor exposición fueron más propensas a ser positivas a PT que a IGRA, lo que sugiere que la PT podría haber sido mejor que la detección de la infección mediante IGRA para la detección de infección antigua/remota que se produjo antes de (y por tanto no se produjo como un resultado de) la exposición reciente63.
En otra investigación61, la proximidad de la exposición reciente (es decir, la misma habitación, otra habitación o una casa diferente) está más asociada con los resultados de PT que con los resultados QFT-GIT.
En el caso de los IGRA en relación con el estudio de contactos, podemos concluir que si bien hay sugerencias de que la positividad a los mismos podría indicar infección reciente, esto no está probado y se necesitarían más estudios para confirmarlo.
Conversiones y reversiones en los IGRALos estudios realizados hasta ahora sobre IGRA no realizaban controles seriados de dichos test. En el estudio de Hill et al., que se llevó a cabo mediante la realización de test IGRA de forma seriada en una serie de contactos expuestos a personas diagnosticadas de TBC en un país de alta prevalencia (Gambia), se observó que los IGRA —más concretamente ELISPOT— presentan en algunas ocasiones conversiones y reversiones que ocurren después de la exposición a M. tuberculosis67-71.
Para interpretar el resultado de los IGRA realizados de forma seriada, primero debemos responder a una serie de preguntas:
- 1.
¿Cuál es la reproducibilidad de la respuesta de las células T en un determinado espacio de tiempo? (Variaciones en la respuesta inter-individuo).
- 2.
¿Qué consideramos reversión y qué punto de corte debemos utilizar para definirla?
- 3.
¿Cuál es el significado clínico y el pronóstico de una reversión?
- 4.
¿Qué es una conversión y qué punto de corte se debe utilizar para definirla? ¿Cómo puede distinguirse de las variaciones no específicas de la respuesta de células T en el tiempo?
- 5.
¿Cuál es el pronóstico de una conversión IGRA? ¿Tienen los individuos con claras conversiones (p. ej., grandes aumentos en las respuestas de interferón gamma en el tiempo) un mayor riesgo de progresión a enfermedad activa que los individuos con conversiones más débiles o resultados negativos?
Estos estudios seriados demuestran a su vez que los IGRA son test muy dinámicos y que la respuesta de las células T, especialmente las respuestas débilmente positivas, tienden a fluctuar en el tiempo, incluso en ausencia de tratamiento específico.
Aunque los datos de que se dispone hasta el momento son limitados, sugieren que los resultados positivos varían más que los negativos. Esto es en parte esperable, porque los resultados positivos pueden variar en ambos sentidos, mientras que los negativos solo pueden variar entre 0 y el punto de corte diagnóstico. En resumen, estos nuevos métodos diagnósticos pueden ser inherentemente propensos a las conversiones y reversiones, y aún no se ha podido determinar si esta característica dinamicidad influye a la hora de valorar los resultados.
Por otro lado, muchos de estos test realizados de forma seriada se han llevado a cabo en países con alta incidencia de TBC. No está claro si se verán hallazgos similares en países donde la exposición a la TBC es menos frecuente.
Reversiones IGRA y su pronósticoEn general, las reversiones son menos frecuentes cuando la respuesta de interferón gamma es fuerte.
Por el contrario las reversiones IGRA son más frecuentes cuando ambos test son discordantes (p. ej., IGRA positivo, PT negativo). Los resultados discordantes son casi siempre resultados débilmente positivos y suelen estar justo por encima del punto de corte.
¿Por qué ocurren las reversiones IGRA? Algunas de estas pueden reflejar la curación de la infección tuberculosa (de forma espontánea o secundaria a tratamiento). Otras reversiones se producen por variaciones biológicas entre individuos positivos a IGRA, y también se pueden producir debido a la variabilidad en los procedimientos llevados a cabo en el laboratorio.
En la práctica diaria los individuos que han dado un resultado positivo a IGRA no se someterán de nuevo al test, como tampoco lo harán los individuos positivos para la PT.
En ese caso ¿tienen importancia las reversiones fuera de los trabajos de investigación? Probablemente no, hasta que conozcamos con mayor seguridad el significado y el pronóstico de dichas reversiones.
Conversiones IGRA y su significadoA pesar de que se ha documentado una alta tasa de conversiones IGRA en poblaciones de alto riesgo con alta incidencia de TBC, no hay un acuerdo en cómo definir las conversiones.
Con los datos de que disponemos no podemos responder a las siguientes cuestiones:
¿Qué grado de incremento de interferón gamma indica una nueva infección? ¿Cuánta de esta variación se debe a la prueba en sí misma o a la variabilidad biológica? ¿Se debe usar el mismo punto de corte para definir ITL que las conversiones? Algunos estudios muestran que si se usa un punto de corte «negativo a positivo» para definir las conversiones, estas pueden ser mayores con IGRA que con la PT, lo que puede indicar mayor sensibilidad a las conversiones (no necesariamente para el diagnóstico de ITL). Sin embargo, una parte de estas pueden deberse a variaciones no específicas alrededor del punto de corte. Ninguno de los estudios realizados toma en consideración dichas variaciones.
Pronóstico de conversiones IGRA y uso potencial de IGRA como prueba predictiva del desarrollo de enfermedad tuberculosaEl riesgo de desarrollo de TBC activa se ha establecido en varios estudios de cohortes tomando como prueba de referencia la PT. Asimismo, gracias a ensayos clínicos controlados, sabemos que iniciar tratamiento profiláctico en personas con PT positiva reduce el riesgo de enfermedad activa72.
Lamentablemente, no hay datos equivalentes para IGRA. Los datos de que disponemos se limitan a un pequeño estudio73 que se llevó a cabo entre los contactos familiares de casos índice y obtuvo como resultado una asociación entre las personas con una fuerte respuesta de interferón gamma al estímulo con ESAT-6 y posterior progresión a TB activa. Pese a ello, el pronóstico de un resultado positivo a IGRA todavía está por determinar.
¿Cuál es el pronóstico de una conversión IGRA? La conversión implica infección reciente (incidente), y el pronóstico es diferente de aquella otra infección que ya existía con anterioridad (prevalente). Por otra parte, el pronóstico de una «conversión fuerte» puede ser muy diferente del de una «conversión débil». No hay datos que respondan directamente a la cuestión de pronóstico de las conversiones, pero los datos emergentes sugieren que respuestas a ambos antígenos ESAT-6 y CFP-10 se correlacionan estrechamente con la replicación in vivo y con la progresión de la infección a enfermedad. Recientemente, Andersen et al.74 han sugerido una hipótesis por la cual valores altos y/o en aumento de los niveles de interferón gamma producidos en respuesta a ESAT-6 por las células T en personas infectadas recientemente pueden ser una señal enfermedad incipiente, y por lo tanto pueden servir como marcador pronóstico del posterior desarrollo de la enfermedad clínica manifiesta en un futuro próximo.
Análisis coste-efectividadEl estudio de contactos de pacientes con TBC está recomendado como un medio para detectar personas infectadas que pueden desarrollar posteriormente la enfermedad. Se ha demostrado que el tratamiento de las personas infectadas, fundamentalmente con isoniacida, disminuye el desarrollo de futuros casos de TBC75. La efectividad y el coste-efectividad de estos programas se ven muy influenciados por la precisión a la hora de identificar individuos infectados con riesgo de desarrollar enfermedad tuberculosa76.
Las normativas referentes al uso de IGRA dependen de cada país. Así, por ejemplo, los Centers for Diseases Control (CDC) de Estados Unidos recomiendan sustituir la PT por los IGRA en todos los casos. Por el contrario, en el Reino Unido, el National Intitute of Health and Clinical Excellence (NICE) recomienda el uso de los IGRA en combinación con la PT, pero solo en los casos en que la tuberculina haya sido positiva77.
Un estudio publicado recientemente78 en el que se comparan las dos pruebas disponibles hasta el momento (QTF-GIT y T-SPOT.TB) concluye que, para el estudio de contactos, la estrategia PT/IGRA utilizados de forma conjunta resulta más económica que la utilización de T-SPOT.TB - QTF-GIT o PT de forma aislada.
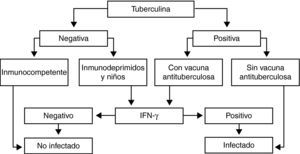
Recomendaciones (fig. 1)La realización de las técnicas de determinación de IGRA en pacientes inmunodeprimidos y en niños debe llevarse a cabo cuando la PT sea negativa, ya que podría tratarse de un falso negativo como consecuencia de la alteraciones inmunitarias, y cuando sea positiva, en las personas que hayan sido vacunadas previamente con BCG, ya que podría estar en relación con la propia vacuna.
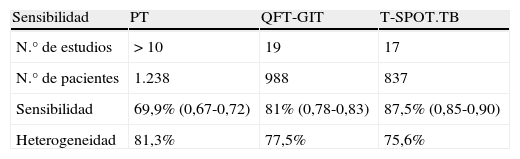
ConclusionesExisten dos metaanálisis10,79-88 que resumen los resultados que se han obtenido hasta ahora con los IGRA. Las principales conclusiones se exponen en la tabla 7.
Sensibilidad de los test de cribado
| Sensibilidad | PT | QFT-GIT | T-SPOT.TB |
| N.° de estudios | >10 | 19 | 17 |
| N.° de pacientes | 1.238 | 988 | 837 |
| Sensibilidad | 69,9% (0,67-0,72) | 81% (0,78-0,83) | 87,5% (0,85-0,90) |
| Heterogeneidad | 81,3% | 77,5% | 75,6% |
| Especificidad | PT | QFT-GIT | T-SPOT.TB |
| N.° de estudios | 6 | 5 | 3 |
| N.° de pacientes | 847 (No BCG) | 513 | 255 |
| Sensibilidad | 97% | 99,2% (IC 95%, 0,98-1,00) | 86,3% (IC 95%, 0,81-0,90) |
| Indeterminados | QTF-GIT | T-SPOT.TB |
| N.° de pacientes | 21.922 | 12.165 |
| Indeterminados | 2,14% (0,02-0,02)ID: 4,42% | 3,80% (0,03-0,04)ID: 6,12% |
ID: inmunodeprimidos.
A modo de resumen y teniendo en cuenta los conocimientos actuales, la cuestión es si los IGRA podrían sustituir a la PT para descartar infección tuberculosa en los pacientes que van a ser sometidos a tratamiento con agentes que puedan afectar al funcionamiento del sistema inmune. Hoy por hoy, parece que pueden complementarla pero no sustituirla. No se dispone de datos sobre el desarrollo de TBC a largo plazo que nos permitan tomar la decisión de tratar o no amparándose exclusivamente en el resultado de los IGRA. Pero no es solo eso, pues además las bases teóricas de los IGRA indican que estas técnicas miden un tipo de respuesta inmunitaria diferente a la que se detecta en la respuesta de hipersensibilidad retardada al PPD. A diferencia de lo que ocurre en el estudio de contactos, en los pacientes que van a ser sometidos a tratamiento inmunosupresor importa tanto la infección reciente como la remota. En cualquier caso, los IGRA representan un avance notable en el diagnóstico de la infección tuberculosa. El lugar que deben ocupar en el cribado de personas de riesgo —entre ellas los candidatos a tratamiento con agentes contra el factor de necrosis tumoral— está aún por definir. Para ello se precisan estudios longitudinales que proporcionen evidencia sólida sobre el valor pronóstico de los indicadores de riesgo para desarrollar TBC a largo plazo.
Conflicto de interesesNo existe conflicto de intereses.
Mi más sincero agradecimiento a José María García y Juan José Palacios por toda la ayuda prestada durante la realización de este trabajo.