El síndrome de apneas e hipopneas durante el sueño (SAHS) se caracteriza por episodios repetidos de colapso en la vía aérea superior. Estos colapsos pueden ser totales (apneas) o parciales (hipopneas). Las consecuencias de estos eventos son caídas en la saturación de oxígeno y despertares cerebrales transitorios, los cuales a su vez se suponen responsables de la somnolencia diurna excesiva y de trastornos neuropsiquiátricos1,2. La prevalencia del SAHS se ha cifrado en torno al 4-6% de los varones y el 2-4% de las mujeres3,4. El infradiagnóstico es un fenómeno universal5. En España se estima que menos del 10% de los casos están diagnosticados y, en consecuencia, tratados6.
El diagnóstico del SAHS se realiza mediante polisomnografía, aunque en pacientes seleccionados puede efectuarse mediante poligrafía respiratoria (PR)5,7–9. Diversos estudios han demostrado que existe una asociación entre apneas del sueño e hipertensión arterial4,10–14, enfermedad cardiovascular y cerebrovascular15–18, y accidentes de tráfico19–22. La presión positiva continua en la vía aérea (CPAP) se considera el tratamiento de elección de los casos más sintomáticos23,24, pues ha demostrado mejorar los síntomas clínicos (especialmente la somnolencia diurna), la calidad de vida y el índice de apneas-hipopneas (IAH)25–29, así como disminuir los accidentes de tráfico30, los eventos cardiovasculares e incluso la mortalidad18. Por lo mencionado, el SAHS se considera un problema de salud pública de primera magnitud8,31.
Año de la Apnea del SueñoEn 2001 la Junta Directiva de la Sociedad Española de Neumología y Cirugía Torácica (SEPAR) decidió llevar a cabo un plan de acciones de un año de duración, conocido como Años SEPAR y promovido por la Fundación Española del Pulmón. El primero fue el Año de la EPOC (2002)32–34, al que siguieron el Año del Asma (2003)35,36, el Año de la Neumonía (2004)37, el Año del Cáncer de Pulmón (2005)38 y, por último, el Año de la Apnea del Sueño (2006). Los Años SEPAR consisten en la realización de un conjunto de actividades divulgativas, dirigidas a la población general y a la Administración sanitaria, en torno a un tema de gran importancia sociosanitaria, es decir, un problema de salud pública. En el Año de la Apnea del Sueño, la población diana principal fue la población general, seguida de los médicos de atención primaria (MAP) y profesionales de medicina del trabajo, centros de reconocimiento de permisos de conducir, organizaciones de consumidores y Administración sanitaria.
Las líneas estratégicas en las que se centró la información y las actividades fueron las siguientes: a) divulgar los aspectos clínicos, diagnósticos y terapéuticos que interesaran a los afectados y sus familiares, o a los profesionales sanitarios no especialistas en la materia; b) dar a conocer y destacar la importancia de los accidentes de tráfico y laborales, así como las complicaciones cardiovasculares asociadas; c) poner en evidencia las demoras en el diagnóstico, la alta prevalencia y el infradiagnóstico; d) resaltar la trascendencia de las apneas del sueño en la infancia y los posibles factores preventivos; e) informar de la relación con la obesidad y recomendar medidas dietéticas saludables, y f) proclamar el derecho a dormir bien y advertir de la influencia del mal dormir sobre la calidad de vida.
Organización y actividades del Año de la Apnea del SueñoPara la organización de las actividades del Año de la Apnea del Sueño se crearon un Comité Central y 11 subcomités regionales. Las actividades realizadas fueron las siguientes:
- 1.
Colaboraciones. El total de colaboradores (fig. 1) ascendió a 50 (29 privados y 31 asociaciones o instituciones). En el capítulo de las instituciones es digno de mención que, además del Ministerio de Sanidad y Consumo y la Dirección General de Tráfico (DGT), se incorporó a la mayoría de los gobiernos autonómicos a través de las direcciones de salud. Flex y Carburos Médica fueron los principales contribuyentes.
- 2.
Informe de consenso. Bajo la tutela del Dr. Joaquín Durán se elaboró un documento de revisión y consenso, realizado por representantes de 17 sociedades y/o instituciones, que es hoy la guía de referencia para el SAHS en lengua española9.
- 3.
Carpa/exposición itinerante. Se fabricó una carpa gigante de 15 m de largo, 9 de ancho y 3 de alto, que recorrió 23 ciudades españolas. En su interior había: a) un microcine donde se proyectaban vídeos informativos; b) casetas de la SEPAR, la DGT, la Dirección General de Salud Pública del Ministerio de Sanidad y Consumo, Flex y Carburos Médica, en las que se repartían documentos informativos y se realizaban cuestionarios sobre apneas del sueño; c) espacios para llevar a cabo espirometrías, con recreación de un laboratorio de sueño con equipos de diagnóstico y tratamiento, y d) 4 grandes pantallas de plasma, que completaban la información de forma continuada.
- 4.
Folleto informativo sobre las apneas del sueño. Contenía información para la población general. Su difusión se realizó en la carpa y a través de las direcciones de salud de las comunidades autónomas para su distribución en centros de salud. Se editó más de un millón de ejemplares.
- 5.
Curso de formación para MAP. Consistió en 3 conferencias formativas (una dictada por un MAP) y un taller práctico de CPAP, que se impartieron en 60 ciudades españolas.
- 6.
Recursos y demoras en el diagnóstico de la apnea del sueño. Se llevó a cabo un estudio que se publicó en Archivos de Bronconeumología (véase más adelante).
- 7.
Apneas del sueño y accidentes. En colaboración con la DGT se contrataron cuñas en radios e inserciones informativas en las revistas de las sociedades científicas, se divulgó el Año de la Apnea del Sueño a través de la Revista Tráfico y se editó y distribuyó el tríptico informativo sobre la somnolencia al conducir. Durante la campaña de operación salida del puente de la Constitución se entregaron 500.000 folletos. Estimamos que leyeron el folleto aproximadamente 1.500.000 personas.
- 8.
Edición del libro Controlando la apnea del sueño. El Área de Enfermería de SEPAR editó un libro destinado a la población general con el objeto de informar sobre la apnea de una forma directa, sencilla y gráfica. Se distribuyeron 20.000 ejemplares en la carpa.
- 9.
Divulgación programada de información para los medios de comunicación. A fin de mantener la atención informativa, se previó la elaboración de noticias en torno a mensajes de interés estratégico para su divulgación progresiva mensual.
- 10.
Creación de una página web (www.apnea2006.org), con información detallada de las actividades del Año de la Apnea del Sueño y enlaces con los patrocinadores.
Aparte del resumen previo sobre el Año de la Apnea del Sueño, en este artículo se revisarán y comentarán los artículos publicados en esta revista desde enero de 2006 a febrero de 2008 para tener una idea de los aspectos científicos que en torno al tema han sido objeto de publicación después de dicho año. La búsqueda de artículos, limitada a las fechas mencionadas, se realizó con las palabras clave "Sleep apnea and Arch Bronconeumol" en el buscador PubMed. Los autores examinaron las publicaciones para determinar si versaban sobre las apneas del sueño. Se excluyeron 2 artículos. Para poner en perspectiva esta información, se analizaron también las publicaciones sobre apneas del sueño realizadas en los mismos períodos temporales de 2 años atrás (de enero de 2000 a febrero de 2002 y de enero de 2003 a febrero de 2005), utilizando la misma estrategia de búsqueda y selección posterior. Se excluyeron 4 artículos.
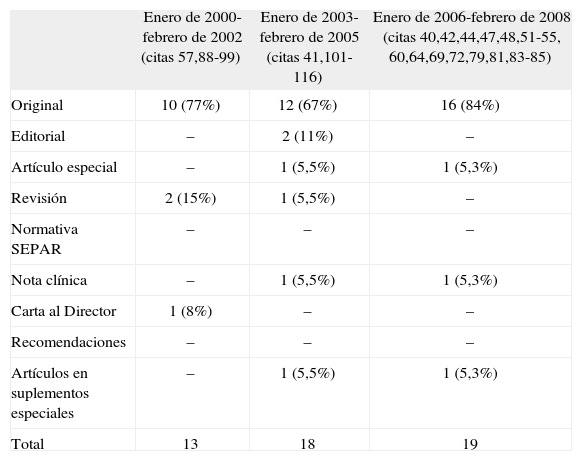
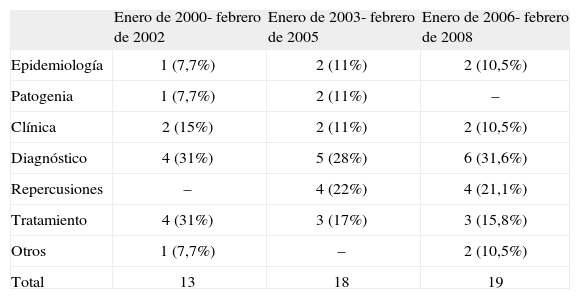
En la tabla I se observa que el número de publicaciones ha aumentado y que los originales son el tipo de publicación más frecuente, llegando al 84% en el último período estudiado. En la tabla II se recogen las publicaciones distribuidas en grupos temáticos. Los artículos sobre diagnóstico y tratamiento son los más frecuentes, y parece observarse una tendencia al descenso de la frecuencia de estudios con temática clínica, frente a un aumento de los que analizan las repercusiones del SAHS.
Distribución de los artículos sobre apneas del sueño aparecidos en Archivos de Bronconeumología en función del tipo de publicación
| Enero de 2000-febrero de 2002 (citas 57,88-99) | Enero de 2003-febrero de 2005 (citas 41,101-116) | Enero de 2006-febrero de 2008 (citas 40,42,44,47,48,51-55, 60,64,69,72,79,81,83-85) | |
| Original | 10 (77%) | 12 (67%) | 16 (84%) |
| Editorial | – | 2 (11%) | – |
| Artículo especial | – | 1 (5,5%) | 1 (5,3%) |
| Revisión | 2 (15%) | 1 (5,5%) | – |
| Normativa SEPAR | – | – | – |
| Nota clínica | – | 1 (5,5%) | 1 (5,3%) |
| Carta al Director | 1 (8%) | – | – |
| Recomendaciones | – | – | – |
| Artículos en suplementos especiales | – | 1 (5,5%) | 1 (5,3%) |
| Total | 13 | 18 | 19 |
Distribución, en función de la temática, de las publicaciones en Archivos de Bronconeumología sobre apneas del sueño
| Enero de 2000- febrero de 2002 | Enero de 2003- febrero de 2005 | Enero de 2006- febrero de 2008 | |
| Epidemiología | 1 (7,7%) | 2 (11%) | 2 (10,5%) |
| Patogenia | 1 (7,7%) | 2 (11%) | – |
| Clínica | 2 (15%) | 2 (11%) | 2 (10,5%) |
| Diagnóstico | 4 (31%) | 5 (28%) | 6 (31,6%) |
| Repercusiones | – | 4 (22%) | 4 (21,1%) |
| Tratamiento | 4 (31%) | 3 (17%) | 3 (15,8%) |
| Otros | 1 (7,7%) | – | 2 (10,5%) |
| Total | 13 | 18 | 19 |
Publicaciones sobre aspectos epidemiológicos. La obesidad es un fenómeno creciente en la sociedad desarrollada. Mientras que en adultos es un claro factor de riesgo de SAHS, en los niños no hay evidencia clara de ello e incluso se ha descrito retraso ponderal39. El objetivo del estudio de Sardón et al40 fue determinar si había una asociación entre el SAHS y la obesidad en una cohorte de niños de 2–14 años remitidos por sospecha clínica de SAHS. A 400 niños (edad media de 5 años; un 65% varones) se les practicó una PR en régimen hospitalario. Se estableció el diagnóstico de SAHS (IAH > 3) en el 74,5% (298 casos). En estos últimos no se demostró asociación entre obesidad e IAH. Una limitación de este estudio es que usó la PR como prueba diagnóstica de SAHS, en lugar de la polisomnografía. La PR no es de uso estandarizado en la infancia, si bien hay más evidencia sobre su empleo como prueba de cribado9,41. Como consecuencia, en el análisis estadístico para determinar la asociación con la obesidad se incluyeron solamente los casos con diagnóstico positivo usando un test de regresión lineal. Este análisis tiene una potencia estadística más limitada que el que hubiera podido hacerse entre casos con diagnóstico positivo y negativo si la prueba diagnóstica hubiera sido la polisomnografía. En cualquier caso, el estudio pone en cuestión la asociación entre SAHS y obesidad en la infancia, e invita a que estudios con otro diseño puedan ratificarlo.
El aumento del conocimiento del SAHS por parte de la población civil y de los MAP está propiciando un aumento importante de la derivación a las consultas de neumología. En el estudio de Pellicer Císcar42 se comparó el cambio (en cantidad y cualidad) que en 10 años había experimentado la demanda asistencial en una consulta de neumología de un hospital comarcal. Para ello se evaluaron las características de los pacientes remitidos a consulta en los períodos 1992–1993 y 2002–2003. La sospecha de apneas del sueño fue la causa de derivación que tuvo un incremento mayor, hasta convertirse en el origen más frecuente de consulta en el período 2002–2003. Sería interesante que estudios venideros tuvieran un objetivo similar para comprobar el "peso" de esta enfermedad en el conjunto de la asistencia neumológica.
Publicaciones sobre aspectos clínicos. Dado que la manifestación clínica de SAHS en los niños es variable43 y la demanda de estudios de sueño se va incrementando, el estudio de Llombart et al44 trató de evaluar las características del SAHS infantil y si había diferencias en los síntomas clínicos, la gravedad o el tratamiento entre niños con hipertrofia amigdalar y los que presentan otras alteraciones que favorecen dicho síndrome. Para ello se revisaron retrospectivamente los casos de 58 niños con la enfermedad, 42 con hipertrofia amigdalar y 16 con otras alteraciones favorecedoras. Aunque el estudio es descriptivo y retrospectivo, resulta interesante constatar las diferencias en la expresión clínica entre niños y adultos. Los niños con SAHS del estudio presentaban un elevado porcentaje de infecciones de repetición, retraso ponderal, hiperactividad y manifestaciones neuropsíquicas, mientras que fueron muy poco frecuentes la somnolencia y la obesidad. Esta última fue más frecuente en el grupo con otras alteraciones favorecedoras, al igual que las alteraciones del macizo facial y una mayor desaturación nocturna. Este grupo precisó con más frecuencia tratamiento combinado con CPAP y cirugía.
El FOSQ (Functional Outcomes of Sleep Questionnaire) es un test diseñado para evaluar la calidad de vida específicamente en trastornos durante el sueño45. Está validado en lengua española46, pero se desconocen los valores en poblaciones afectadas y sanas. Aunque su uso está muy extendido, no se ha precisado si es una herramienta útil para valorar concretamente el impacto de la somnolencia en pacientes con SAHS. En el estudio de Vidal et al47 se evaluó a 31 pacientes con SAHS y a 31 personas supuestamente sanas. Además de obtener valores de referencia, el estudio demostró que el FOSQ, en comparación con la escala Epworth, es un buen instrumento para la valoración del impacto de la somnolencia en las actividades de la vida diaria y, en consecuencia, tendría utilidad práctica en la estimación de la respuesta al tratamiento. Como otras escalas de calidad de vida en el SAHS, consume tiempo, lo que limita su uso en la práctica clínica. Sería muy útil disponer de un test contrastado que requiera poco tiempo, como una escala analógica o similar.
Publicaciones sobre el diagnóstico del SAHS. La polisomnografía de diagnóstico y tratamiento —de noche partida (split night)— se está usando ampliamente sobre todo en países como EE.UU.7, en los que la PR y la titulación con auto-CPAP no son de uso estándar y las aseguradoras no reintegran su coste. El estudio de Ciftci et al48 evaluó la polisomnografía de 45 pacientes con SAHS (IAH > 5) dividiendo el período en las primeras 3 h y el resto. El objetivo fue demostrar si la primera parte de la polisomnografía tenía características similares a la segunda y a la duración total del estudio (suma de la primera y segunda partes). Aunque se obtuvo diferencias en los porcentajes del sueño profundo (mayor en las primeras 3 h) y REM (mayor en el segundo período), no hubo diferencia en el IAH, por lo que seguramente la primera mitad refleja lo que sucede en el total de la noche en lo que a las alteraciones respiratorias se refiere. Por otra parte, dado que la segunda mitad fue similar a la primera, no habría impedimentos para llevar a cabo una titulación de CPAP en esta segunda mitad. Estos resultados son concordantes con los obtenido en otros estudios usando titulación de CPAP eficazmente durante el segundo período de la polisomnografía13. Sería interesante que estudios futuros determinaran si la realización de la PR más autotitulación domiciliarias tiene mejor relación coste/efectividad que el modelo de una noche partida.
La pulsioximetría es un tipo de registro que se usaba anteriormente para el diagnóstico del SAHS. Acabó desaconsejándose porque presentaba alta especificidad y baja sensibilidad49. La mayor parte de los estudios se hicieron por debajo de 2.000 m de altitud. Con la disminución de la presión parcial de oxígeno, pequeños cambios en la ventilación podrían en teoría provocar desaturaciones de oxígeno, debido a la diferente posición en la curva de disociación de la hemoglobina. Por otra parte, existe hoy día un interés creciente por los sistemas simplificados de diagnóstico monocanal, como la oximetría y posterior autotitulación de CPAP50, o con sólo un canal de flujo por sonda nasal. En el artículo de Torre-Bouscoulet et al51, realizado en Ciudad de México (2.240 m), se incluyó, por una parte, a 38 pacientes con sospecha de SAHS a los que se practicó una polisomnografía convencional (flujo mediante sonda nasal) y, por otra parte (sin aleatorización), a otro grupo de 30 pacientes, con la misma sospecha, a los que se realizó únicamente un estudio con un sistema monocanal que medía sólo flujo (sonda nasal; ApneaLink®, ResMed Corp., Poway, CA, EE.UU) y una pulsioximetría (no integrada en el ApneaLink®). En el caso de la polisomnografía, en la definición de hipopneas se tuvieron en cuenta la caída del flujo con desaturación o el microdespertar, y en el dispositivo ApneaLink®, sólo la caída del flujo. Para el análisis del índice de desaturación de las pulsioximetrías se evaluó por separado las que se realizaron con la polisomnografía y las que se llevaron a cabo al mismo tiempo que el ApneaLink®. En ambas el criterio fue sólo la desaturación. Hubo un buen acuerdo entre el IAH (polisomnografía y ApneaLink®) y el índice de desaturación de las pulsioximetrías. También se valoró la rentabilidad diagnóstica del SAHS con varios puntos de corte. Se obtuvieron valores más altos en sensibilidad que en especificidad. Estudios posteriores deberán demostrar si la eficacia diagnóstica de los pulsioxímetros es mayor a esta altitud que a nivel del mar.
La creciente demanda de estudios de sueño está dando lugar a retrasos en el acceso al diagnóstico5,52. La polisomnografía es cara y consume tiempo, por lo que hay que explorar el uso de otros sistemas más simplificados de diagnóstico. La PR es un sistema que integra 4–6 canales de registro (nivel 3 de la American Academy of Sleep Medicine). Su eficacia puede considerarse probada cuando se realiza de forma vigilada en el hospital5. Se han hecho algunos estudios con PR de forma no vigilada en el domicilio, pero las numerosas diferencias metodológicas entre ellos (equipos de PR diferentes, distintos sistemas logísticos para llevar a cabo el estudio en el domicilio, diversos sistemas de medida del flujo, diferentes definiciones de evento apneico, análisis automático o manual, distintos puntos de corte del IAH y escasos estudios con evaluación del coste/beneficio) dificultan disponer de un nivel de evidencia alto. Alonso et al53 realizaron un estudio con el objetivo de evaluar la fiabilidad diagnóstica de un equipo de PR (Edentrace II®, Edentec Corp., Minnesota, EE.UU.; flujo mediante termistor) y su coste, en comparación con la polisomnografía convencional. Los estudios se llevaron a cabo en el domicilio, donde una enfermera adiestrada se encargaba de colocar el equipo al paciente. Se incluyó a 45 pacientes con sospecha clínica de SAHS. Tomando como diagnóstico un IAH ≥ 10 en la polisomnografía, la prevalencia de SAHS fue del 46,6%. El punto de corte más eficiente del índice de eventos respiratorios (RDI, respiratory disturbance index) en la PR fue 11,6; el más sensible, 7,2, y el más específico, 13,7. El cálculo de las probabilidades diagnósticas, teniendo en cuenta que la probabilidad pretest de presentar SAHS fue del 46,6%, sería el siguiente: si se realiza una PR y el RDI es inferior a 7,2 (punto sensible), la probabilidad postest de que el paciente presente SAHS se reduce hasta el 13,6%, y si el resultado es positivo, es decir, el RDI es igual o mayor de 13,7 (punto específico), la probabilidad postest de que tenga SAHS sería del 92,8%. El coste de la PR por persona fue de 147 e y el de la polisomnografía, de 179 e.
El estudio de Jurado Gámez et al54, con un objetivo y método similares al anterior, evaluó a 52 pacientes. El dispositivo de PR (Compumedic Series-P Screener®, Compumedic Sleep Ltd., Abbotsford, Australia) mide el flujo por termistor y presión nasal. La selección de pacientes fue aparentemente similar a la del estudio de Alonso et al53 (sospecha clínica de SAHS), aunque la prevalencia fue del 90% tomando igual punto de corte que estos autores en la polisomnografía (IAH > 10). Esta elevada prevalencia limita la evaluación de parámetros de eficacia diagnóstica (especificidad y valores predictivos). Con un punto de corte de IAH superior a 10 en la polisomnografía y PR, la sensibilidad fue del 87%, mientras que en el estudio anterior la sensibilidad pretest fue del 90% (punto de corte sensible) y del 61% (punto de corte específico). La mejor área bajo la curva fue para un punto de corte de IAH de 5,6 en la PR, mientras que en el estudio anterior lo fue para un IAH de 11,6. En la evaluación de coste no se tuvieron en cuenta los mismos parámetros, pero en ambos trabajos la PR fue más económica (PR: 153 e; polisomnografía: 255 e).
Estos 2 estudios indican que la PR realizada en el domicilio es eficaz en el diagnóstico y eficiente en términos de coste, pero también ponen de manifiesto la variabilidad en los resultados. Sería deseable que estudios multicéntricos y con una muestra más amplia ratificaran sus resultados. Otro punto que debe dilucidarse es si se obtendría mejor coste/efectividad con los diferentes sistemas logísticos de transporte del equipo y explicación sobre su colocación. Los más frecuentes en nuestro país52 son: a) los pacientes acuden al hospital durante el día, recogen el aparato de PR y reciben la información para que se lo coloquen ellos mismos en el domicilio, y b) personal especializado (del hospital o más a menudo de las compañías proveedoras de CPAP) se encarga del transporte del equipo y de la explicación de su uso, tras lo cual se procede a la colocación nocturna del equipo, bien por el propio paciente, bien directamente por el personal de transporte, como en el caso de los 2 estudios comentados.
El infradiagnóstico es un grave problema en el SAHS. Como ya se ha mencionado, se estima que el 90% de los pacientes con SAHS grave no están diagnosticados ni tratados. Se han propuesto diferentes métodos para paliar este problema, como, por ejemplo, campañas de información dirigidas a la población civil, autoridades sanitarias y MAP, como se hizo en el Año de la Apnea del Sueño. La eficacia de un plan específico de formación para MAP no ha sido muy estudiada. El artículo de Martínez-García et al55 se centra en este tema. Se ofreció a un grupo de 16 MAP de una misma área de salud información adicional sobre el SAHS mediante 2 charlas-talleres, una hoja de derivación protocolizada y contacto directo con la unidad de sueño. Otro grupo de 21 MAP de la misma área que no recibieron formación sirvió de control. Se obtuvo datos de ambos grupos en los períodos de enero a junio de 2005 (previo a la formación) y de enero a junio de 2006 (después de la formación). En el grupo de MAP que recibieron formación aumentaron significativamente, con respecto al grupo sin formación, el número de derivaciones y la concordancia en la información recogida por el MAP y el especialista. Aunque este estudio tiene la limitación de haberse llevado a cabo en un área de salud reducida, sus resultados alientan el convencimiento de que el incremento de la motivación científica de los MAP redunda en una reducción del infradiagnóstico y en una mejora de la calidad de las derivaciones.
La elevada prevalencia del SAHS, la relevancia de sus repercusiones, la eficacia del tratamiento y el infradiagnóstico inciden en el aumento de la demanda de estudios de sueño, lo que a su vez incide en el incremento de la demora en su diagnóstico. Es necesario conocer la situación del diagnóstico del SAHS para que los especialistas y las autoridades sanitarias, responsables de solventar el problema, dispongan de la información precisa para adaptar los recursos a las necesidades. En nuestro país se han realizado varias evaluaciones en este sentido6,56–58. En la más reciente52, que se llevó a cabo durante el Año de la Apnea del Sueño, se realizó una encuesta a los 780 centros sanitarios incluidos en el catálogo del Ministerio de Sanidad y Consumo. Sólo el 29% evaluaba a pacientes con sospecha de SAHS. La demora media en consulta fue de 61 días y la demora media para realizar una PR, de 224 días. La media de equipos de PR fue de 0,99/100.000 habitantes, cuando lo recomendable es 3/100.000. El retraso medio para la realización de polisomnografía fue de 166 días. La media de camas de polisomnografía fue de 0,49/100.000 habitantes, cuando lo recomendable es 1/100.000. Sólo el 18% de los centros que disponía de PR y el 33% de los que tenía polisomnografía contaban con un técnico para realizar las lecturas diurnas, lo que seguramente redundaba en una baja optimización de los equipos. La conclusión del estudio fue que la notable deficiencia de recursos llevaba a inaceptables listas de espera. Aunque se observó que la situación del diagnóstico de SAHS había mejorado respecto a estudios previos, seguía siendo mejorable, por lo que es imprescindible que las autoridades sanitarias dediquen más recursos a este problema de salud pública.
Publicaciones sobre las repercusiones del SAHS. La asociación de insuficiencia cardíaca congestiva y SAHS es un hecho conocido59. La prueba de referencia para el diagnóstico de la insuficiencia cardíaca es el cateterismo, aunque hay métodos no invasivos, como la ecocardiografía, los isótopos radiactivos y la reinhalación de anhídrido carbónico (CO2). El estudio de Alonso-Fernández et al60, realizado en pacientes con SAHS, comparó la variabilidad y reproducibilidad en la medida del gasto cardíaco evaluado por 2 técnicas de reinhalación de CO2 (equilibrio y exponencial) con la función ventricular izquierda medida por ecocardiografía. El gasto cardíaco medido por el método de reinhalación de CO2 se correlacionó, aunque modestamente, con la función ventricular sistólica de la ecocardiografía. De los 2 métodos de reinhalación, equilibrio y exponencial, el primero tuvo menos variabilidad y mayor reproducibilidad. En definitiva, este estudio indica que en pacientes con SAHS la reinhalación de CO2 puede ser de utilidad para determinar el gasto cardíaco, pero no parece una alternativa a la estimación de la función ventricular mediante ecocardiografía.
El 50% de los pacientes con hipertensión arterial tratada tiene cifras elevadas de presión arterial. Un 10% continúa presentando hipertensión arterial a pesar de la combinación de varios fármacos61. Algunos trabajos han asociado la existencia de mal control de la presión arterial con el aumento del número de eventos apneicos62,63, aunque la definición de hipertensión arterial de mal control cambia de unos a otros. El artículo de Martínez-Garcia et al64 se propuso el objetivo de analizar la relación entre los eventos apneicos y la hipertensión arterial de difícil control, entendida como aquélla que permanece elevada a pesar del tratamiento con 3 o más fármacos antihipertensivos. Se estudió a 49 pacientes. La presión arterial sistólica, tanto diurna como nocturna (determinada mediante registro ambulatorio de 24 h), fue significativamente más alta en el grupo de 14 pacientes con SAHS grave (IAH > 30) que en el de 15 pacientes con SAHS leve (IAH de 10–29) y que en el de 20 pacientes sin SAHS (IAH < 10). No se observaron diferencias en la presión diastólica nocturna, pero sí en la diastólica diurna, entre los grupos con SAHS grave y leve. Asimismo, el consumo de fármacos antihipertensivos era mayor en los pacientes con SAHS grave. Tras ajustar por edad y sexo, en los pacientes sin SAHS se observó una correlación significativa y positiva de las presiones arteriales (sistólica y diastólica) con el índice de masa corporal (IMC), pero ninguna correlación con el IAH. Con los mismos ajustes de edad y sexo, los pacientes con SAHS (leve y grave) tuvieron correlaciones positivas y significativas con el IAH e IMC. El análisis de regresión mostró que IAH e IMC fueron factores independientes de asociación, si bien el primero poseía un valor predictivo más alto. Este estudio confirma la elevada prevalencia de SAHS en los pacientes con hipertensión arterial de difícil control y perfila 2 factores predictivos: la obesidad y el SAHS. Otros estudios deberán demostrar la relación de causalidad comprobando si el tratamiento con CPAP permite mejorar el control de la presión arterial sin que se produzcan cambios en el IMC.
La hiperuricemia se observa con frecuencia en pacientes con SAHS, seguramente asociada a obesidad65. Sin embargo, puede ser un marcador de hipoxia tisular66 y su presencia se ha asociado al SAHS al valorar la excreción urinaria durante la noche67,68. Por lo tanto, Ruiz et al69 se plantearon si la uricemia podía ser un marcador biológico de SAHS. Analizaron retrospectivamente una muestra de 1.135 sujetos a los que se había realizado una PR (n = 819) o una polisomnografía (n = 316) por sospecha de SAHS. El estudio demuestra que existe asociación entre la uricemia y el número de eventos apneicos y de desaturaciones. Sin embargo, al ajustar la asociación por factores de confusión (principalmente el IMC), la asociación desaparece, lo que indica que no es un factor independientemente asociado y que, en consecuencia, carece de valor predictivo. Como otros estudios han demostrado la disminución de la excreción urinaria nocturna de ácido úrico en pacientes con SAHS tratados con CPAP66,68, es probable que la hipoxemia originada en el SAHS eleve el ácido úrico, pero la obesidad parece modularlo en mayor medida.
Los episodios de hipoxia y reoxigenación producidos por las apneas e hipopneas pueden liberar radicales libres en exceso, de forma que se supere la capacidad antioxidante, lo que da lugar a estrés oxidativo70. Éste, a su vez, puede favorecer la disfunción endotelial y el desarrollo de enfermedades cardiovasculares. Algunos estudios han observado que los marcadores de estrés oxidativo disminuyen una vez que los pacientes con SAHS reciben tratamiento con CPAP71. Hernández et al72 se plantearon el objetivo de comprobarlo en una muestra de 36 pacientes con SAHS subsidiarios de tratamiento con CPAP y 10 personas supuestamente sanas como controles. El marcador de estrés oxidativo elegido fue el malondialdehído, producto secundario de la descompensación de los peróxidos lipídicos. Después de una media de casi 3 meses de seguimiento, en los pacientes tratados con CPAP disminuyó significativamente el marcador de estrés oxidativo (ajustado por factores de confusión), que, en cambio, no se modificó en los controles. Este estudio confirma los hallazgos previos en una muestra más amplia y ayuda a entender el riesgo cardiovascular de los pacientes con SAHS.
Publicaciones sobre el tratamiento del SAHS. La demanda de tratamiento con presión positiva a través de mascarillas nasales es creciente en el SAHS y en enfermedades subsidiarias de tratamiento con ventilación no invasiva73–77. Debido a que el paciente inhala y exhala por el mismo circuito, es preciso mantener una adecuada renovación del aire que permanece en la mascarilla para evitar la reinhalación de CO2. Esto se consigue mediante un orificio o ventana que permite una fuga sin impedir el nivel adecuado de presurización78. El objetivo del estudio de Mediano et al79 fue analizar la fracción de CO2 al final de la espiración (end tidal) de un nuevo prototipo de mascarilla fabricada en España frente a 2 modelos comerciales: Profile Lite® y ComfortClassic® (Respironics Inc., Pittsburgh, Pensilvania, EE.UU.). Se incluyó a 11 voluntarios supuestamente sanos, a 12 pacientes con SAHS grave y a otros 12 con hipercapnia que en principio no presentaban SAHS. Se midió la fracción de CO2 al final de la espiración después de 3 min de tratamiento con CPAP con 4; 5; 6; 8; 10; 15, y 20 cmH2O. Para la misma presión en la mascarilla, el prototipo tuvo fracciones espiratorias de CO2 menores que las 2 mascarillas comerciales al analizar la muestra en conjunto. Al dividir la muestra por enfermedades, la fracción de CO2 al final de la espiración fue inferior a partir de 4 cmH2O de CPAP en el grupo de pacientes con hipercapnia y de 8 cmH2O en los otros 2. Este estudio revela la necesidad de conocer detalles sobre la concentración de CO2 residual de las mascarillas que se usan en la práctica diaria a fin de poder elegir las más convenientes, sobre todo en el caso de pacientes con hipercapnia subsidiarios de tratamiento con CPAP o ventilación no invasiva. Esta información debería constar en la descripción de las características técnicas de las mascarillas de uso comercial.
El síndrome de apneas del sueño de origen central supone menos del 10% de los casos estudiados por sospecha de apneas nocturnas80. Este síndrome puede presentarse con hipercapnia diurna o normocapnia, y ser idiopático o secundario. Llombart et al81 describen el caso de una paciente con normocapnia, síndrome de apnea central, insuficiencia renal crónica e hiperparatiroidismo. El número de eventos centrales disminuyó sustancialmente cuando se le realizo una hiperparatiroidectomía y se inicio tratamiento con diálisis de forma reglada. Las apneas centrales residuales respondieron al tratamiento con CPAP, a diferencia de lo que había ocurrido en un intento previo a la intervención y diálisis. Los autores comentan las potenciales causas del síndrome de apnea central en este caso.
El acceso al diagnóstico del SAHS es un problema universal56,82, al que se añaden las dificultades de financiación (para el diagnóstico y tratamiento) en los países en desarrollo. Torre Bouscoulet et al83 se propusieron analizar con qué frecuencia inician tratamiento con CPAP aquellos a quienes se les indica y cuál es el cumplimiento terapéutico. El estudio se desarrolló en un hospital de referencia de Ciudad de México que atendía preferentemente a pacientes sin seguridad social. En este país sólo el 45% de la población tiene seguridad social y la cobertura del tratamiento con CPAP no es universal. Se incluyó en el estudio a 304 pacientes a los que se había recomendado comenzar tratamiento con CPAP, cuyo equipo debían conseguir ellos mismos. Lo inició el 55%, de los que un 28% obtuvo el equipo de forma gratuita (beneficencia o seguridad social) y el 72% restante lo compró (o alquiló). En cuanto a las diferencias entre los que iniciaron y no el tratamiento, destacaban la existencia de seguridad social, mayor RDI y mayor frecuencia de SAHS grave (RDI > 30 y escala de Epworth > 10). El estudio no evaluó si la obtención gratuita del dispositivo fue un factor discriminante, pero, dado que la mayoría de los que tenían seguridad social lo obtuvieron de forma gratuita (65%), es muy probable que este factor condicionara que tener seguridad social fuera un factor diferenciador. Al contrario de lo que sucede en países desarrollados, la escala de Epworth no fue un factor predictivo de observancia del tratamiento ni de mejor cumplimiento. En resumen, este estudio no ofrece todas las respuestas, pero en apariencia, en los países en desarrollo (con escasa cobertura aseguradora), la gratuidad del tratamiento y presentar una enfermedad grave que precisa tratamiento (con cierta independencia de sentir más o menos somnolencia diurna) podrían ser los factores que mejor predicen la adquisición de los equipos para el inicio del tratamiento.
Publicaciones sobre otros aspectos del SAHS. En el artículo publicado por De Granda Orive y Jareño Esteban84 se revisaron y comentaron las 59 publicaciones aparecidas en el año 2006 en Archivos de Bronconeumología. En lo que hace referencia a los trastornos del sueño, se comentaron 440,64,69,72 de las mencionadas en el presente artículo.
El artículo de Alonso Álvarez et al85 revisó el SAHS en niños. Éste es un tema de interés creciente debido a que las sociedades pediátricas recomiendan el cribado activo (la prevalencia estimada puede situarse entre el 1 y el 3%)86 y a que el conocimiento sobre la enfermedad y estandarización de los métodos diagnósticos es menor que en el adulto. Presenta claras diferencias con el SAHS del adulto. En primer lugar, en su patogenia parecen tener más relevancia las anomalías de la vía aérea superior, especialmente la hipertrofia amigdalar. No obstante, los niños sin SAHS pueden tener el mismo grado de hipertrofia amigdalar que aquéllos con la enfermedad, lo que evidencia que debe de haber más condicionantes, quizá genéticos87. Los síntomas tienen diferente expresión: predominan los que acontecen durante el sueño (ronquido, respiración ruidosa, apneas observadas, sudación, adopción de posturas anómalas con la cabeza hiperextendida, etc.) sobre los diurnos (trastornos del comportamiento, hiperactividad, retraso escolar y del crecimiento, etc.). El diagnóstico se realiza por polisomnografía y además el tiempo para considerar evento apneico es más corto que en el adulto, ya que pequeñas hipoventilaciones pueden provocar desaturación. No está claro qué punto de corte de apneas o de apneas más hipopneas puede considerarse patológico88 ni cuál sería el tratamiento de los casos leves/moderados. En los casos graves el tratamiento de primera línea es el quirúrgico.
- Home
- All contents
- Publish your article
- About the journal
- Metrics