En la práctica clínica se sospecha el diagnóstico de eosinofilia pulmonar en pacientes con síntomas respiratorios (disnea, tos o sibilancias), infiltrados pulmonares migratorios en la radiografía del tórax y la demostración de eosinofilia en la sangre periférica o, preferentemente, en el pulmón1,2. El síndrome hiperosinofílico (HES) es una entidad rara con diferentes variedades, una de las más excepcionales es la mieloproliferativa. Presentamos el caso de un HES mieloproliferativo con FIP1L1/PDGFRA diagnosticado de eosinofilia pulmonar.
Varón de 60 años de edad fumador de 50 paq/año visto en neumología por empeoramiento de su tos y expectoración habituales, sin otra clínica asociada en los 2 meses previos. El paciente había sido diagnosticado 2 años antes de EPOC grado ii (volumen espiratorio forzado en primer segundo [FEV1] 79%) con buen control clínico tras el abandono del hábito tabáquico y tratamiento con fluticasona/salmeterol 25/250mcg.
En la exploración física no se apreciaron adenopatías, la auscultación objetivó algún roncus con una frecuencia respiratoria de 16rpm y cardiaca rítmica a 90latidos por minuto. El resto de la exploración fue normal.
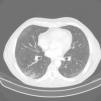
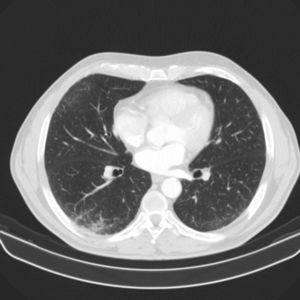
Se solicitó análisis de sangre donde destacó una leucocitosis de 12.590cél/mm con eosinófilos 8.560 (61%). El resto del hemograma, coagulación y bioquímica fueron normales. Las pruebas de función respiratoria: FEV1 2,610l (87%), capacidad vital forzada (FVC) 4,090l (109%), FEV1/FVC 63,78%. El test broncodilatador y la provocación con metacolina fueron negativas. La radiografía de tórax evidenció signos radiológicos de EPOC. La TC de tórax y abdomen mostró enfisema centroacinar y paraseptal con micronódulos en los lóbulos pulmonares superiores, lóbulo medio y língula, así mismo engrosamiento al nivel de la vejiga con sospecha de malignidad (fig. 1). El ecocardiograma fue normal. Tras estos hallazgos el paciente fue visto por el servicio de urología con diagnóstico posterior de carcinoma urotelial, estableciendo tratamiento específico. La elevada cifra de eosinófilos en sangre llevó a plantear un diagnóstico diferencial minucioso. Se solicitaron pruebas para parásitos, helmintos (Ascaris lumbricoides, Taenia solium, hidatidosis, Toxocara canis, Leishmania), hongos y coprocultivo, siendo todas negativas. Además, la serología para virus de hepatitis A, B y C, virus de la inmunodeficiencia humana, estudio de Mycobacterium y Bordetella fueron negativos. Ante estos hallazgos se practicó una fibrobroncoscopia obteniendo muestras de broncoaspirado, lavado broncoalveolar (BAL) y biopsia transbronquial (BTB). El broncoaspirado fue negativo para células malignas. El recuento celular del BAL fue: linfocitos 6%, polimorfonucleares 69% y eosinófilos 20%. El análisis anatomopatológico de la BTB objetivó mucosa bronquial y parénquima pulmonar con infiltrados de eosinófilos. Se confirmó por tanto eosinofilia pulmonar. El estudio inmunológico con anticuerpos antinucleares, anticuerpos anti citoplasma de neutrófilos y factor reumatoide también resultó negativo.
Se consultó al servicio de hematología ante la persistencia de eosinofilia elevada (11,330/μl) con alto nivel de eosinofilia pulmonar (20%). Con estos resultados programaron biopsia de médula ósea que mostró marcada eosinofilia de predominio maduro. Realizaron además citometría de flujo que reveló un predominio de CD3. Se llevó a cabo análisis por hibridación fluorescente in situ (FISH) para la detección genética, técnica que permite detectar y localizar una secuencia específica de ADN en un cromosoma tras hibridación con una molécula fluorescente. Se detectó mediante esta técnica positividad para el gen 4q12 FIP1L1 en el 20% de las células con un cariotipo normal. El resto del análisis genético fue negativo. Con estos datos e inmunofenotipo se consideró el diagnóstico de síndrome hipereosinofílico de naturaleza tumoral, permitiendo diferenciar entre mieloproliferativo y linfoproliferativo. El paciente fue diagnosticado entonces de síndrome hipereosinofílico mieloproliferativo con afectación pulmonar y se inició tratamiento específico.
El síndrome hipereosinofílico (HES) es un grupo heterogéneo de trastornos que engloba desde causas idiopáticas hasta enfermedades tumorales. Afecta sobre todo a varones entre 20-40 años de edad con una eosinofilia ≥1.500cél/mm3 durante más de 6 meses y signos de afectación orgánica3. En un 40% de los casos se detecta afectación pulmonar (tos e infiltrados pulmonares con micronódulos en la TC y afectación pleural)4.
Nuestro paciente presentaba una marcada eosinofilia periférica junto con un empeoramiento de su enfermedad respiratoria (EPOC) de 2 meses de evolución y pruebas de imagen con afectación pulmonar. El diagnóstico diferencial de este tipo de proceso patológico es complejo. En los pacientes con afectación pulmonar y sin evidencia de daño en otros órganos y eosinofilia se deben excluir en primer lugar causas infecciosas, alérgicas, fármacos y/o enfermedades autoinmunes5. Gracias a la valoración por parte del servicio de hematología fue posible establecer un diagnóstico definitivo. En este caso la presencia de eosinófilos en BAL y en BTB nos llevó a practicar una biopsia de médula ósea, la cual junto con la posterior valoración genética permitió la confirmación del diagnóstico de HES mielopreoliferativo con FIP1L1/PDGFRA positivo6,7.
El HES incluye una variante linfoproliferativa en el 90% de los casos y una mieloproloferativa en el 10%. Esta variable se debe en la mayoría de las ocasiones a la reordenación del gen FIP1L1/PDGFRA, aunque pueden evidenciarse otros trastornos genéticos. Se detecta mediante la técnica de FISH, la cual consigue identificar anomalías cromosómicas al captar el punto fluorescente en el cromosoma al que hibrida cada sonda de FISH. Esta mutación provoca la activación continua de una tirosina quinasa que da lugar a una proliferación clonal de eosinófilos8–10.
Aunque el HES es una entidad muy rara y que se desconocen muchos aspectos de ella, no pensamos que tenga relación con el tumor urotelial que presenta nuestro enfermo, aunque no se puede descartar con seguridad.
Para concluir, en la valoración de las eosinofilias pulmonares hay que tener en cuenta, cuando el número de eosinófilos es muy elevado, la posibilidad de enfermedades raras hematológicas como el HES mieloproliferativo con FIP1L1/PDGFRA positivo.