Uno de los síntomas destacados de la fibrosis quística (FQ) es la tos crónica, que afecta a la calidad de vida y a las relaciones sociales de los pacientes que la padecen. Nuestro objetivo fue analizar la fiabilidad y la validez de la versión en español del Cuestionario de Tos Leicester (Leicester Cough Questionnaire [LCQ]) en niños y adolescentes con FQ.
MétodosTras adaptar el cuestionario al español por el método normalizado de traducción y traducción inversa, tres centros españoles especializados en FQ reclutaron 58 pacientes de 7 a 18años de edad con FQ estable. El cuestionario se administró en 2 ocasiones (LCQ1 y LCQ2), dejando transcurrir un intervalo 2-de entre 2 y 4semanas entre ambas administraciones. Para correlacionar los resultados con la calidad de vida (CVRS) se utilizó la versión validada al español del Cystic Fibrosis Questionnaire-Revised (CFQ-R).
ResultadosLa población estudiada estuvo compuesta por un 62% de pacientes varones; la media de edad fue de 11,7±3,1años y el promedio de índice de masa corporal de 19±3kg/m2. Las medianas de las puntuaciones totales del LCQ fueron las siguientes: 19 (17,75-21) en el LCQ1 frente a 19 (16-21) en el LCQ2 (p=0,199). Se obtuvieron los siguientes coeficientes alfa de Cronbach: LCQtotal 0,83; LCQfísico 0,82; LCQpsicológico 0,74, y LCQsocial 0,62. Los coeficientes de correlación intraclase de las puntuaciones de los dominios LCQfísico, LCQpsicológico, LCQsocial y de la puntuación LCQtotal fueron de 0,69, 0,59, 0,45 y 0,71, respectivamente. Las correlaciones más significativas con el CFQ-R con respecto a la puntuación total (LCQtotal) fueron: para el dominio síntomas respiratorios 4 = 0,51 (p < 0,001) y para el dominio capacidad física r = 0,62 (p < 0,05).
ConclusiónLa versión en español del Cuestionario de Tos Leicester es fiable y válida en niños y adolescentes con FQ; además, en esta población el cuestionario se correlaciona bien con la calidad de vida
Cystic fibrosis (CF) patients present chronic cough as one of the main symptoms, which has an important effect on quality of life and social relations. Our goal was to validate the Spanish version of the Leicester Cough Questionnaire (LCQ) in a group of children and teenagers with CF.
MethodsAfter adapting to Spanish by standardized translation and retro-translation methodology, a sample of 58 stable CF patients from 7 to 18years were recruited from three CF specialized centers in Spain. The questionnaire was administered twice; the second administration (LCQ2) was performed between 2-4 weeks later than the first one (LCQ1), in order to analyse the reliability and validity of the Spanish version. To correlate results with health related quality of life (HRQoL) we used the Cystic Fibrosis Questionnaire-Revised (CFQ-R).
ResultsPopulation was composed by 62% male, age 11.7±3.1years and body mass index (BMI) 19±3kg/m2. Total scores from LCQ were: LCQ1 19 (17.75-21) vs LCQ2 19 (16-21) (P=.199). Cronbach's Alpha coefficient was 0.83 for the LCQtotal and for each specific domain was: 0.82 LCQphysical; 0.74 LCQpsychological and 0.62 LCQsocial. Intraclass correlation coefficient was: 0.69 LCQphysical; 0.59 LCQpsychological; 0.45 LCQsocial and 0.71 LCQtotal (good reliability). Relations with CFQ-R showed moderated and significant results: for the LCQtotal: respiratory symptom domain r = 0,51 (P<.001) and physical capacity domain r = 0,62 (P<.05).
ConclusionThe Spanish version of the Leicester Cough Questionnaire is reliable and valid for children and adolescents with CF and it has good relations with health related quality of life in this population.
La fibrosis quística (FQ) es una enfermedad genética, crónica y progresiva que afecta a diversos órganos, tales como las células exocrinas de las vías respiratorias, el páncreas, el hígado, los conductos sudoríparos y el aparato reproductor1. La fisiopatología pulmonar de la FQ se caracteriza por una carencia o defecto de la función de la proteína reguladora de la conductibilidad transmembrana (CFTR). Esto provoca una anomalía en la regulación del volumen de líquido periciliar, con disminución del aclaramiento mucociliar y la consecuente producción de tapones y obstrucción pulmonar2. La tos productiva es un síntoma universal en la FQ, la cual se cronifica a medida que avanza la enfermedad3. Las exacerbaciones respiratorias cursan con aumento de la tos y la expectoración, pérdida del apetito y deterioro de la capacidad para practicar ejercicio, lo que genera absentismo escolar4. Las exacerbaciones son más frecuentes a medida que la FQ progresa y la tos pasa a ser un síntoma habitual5.
Asimismo, la tos tiene una influencia directa sobre la supervivencia y es una medida importante de la evolución de la enfermedad y de la eficacia del tratamiento6-8. La experiencia clínica sugiere que la tos crónica interfiere las dimensiones física, emocional y social del paciente. En consecuencia, la calidad de vida del paciente empeora considerablemente y sus relaciones sociales resultan afectadas9,10. La monitorización de la calidad de vida relacionada con la salud y el efecto de la tos puede contribuir a mejorar la eficacia del tratamiento, prolongar la longevidad y reducir los costes económicos de la enfermedad11, ya que la tos podría ser un síntoma importante para poder pronosticar y prevenir posibles exacerbaciones12.
La evaluación de la calidad de vida relacionada con la salud (CVRS) es la base para poder valorar el efecto de la enfermedad y de los tratamientos sobre las actividades cotidianas del paciente, algo que las pruebas clínicas convencionales no reflejan11,13. Los cuestionarios de CVRS correlacionan la tos crónica con la calidad de vida del paciente, aunque la tos no está bien representada en este tipo de cuestionarios10, por lo que su efecto sobre la vida del paciente, particularmente en niños, no está bien descrito. La tos es un marcador de las exacerbaciones de la FQ que afecta de manera notable la CVRS, en particular en adolescentes14.
El Cuestionario de Tos Leicester (Leicester Cough Questionnaire [LCQ]) se diseñó para evaluar objetivamente la tos crónica y su efecto sobre la calidad de vida. Está estructurado en tres dominios: físico, psicológico y social15, y Murray et al.16 comunicaron buenos resultados al administrarlo a adultos con bronquiectasias no debidas a FQ. El LCQ se ha traducido a diversos idiomas, como el holandés o el chino17,18, y es un instrumento de uso habitual que proporciona resultados sólidos para evaluar el efecto de la tos en distintas enfermedades respiratorias, incluso en caso de tos aguda19. Sin embargo, existe poca información relativa a la evaluación de la tos en la FQ20, un síntoma que se suele relacionar con los periodos de exacerbación de la patología y que se ha estudiado poco en niños21.
Tras analizar las publicaciones más recientes, el LCQ parece ser un instrumento adecuado para evaluar la tos en poblaciones jóvenes con FQ y su uso no se ha investigado en concreto en este grupo de pacientes.
El propósito del presente estudio fue traducir y validar la versión en español del LCQ en niños y adolescentes con FQ, con el fin de proporcionar un nuevo instrumento útil para analizar el efecto de la tos en esta población. La versión en español del LCQ podría ser un instrumento de uso simple y fácil que se podría incorporar a las evaluaciones de la tos en pacientes jóvenes con FQ.
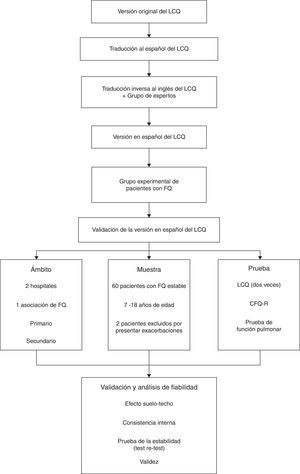
MétodosParticipantesLos pacientes estudiados todos en centros españoles se seleccionaron en el Hospital de Sabadell, Corporació Sanitària Universitària Parc Taulí de Sabadell (Barcelona), el Hospital Ramón y Cajal y la Asociación Madrileña de Fibrosis Quística de Madrid. Todos los participantes se reclutaron durante el periodo comprendido entre mayo y septiembre de 2011. Los criterios de inclusión fueron los siguientes: pacientes de 7 a 18años de edad con FQ clínicamente estable, sin exacerbaciones en las 4semanas anteriores a la inclusión en el estudio y con capacidad para leer y comprender los cuestionarios. Inicialmente se incluyeron 60 pacientes, 2 de los cuales fueron excluidos por haber presentado una exacerbación respiratoria durante el estudio (fig. 1).
El Comité de Ética del Hospital de Sabadell, Corporació Sanitària Universitària Parc Taulí y Universitat Pompeu Fabra de Barcelona, España, aprobaron el estudio. Antes del inicio, los padres firmaron el documento de consentimiento informado. En el caso de los mayores de 14 años, los niños también firmaron el consentimiento.
Para describir mejor su estado clínico, todos los pacientes se sometieron a una espirometría forzada convencional22, practicada mediante espirómetros portátiles: Easyone™ Bluetooh Cradle, modelo 2010BLT (Zúrich, Suiza) en los centros de Madrid y Datospir-600 Sibelmed (Barcelona España), en el centro de Sabadell.
Cuestionario de TosEl LCQ determina el efecto de la tos sobre la calidad de vida15. Se trata de un cuestionario administrado por el propio paciente que comprende 19 ítems divididos en 3 dominios: físico (8 ítems), psicológico (7 ítems) y social (4 ítems), en el que las respuestas se representan en una escala Likert de 7 puntos. La puntuación total, comprendida en un intervalo de 3 a 21, se obtiene sumando las puntuaciones de los 3 dominios y dividiendo el resultado por 3; las puntuaciones más altas indican menor efecto de la tos sobre la calidad de vida. Asimismo, cada dominio se puede analizar por separado.
Calidad de vidaLa versión española del Cystic Fibrosis Questionnaire-Revised (CFQ-R) es un cuestionario de calidad de vida diseñado específicamente para pacientes con FQ mayores de 6años de edad23. Ha sido traducido a diversos idiomas, entre los cuales figura el español24. Utilizamos 3 versiones del cuestionario según el grupo de edad: el CFQ-R 6-11 (para pacientes de 6 a 11años), el CFQ-R12-13 (para pacientes de 12 y 13años) y el CFQ-R14+ (para adolescentes). Los ítems, contestados por el propio paciente, abarcan diferentes áreas: función física, vitalidad, percepción de salud, síntomas respiratorios, carga del tratamiento y funciones de rol, emocional y social. Las respuestas se registran en una escala Likert de 4 puntos en la que se califica la frecuencia, la dificultad o la veracidad de las aseveraciones para describir la situación del paciente. Se obtiene una puntuación final de cada dominio, cada uno puntuado entre 0 y 100, y las puntuaciones más altas indican mayor calidad de vida del paciente.
Proceso de validaciónPara el proceso de validación seguimos el método normalizado de traducción directa e inversa. En primer lugar tradujimos el cuestionario original al español, y a continuación un traductor oficial de lengua materna inglesa lo tradujo de nuevo al inglés. Un grupo de expertos en enfermedades respiratorias y tos comentó y comparó las 2 versiones con el fin de identificar las expresiones más adecuadas para mejorar la comprensión de los pacientes. Tras este proceso, la versión preliminar del cuestionario se probó en un grupo de pacientes (n=8) con el fin de conocer sus impresiones y comentarios. Durante la etapa final se introdujeron pequeñas modificaciones, pero se evitó cambiar el sentido del cuestionario. Únicamente se adaptaron 2 preguntas en las que, al igual que se hizo en el cuestionario original, se incluyó una palabra de uso común entre paréntesis para mejorar la comprensión de los niños (fig. 1).
Para validar la versión en español del LCQ, el cuestionario final se administró 2 veces, dejando transcurrir un intervalo de 15-30días entre ambas, y se compararon los resultados. Durante este periodo, los pacientes procuraron no hacer cambios en su tratamiento rutinario, como iniciar actividades físicas, modificar la medicación así como no realizar actividades inusuales que pudiesen interferir en la tos durante el proceso de validación. Si hubo algún cambio, el paciente se excluyó automáticamente del estudio.
Asimismo, los efectos suelo y techo se pueden evaluar si más del 15% de los pacientes alcanzan la puntuación más baja o más alta posible, lo que significa el mayor o menor efecto de la tos sobre la calidad de vida. La ausencia de efectos suelo o techo es indicativa de una buena validez del contenido25.
Análisis estadísticoPara el análisis estadístico se utilizó el programa PASW Statistics 18 (SPSS Inc., IBM, EE.UU.). Las características demográficas se representan con la mediana y el rango intercuartil. La distribución de los datos se analizó con la prueba de Shapiro-Wilk. Debido a que la mayoría de los datos no presentaban una distribución normal, se utilizaron estadísticos no paramétricos (p<0,05).
Para comprobar la fiabilidad del cuestionario se examinó su consistencia interna y su reproducibilidad. La validez del cuestionario (consistencia interna) se evaluó mediante el coeficiente alfa de Cronbach y los coeficientes de correlación total de los ítems, mientras que la fiabilidad se evaluó mediante el coeficiente de correlación intraclase (CCI). Se asumió que el coeficiente alfa de Cronbach debía ser >0,70, y se definieron los niveles de fiabilidad en base a la siguiente clasificación: fiabilidad alta, CCI≥0,90; fiabilidad buena, CCI≥0,70 y <0,90; fiabilidad aceptable, CCI≥0,40 y <0,70, y fiabilidad baja, <0,40. La coherencia temporal se evaluó a partir de un diagrama de Bland-Altman de la puntuación LCQ total, calculando la diferencia media entre las 2 mediciones y la correspondiente desviación estándar (DE)26. En este diagrama es de esperar que el 95% de las diferencias sean inferiores a 2DE.
El cambio mínimo detectable (CMD) se calculó mediante la fórmula: CMD=±1,96×√2×EEM, donde 1,96 se deriva del intervalo de confianza (IC) del 95%.
El error de medición se expresó mediante el error estándar de la medición (EEM), calculado con la fórmula: DE×(√1–CCI), donde DE es la desviación estándar de los valores de todos los participantes y CCI es el coeficiente de fiabilidad27.
La validez convergente se evaluó a partir del coeficiente de correlación de Spearman de las puntuaciones LCQ y CFQ-R. La correlación se consideró sólida si el valor era superior a 0,60; moderada si se situaba entre 0,30 y 0,60, y baja (muy baja) si era inferior a 0,3025.
ResultadosDatos demográficosEl grupo final comprendió 58 pacientes con FQ clínicamente estable, el 38% de los cuales eran mujeres; la media de edad fue de 11,7±3,1años; el promedio de índice de masa corporal (IMC) de 19±3kg/m2, y los pacientes mantenían una función pulmonar conservada: capacidad vital forzada (FVC) 2,68±0,93l; volumen espiratorio forzado en el primer segundo (FEV1) 2,25±0,79l, y cociente FEV1/FVC de 83,85±6,9%.
La demografía y las características clínicas se muestran en la tabla 1.
Características de los pacientes
| Características de los pacientes (n=58) | |
|---|---|
| Sexo: M/F (%) | 62/38 |
| Edad (años) | 12 (9-14) |
| Estatura (m) | 1,47 (1,33-1,58) |
| Peso (kg) | 41,3 (30,2-52,1) |
| IMC (kg/m2) | 18,3 (16,6-21) |
| FVC (l) | 2,45 (2,01-3,37) |
| FVC (%) | 101 (83-114) |
| FEV1 (l) | 2,05 (1,72-2,92) |
| FEV1 (%) | 94 (83-114) |
| FEV1/FVC (%) | 84,4 (78,9-89,6) |
FEV1: volumen espiratorio forzado en el primer segundo; FEV1/FVC: cociente flujo/volumen; FVC: capacidad vital forzada; IMC: índice de masa corporal.
Datos expresados con la mediana y rango intercuartil.
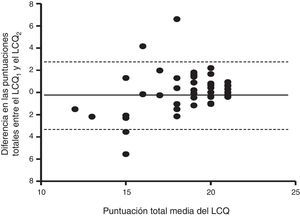
El análisis de reproducibilidad de la versión en español del LCQ no mostró diferencias significativas en las medianas ni en los rangos intercuartílicos de ambas administraciones (tabla 2). Las puntuaciones de los 3 dominios y la puntuación total fueron similares en ambas administraciones: 6,19 frente a 6,50 en el LCQfísico; 6,43 frente a 6,43 en el LCQpsicológico; 6,75 frente a 6,75 en el LCQsocial, y 19 frente a 19 en el LCQtotal (1.a administración frente a la 2.a [p=n/s]). El análisis de Bland y Altman mostró mayor concordancia entre los resultados de las puntuaciones totales de ambas administraciones. En la figura 2 se muestra el diagrama de Bland-Altman de las puntuaciones totales del LCQ. La validez y la fiabilidad de los resultados obtenidos a partir del coeficiente alfa de Cronbach y el coeficiente de correlación intraclase (CCI) se presentan en la tabla 3. Los resultados indicaron niveles de fiabilidad aceptables: CCI≥0,40 y <0,70, excepto en el dominio LCQtotal, en el que se obtuvo un CCI de 0,71, lo que indicó una buena fiabilidad. Cabe destacar que no se observó efecto suelo (0%) en ninguno de los dominios del cuestionario.
Diferencias entre las administraciones del Cuestionario de Tos Leicester
| 1.ª administración | 2.ª administración | p | |
|---|---|---|---|
| Dominio físico | 6,19 (5,47-6,78) | 6,50 (5,59-6,75) | 0,504 |
| Dominio psicológico | 6,43 (5,43-6,86) | 6,43 (5,71-6,86) | 0,838 |
| Dominio social | 6,75 (6,00-7,00) | 6,75 (6,25-7,00) | 0,975 |
| Total | 19 (17,75-21) | 19 (16-21) | 0,199 |
Prueba de Wilcoxon, p<0,05.
Datos expresados con la mediana y rango intercuartil.
Diagrama de Bland-Altman de las puntuaciones totales del LCQ y los cambios observados entre la primera y la segunda administración.
La línea continua representa la diferencia media entre las 2 administraciones y las líneas discontinuas los límites de acuerdo, que representan 2 veces la desviación estándar de la diferencia media.
Diferencia en las puntuaciones totales entre el LCQ1 y el LCQ2
Puntuación total media del LCQ.
Análisis de fiabilidad y validez del LCQ
| Cuestionario de Tos Leicester | Mínimo (%) | Máximo (%) | Alfa de Cronbach | CCI (IC 95%)a | EEM | CMD |
|---|---|---|---|---|---|---|
| Área física | 0 | 36,1 | 0,82 | 0,69 (0,52-0,81) | 0,46 | 1,07 |
| Área psicológica | 0 | 41,3 | 0,74 | 0,59 (0,38-0,74) | 0,59 | 1,39 |
| Área social | 0 | 62,1 | 0,62 | 0,45 (0,20-0,65) | 0,63 | 1,47 |
| Total | 0 | 29,3 | 0,83 | 0,71 (0,54-0,82) | 1,28 | 2,99 |
CCI: coeficiente de correlación intraclase; CMD: cambio mínimo detectable; EEM: error estándar de mediciones.
El cambio mínimo detectable (CMD) en el LCQ se situó entre 1,07 y 3, con un error estándar de las mediciones (EEM) de 0,46 a 1,28 (tabla 3).
Relaciones entre la versión en español del Cuestionario de Tos Leicester y la calidad de vida relacionada con la saludPara comprender mejor las dimensiones que abarca el LCQ, comparamos los resultados de las dimensiones del cuestionario con la calidad de vida evaluada mediante el CFQ-R. Para ello, analizamos todos los dominios del cuestionario (capacidad física, función de rol, vitalidad, función emocional, función social, percepción de la imagen corporal, alimentación, carga del tratamiento, percepción de salud, percepción del peso y síntomas respiratorios y digestivos). En la tabla 4 se muestran las correlaciones más significativas e interesantes, y cabe señalar que se observaron correlaciones significativas entre el CFQ-R y los dominios de capacidad física, síntomas respiratorios e imagen corporal del LCQ (p<0,001).
Correlaciones entre las diferentes áreas del LCQ, CFQ-R y función pulmonar
| Áreas del Cuestionario de Tos Leicester | ||||
|---|---|---|---|---|
| Física | Psicológica | Social | Total | |
| Área de síntomas respiratorios (CFQ-R niños) | 0,624** | 0,378* | 0,236 | 0,513** |
| Área de capacidad física (CFQ-R adolescentes) | 0,653* | 0,749** | 0,739** | 0,627* |
| Área de síntomas respiratorios (CFQ-R adolescentes) | 0,700** | 0,734** | 0,684* | 0,670* |
| Área de imagen corporal (CFQ-R adolescentes) | 0,577* | 0,575* | 0,599* | 0,637* |
| FVC (l) | 0,427** | 0,601** | 0,462** | 0,557** |
| FEV1 (l) | 0,487** | 0,626** | 0,456** | 0,582** |
CFQ-R adolescentes: Cystic Fibrosis Questionnaire-Revised para adolescentes mayores de 14 años; CFQ-R niños: Cystic Fibrosis Questionnaire-Revised para niños de 6 a 13 años; FEV1: volumen espiratorio forzado en el primer segundo; FVC: capacidad vital forzada.
Correlaciones de Spearman.
La versión en español del cuestionario LCQ es válida y fiable para evaluar el efecto de la tos sobre la calidad de vida de niños y adolescentes con FQ. Queremos resaltar que el nuestro fue el primer estudio en el que el LCQ se administró a niños de esta población; no se encontraron referencias relativas a este grupo de pacientes.
Los resultados obtenidos con la versión en español del LCQ fueron similares a los obtenidos con la versión original de Birring et al.15. El cuestionario original mostró una buena fiabilidad de las puntuaciones de todos los dominios y la puntuación total. Sin embargo, la versión en español indicó valores más bajos en ambos coeficientes, el coeficiente alfa de Cronbach (0,62-0,83) y el CCI (0,45-0,71). Es necesario comentar que los coeficientes obtenidos con la versión en español fueron inferiores a los obtenidos con la versión original y en otros estudios15,16, pero estos resultados posiblemente puedan explicarse por la corta edad de los pacientes incluidos en la muestra. Los estudios que aplican el LCQ se han llevado a cabo en adultos, puesto que los niños y adolescentes perciben su entorno de forma diferente, en consecuencia es lógico esperar resultados ligeramente diferentes28. Esto afectó a las puntuaciones, como confirmó el porcentaje de pacientes jóvenes (50%) que no consideró que tener tos significase tener un problema. Las puntuaciones totales fueron reproducibles, con coeficientes de correlación intraclase superiores a 0,7. Por consiguiente, la reproducibilidad del LCQ fue adecuada en pacientes con FQ y coherente con los resultados obtenidos con anterioridad29.
Por otro lado, la excelente estabilidad de la versión en español del LCQ indica que el efecto de la tos sobre la calidad de vida es menor en la población estudiada, lo que probablemente sea debido a la edad y al bajo nivel de gravedad de la enfermedad pulmonar de estos pacientes; esto también es una explicación plausible del hecho de que en el estudio no se encontrase un efecto suelo. Gee et al.30 confirmaron que los pacientes gravemente afectados tienden a producir mayor efecto suelo; sin embargo, los pacientes con enfermedad de moderada o escasa gravedad generan efectos techo en la mayor parte de ítems. Este fue el caso de nuestros pacientes, más del 15% de los cuales mostraron efecto techo en todos los dominios. Este hecho podría haber limitado la validez interna de la versión en español. No obstante, la leve intensidad de los síntomas respiratorios y la edad de los pacientes incluidos podrían explicar los resultados obtenidos. En segundo lugar, el sexo y la edad son importantes factores predictivos de la calidad de vida relacionada con la salud, y los niños notificaron cargas de tratamiento inferiores a las que sus padres percibían31. Por todo esto, el coeficiente más bajo en el dominio social obtenido con la versión en español del cuestionario podría ser debido a la corta edad de la población estudiada (es probable que el impacto social de la tos todavía no sea importante en esta población y que la tos no represente un obstáculo para su vida cotidiana).
El LCQ fue un buen instrumento para determinar el efecto de la tos sobre la calidad de vida, como demostraron las sólidas y significativas correlaciones observadas entre el LCQ y el CFQ-R, especialmente en los dominios físico y de síntomas respiratorios. Por consiguiente, podemos asegurar que el LCQ refleja fielmente el efecto de la tos sobre la calidad de vida de los pacientes con FQ.
El uso de instrumentos subjetivos, como escalas analógicas visuales, puntuaciones o diarios de la tos, para determinar el efecto de tos está muy extendido. A pesar de que se desconoce cuál es el instrumento óptimo para evaluar su intensidad, es probable que sea una combinación de evaluaciones subjetivas y objetivas, y es necesario examinar instrumentos validados para ello. Asimismo, consideramos importante enfatizar la importancia de validar y confirmar la fiabilidad de las versiones en español de estos instrumentos, incluso cuando lo cumplimentan menores, lo que no se había examinado en estudios anteriores.
LimitacionesEl estudio tuvo algunas limitaciones que debemos mencionar.
En primer lugar, los investigadores detectaron algunas dificultades en la comprensión de los ítems por parte del grupo experimental de pacientes jóvenes, que en la versión final se resolvieron mediante la adición entre paréntesis de un sinónimo junto a la palabra que podía dar lugar a confusiones.
Otra dificultad fue la distribución irregular de edades, que pudo conducir a la interpretación errónea de algunos datos, debido a las diferencias existentes entre adolescentes y niños en cuanto a la percepción de enfermedad. Asimismo, debido al bajo nivel de gravedad de la enfermedad, los resultados podrían haber sobreestimado el efecto techo y la calidad de vida de los pacientes y haber minimizado el efecto de la tos.
Debemos señalar que la muestra de pacientes no se seleccionó específicamente para validar el cuestionario, sino que se obtuvo de entre el grupo habitual de usuarios de la consulta hospitalaria de neumología. Si el grupo estudiado hubiese incluido pacientes con FQ grave y moderada, se habría podido demostrar que la versión en español del LCQ es realmente capaz de distinguir el efecto de la tos sobre la calidad de vida. Las diferencias en las pautas de medicación de los pacientes incluidos también podrían haber afectado la tos y modificado los resultados del LCQ. Para reducir este efecto, el equipo investigador se aseguró de que durante el proceso de validación no hubiese variaciones en la medicación que los pacientes recibían.
A pesar de estas limitaciones, no se debe olvidar que la finalidad del estudio fue demostrar la validez de la versión en español del cuestionario LCQ en pacientes jóvenes con FQ y no mostrar si tosen más o menos.
Para concluir, la versión en español del LCQ es válida para evaluar el impacto de la tos sobre la calidad de vida de niños y adolescentes con FQ. A la vista de estos resultados, recomendamos su empleo regular para detectar los posibles cambios en la calidad de vida que pueden surgir a lo largo de la evolución de la enfermedad.
FinanciaciónEl proyecto ha sido financiado parcialmente por el Proyecto Avanza, TSI-020110-2009-431, Ministerio de Industria, Turismo y Comercio, España.
Conflicto de interesesLos autores afirman no tener ningún conflicto de intereses en relación con este manuscrito.
Los autores desean expresar su agradecimiento a los pacientes que han participado en este estudio y a sus padres, así como a las instituciones que les han permitido usar sus dependencias. También desean reconocer la importante colaboración del equipo Activa, Norma Trujillo, Lisbeth Hernández, Adrián Rejas, Dr. Jordi Villà y, en particular, la de William Lalinde. Por último, agradecer al prof. Ibai López-Uralde Villanueva por su inestimable aportación en el análisis estadístico.