Los micronódulos pulmonares solitarios (MNPS) se caracterizan por un diámetro de 0,1-0,5cm.
ObjetivoEl objetivo de este estudio prospectivo es evaluar el abordaje quirúrgico del MNPS con objeto de establecer el tratamiento más apropiado.
MétodosEntre enero del 2007 y junio del 2011, se evaluó prospectivamente a un total de 146 pacientes con MNPS, 94 varones y 52 mujeres. Se dividió a los pacientes en 2 grupos en función de los antecedentes de enfermedad maligna (grupo A, 59 pacientes) y los factores de riesgo genéricos para el cáncer de pulmón (grupo B, 87 pacientes). Tras obtener información sobre los pacientes, propusimos la cirugía o un seguimiento mediante tomografía computarizada de cortes finos (TCCF) a ambos grupos.
ResultadosLa preferencia por la cirugía frente al seguimiento con TCCF fue del 90% frente al 10% en el grupo A y del 78% frente al 22% en el grupo B, respectivamente. En el grupo A detectamos 46 metástasis de un cáncer previo (78%), 8 cánceres primarios de pulmón (14%) y 5 lesiones benignas (8%). En el grupo B encontramos 5 metástasis (6%), 13 cánceres de pulmón no microcíticos (15%) y 69 lesiones benignas (79%). El análisis estadístico puso de relieve un valor predictivo positivo elevado (VPP = 0,9) para el total de pacientes quirúrgicos frente a los pacientes con seguimiento mediante TCCF.
ConclusionesLa indicación para la cirugía en el micronódulo pulmonar solitario tiene como finalidad establecer un diagnóstico precoz y la curación de la enfermedad maligna. Nuestro estudio indica que, en los pacientes con un cáncer previo, la cirugía es imprescindible. En los pacientes con un riesgo genérico de cáncer de pulmón, las indicaciones quirúrgicas deben ser más cuidadosas, aun cuando un 21% de enfermedades malignas en el grupo B parece indicar en cualquier caso la conveniencia de la cirugía.
Solitary pulmonary micronodules (SPMN) characteristically have a diameter of 0.1-0.5cm.
ObjectiveThe aim of this prospective study is to evaluate the surgical approach to SPMN in order to establish the most appropriate treatment.
MethodsBetween January 2007 and June 2011, 146 SPMN patients (94 males and 52 females) were prospectively evaluated. Patients were divided into two groups based on history of malignancy (Group A, 59 patients) and generic risk factors for lung cancer (Group B, 87 patients). After gathering patient information, we proposed surgery or thin-section computed tomography (TSCT) follow-up to both Groups.
ResultsPreference for surgery versus TSCT follow-up was 90% versus 10% in Group A and 78% versus 22% in Group B, respectively. In Group A, we discovered 46 metastases from previous cancer (78%), 8 primary lung cancers (14%) and 5 benign lesions (8%). In Group B, we found 5 metastases (6%), 13 non-small-cell lung cancer (15%) and 69 benign lesions (79%). Statistical analysis revealed a high positive predictive value (PPV = 0.9) between total surgical patients versus TSCT follow-up patients.
ConclusionsThe indication for surgery in solitary pulmonary micronodules is aimed at establishing early diagnosis and curing malignant disease. Our study indicates that in patients with previous cancer, surgery is essential. In patients with generic risk for lung cancer, surgical indications should be contemplated more carefully, even though the pulmonary malignancy rate of 21% in Group B seems to indicate the advisability of surgery.
La probabilidad de detectar un nódulo pulmonar solitario (NPS) mediante el examen radiológico ha aumentado considerablemente en los últimos años1,2. Esto se debe al uso de la tomografía computarizada de cortes finos (TCCF), que puede mostrar lesiones de tan solo 0,1-0,5cm, reduciendo las falsas imágenes causadas por el movimiento respiratorio y cardiaco. Como consecuencia de las mejoras de la TC, la definición del NPS3,4 como una lesión estructurada y redondeada de un diámetro ≤ 3cm ha dejado de ser, probablemente, apropiada. Creemos que es más correcto considerar 2 entidades diferentes: el micronódulo pulmonar solitario (MNPS), de un diámetro de entre 0,1 y 0,5cm, y el NPS, de un diámetro de entre 0,6 y 2cm. Las lesiones de más de 2cm de diámetro deben considerarse masas y presumiblemente cánceres de pulmón mientras no se demuestre lo contrario histológicamente. De hecho, Wahidi et al.5 mostraron la presencia de una enfermedad maligna en entre el 33 y el 64% de los nódulos de un diámetro de 1,1cm y 2cmm y en entre el 64 y el 82% en los nódulos de un diámetro superior a 2cm. El NPS puede abordarse con múltiples enfoques diagnósticos para definir su naturaleza. La TC espiral que resalta los aspectos morfológicos del NPS permite diferenciar el potencial benigno y maligno de la lesión. Lee et al.6 llevaron a cabo una reconstrucción de los nódulos pulmonares solitarios de tamaño inferior al centímetro, con el empleo de cortes de TC de 5mm y de 1mm en 529 pacientes. Estos autores señalaron que el tamaño del nódulo, la presencia de calcificaciones y la consistencia eran diferentes en las imágenes de TC de 5mm y de 1mm. Su conclusión fue que tanto la TC de cortes finos como la de cortes gruesos eran importantes para caracterizar mejor los nódulos. La tomografía de emisión de positrones con 18-F fluorodesoxiglucosa (18F-FDG PET) garantiza una mejor contribución al tratamiento de los NPS. Christensen et al.7, en un estudio de 42 nódulos pulmonares de un diámetro superior a 7mm, mostraron un resultado cualitativo positivo de la 18F-FDG PET en 24 de 25 casos de lesiones malignas y en 4 de 17 de lesiones benignas. Estos autores describieron una sensibilidad, una especificidad, un valor predictivo positivo (VPP) y un valor predictivo negativo del 96, el 76, el 86 y el 93%, respectivamente. En nuestra experiencia8, que incluye a 57 pacientes con lesiones de entre 5mm y 9mm, la 18F-FDG PET/TC mostró una sensibilidad, especificidad y exactitud del 95, el 72 y el 82%, respectivamente. La fibrobroncoscopia9, la biopsia o la aspiración transbronquial bajo guía de ecografía endobronquial (EBUS-TBB/TBNA)10, la biopsia pulmonar percutánea bajo guía de TC (CTPLB)11,12 y la cirugía torácica asistida por vídeo (VATS)13 para los NPS periféricos permitieron obtener el diagnóstico histológico preoperatorio y establecer el tratamiento quirúrgico. El tratamiento del MNPS continúa siendo controvertido. Los nódulos de menos de 5mm de tamaño no muestran unas características radiológicas específicas, que permitan obtener una orientación respecto a su naturaleza maligna o benigna. Los métodos mínimamente invasivos (EBUS-TBB/TBNA, CTPLB, VATS) para la detección y el diagnóstico de un MNPS indeterminado están contraindicados, sea cual sea la localización, debido a la dimensión del nódulo. Nuestra experiencia clínica sugiere que la minitoracotomía con preservación muscular y la palpación manual del pulmón son la mejor opción para localizar y extirpar la lesión, junto con una evaluación histológica intraoperatoria. El objetivo de este estudio es definir el enfoque diagnóstico y terapéutico ideal ante un MNPS.
Pacientes y métodosTras la obtención de la aprobación por parte del comité ético, entre enero del 2007 y junio del 2011, incluimos en nuestro estudio a 146 pacientes con un MNPS detectado mediante TCCF del tórax. Había 94 varones (64%) y 52 mujeres (36%), con una media de edad de 51 ± 9 años (rango: 41-84 años). Los MNPS no estaban calcificados, no tenían un aspecto de opacidad en vidrio esmerilado y mostraban unos márgenes regulares. En todos los pacientes, la broncoscopia de autofluorescencia fue negativa para lesiones premalignas o malignas y no hubo ningún paciente que presentara apnea obstructiva del sueño ni comorbilidades. Se definieron 2 grupos de pacientes en función de los datos obtenidos en la anamnesis y se les aplicó una metodología de tratamiento diferente14: a) grupo A, pacientes con antecedentes: de enfermedad maligna, en los que se recomendó la extirpación mediante minitoracotomía con preservación muscular. En caso de que el paciente no diera su consentimiento para ello, se recomendaba una TCCF de tórax a los 2 meses, y b) grupo B, pacientes con factores de riesgo generales para el cáncer de pulmón (tabaquismo, edad avanzada y enfermedad pulmonar obstructiva crónica) a los que se dio a elegir entre la resección quirúrgica o el seguimiento mediante TCCF de tórax a los 3 meses. La TCCF de control a los 2 o 3 meses en el grupo A y el grupo B, respectivamente, se asoció a un examen de los factores que influyen en la probabilidad de cáncer de pulmón en un nódulo pulmonar propuestos por Libby et al.15. Después de la verificación mediante TCCF, la persistencia o el aumento de volumen del nódulo determinaban la indicación de cirugía en ambos grupos. El grupo A constó de 59 pacientes (40%) con antecedentes previos de cáncer en localizaciones no pulmonares, y de entre 41 y 55 años de edad, que nos fueron remitidos por oncólogos. Los tumores primarios fueron de los siguientes tipos: 21 colorrectal (36%), 15 riñón (25%), 13 mama (22%), 6 próstata (10%), 3 vejiga urinaria (5%) y uno etmoidal (2%). Los cánceres no habían tenido una localización extrarregional (M0) y habían requerido quimioterapia adyuvante en 13 pacientes (22%) por una invasión ganglionar N1 (8 cánceres colorrectales y 5 cánceres de mama). El periodo libre de enfermedad entre el cáncer previo y la detección del nódulo pulmonar fue de 2 ± 1 años. En 16 pacientes (27%) estudiamos las mutaciones KRAS mediante reacción en cadena de polimerasa (PCR), con objeto de definir la correlación entre la alteración genética y el cáncer de pulmón. El grupo B lo formaron 87 pacientes (60%), de edades comprendidas entre 56 y 84 años, con una media de consumo tabáquico de 20 paquetes/años. Veinticinco pacientes (29%) tenían entre 80 y 84 años. Un total de 42 pacientes con enfermedad pulmonar obstructiva crónica (48%) fueron clasificados en un estadio ii según la estrategia GOLD16. Veinte pacientes (23%) indicaron unos antecedentes de tabaquismo de 40 paquetes/años. En 28 pacientes (32%), la detección del MNPS fue accidental en la TCCF de tórax llevada a cabo por un dolor torácico y/o disnea aguda. El programa de detección sistemática voluntaria del cáncer de pulmón mediante TCCF de dosis bajas del tórax detectó el MNPS en 59 pacientes (68%). Este programa, que nos ha permitido observar a 463 pacientes, estuvo destinado a trabajadores y pensionistas de edad ≥ 50 años, sin diagnóstico previo de carcinoma broncógeno, que tenían unos antecedentes de tabaquismo de al menos 10 años de forma continua y que habían presentado un episodio agudo de neumonía o hemoptisis en los últimos 5 años, en relación con unos antecedentes de inhalación de polvo de partículas finas.
Dado que tanto la cirugía como la conducta expectante comportan riesgos, se obtuvo el consentimiento informado de todos los pacientes.
Análisis estadísticoEl análisis se llevó a cabo con el programa SPSS 10.0. Los datos se introdujeron en una base de datos con el empleo del programa SPSS Data Entry II (SPSS Inc., Chicago, EE. UU.) y se expresaron en forma de media ± desviación estándar (rango del 95%). Evaluamos en cada grupo el porcentaje de casos de cáncer primario de pulmón y de metástasis diagnosticados en pacientes en los que se había aplicado el enfoque quirúrgico. Llevamos a cabo un análisis de la razón de riesgos que definió las diferentes asociaciones de variables y nos permitió determinar la razón de frecuencias observadas (prueba de la χ2) de la incidencia de la enfermedad maligna. Determinamos también el VPP de la cirugía total y del seguimiento con TCCF en los 2 grupos. Todos los valores de p inferiores a 0,05 se consideraron indicativos de una significación estadística y se determinó el IC del 95%.
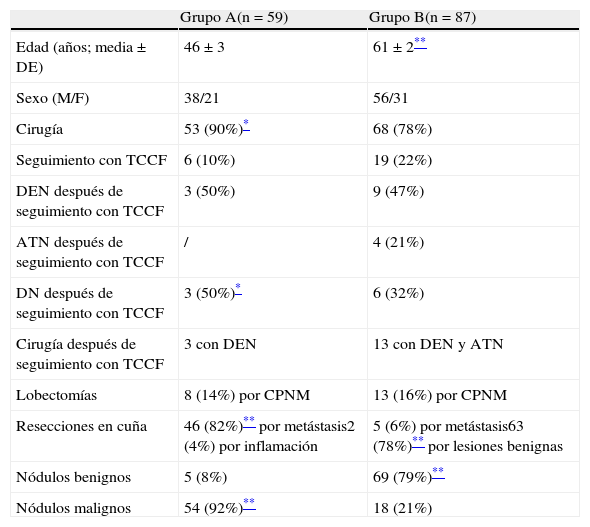
ResultadosEn el grupo A, 53 pacientes (90%) aceptaron la intervención quirúrgica, mientras que 6 pacientes (10%) decidieron optar por la TCCF del tórax a los 2 meses. En función del examen histológico intraoperatorio realizado, en el subgrupo de cirugía llevamos a cabo las siguientes operaciones: a) 45 resecciones en cuña (85%), 43 por metástasis y 2 por inflamaciones inespecíficas, y b) 8 lobectomías (15%) por cáncer de pulmón primario (3 adenocarcinomas, 4 carcinomas de células escamosas y un carcinoma de células broncoalveolares) asociadas a una disección ganglionar. Los tumores secundarios fueron de los siguientes tipos de carcinomas: 15 colorrectal (35%), 12 riñón (28%), 11 mama (26%), 4 próstata (9%) y uno etmoidal (2%). La histopatología postoperatoria confirmó el diagnóstico intraoperatorio. Los cánceres de pulmón no microcíticos (CPNM) se clasificaron en un estadio iA (T1aN0M0). La PCR reveló la presencia de mutaciones de KRAS (codones 12 y 13) en 11 (3 adenocarcinomas y 8 cánceres colorrectales) de 16 pacientes. En los pacientes en los que se utilizó un seguimiento mediante TCCF, la lesión desapareció en 3 casos (50%) y se mantuvo en un diámetro estable en los otros 3 (50%). Estos 3 últimos pacientes optaron por la cirugía en ese momento y las resecciones en cuña revelaron una recurrencia del cáncer previo (2 carcinomas colorrectales y uno de vejiga urinaria). En total, en el grupo A el porcentaje de enfermedades malignas fue del 92% (54 pacientes) y el de enfermedades benignas del 8% (5 pacientes).
En el grupo B, 68 pacientes (78%) optaron por la cirugía y 19 (22%) por la TCCF de tórax a los 3 meses. En el subgrupo quirúrgico, las extirpaciones de parénquima correspondieron a lo siguiente: a) 59 resecciones en cuña (87%), 55 por inflamaciones inespecíficas, neumonía redonda, fibrosis focal o hemorragia, y 4 por tumores secundarios (3 carcinomas renales y uno colorrectal); b) 9 lobectomías (13%) por un CPNM (4 adenocarcinomas, 3 carcinomas espinocelulares y 2 carcinomas de células broncoalveolares). La TCCF postoperatoria cerebral y abdominal identificó el cáncer primario en los pacientes con metástasis pulmonares, mientras que fue negativa para lesiones secundarias extratorácicas en los CPNM (T1aN0M0: estadio iA). En los pacientes del grupo B en los que se realizó un seguimiento con TCCF, se observó lo siguiente: a) un aumento del tamaño del nódulo en 4 pacientes (21%); en estos casos, se practicó una lobectomía por un carcinoma espinocelular en estadio iA (T1aN0M0) en la TCCF; b) la persistencia de un MNPS estable en 9 pacientes (47%), que optaron por la cirugía. Las resecciones en cuña permitieron establecer el diagnóstico de 8 inflamaciones inespecíficas o granulomas y de una metástasis de cáncer de próstata, y c) la desaparición del MNPS en 6 pacientes (32%). En total, el grupo B presentó un porcentaje de enfermedades malignas del 21% (18 pacientes) y un porcentaje de enfermedades benignas del 79% (69 pacientes).
Las características demográficas de los pacientes del grupo A y del grupo B se indican en la tabla 1.
Características clínicas de los pacientes del grupo A (cáncer extrapulmonar previo) y del grupo B (factores de riesgo generales para el cáncer de pulmón) incluidos en este estudio
| Grupo A(n = 59) | Grupo B(n = 87) | |
| Edad (años; media ± DE) | 46±3 | 61±2** |
| Sexo (M/F) | 38/21 | 56/31 |
| Cirugía | 53 (90%)* | 68 (78%) |
| Seguimiento con TCCF | 6 (10%) | 19 (22%) |
| DEN después de seguimiento con TCCF | 3 (50%) | 9 (47%) |
| ATN después de seguimiento con TCCF | / | 4 (21%) |
| DN después de seguimiento con TCCF | 3 (50%)* | 6 (32%) |
| Cirugía después de seguimiento con TCCF | 3 con DEN | 13 con DEN y ATN |
| Lobectomías | 8 (14%) por CPNM | 13 (16%) por CPNM |
| Resecciones en cuña | 46 (82%)** por metástasis2 (4%) por inflamación | 5 (6%) por metástasis63 (78%)** por lesiones benignas |
| Nódulos benignos | 5 (8%) | 69 (79%)** |
| Nódulos malignos | 54 (92%)** | 18 (21%) |
ATN: aumento de tamaño del nódulo; DE: desviación estándar; DEN: dimensión estable del nódulo; DN: desaparición del nódulo; TCCF: tomografía computarizada de cortes finos.
Ausencia de asterisco (*): no se detectaron diferencias estadísticamente significativas.
Todos los pacientes con cáncer fueron objeto de una vigilancia con radiografías de tórax mensuales durante los 4 primeros meses y con el empleo de TCCF corporal total a los 6 y 12 meses en el primer año, y luego cada 12 meses a partir del segundo año. En el caso de que se observara una lesión sospechosa en la TCCF, el estudio diagnóstico se completaba mediante 18F-FDG PET/TC. En los pacientes con metástasis pulmonares se utilizó una quimioterapia específica. Todos los pacientes con cáncer continúan con vida y sin signos de enfermedad a los 36 ± 2 meses de la operación.
Análisis estadísticoEl análisis de la razón de riesgos puso de relieve la asociación estadísticamente significativa entre cirugía y seguimiento en el grupo A, que confirmó la necesidad de un abordaje quirúrgico (p = 0,002; VPP = 0,96). Esta correlación no es estadísticamente significativa en el grupo B (p = 0,716; VPP = ns). La asociación del total de pacientes quirúrgicos en el grupo A y el grupo B fue estadísticamente significativa (p = 0,0001; VPP = 0,8), al contrario de lo observado en los pacientes en los que se optó por el seguimiento (p = 0,560; VPP = ns). La correlación del total de pacientes quirúrgicos frente a los de seguimiento con TCCF no mostró significación estadística (p = 0,092) pero tuvo un VPP elevado (VPP = 0,9), lo cual subraya el hecho de que la cirugía fue la opción de tratamiento prioritaria (tabla 2).
Análisis estadístico de diferentes parámetros evaluados en pacientes del grupo A y del grupo B
| n.p. | RR | p | VPP | |
| Grupo A | 59 | 1,925 | 0,002 | 0,96 |
| Grupo B | 87 | 0,726 | 0,716 | n.s. |
| Total de pacientes quirúrgicos | 121 | 22,711 | 0,0001 | 0,8 |
| Total de pacientes con seguimiento | 25 | 2,125 | 0,560 | n.s. |
| Total de pacientes quirúrgicos frente a total de pacientes con seguimiento | 146 | 1,154 | 0,092 | 0,9 |
n.p.: número de pacientes; n.s.: no significativo; RR: razón de riesgos; VPP: valor predictivo positivo.
Nuestro estudio intentó esclarecer si la cirugía está justificada en el tratamiento de los micronódulos pulmonares solitarios, con objeto de evitar que la extirpación vaya más allá de los posibles beneficios que puede proporcionar. Libby et al.17 señalaron que el seguimiento mediante TC a un año de un nódulo de diámetro < 5mm es seguro, ya que el riesgo de malignidad es bajo. En 2 estudios de detección sistemática del cáncer de pulmón se ha resaltado que la probabilidad de enfermedad maligna en un nódulo de tamaño < 5mm es inferior al 1%1,18. Nuestros resultados parecen contrastar con estas consideraciones, puesto que el porcentaje de lesiones malignas y benignas fue del 49% (72 pacientes) y del 51% (74 pacientes), respectivamente. Además, 4 (33%) de los 12 pacientes con una dimensión estable del nódulo en el seguimiento mediante TCCF presentaron una metástasis pulmonar tras la extirpación. Esto subraya que el tiempo de duplicación del cáncer de pulmón primario o secundario es variable y que la expansión volumétrica de la lesión no puede tomarse como único criterio de malignidad. Estudiamos las mutaciones de KRAS en tan solo un 27% de los pacientes del grupo A debido al alto coste de la prueba. A pesar del reducido número de pacientes, la importancia de esta prueba es incuestionable como predictora de las metástasis pulmonares. Mascaux et al.19, en un metanálisis de 53 estudios sobre el cáncer de pulmón, mostraron que las mutaciones de KRAS eran un factor pronóstico negativo respecto a la supervivencia, con una razón de riesgos global de 1,40 (IC, 1,18-1,65) y de 1,59 (IC, 1,26-2,02) en los adenocarcinomas. Las pequeñas dimensiones de los MNPS reducen considerablemente las opciones diagnósticas y terapéuticas, y las de las posteriores decisiones clínicas. La Fleischner Society20 ha propuesto unas guías para el tratamiento de los nódulos pulmonares de un diámetro ≤ 8mm, que han sido avaladas por el American College of Chest Physicians21. Este enfoque se basaba en verificaciones repitiendo la TC hasta los 24 meses, en función de la presencia o ausencia de factores de riesgo para el cáncer de pulmón y la estabilidad dimensional de la lesión. El aumento de tamaño del nódulo recomendaba la resección quirúrgica. Nuestra opinión personal, basada en la práctica clínica diaria en el cáncer de pulmón, es que estas estrategias pueden determinar la progresión del tumor durante la observación, de tal manera que pase a ser inoperable. Nosotros hemos observado también sistemáticamente que la percepción de la guía de Fleischner por parte de los radiólogos y neumólogos lleva a diferencias en el cumplimento de estos requisitos y a no considerar la posibilidad de la cirugía. En el grupo A descubrimos 51 lesiones malignas (96%) en 53 pacientes y en el grupo B 13 lesiones malignas (19%) en 68 pacientes que aceptaron la intervención en primera intención. El papel de la cirugía fue incontestable en los casos de cáncer extratorácico previo, mientras que puede discutirse en el caso de los factores de riesgo generales. De hecho, puede objetarse que 55 pacientes (81%) del grupo B que presentaban lesiones benignas fueron expuestos al riesgo de las posibles complicaciones asociadas a una resección mediante cirugía abierta. Pensamos que debe alcanzarse una extirpación rápida de la enfermedad maligna, ya que ello mejora la calidad de vida y la supervivencia. La supervivencia a 5 años tras la resección de un CPNM en estadio iA o iB es de entre el 63 y el 83,7%, y de entre el 46 y el 76%, respectivamente22,23, gracias a un tratamiento quirúrgico radical. En el caso de una metástasis solitaria, un intervalo libre de enfermedad > 36 meses comporta un pronóstico favorable. La metastasectomía garantiza una mejor supervivencia a 5 años en los pacientes con tumores de células germinales (tasa del 80%) y con cánceres ginecológicos (tasa del 53%), mientras que no mejora la supervivencia a 5 años en el caso del melanoma (tasa del 16%)24. Aunque nuestros resultados pusieron de manifiesto que el enfoque quirúrgico tiene cierta validez y justificación en el tratamiento del MNPS, creemos que las indicaciones no pueden derivar de un estudio de un solo centro, sino que requieren un consenso general de cirujanos torácicos, neumólogos y oncólogos. Este consenso implica el reconocimiento de que los nódulos de un diámetro inferior a 5mm pueden constituir una entidad clínica diferenciada de la de los nódulos de un diámetro superior a 5mm, con problemas diagnósticos y terapéuticos diferentes y específicos. Teniendo esto en cuenta, la limitación de nuestro estudio podría radicar en el hecho de no haber considerado a pacientes sin factores de riesgo para el cáncer de pulmón.
En conclusión, continúa siendo necesario examinar cuidadosamente el tratamiento del MNPS. Dadas las pequeñas dimensiones de los nódulos y la imposibilidad de un diagnóstico preoperatorio mediante un abordaje mínimamente invasivo, los pacientes prefirieron o fueron inducidos por los clínicos a optar por un seguimiento de TCCF. Creemos que la cirugía no puede quedar limitada tan solo al aumento del diámetro de la lesión, ya que la probabilidad de enfermedad maligna en un MNPS no se conoce, al igual que ocurre con la posibilidad de conversión de un cáncer localizado en uno avanzado durante el seguimiento. Los MNPS inalterados tras la primera verificación con TCCF constituyen una indicación electiva para la extirpación y no un criterio para descartar la cirugía. Además, no disponemos de evidencias relativas al coste social de la repetición de las TCCF, ni respecto a los riesgos que comporta para los pacientes la exposición a la radiación. Esperamos que nuestro estudio sirva de trampolín para la realización de un estudio multidisciplinario aleatorizado, destinado a establecer unas guías internacionales compartidas para el tratamiento del MNPS.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.