Se estima que más de 2.000 millones de personas están infectadas con Mycobacterium tuberculosis1. El objetivo principal del tratamiento antituberculoso es eliminar rápidamente los bacilos y evitar la aparición de resistencias. Las pautas de 6 meses con fármacos antituberculosos de primera línea son las que han demostrado una mayor efectividad2. La presencia de resistencia a fármacos, contraindicación o intolerancia a los agentes de primera línea puede justificar su sustitución por uno o más agentes de segunda línea2. Presentamos el caso de un paciente con tuberculosis (TB) y antecedentes de enfermedad celíaca (EC), el cual fue tratado con fármacos antituberculosos de primera línea que no toleró, lo que motivó su sustitución por un agente de segunda línea con buena evolución.
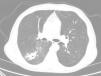
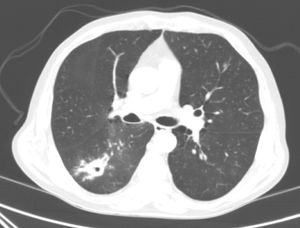
Varón de 70 años, con antecedentes de tabaquismo activo, diabetes mellitus, cardiopatía isquémica y EC. En junio de 2016 fue ingresado por hemoptisis de 2 días de evolución. La radiografía de tórax mostraba una opacidad en el lóbulo inferior derecho (LID). En la TC torácica se objetivó una lesión pseudonodular mal definida, cavitada, con un diámetro máximo de 35mm, en el segmento superior del LID, con múltiples opacidades centrolobulillares y en vidrio deslustrado adyacentes (fig. 1). Ni la fibrobroncoscopia ni la biopsia con aguja gruesa guiada por TAC de la lesión pulmonar permitieron llegar a un diagnóstico, por lo que se realizó una PET-TC, observándose una captación patológica significativa. Por ello se efectuó una biopsia intraoperatoria, siendo el diagnóstico anatomopatológico compatible con un proceso inflamatorio crónico granulomatoso necrosante de probable etiología tuberculosa. Lamentablemente, la muestra no fue remitida a Microbiología, por lo que el paciente fue diagnosticado de TB probable.
En agosto de 2016 se inició tratamiento con tuberculostáticos (isoniazida, rifampicina, pirazinamida y etambutol, asociados en la misma tableta —Rimstar®—, una combinación exenta de gluten) con buena tolerabilidad inicial. Al mes del inicio del tratamiento, el paciente ingresó por diarrea (10-15 deposiciones al día) y pérdida de 5kg de peso. Los análisis de laboratorio mostraron una acidosis metabólica secundaria. Las muestras de heces fueron negativas para Clostridium difficile, no aislándose enteropatógenos en el cultivo ni tampoco parásitos. Los familiares del paciente referían incumplimiento de la dieta sin gluten, por lo que se mantuvo el tratamiento con tuberculostáticos por separado y se realizó dieta correcta. Se solicitaron anticuerpos anti-transglutaminasas Ig A (marcador de transgresión dietética) que fueron negativos y se inició tratamiento con metronidazol. Con todo ello se redujo el número de deposiciones y el paciente fue dado de alta. A los 3 días ingresó nuevamente por persistencia de la diarrea, deterioro del estado general y acidosis metabólica. Ante estos hallazgos se suspendió el tratamiento con tuberculostáticos. Con ello cesó la diarrea y se comprobó la resolución de las alteraciones analíticas. Se revisaron los excipientes de los medicamentos y se comprobó que algunos de ellos (concretamente isoniazida) contenían gluten (almidón de trigo). La gastroscopia mostró atrofia vellositaria subtotal (Marsh 3C) y en la colonoscopia no se encontraron alteraciones. Finalmente, se decidió dar de nuevo el alta al paciente sin tratamiento tuberculostático.
Un mes después el paciente acudió a revisión. No había presentado nuevos episodios de diarrea y había ganado 6kg de peso. Al suponerse una lesión paucibacilar, se decidió tratar al paciente con 2 fármacos durante 9 meses. Además, como es bien sabido, el gran aporte de la isoniazida al tratamiento de la TB es por su gran actividad bactericida. Pero cuando la TB tiene baciloscopia y cultivo negativo en esputo y broncoaspirado, como ocurría en nuestro paciente, este posible papel bactericida de la isoniazida ya no es tan relevante, pues en estos casos son más determinantes los medicamentos con actividad esterilizante, como la rifampicina y el moxifloxacino3,4. Por lo tanto, de los 4 fármacos que ya el paciente no había tolerado previamente en 2 ocasiones, el único auténticamente relevante para una TB como la que presentaba este enfermo era la rifampicina. Por ello, se comenzó con la rifampicina a dosis crecientes (el primer día 100mg, el segundo día 200mg, el tercer día 300mg, el cuarto día 400mg, el quinto día 500mg y el sexto día 600mg). Tras comprobar que la tolerabilidad era buena, una semana después se añadió moxifloxacino (los 3 primeros días 200mg; a partir del cuarto día, 400mg). Y es que, después de comprobar la tolerabilidad de la rifampicina nos preocupó el poder incluir un fármaco nuevo que, además de que tuviese una buena actividad bactericida, también tuviese actividad esterilizante. Y el ideal en este caso era el moxifloxacino. En las revisiones posteriores el paciente refería buena tolerabilidad al tratamiento, sin alteraciones analíticas.
Existen enfermedades sistémicas que aumentan el riesgo de desarrollar TB activa. La EC es un factor de riesgo para el desarrollo de TB5. Aunque el mecanismo no se conoce por completo, puede deberse a la malabsorción y la falta de vitamina D en los individuos con dicha enfermedad6. Los pacientes con EC presentan a menudo una inflamación persistente de bajo grado con un estado vitamínico afectado, incluso muchos años después de la introducción de una dieta libre de gluten. Adicionalmente, esta dieta suele ser baja en vitamina D, aumentando así el riesgo de su deficiencia. Se ha demostrado que la vitamina D induce la síntesis de óxido nítrico en los macrófagos con el fin de suprimir el crecimiento de M. tuberculosis en dichas células, aumenta el efecto del interferón-γ en la promoción del proceso granulomatoso y promueve la diferenciación de los monocitos en células epitelioides y células gigantes multinucleadas, que forman parte prominente de los granulomas6,7.
Los vínculos genéticos más fuertes con la EC se encuentran dentro del locus del MHC, con una correlación bien establecida con HLA-DQ2 (DQA1*05/DQB1*02)6. Se han documentado asociaciones entre la TB y varios alelos HLA, aunque no son tan fuertes como en la EC6. En los europeos del norte, el HLA-DQ2 suele ser parte del llamado haplotipo ancestral 8.18, que contiene un número de genes entre los que se incluyen alelos específicos de las moléculas HLA de clase I y clase II, así como genes para TNF-α y factores de complemento C2 y C4. Dado que la molécula C2 es importante en la invasión micobacteriana de los macrófagos, es posible que un alelo C2 particular pudiera promover la infección por TB en un subgrupo de pacientes6.
Además de aumentar el riesgo de desarrollar TB, la EC puede ser un factor de complicación de dicha enfermedad, aumentar su gravedad e incrementar (hasta 6 veces) la probabilidad de muerte por TB4. Una complicación adicional es que los pacientes con TB que tienen malabsorción mediada por EC pueden estar en riesgo de resistencia a los fármacos antituberculosos debido a su menor biodisponibilidad6. También pueden presentar una mala tolerabilidad a los mismos, como sucedió en nuestro paciente, debido a que algunos medicamentos como la isoniazida contienen excipientes con gluten. La sustitución de algunos de los fármacos de primera línea por uno de segunda línea permitió mejorar la tolerabilidad al tratamiento y continuar con su administración.
En conclusión, en un paciente celíaco, una mala tolerancia a los medicamentos para la TB obliga a la revisión de los preparados por si presentan gluten. Si el problema persiste tras la introducción gradual de los fármacos, puede realizarse una sustitución de fármacos de primera línea por fármacos de segunda línea.