El tratamiento de elección de la proteinosis alveolar en niños es el lavado pulmonar total, que consiste en la eliminación del material proteináceo depositado a nivel alveolar a través de la instilación de suero directamente en el pulmón1. Realizar dicho procedimiento en pediatría supone un verdadero reto técnico dada su rareza y la falta de material específico2.
Presentamos el caso de una paciente sana hasta los 7 meses de vida, cuando se le diagnosticó de leucemia mieloblástica aguda tipo M5a. Por este motivo, a los 13 meses de edad, recibió un trasplante de progenitores hematopoyéticos (TPH) haploidéntico del padre en primera remisión completa. Como complicación post-TPH sufrió enfermedad de injerto contra huésped aguda generalizada, que precisó tratamiento inmunosupresor intensivo. A los 2 meses del TPH una TC de tórax, realizada por fiebre persistente, fue normal.
La enfermedad respiratoria empezó a los 20 meses de edad (7 meses post-TPH), tras una sepsis por Klebsiella pneumoniae. Presentó dificultad respiratoria e hipoxemia progresivas.
Al no mejorar los síntomas respiratorios a pesar de antibioterapia, se indicó una TC de tórax en la que se objetivó un patrón bilateral «en empedrado». Se realizó, en un mismo acto anestésico, un lavado broncoalveolar (cuya citología mostró abundante material granular denso PAS positivo, creciendo en el cultivo Pseudomonas aeruginosa) y una biopsia pulmonar mediante minitoracotomía, que sirvió para descartar infección y neumopatía intersticial por déficit de surfactante, y además confirmó el diagnóstico de proteinosis alveolar.
Ante estos hallazgos se decidió realizar un lavado pulmonar terapéutico de forma secuencial. Se realizaron 12 pases de 27ml/kg de suero calentado cada uno en el pulmón derecho, introduciendo un total de 2.700ml. Dos semanas después en el pulmón izquierdo, usando alrededor de 2.500ml.
Ante la falta de tubos de doble luz para niños menores de 8 años, se optó por introducir 2 tubos endotraqueales mediante laringoscopia directa:
- –
Uno colocado en tráquea para mantener la ventilación (de 3,5mm de diámetro).
- –
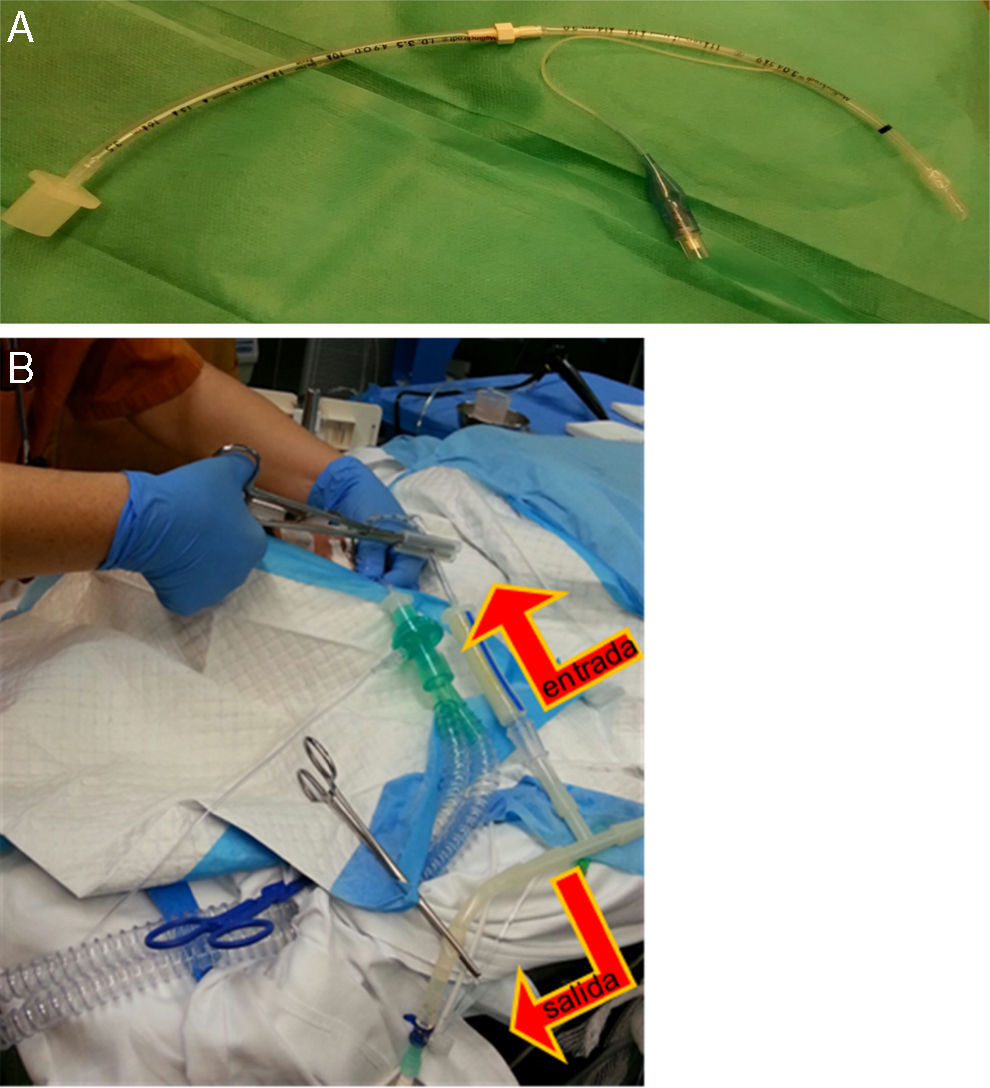
Otro con balón en uno de los bronquios principales, de 3mm de diámetro y telescopado para tener tanto el calibre como la longitud suficientes, a través del cual se instiló el suero (fig. 1A).
Figura 1.A) Tubo endotraqueal de 3mm con balón, alargado a través de conexión con otro de 3,5mm, y a través del cual se hacía la instilación y recogida del suero caliente una vez enclavado en el bronquio principal. B) Imagen en la que se aprecia tubo que queda ubicado en tráquea, a través del cual se ventila a la paciente, y el tubo colocado en bronquio principal mediante el que se instilaba el suero fisiológico con un sistema de clampaje alternante (cerrando salida en el momento de instilación y cerrando entrada en el momento de vaciamiento del líquido pulmonar), según se muestra con las flechas.
La ubicación correcta de ambos tubos se comprobó mediante broncoscopia flexible y escopia.
La entrada y salida de líquido en el bronquio fue por gravedad; se usó un sistema de conexiones que se clampaban para permitir la entrada o salida del líquido de forma alterna (fig. 1B).
Tras cada procedimiento ingresó durante 12h en la UCI. Recibió corticoides para prevenir el edema laríngeo y se extubó en pocas horas sin complicaciones.
La respuesta clínica tras el lavado de ambos pulmones fue muy buena, y rápidamente desapareció la hipoxemia. A las 2 semanas del procedimiento se realizó una TC de tórax de alta resolución y baja radiación en la que aún persistían lesiones pulmonares en vidrio esmerilado, aunque en menor extensión que previamente.
Se descartó la presencia en sangre de autoanticuerpos anti-factor estimulante de colonias de granulocitos-monocitos (GM-CSF), y también fue normal el estudio de mutaciones de GATA2.
Tras 5 meses del procedimiento, se repitió el lavado pulmonar al reaparecer la hipoxemia, mejorando de nuevo clínicamente.
A través de este caso, describimos el procedimiento y material para la realización del lavado pulmonar total en un niño pequeño, con aportaciones prácticas para su manejo, incluyendo el empleo de 2 tubos endotraqueales de forma simultánea, uno de ellos modificado para incrementar su longitud y permitir la intubación selectiva. Se optó por este sistema ya que el lavado parcial mediante instilación de cantidades más pequeñas de suero a través del broncoscopio en los diferentes segmentos pulmonares es más laborioso, aunque puede ser una opción ante pacientes con insuficiencia respiratoria grave que no tolerarían el lavado pulmonar total3.
Se considera que el desencadenante en nuestra paciente puede ser una disfunción transitoria de los macrófagos alveolares (encargados del catabolismo del surfactante junto con los neumocitos tipo II) por la inmunosupresión, ocasionando la ocupación del espacio alveolar4. Otro factor asociado a esta enfermedad en la literatura es el infeccioso, por lo que los microorganismos hallados tanto en sangre como en el lavado broncoalveolar podrían haber jugado un papel relevante en la evolución respiratoria de esta niña5.
Los autores expresan su gratitud al equipo médico de la unidad de hematología pediátrica, especialmente a la Dra. Laura Alonso, además del resto de compañeros de la unidad de neumología pediátrica, sobre todo al Dr. Antonio Moreno y a la Dra. Alba Torrent, por su ayuda en la preparación de este artículo. Además, queremos agradecer a todo el personal de quirófano que colaboró en la organización y realización exitosa del procedimiento detallado en el mismo.